Der Deszensus genitalis ist bei älteren Frauen ein häufig beschriebenes Beschwerdebild. Dieser kann jedoch auch in der Schwangerschaft sowie in den Wochen und Monaten postpartal auftreten. Die vorübergehende Spontanheilung und die muskulären Kompensationsmechanismen junger Frauen verzögern nicht selten Diagnostik und Therapie. Eine frühzeitige Physiotherapie ergänzend mit Pessaranwendung in der Schwangerschaft und im Wochenbett ist vielversprechend und kann operativen Interventionen vorbeugen.
In den westlichen Ländern ist die Geburt für Mutter und Kind bezüglich fetaler und maternaler Morbidität und Mortalität über die vergangenen Jahrzehnte deutlich risikoarmer geworden, so dass Aspekte über die Auswirkungen von Schwangerschaft und Geburt auf den Beckenboden in den Fokus der Gynäkologie rückten. Die Schwangerschaft an sich und insbesondere die vaginal operative Entbindung können zu einem potenziellen Risikofaktor für Beckenbodenfunktionsstörungen, wie Deszensus genitalis mit Darm- und Blasenfunktionsstörungen, werden.
Epidemiologie und Problematik
Die Lebenszeit-Prävalenz eines Deszensus genitalis bei Frauen ab 20 Jahren beträgt 23.7% (1). Auch wenn die mittlere Latenz bis zur operativen Intervention 33.5 Jahre beträgt, können die Symptome bereits in den ersten Tagen und Wochen postpartal auftreten (2).
Im 3. Trimenon konnte im Rahmen von Studien ein Deszensus in 4%, postpartal sogar in 9% der Frauen nachgewiesen werden. Im Verlauf von 12 Monaten bildet sich dieser teilweise spontan zurück, persistiert aber 5 x häufiger nach sekundärer Sectio oder vaginaler Entbindung als nach elektiver Sectio (3, 4). Die Tatsache, dass nach einer elektiven Sectio caesarea die Prävalenz von Beckenbodenbeschwerden nicht die gleiche ist wie bei nulliparen Patientinnen weist darauf hin, dass schon während der Schwangerschaft Veränderungen am Beckenboden geschehen.
Die Symptome wirken sich auf soziale Interaktionen, Beziehungen und Emotionen aus und reduzieren signifikant die Lebensqualität der betroffenen Frauen (6).
Eine Verspätung bei Diagnostik und Therapieinitiierung führt dazu, dass konservative Massnahmen wie Pessare und Physiotherapie frustran verlaufen und operative Interventionen häufiger werden.
Bereits heute beträgt das Lebenszeitrisiko für einen Eingriff am Beckenboden 19%, basierend auf Daten einer australischen Studie, und eine Verdoppelung bis 2050 wurde hochgerechnet (7). Diese Zunahme an Behandlungen wird das Gesundheitssystem belasten.
Ätiologie und Pathogenese
Schwangerschaft und Geburt an sich stellen den Hauptrisikofaktor für die Entwicklung eines Deszensus dar. Dabei trägt die erste vaginale Geburt, insbesondere die vaginaloperative Entbindung, zur späteren Entstehung eines Prolapses bei (8, 9, 10, 11). Dass genitale Senkungen aber auch bei Nulliparen auftreten, zeigt, dass neben geburtshilflichen Ursachen weitere Risikofaktoren zu berücksichtigen sind. Heute weiss man, dass Adipositas, Bindegewebsschwächen, zunehmendes Alter, Östrogenmangel sowie Faktoren, die eine chronische intraabdominale Druckerhöhung bewirken (chronische Obstipation, schwere körperliche Arbeit, chronischer Husten etc.) ursächlich in der Deszensusentstehung sind.
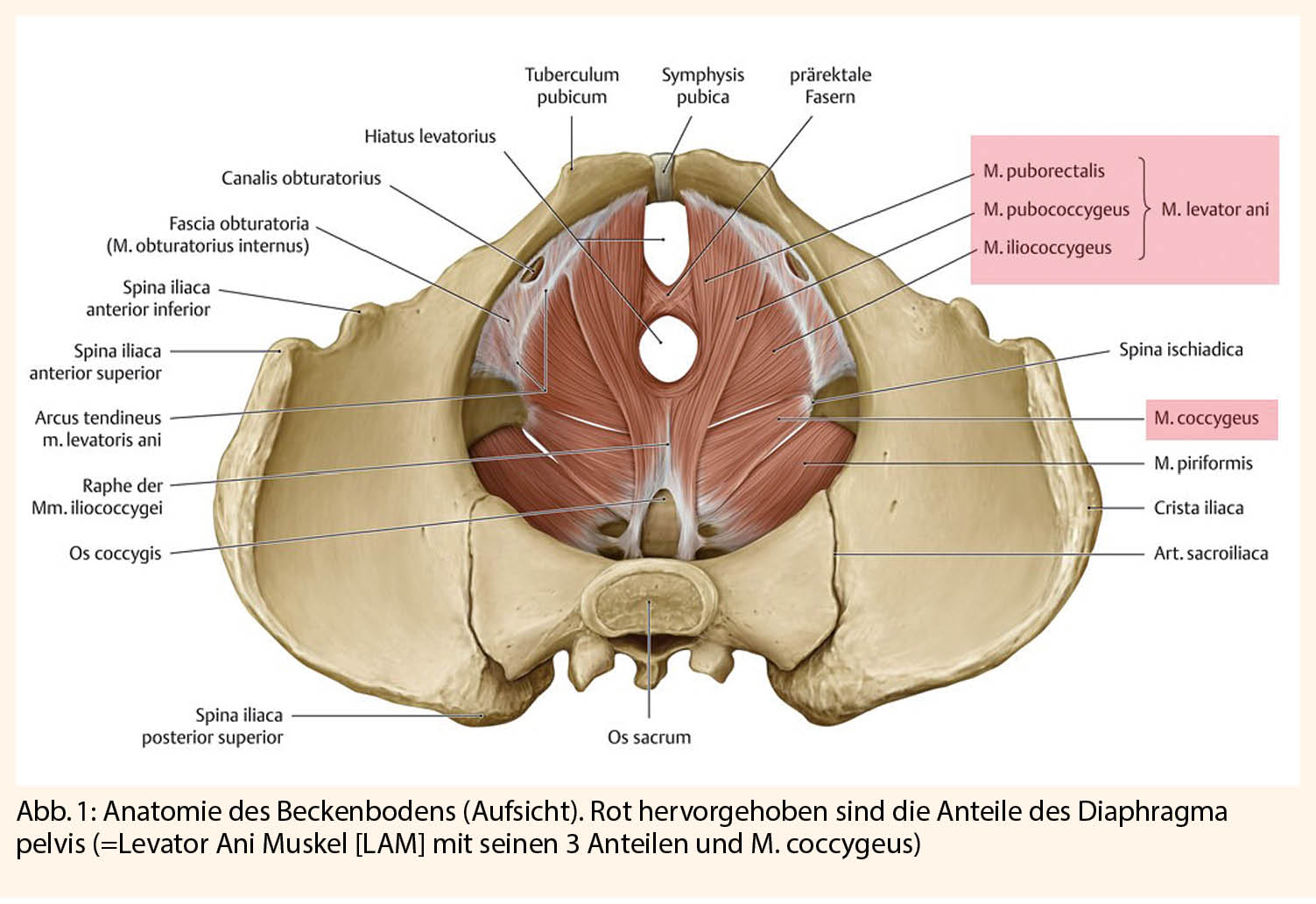
Ein Grundverständnis der Anatomie des Beckenbodens ist notwendig, um die Pathogenese des Deszensus genitalis zu verstehen: Kaudal wird die Bauchhöhle durch das Diaphragma pelvis begrenzt. Dieses besteht aus dem M. levator ani (LAM; bestehend aus: Mm. puborectalis, pubococcygeus [synonym puboviszeralis] und iliococcygeus), dem M. coccygeus und ergänzendem Bindegewebe (Abb. 1). Durch die Anatomie des weiblichen Urogenitaltraktes entsteht retrosymphysär eine natürliche Schwachstelle, der Hiatus urogenitalis, sowie kaudal der Hiatus analis, die entscheidend durch den LAM gestützt werden.
Durch die Schwangerschaft und besonders auch die Geburt sind Läsionen des LAM nicht selten. Diese Läsionen sind signifikant mit einem Deszensus genitalis assoziiert (12). Höheres maternales Alter, Über- und Untergewicht, vergrösserte Zirkumferenzen der fetalen Schädel, protrahierte Austreibungsperioden, lange/verfrühte Pressperioden und vaginaloperative Entbindungen sind bekannte Risikofaktoren für Schädigungen des LAM und innervierender Nerven (13, 14, 15, 16).
Dass häufig Dekaden bis zur primären Diagnostik und Therapieeinleitung vergehen, wird unter anderem der initialen Erholung des Beckenbodens zugeschrieben. Bei jüngeren Frauen ist ein Übergang in einen asymptomatischen Deszensus häufig (17, 18). Es wird angenommen, dass bei jüngeren Frauen die Aufmerksamkeit in den ersten Monaten nach einer Entbindung besonders dem Neugeborenen gilt, und die körpereigenen Veränderungen am Beckenboden zweitrangig sind (19).
Kompensationsmechanismen wie eine gut erhaltene glatte Muskulatur des M. sphincter urethrae internus und M. sphincter ani internus, sowie ein intaktes Nervensystem ohne altersbedingte Degeneration mit guter Funktion der Skelettmuskulatur können die Deszensusbeschwerden maskieren.
Klinik und Diagnostik
Eine weiterführende Diagnostik ist indiziert, wenn bereits in den ersten Wochenbetttagen oder in der Postpartumkontrolle 6 Wochen nach Geburt folgende Symptome beschrieben werden :
- Belastungs-/ Dranginkontinenz, Pollakisurie, Restharngefühl, rezidivierende Harnwegsinfekte
- Stuhl- oder Flatusinkontinenz
- Druckgefühl auf den Damm und genitales Schwere-/Fremdkörpergefühl, Dyspareunie
- Sicht- oder tastbarer Genitalprolaps
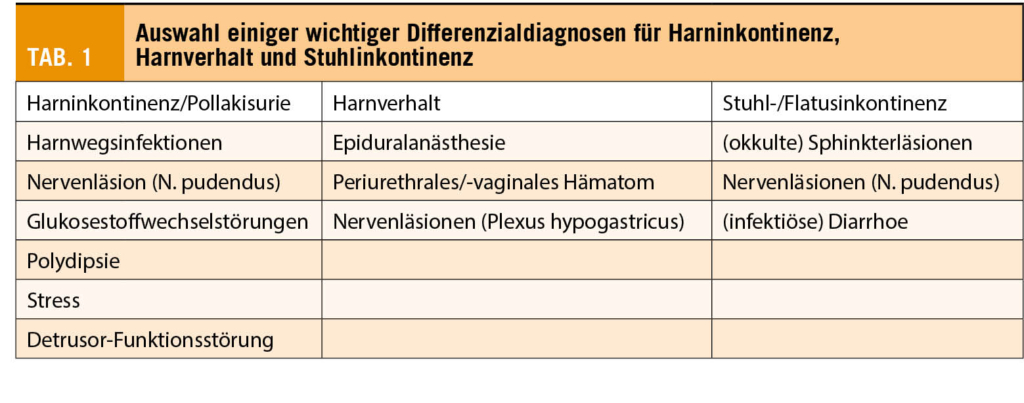
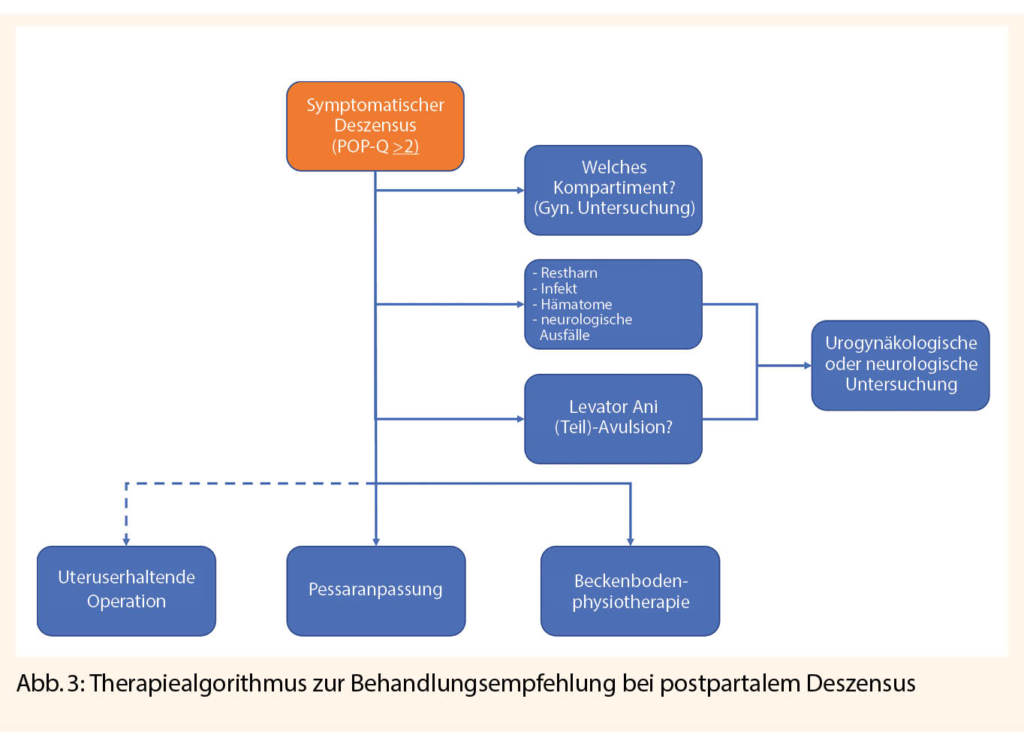
Bei Auftreten von Deszensusbeschwerden soll nach Ausschluss möglicher Differenzialdiagnosen (Tab. 1) die Schädigung oder veränderte Kontrolle der Beckenbodenmuskulatur urogynäkologisch erfasst werden. Neben einer allgemeinen gynäkologischen Untersuchung mittels Spekulum, sind die Perineal- oder Introitussonographie zum Nachweis von muskulären Läsionen, sowie eine Urodynamik im Falle von Inkontinenz indiziert (21).
Zeigt sich im Perinealultraschall ein kompletter ein- oder zweiseitiger Levatordefekt, ist eine Spontanheilung seltener und die Gefahr einer späteren Deszensusentwicklung ist höher einzustufen (22). Prognostisch ist die Unterteilung in LAM-I-Defekt (partieller Defekt) versus LAM-II-Defekt (vollständiger Abriss am Ursprungsort) wichtig (23). Beim LAM-I-Defekt bestehen gute Chancen, dass der Muskel sich wieder am Ursprungsort einheilt.
Therapie, Primär- und Sekundärprävention
Primärprävention in der Schwangerschaft und Geburt
In der Schwangerenvorsorge wird empfohlen, Inkontinenzprobleme anzusprechen. Bei bereits vor der Konzeption bestehender Inkontinenz ist eine Beckenbodenrehabilitation mit Physiotherapie und die Elimination von Risikofaktoren (z.B. Übergewicht) anzustreben, da das Risiko einer postpartalen Aggravation erhöht ist (Tab. 2). In der Schwangerschaft ist auch asymptomatischen, kontinenten Patientinnen, besonders aber Patientinnen mit Risikofaktoren, eine Beckenbodenphysiotherapie anzubieten (24, 25). Um einen optimalen und bleibenden Effekt zu erzielen, sollte diese im Einzelunterricht und ab der 18. SSW erfolgen. Negative Folgen auf vorzeitige Wehen oder Frühgeburten konnten bis anhin nicht erhärtet werden (26).
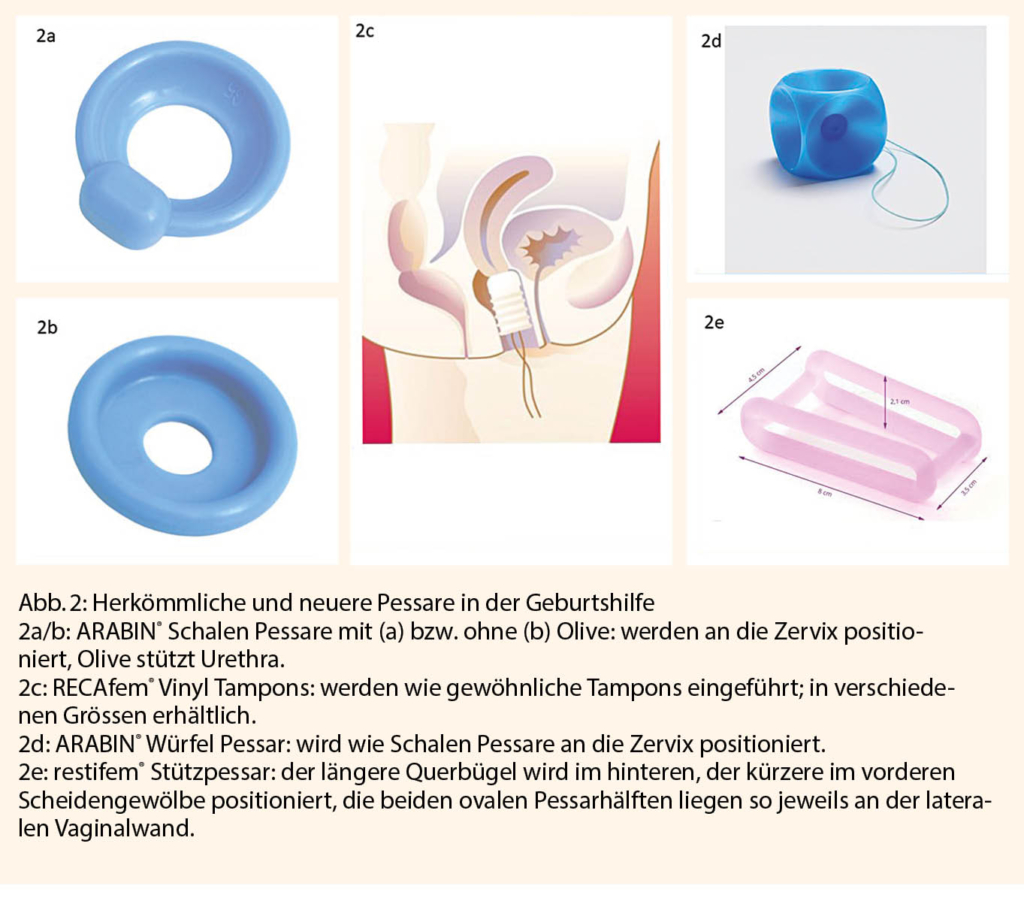
Im Falle von höhergradigem Prolaps in der Schwangerschaft reduzieren Ruhe und die frühzeitige Anwendung von Pessaren das Zervixödem und schützen den Gebärmutterhals vor Erosion und Infektionen (Abb. 2).
Sub partu setzt die Prävention bei einem aktiven Management und guten Timing der Geburtshelfer*innen an. Bei zu schnellem Durchtritt der kindlichen Leitstelle durch den Beckenboden sind Avulsionen des LAM, bei zu langsamen dessen Überdehnung und Nervenläsionen häufiger (13). Die optimale Dauer der Austreibungsperiode bleibt unklar, sicher ist aber, dass sich Beckenbodentraumata durch korrekte kindliche Einstellung, kurze und verzögerte aktive Pressperioden und das Bevorzugen von Vakuumextraktionen gegenüber Forceps-Entbindungen reduzieren lassen (27). Eine frühzeitige Episiotomie kann entgegen früherer Meinung weder vor höhergradigen Dammrissen noch vor LAM-Schädigungen schützen (28). Prophylaktische Episiotomien sind zu unterlassen.
Postpartales Therapiemanagement und Sekundärprävention
Um das Risiko für eine Deszensusproblematik und Folgeprobleme zu erkennen, muss der genaue Geburtsverlauf in der Nachkontrolle bekannt sein (29, 30). Auch bei geringen Beschwerden ist eine Therapie auf jeden Fall indiziert, da eine Aggravation postmenopausal zu erwarten ist.
Das konservative Management ist bei jungen Frauen mit möglicherweise noch nicht abgeschlossener Familienplanung gegenüber der chirurgischen Therapie vorzuziehen, da diese eine Spontangeburt und je nach Verfahren eine Schwangerschaft verunmöglichen. Die Therapieoption des exspektativen Prozederes ist Frauen mit Erstdiagnose im höheren Alter vorbehalten.
Als Primärtherapie wird eine frühzeitige und spezialisierte Physiotherapie im Wochenbett zur Beckenbodenrehabilitation empfohlen. Auch bei frühem Beginn im Wochenbett ist kein negativer Effekt auf die Beckenbodenmuskulatur zu beobachten. Beckenbodenphysiotherapie kann in den ersten Wochen postpartal im Sinne einer Frührehabilitation begonnen werden (25). Als Therapiemodalitäten hat sich die Physiotherapie mit gezielter Steigerung von Kraft, Ausdauer und Reaktionsfähigkeit der Beckenbodenmuskulatur etabliert. Ergänzend können Therapieverfahren wie Elektrostimulation, Biofeedback-Training und das Beckenbodentraining mittels vaginal zu applizierenden Gewichten verschrieben werden (24, 31). Der Trainingseffekt wird unter Pessaranwendung über Wochen unterstützt, indem die geschädigten Muskeln und Ligamente möglichst in ihrer ursprünglichen Lage aktiviert werden.
Insgesamt ist eine gute Compliance der Patientinnen gefordert, eine Aufklärung über den unter Umständen verzögerten Nutzen und die Verhinderung von späteren Operationen sollte ebenso angesprochen werden. Obwohl die primäre Sectio caesarea protektiv für einen Deszensus genitalis ist, gilt es, andere ungünstige Auswirkungen der Sectio auf den Beckenboden abzuwägen. Einerseits gilt der protektive Effekt nicht für die Dranginkontinenz, anderseits birgt die Sectio weitere Risiken und ist häufiger mit Dyspareunien assoziiert (32, 33, 34).
Praxisrelevante Schlussfolgerungen
Da viele Frauen die Beschwerden in der Schwangerschaft als transientes Phänomen interpretieren, sucht nur ein Bruchteil von ihnen aktiv professionelle Hilfe. Inkontinenzbeschwerden treten postpartal bei bis zu 2 von 3 Frauen auf, wobei sich nur jede 8. dieser Frauen Hilfe sucht (35, 36).
Die Schwierigkeit besteht darin, diese Patientinnen zu identifizieren und eine frühzeitige Therapie als Sekundärprävention einzuleiten. Die konservativen Interventionen sind bei jüngeren Frauen vielversprechend und mit einem guten Outcome assoziiert. Ein Rückgang um mindestens eine Stufe im POP-Q-System nach Beckenbodenphysiotherapie ist gegenüber Kontrollgruppen signifikant häufiger (37). Häufige Gründe für die späten Interventionen sind Stigmatisierungen seitens Patientinnen und die Interpretation als transientes Phänomen, was auch unter der Ärzteschaft eine verbreitete Vorstellung ist. Die Wichtigkeit, Symptome eines Deszensus vor, während und besonders auch nach einer Schwangerschaft aktiv anzusprechen, ist hervorzuheben.
Wird ein Deszensus diagnostiziert, ist ein frühzeitiger Therapiebeginn wichtig. Eine spezialisierte Beckenbodenphysiotherapie soll bereits in der Schwangerschaft und auch unmittelbar postpartal begonnen werden, sofern Nebendiagnosen dies erlauben. Damit Läsionen der Beckenbodenstrukturen an korrekter Lage abheilen können, steht ein breites Angebot an Pessaren zur Verfügung, die nach Instruktion der Patientinnen bereits in der Schwangerschaft angewendet werden können.
Operationen sind bei jungen Patientinnen mit manchmal noch offener Familienplanung sekundär und Einzelfällen vorbehalten.
Copyright bei Aerzteverlag medinfo AG
Universitätsspital Zürich
Klinik für Gynäkologie
Frauenklinikstrasse 10
8006 Zürich
gian.stoeckli@usz.ch
Stellvertretende Klinikdirektorin
Klinik für Gynäkologie, USZ
Frauenklinikstrasse 10
8006 Zürich
cornelia.betschart@usz.ch
Die Autoren haben im Zusammenhang mit diesem Artikel keine Interessenskonflikte deklariert.
Literatur:
1. Nygaard, M. D. Barber, K. L. Burgio, K. Kenton, S. Meikle, J. I. Schaffer, C. Spino, W. E. Whitehead, J. M. Wu und D. J. Brody, «Prevalence of Symptomatic Pelvic Floor Disorders in US Women,» JAMA, Bd. 300, Nr. 11, pp. 1311-1316, 2008.
2. V. Thomas, K. L. Shek, R. G. Rojas und H. P. Dietz, «Temporal latency between pelvic floor trauma and presentation for prolapse surgery: a retrospective observational study,» In Irogynecol J, Bd. 8, Nr. 26, pp. 1185-1189, 2015.
3. C. Reimers, J. E. Stær-Jensen, F. Siafarikas, K. Bø und M. E. Engh, «Association between vaginal bulge and anatomical pelvic organ prolapse during pregnancy and postpartum: an observational study,» In Urogynecol J, Bd. 29, pp. 441-448, 2018.
4. Y. Chen, F.-Y. Li, X. Lin, J. Chen, C. Chen und M. K. Guess, «The recovery of pelvic organ support during the first year postpartum,» BJOG, Bd. 120, pp. 1430-1437, 2013.
5. C. Reimers, F. Siafarikas, J. Stær-Jensen, M. C. Småstuen, K. Bø und M. E. Engh, «Risk factors for anatomic pelvic organ prolapse at 6 weeks postpartum: a prospective observational study,» Int Urogynecol J, Bd. 30, pp. 477-482, 2019.
6. G. A. Digesu, C. Chaliha, S. Salvatore, A. Hutchings und V. Khullar, «The relationship of vaginal prolapse severity tosymptoms and quality of life,» BJOG An Int J Obstet Gynaecol, Bd. 112, pp. 971-976, 2005.
7. J. M. Wu, A. F. Hundley, R. G. Fulton und E. R. Myers, «Forecasting the prevalence of pelvic floor disorders in U.S. Women: 2010 to 2050,» Obstet Gynecol, Bd. 114, pp. 1278-1283, 2009.
8. I. K. Atan, S. Lin, H. P. Dietz, P. Herbison, P. D. Wilson und P. S. Group, «It is the first birth that does the damage: a cross-sectional study 20 years after delivery,» In Urogynecol J, Bd. 29, pp. 1637-1643, 2018.
9. T. A. Horak, R. A. Guzman-Rojas, K. L. L. Shek und H. P. Dietz, «Pelvic floor trauma: does the second baby matter?,» Ultrasound Obstet Gynecol, Bd. 44, pp. 90-94, 2014.
10. H. P. Dietz, C. Walsh, N. Subramaniam und T. Friedman, «Levator avulsion and vaginal parity: do subsequent vaginal births matter?,» Int Urogynecol J, Bd. 31, pp. 2311-2315, 2020.
11. M. Gyhagen, M. Bullarbo, F. Nielsen und I. Milsom, «Prevalence and risk factors for pelvic organ prolapse 20 years after childbirth: a national cohort study in singleton primiparae after vaginal or caesarean delivery,» British Journal of Obstetrics and Gynaecology, Bd. 120, Nr. 2, pp. 152-160, 2013.
12. V. L. Handa, J. L. Blomquist, J. Roem, A. Muñoz und H. P. Dietz, «Pelvic Floor Disorders After Obstetric Avulsion of the Levator Ani Muscle,» Female Pelvic Med Reconstr Surg, Bd. 25, pp. 3-7, 2019.
13. V. Marsoosi, A. Jamal, L. Eslamian, S. Oveisi und a. S. Abotorabi, «Prolonged Second Stage of Labor and Levator Ani Muscle Injuries,» Glob J Health Sci, Bd. 7, pp. 267-273, 2015.
14. K. L. Shek und H. P. Dietz, «Intrapartum risk factors for levator trauma,» BJOG, Bd. 117, pp. 1485-1492, 2010.
15. R. Kearney, J. M. Miller, J. A. Ashton-Miller und J. O. L. DeLancey, «Obstetric factors associated with levator ani muscle injury after vaginal birth,» Obstet Gynecol, Bd. 107, pp. 144-149, 2006.
16. H. U. Memon, J. L. Blomquist, H. P. Dietz, C. B. Pierce, M. M. Weinstein und V. L. Handa, «Comparison of Levator Ani Muscle Avulsion Injury After Forceps-Assisted and Vacuum-Assisted Vaginal Childbirth,» Obstetrics & Gynecology, Bd. 125, pp. 1080-1087, 2015.
17. J. O. L. DeLancey, L. Kane-Low, J. M. Miller, D. A. Patel und J. A. Tumbarello, «Graphic Integration of Causal Factors of Pelvic Floor Disorders: An Integrated Lifespan Model,» Am J Obstet Gynecol, Bd. 199, 2008.
18. I. Volløyhaug, S. Mørkved und K. Å. Salvesen, «Association between pelvic floor muscle trauma and pelvic organ prolapse 20 years after delivery,» Int Urogynecol J, Bd. 27, pp. 39-45, 2016.
19. C. L. Kinman, C. A. Lemieux, A. Agrawal, J. T. Gaskins, K. V. Meriwether und S. L. Francis, «The relationship between age and pelvic organ prolapse bother,» Int Urogynecol J, Bd. 28, pp. 751-755, 2016.
20. M. Lipschuetz, S. M. Cohen, M. Liebergall-Wischnitzer, K. Zbedat, D. Hochner-Celnikier, Y. Lavy und S. Yagel, «Degree of bother from pelvic floor dysfunction in women one year after first delivery,» Eur J Obstet Gynecol Reprod Biol, Bd. 191, pp. 90-94, 2015.
21. R. Tunn, G. Schaer, U. Peschers, W. Bader, A. Gauruder, E. Hanzal, H. Koelbl, D. Koelle, D. Perucchini, E. Petri, P. Riss, B. Schuessler und V. Viereck, «Updated recommendations on ultrasonography in urogynecology,» Int Urogynecol J, Bd. 16, pp. 236-241, 2005.
22. M. A. v. Gruting, K. W. M. v. Delft, A. H. Sultan und R. Thakar, «The natural history of Levator ANI Muscle Avulsion 4 years following childbirth,» Ultrasound in Obstetrics & Gynecology, 2020.
23. J. A. García-Mejido und J. A. Sainz, «Type of levator ani muscle avulsion as predictor for the disappearance of avulsion,» Neurology and Urodynamics, Bd. 39, pp. 2293-2300, 2020.
24. S. L. Wallace, L. D. Miller und K. Mishra, «Pelvic floor physical therapy in the treatment of pelvic floor dysfunction in women,» Curr Opin Obstet Gynecol, Bd. 31, pp. 485-493, 2019.
25. M. K. Tennfjord, M. E. Engh und K. Bø, «The Influence of Early Exercise Postpartum on Pelvic Floor Muscle Function and Prevalence of Pelvic Floor Dysfunction 12 Months Postpartum,» Phys Ther, Bd. 100, pp. 1681-1689, 2020.
26. S. J. Woodley, P. Lawrenson, R. Boyle, J. D. Cody, S. Mørkved, A. Kernohab und E. J. C. Hay-Smith, «Pelvic floor muscle training for preventing and treating urinary and faecal incontinence in antenatal and postnatal women,» Cochrane Database Syst Rev, Bd. 5, 2020.
27. M.-A. Harvey, M. Pierce, J.-E. W. Alter, Q. Chou, P. Diamond, A. Epp, R. Geoffrion, A. Larochelle, K. Maslow, G. Neustaedter, D. Pascali, M. Pierce und J. Schulz, «Obstetrical Anal Sphincter Injuries (OASIS): Prevention, Recognition, and Repair,» J Obstet Gynaecol Can, Bd. 37, pp. 1131-1148, 2015.
28. L. Speksnijder, D. M. J. Oom, J. V. Bavel, E. A. P. Steegers und A. B. Steensma, «Association of levator injury and urogynecological complaints in women after their first vaginal birth with and without mediolateral episiotomy,» Am J Obstet Gynecol, Bd. 220, pp. 93.e1-93.e9, 2019.
29. H. P. Dietz und J. M. Simpson, «Levator trauma is associated with pelvic organ prolapse,» BJOG, Bd. 115, pp. 979-984, 2008.
30. S. Albrich, K. Rommens, J. Steetskamp, V. Weyer, G. Hoffmann, C. Skala und E. Zahn, «Prevalence of Levator Ani Defects in Urogynecological Patients,» Geburtshilfe Frauenheilkunde, Bd. 75, pp. 51-55, 2015.
31. W. Fischer und K. Baessler, «Postpartum pelvic floor conditioning using vaginal cones: not only for prophylaxis against urinary incontinence and descensus,» In Urogynecol J Pelvic Floor Dysfunct, Bd. 7, pp. 208-214, 1996.
32. C. Larsson, C. L. Hedberg, E. Lundgren, L. Söderström, K. Tunon und P. Nordin, «Anal incontinence after caesarean and vaginal delivery in Sweden: a national population-based study,» The Lancet, Bd. 393, Nr. 10177, pp. 1233-1239, 2019.
33. D. Baud, J. Sichitiu, V. Lombardi, M. D. Rham, S. Meyer, Y. Vial und C. Achtari, «Comparison of pelvic floor dysfunction 6 years after uncomplicated vaginal versus elective cesarean deliveries: a cross-sectional study,» Scientific Reports, 2020.
34. G. Rortveit, A. K. Daltveit, Y. S. Hannestad und S. Hunskaar, «Urinary Incontinence after Vaginal Delivery or Cesarean Section,» N Engl J Med, Bd. 348, pp. 900-907, 2003.
35. H. F. A. Moossdorff-Steinhauser, B. C. M. Berghmans, M. E. A. Spaanderman und E. M. J. Bols, «Urinary incontinence during pregnancy: prevalence, experience of bother, beliefs, and help-seeking behavior,» Int Urogynecol J, Bd. 32, pp. 695-701, 2020.
36. H. F. A. Moossdorff-Steinhauser, B. C. M. Berghmans, M. E. A. Spaanderman und E. M. J. Bols, «Prevalence, incidence and bothersomeness of urinary incontinence in pregnancy: a systematic review and meta-analysis,» Int Urogynecol J, 2021.
37. C. Li, Y. Gong und B. Wang, «The efficacy of pelvic floor muscle training for pelvic organ prolapse: a systematic review and meta-analysis,» Int Urogynecol J, Bd. 27, pp. 981-992, 2016.