Die Meningitis beim Kind stellt ein gefährliches Krankheitsbild mit einer hohen Letalität dar. Es ist entscheidend, dass beim Erstkontakt in der Praxis die Verdachtsdiagnose gestellt und korrekt gehandelt wird. Dieser Artikel soll für solche Situationen eine Hilfestellung sein, nicht im Sinne einer Übersichtsarbeit, als vielmehr eines praktischen Leitfadens.
Fallvignette
Ein 3-jähriges Mädchen wird im November beim diensthabenden Hausarzt vorgestellt. Sie hat seit 3d Schnupfen, etwas Husten, Fieber bis 38.9 °C (tympanal), eine linkseitige Otalgie und zweimalig erbrochen. Ihre beiden Geschwister sind auch erkältet. Die persönliche Anamnese ist unauffällig. Es wurden nur die Basisimpfungen verabreicht. Ihr Allgemeinzustand ist leicht reduziert, sie ist weinerlich und anhänglich. Im Status fällt ein gerötetes Trommelfell links und ein leicht geröteter Rachen auf. Die Auskultation der Lunge (durch das T-Shirt, da die Patientin weint und sich wehrt) ist normal. Es wird die Verdachtsdiagnose einer Otitis media acuta links gestellt. Die Patientin wird mit fixer Analgesie und Empfehlung einer Verlaufskontrolle am Folgetag beim Kinderarzt, entlassen. Beim Verlassen der Praxis weigert sich das Mädchen zu gehen, sie wird von der Mutter herausgetragen. Zwei Stunden später zuhause erbricht sie mehrmals und krampft. Der Rettungsdienst wird avisiert. Auf der Notfallstation Kinderspital: GCS 13, AF 30/min, HF 160/min, Rekapillarisationszeit zentral 4sec, kühle Peripherie. Ein Meningismus fällt auf. Abnahme von Blutkulturen und Sepsislabor, Volumen- und Antibiotikagabe. Bei weiterer Verschlechterung Verlegung auf die Intensivstation, dort Intubation und Beatmung. Im Verlauf der nächsten Stunden Stabilisierung des Zustandes, keine weiteren Krampfanfälle. Bildgebung des ZNS unauffällig. Durchführung einer Lumbalpunktion. Liquorpleozytose. Die Mikrobiologie meldet Wachstum von Gram positiven Diplokokken aus der Blutkultur. Die Liquor PCR zeigt S. pneumoniae. Nach 3d kann das Mädchen auf die Normalstation verlegt werden.
Nach der Einleitung mit allgemeinen Informationen werden die wichtigsten Punkte aus Anamnese und Untersuchung in Abhängigkeit der verschiedenen Alterskategorien zusammengefasst. Weiter soll die Sepsis als möglicher Krankheitsverlauf in Erinnerung gerufen werden und zum Schluss auf die Prävention und damit die empfohlenen Impfungen eingegangen werden.
Einleitung
Eine bakterielle Meningitis im Kindesalter entsteht meistens durch Schleimhautinvasion der Bakterien nach Kolonisation des Nasopharynx. Im weiteren Verlauf kommt es zur hämatogenen Ausbreitung und schliesslich zur Invasion des ZNS durch Überwindung der Bluthirnschranke. Abhängig von der Immunitätslage und der Bakterienlast, kann es dabei auch zu einer Sepsis kommen. In der Pädiatrie wird die Sepsis als eine dysregulierte Immunantwort auf eine Infektion, die zu einer oder mehrerer Organdysfunktionen führt, definiert. Die Krankheitsbilder Sepsis und Meningitis können parallel ablaufen. Es gilt, beim Kind neben Meningitiszeichen auch aktiv nach Sepsiszeichen zu suchen, weil dies für das unmittelbare Management entscheidend sein kann.
Die für die akute eitrige Meningitis verantwortlichen Bakterien sind hauptsächlich S. pneumoniae, N. meningitidis, H. influenzae Typ b (Hib) und Gruppe B Streptokokken (GBS). Bei Neugeborenen und Säuglingen < 3 Monate sind Gruppe B Streptokokken, bei Säuglingen > 3 Monate bis zu 9-jährigen Kindern S. pneumoniae sowie N. meningitidis und bei Jugendlichen N. meningitidis die häufigsten Erreger. Der Häufigkeitsgipfel für bakterielle Meningitis liegt in den ersten beiden Lebensjahren. Meningokokken-Erkrankungen weisen einen 2. Häufigkeitsgipfel im Adoleszentenalter auf. Bei Säuglingen und Kleinkindern verursachen Pneumokokken die schwerste Form einer bakteriellen Meningitis. Komplikationsreiche Verläufe und neurologische Defektheilungen sind häufiger als bei einer Meningokokken- oder Hib-Meningitis. Die Pneumokokken-Meningitis weist die höchste Letalität unter den klassischen Meningitis-Erregern auf (1-3). In der Schweiz bei Kindern < 5 Jahren hat seit Einführung der Hib Impfung 1991 die Inzidenz invasiver Infektionen (inkl. Meningitiden) innert 21 Jahren von 44 auf 1.5 pro 100 000 dramatisch abgenommen. Die Einführung der Pneumokokken Konjugatimpfstoffe (PCV7 und PCV13 im Jahr 2005 resp. 2011) bewirkte eine Inzidenzreduktion innert 6 Jahren von 37 auf 9. Bei den invasiven Meningokokken-Infektionen sank diese nach Einführung der Konjugatimpfstoffe (MCV-C und MCV-ACWY im Jahr 2006 resp. 2011) innert 9 Jahren von 6.3 auf 3.9 bei Kindern < 5 Jahren resp. bei Jugendlichen von 2.3 auf 0.7. Nach wie vor sind aber in der Schweiz die Pneumokokken die häufigsten Erreger bakterieller Meningitiden bei Kindern > 1 Monat (4-6). In der Gesamtschau ist die aseptische oder virale Meningitis wesentlich häufiger (Inzidenz 70 pro 100 000 bei Säuglingen). Am häufigsten (80-90%) wird diese Form durch Enteroviren, gehäuft während der Sommer- und Herbstmonate, verursacht (7, 8).
Risikofaktoren für eine bakterielle Meningitis (9):
- Alter < 2 Jahren und Jugendliche
- Keine Impfung (Pneumokokken, Hib, Meningokokken)
- Asplenie, Immunschwäche (primär oder sekundär), systemische Grunderkrankung
- Kürzliche Infektionserkrankung (Atemwege oder Otitis media)
- Anatomische Fehlbildungen (HNO, ZNS)
- Cochleaimplantat
- Kürzlicher Kontakt mit Meningitispatienten (Schule, Kita, Hort)
- «Crowding» (Militärdienst, Auffangeinrichtungen)
- Reise in Meningokokken endemische Gebiete wie Sub-Sahara Afrika
Präsentation – was Eltern berichten oder erfragt werden muss
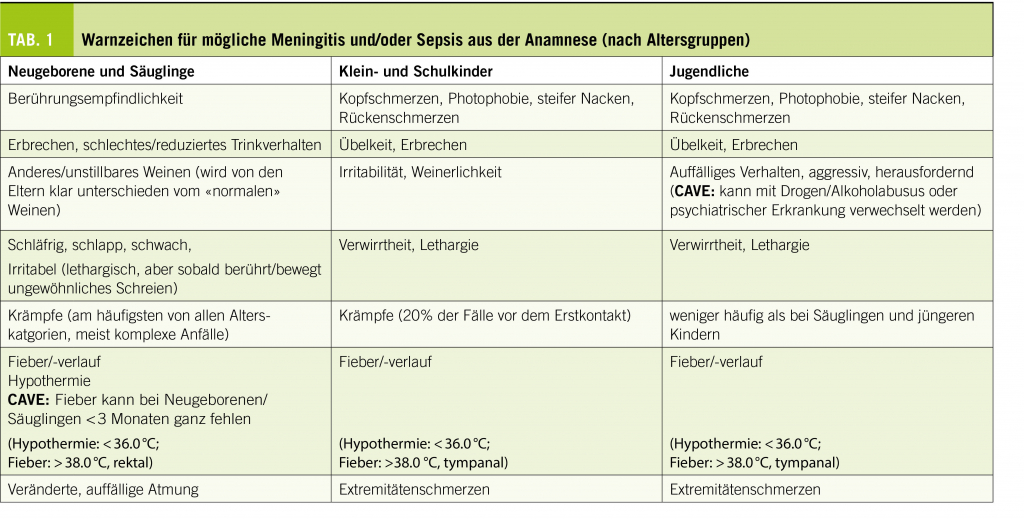
Die in Tabelle 1 sortierten Zeichen und Allgemeinzustandsveränderungen können sich langsam progredient über einige Tage, jedoch auch fulminant innert weniger Stunden, manifestieren. Kinder unter zwei Jahren stellen für die Evaluation eine grosse Herausforderung dar (1, 10, 11). Was die Eltern berichten (was ihnen aufgefallen ist, was ihnen Sorgen macht) hat bei diesen Patienten einen besonders hohen Stellenwert. Lassen Sie sich von Eltern leiten, wenn sie zum Beispiel sagen… ihr Säugling sei ungewöhnlich schläfrig, schreie anders, atme komisch oder stelle keinen Augenkontakt mehr her. Kinder mit akut eitriger Meningitis sind allgemein in einem schlechteren Allgemeinzustand als Kinder mit viraler Meningitis.
Status
Ängstliche Kleinkinder sollten, wenn immer möglich, nicht von den Eltern getrennt werden. Die primäre Untersuchung kann auch beim sitzenden oder liegenden Kind auf dem Schoss der Betreuungsperson erfolgen. Eine systematische Vorgehensweise und damit die rasche Evaluation eines kranken Kindes ist notwendig. Hilfreich bei der ersten Risikoeinschätzung ist die Beurteilung
- des Allgemeinzustands: Bewusstsein, Tonus, Augenkontakt, Interaktion, Kommunikation, Tröstbarkeit, Schmerzen
- der Atmung: Körperposition, Geräusche, Dyspnoezeichen, Atemfrequenz, Sättigung
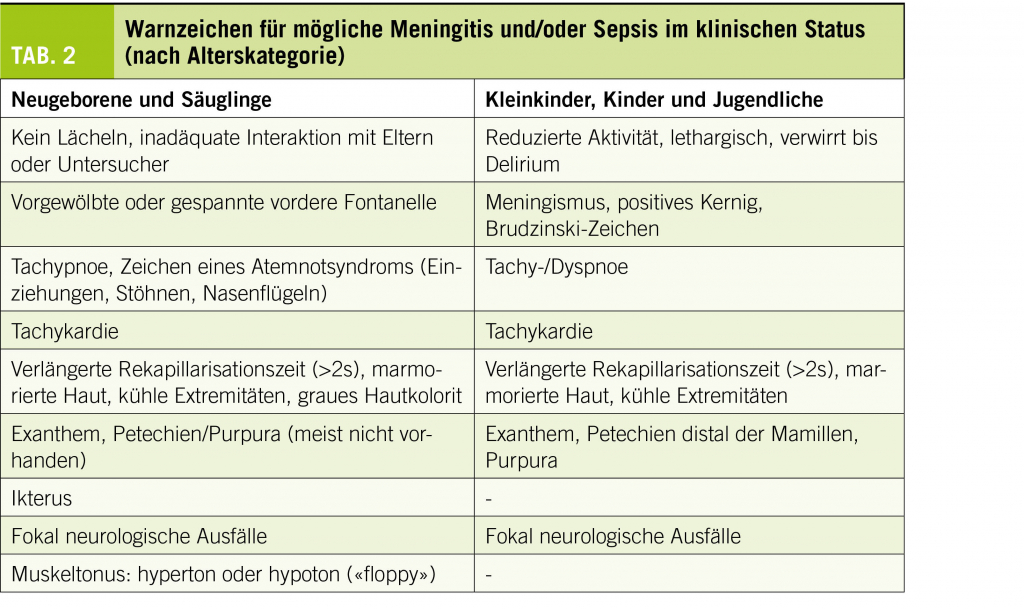
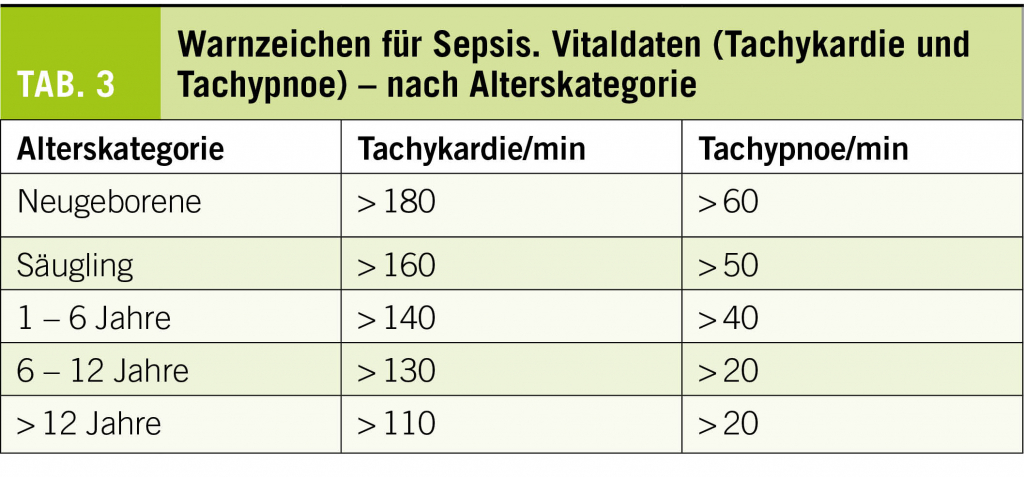
- des Kreislaufs: Blässe, Zyanose, kühle Extremitäten, Rekapillarisationszeit, HerzfrequenzDanach muss ein genauer und umfassender Status durchgeführt werden. Das Kind soll für die Untersuchung IMMER völlig entkleidet und von Kopf bis Fuss untersucht werden. Im Status gilt es neben den neurologischen Zeichen (wie Irritabilität, Berührungsempfindlichkeit, Meningismus, fokale Ausfälle) auch Sepsiszeichen (Tab. 2) zu suchen, da diese bereits als Vorbote oder zeitgleich mit einer Meningitis auftreten können. Erwachsene reagieren im Rahmen einer Sepsis primär mit einem verminderten systemisch-vaskulären Widerstand (warmer Schock). Neugeborene und Kleinkinder dagegen haben in der Frühphase einer Sepsis häufig einen erhöhten vaskulären Widerstand (kalter Schock). Eine verlängerte Rekapillarisationszeit, kühle Extremitäten und eine Tachykardie sind die klassischen Zeichen eines frühen Schockzustands bei noch erhaltenem Blutdruck (kompensierter Schock). Im dekompensierten Zustand sind eine Bewusstseinseintrübung und eine beginnende arterielle Hypo-
tonie typisch. Der Blutdruckabfall ist bei Kindern ein Spätzeichen und steht oft kurz vor dem vollständigen Kreislaufzusammenbruch (11,12). Das korrekte Messen des Blutdrucks beim Säugling und Kleinkind ist nicht immer einfach und muss in der Praxis nicht durchgeführt werden können.
Merke
Man sollte die Eltern ermutigen, sich mit dem Kind wieder vorzustellen, sollte es sich verschlechtern. Eine Verdachtsdiagnose ist nur die «beste Vermutung» und nie unfehlbar, solange sie nicht mit entsprechenden Befunden bestätigt werden konnte. Wenn die Symptome fortschreiten und der Verlauf nicht zur Verdachtsdiagnose passt, muss man dies erkennen und bereit sein, den Fall neu zu überdenken. Fehler passieren, wenn Ärzte auf ihre initiale Verdachtsdiagnose fixiert bleiben.
Management in der Praxis
Bei Verdacht auf eine eitrige Meningitis oder Sepsis (siehe Warnzeichen aus Tab. 1-3) sollte das Kind unverzüglich mit der Ambulanz in die nächste Kinderklinik geschickt werden. Das rasche Einleiten der Therapie (parenterales Antibiotikum und Volumen) rettet Leben. Bei Säuglingen < 3 Monaten in reduziertem Allgemeinzustand muss immer eine Zuweisung erfolgen. Durchführung von laborchemischen Abklärungen (z.B. Blutbild, CRP) sind nicht sinnvoll, da auch nicht wegweisend.
Bei Verdacht auf eine Meningitis aber gutem Allgemeinzustand und stabilen Kreislaufparametern, kann das Kind mit Privattransport verlegt werden. Durchführung von laborchemischen Abklärungen ist auch hier nicht sinnvoll. Eine Meningitis kann nur mittels Lumbalpunktion diagnostiziert werden. Falls eine sofortige Verlegung bei Verdacht auf eitrige Meningitis und/oder Sepsis nicht möglich sein sollte oder es zu Verzögerungen kommt, ist folgende Initialtherapie sinnvoll:
- Sauerstoffzufuhr
- Volumenbolus mit balancierter, kristalloider Lösung (z.B. Ringerfundin) 20 ml/kg aus der Hand
- Ceftriaxon (einmalig) als Kurzinfusion i.v. / i.m. Dosis: 100mg/kg KG (maximale Einzeldosis: 4g)
Prävention – Impfungen
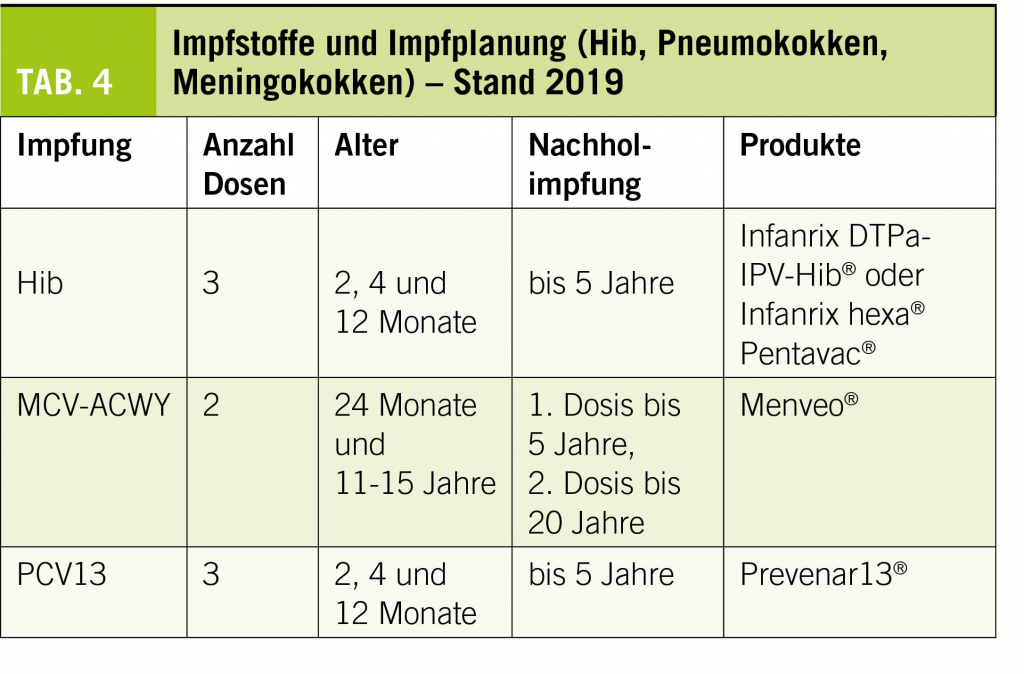
Wie die Fallzahlen aus den vergangenen Jahren zeigen, lässt sich das Risiko, an einer Meningitis mit potentiell tödlichen Folgen oder neurologischen Langzeitschäden zu erkranken, durch eine korrekte Immunisierung deutlich senken. Die Impfungen, gemäss Tabelle 4 sind aktiv zu empfehlen.
Praxis Ottenbach
Affolternstrasse 21
8913 Ottenbach
Leitung Pädiatrische Infektiologie,
Luzerner Kantonsspital
6000 Luzern 16
michael.buettcher@luks.ch
Die Autoren geben an, dass in Zusammenhang mit diesem Artikel kein Interessenskonflikt besteht.