Tinnitus ist ein häufiges Symptom, das für viele Ärzte nicht richtig fassbar ist. Dieser Artikel soll Klarheit über die Entstehungsmechanismen und die aktuellen Behandlungsmöglichkeiten eines Ohrgeräusches liefern.
Risikofaktoren und Epidemiologie
Der Hauptrisikofaktor für die Entstehung eines Ohrgeräusches ist eine Hörminderung. Diese kann vorübergehend oder permanent sein. Aufgrund der Presbyakusis findet sich die höchste Prävalenz für Tinnitus in der älteren Bevölkerung ab einem Alter von etwa 60 Jahren (1). Neben der altersbedingten Schwerhörigkeit sind auch akute oder chronische Lärmbelastungen ein wichtiger Faktor. Interessanterweise sind mehr Männer als Frauen betroffen (2, 3). Tinnitus kann plötzlich auftreten, etwa in Zusammenhang mit einem Hörsturz oder einen langsamen, schleichenden Verlauf nehmen, wenn der Hörverlust über Jahre progredient ist. Weitere, einfach messbare Risikofaktoren für Tinnitus sind trotz umfangreicher Untersuchungen nicht zu ermitteln. Vielfach konnte allerdings bestätigt werden, dass eine vorhandene Depression einen erheblich höheren Leidensdruck bei zusätzlich vorhandenem Tinnitus bewirkt (4, 5). Ein Zusammenhang mit Rauchen, Alkoholkonsum, Übergewicht, Schädeltraumen oder Bluthochdruck wird vermutet (6).
Ototoxische Medikamente, wie Aminoglykosid-Antibiotika, platinhaltige Chemotherapeutika oder Salicylate, können neben einem Hörverlust auch einen Tinnitus bedingen. Eine genetische Prädisposition für bestimmte Formen von Tinnitus wird angenommen, ist aber derzeit noch Gegenstand wissenschaftlicher Überprüfung (7-10).
Die in der Literatur angegebene Zahl der von Tinnitus betroffenen Menschen hat eine sehr grosse Bandbreite. Einige Studien gehen davon aus, dass etwa 10 – 25% aller Erwachsenen von Tinnitus betroffen sind (11-14).
Andere Studien zeigen jedoch das bis zu 80% aller Erwachsenen bereits Erfahrung mit einer Form von Tinnitus gemacht haben (7, 15). Die Prävalenz des dekompensierten Tinnitus schwankt zwischen 1 und 15% (11-13, 16).
Pathophysiologie
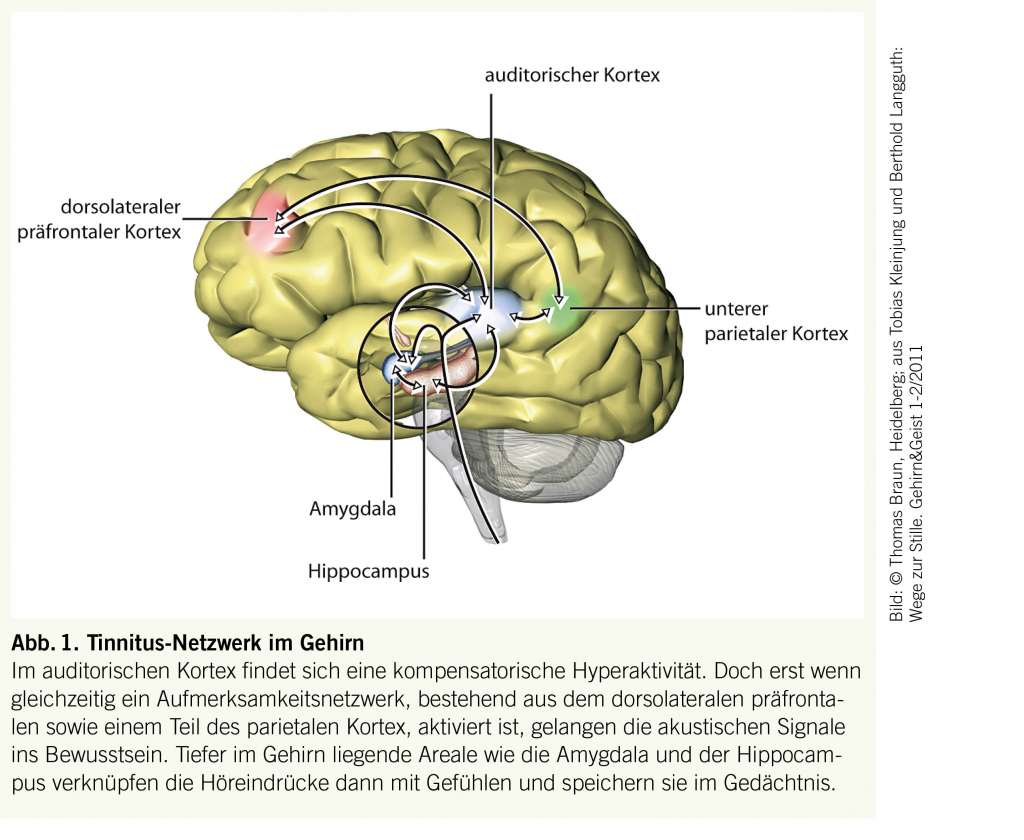
Die Pathophysiologie von subjektivem Tinnitus ist heterogen und erklärt somit die verschiedenen Ausprägungen und Unterschiede in der individuellen Betroffenheit. Ein gemeinsames Grundmodell scheint aber den verschiedenen Formen zugrunde zu liegen. Demnach führt Hörverlust zu veränderter elektrophysiologischer Aktivität im auditorischen Kortex. Der verminderte Input aus der Peripherie führt zu einer Neuorganisation des auditorischen Kortex im Sinne einer Kompensationsreaktion. Daraus resultiert eine kontinuierliche Überaktivität auch in ruhigen Situationen. Durch Vernetzung des auditorischen Kortex mit anderen Zentren des Gehirns, welche für Aufmerksamkeit und Bewusstsein (dorsolateraler präfrontaler und parietaler Kortex), Emotion (Amygdala), Stress (Amygdala) und Gedächtnis (Amygdala und Hippocampus) verantwortlich sind, kommt es zur bewussten Wahrnehmung von Tinnitus (siehe Abbildung). Je nach Konfiguration des Netzwerkes lassen sich so auch die unterschiedlichen Belastungsformen durch Tinnitus erklären. Leider lassen sich die bisher gewonnenen Erkenntnisse über die Pathophysiologie von Tinnitus (noch) nicht für eine bessere Phänotypisierung des einzelnen Betroffenen in der Praxis anwenden.
Vorgehen bei Patienten mit Tinnitus – Abklärungen
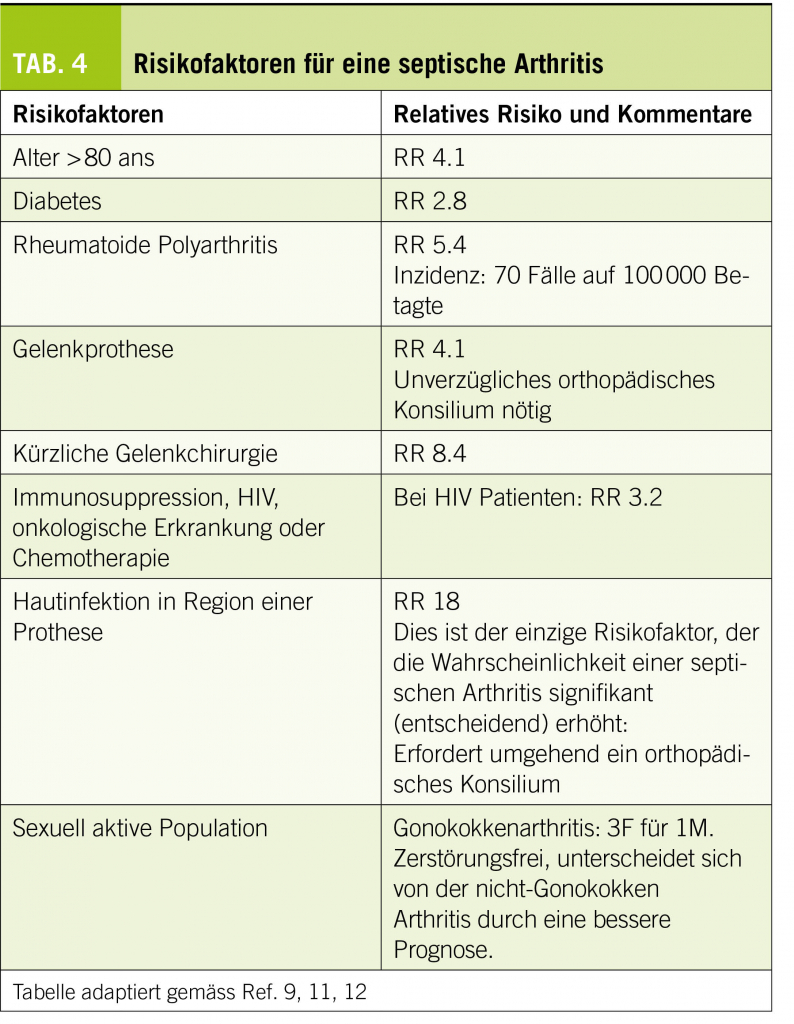
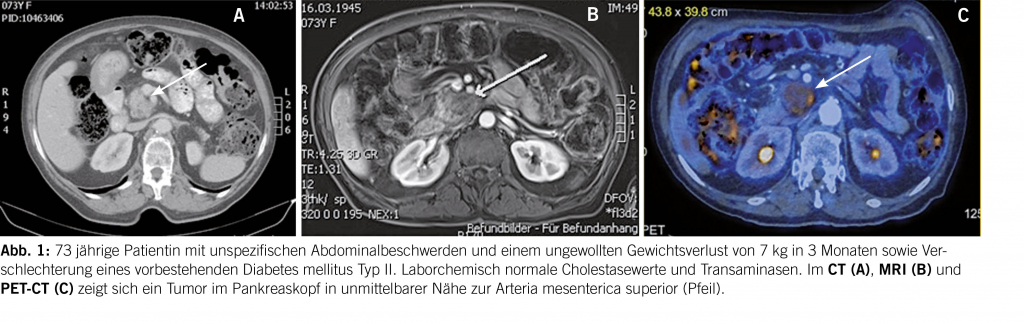
Sollte ein Tinnitus über mehrere Tage bestehen, so ist eine Abklärung sinnvoll. An erster Stelle steht die Ohrinspektion mittels Otoskop oder Ohrmikroskop. Hier können mögliche zugrundeliegende Ursachen, wie akute oder chronische Infekte (Otitis media oder externa) oder obstruierendes Cerumen erkannt oder ausgeschlossen werden. Ebenso wichtig ist die Erfragung der Umstände, unter denen das Ohrgeräusch aufgetreten ist. Der Zeitverlauf (akut bis 3 Monate vs. chronisch) ist ein wichtiger Faktor für eine mögliche Therapie-Entscheidung. Auch die Qualität des Tinnitus, ein möglicher pulsatiler Charakter, sowie ein begleitender Hörverlust und Schwindel können wichtige Hinweise liefern. Bei längerer Persistenz, bzw. entsprechendem Verdacht ist dann die audiologische Testung der Ohren mittels Tonaudiometrie angezeigt. Eine asymmetrische Hörkurve mit gleichzeitigem Tinnitus auf der schlechteren Seite, sollte Anlass für eine Bildgebung mittels MRI des Felsenbeines zum Ausschluss einer intra- oder retrocochleären Pathologie (z.B. Schwannom) geben (17, 18). Bei pulssynchronem Tinnitus würde eine zusätzliche Magnetresonanz-Angiographie (MRA) zur Abklärung einer Gefässveränderung (Stenose, atypischer Verlauf, Glomustumor, sinudurale arteriovenöse-Fistel, knöcherne Dehsizenz, Gefässnerven-Konflikt) ergänzt werden.
Bei chronischem Verlauf können validierte Fragebögen zur Erfassung des subjektiven Leidensdrucks und Schweregrades des Tinnitus eingesetzt werden (19).
Therapie
Bei der Wahl der geeigneten Therapie orientiert man sich an der Zeitdauer des Tinnitus (akut vs. chronisch). Von den im Folgenden erwähnten Therapieformen kommen beim akuten Tinnitus der Psychoedukation/Counseling und der Pharmakotherapie eine besondere Bedeutung zu, wohingegen die anderen dargestellten Formen mehr der chronischen Verlaufsform vorbehalten sind.
Psychoedukation/Counseling
Eine klärende, psychoedukative Erläuterung (typischerweise als «Counseling» bezeichnet) wird als grundlegende Komponente jeglicher Tinnitus-Therapie empfohlen (19, 20). Eine verständliche und verständnisvolle Aufklärung über die grundsätzlich gutartige Natur des idiopathischen Tinnitus und seine Entstehungs-Mechanismen ist in vielen Fällen völlig ausreichend. In erster Linie ist Tinnitus ein Symptom und nicht eine Erkrankung. Oben beschriebene Veränderungen im MRI sind äusserst selten und sollten sicherlich kein Gegenstand eines ersten beratenden Gespräches sein. Die erste Beratung stellt häufig die Grundlage für eine erfolgreiche Etablierung konstruktiver Kompensations- und Habituationsmechanismen dar. Daneben gilt es insbesondere bei wiederholten Beratungen auf den in aller Regel günstigen Verlauf hinzuweisen. Hierbei ist allerdings wichtig festzuhalten, dass für die meisten Formen von Tinnitus eine kausale Therapie (im Sinne einer Auslöschung der Tinnitus-Wahrnehmung) nicht existiert und, dass ein erfolgreicher Verlauf einer Therapie einen günstigen Umgang mit dem Tinnitus ohne Beeinträchtigung der Lebensqualität bedeutet.
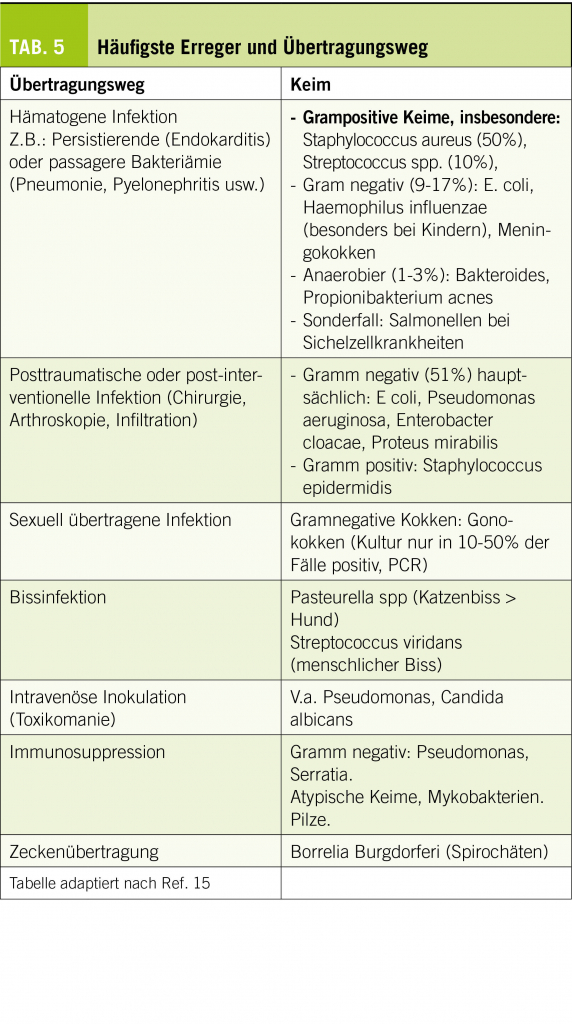
Otologisch-audiologische Therapie
Sollte eine verbesserungswürdige Schwerhörigkeit vorliegen, so sollten entsprechende Massnahmen ergriffen werden. Dies kann je nach Ätiologie des Hörverlustes eine Hörgeräteversorgung (z.B. sensorineurale Schwerhörigkeit) oder auch eine operative Massnahme sein (z.B. Stapesplastik bei Otosklerose). Der positive Effekt auf den Tinnitus kommt hier durch die Maskierung zentraler Vorgänge durch ein verbessertes peripheres Gehör zustande. Bei vollständiger Taubheit kann die Versorgung mit Cochlea-Implantaten im Einzelfall eine hochwirksame Therapieform darstellen.
Um eine De-Fokussierung weg von dem durch die Betroffenen als störend empfundenen Tinnitus zu erzielen, ist in manchen Fällen eine auditorische Stimulation hilfreich. Konkret wird den Patienten empfohlen mittels einer natürlichen oder artifiziellen Schallquelle (Musik, Zimmerbrunnen, offenes Fenster, Rauschgenerator, Smartphone-App) ein Geräusch zu erzeugen, welches vom Tinnitus ablenkt. Dies soll verhindern, dass Patienten, welche sich zum Beispiel beim Einschlafen nicht vom Tinnitus in der für sie erforderlichen Art und Weise distanzieren können, zu sehr auf das Geräusch fixieren.
Kognitive Verhaltenstherapie
Der Goldstandard in der Therapie des chronischen dekompensierten Tinnitus ist die kognitive Verhaltenstherapie (CBT). Bei einem dekompensierten Tinnitus liegen neben dem Tinnitus psychische Komorbiditäten (z.B. Angststörung, Depression) vor, die das Erleben des Tinnitus negativ beeinflussen. Eine psychologisch-psychiatrische Mitbetreuung ist hier sicherlich sinnvoll. Bei schweren Verlaufsformen kann die gleichzeitige psychopharmakologische Therapie von Komorbiditäten wie Angst-, Schlaf- und depressiven Störungen zu einer schnelleren Verbesserung als durch die CBT alleine führen. Eine Kombination von psychotherapeutischen Verfahren (CBT, Entspannungsverfahren) mit akustischen Ablenkungsverfahren (z.B. Rauschgeneratoren, Hörgeräten) wird auch als Tinnitus Retraining Therapie (TRT) bezeichnet.
Pharmakotherapie des Tinnitus
Bisher kann in der Therapie des Tinnitus pharmakologisch kein alleiniger medikamentöser Behandlungsansatz als etablierte therapeutische Option betrachtet werden. Trotz der Untersuchung einer Vielzahl von Pharmaka existiert derzeit weder in Europa noch in den USA ein spezifisch für die Indikation Tinnitus zugelassenes Medikament (21). Insbesondere bei akutem Tinnitus wird dennoch in manchen Fällen ein pharmakologischer Ansatz gewählt. Dies geschieht hinsichtlich der Annahme, dass ein akut aufgetretenes Ohrgeräusch auch als eine akute Funktionsstörung des Innenohres interpretiert werden kann. Vor diesem Hintergrund wird in manchen Fällen ein orales oder intratympanal appliziertes Steroid empfohlen. Eine Evidenz auf der Grundlage randomisierter Studien existiert allerdings für dieses Vorgehen nicht (22). Die Verabreichung von durchblutungsfördernden Medikamenten (z. B. Ginkgo, Pentoxiphyllin, Betahistin) ist angesichts fehlender Signifikanz in Studien und der Erkenntnisse über die pathophysiologischen Entstehungsmechanismen sehr umstritten (18, 22). Bei schwerwiegenden Verlaufsformen muss in manchen Fällen eine Pharmakotherapie zur Verbesserung von Begleiterkrankungen, wie etwa einer schweren Schlafstörung, Depression oder Angststörung, in Erwägung gezogen werden.
Somatosensorischer Tinnitus
Eine Sonderform des Tinnitus wird als «somatosensorischer Tinnitus“ bezeichnet. Bei dieser Form geht man davon aus, dass im Sinne des oben beschriebenen Tinnitus-Netzwerk-Konzeptes nicht nur eine Veränderung des auditorischen Inputs, sondern auch abnormale Aktivität von somatosensorischen Afferenzen (ausgehend vom Kiefergelenk und der HWS) einen bestehenden Tinnitus modulieren und in manchen Fällen vielleicht auch ursächlich induzieren kann. Sollte ein Zusammenhang aufgrund der Anamnese oder der Untersuchung (z.B. Modulation eines Tinnitus durch bestimmte Bewegungen im Kiefergelenk oder in den Kopfgelenken) bestehen, so sollte eine Abklärung im entsprechenden Bereich (Physiotherapie, Zahnheilkunde) in Erwägung gezogen werden. Möglichweise ergibt sich hieraus eine unterstützende Therapie.
Alternative Therapieformen
Da Tinnitus, wie oben beschrieben, nicht zu den Symptomen zählt, die nach Vorgehensweise der wissenschaftlich basierten Medizin in den meisten Fällen geheilt, also beseitigt werden können, finden manche Betroffene auch Zuflucht in alternativen Heilmethoden. Hierunter fallen Methoden wie die Akupunktur, Ayurveda, Homöopathie, verschiedene Formen der Musik- und Klangtherapie, Hypnotherapie, Kinesiologie, Lasertherapie, etc. Für die meisten dieser Ansätze existiert in der wissenschaftlichen Medizin keine geeignete Untersuchung, die einen Wirksamkeitsnachweis bei Tinnitus belegt oder die durchgeführten Studien ergaben ein negatives Ergebnis (23, 24). Für sämtliche dieser Methoden existieren Fallberichte von Betroffenen, die einen positiven Effekt der jeweiligen Technik beschreiben. Dies mag im Wesentlichen auf einem Placeboeffekt, suggestiven Wirkungen oder bisher nicht bekannten Beeinflussungen der komplexen Tinnitus-Pathophysiologie beruhen. Somit kann nicht ausgeschlossen werden, dass manche Ansätze einen komplementären (ergänzenden) Aspekt zu den oben beschriebenen medizinisch-psychologischen Behandlungsmassnahmen haben können.
Experimentelle Therapieansätze
In den letzten 20 Jahren wurden, ausgehend von der Annahme, dass chronischer Tinnitus ein Phänomen ist, das aus einem komplexen Zusammenspiel und Aktivitätsveränderungen verschiedener Zentren des Gehirns hervorgeht, neuromodulatorische Therapieansätze entwickelt. Dabei werden unterschiedliche Ansätze verfolgt, die überwiegend nicht-invasiv versuchen, die elektrische Aktivität des Gehirns in den entsprechenden Regionen günstig zu beeinflussen (25). Neben der transkraniellen Magnetstimulation, der transkraniellen Elektrostimulation kommt auch die Methode des Neurofeedbacks zum Einsatz. Detaillierte Evaluationen der klinischen Wirksamkeit durch grosse randomisierte kontrollierte Studien stehen noch aus (25).
Auch unterschiedliche Formen der auditorischen Stimulation werden aktuell erprobt. Die Ansätze unterscheiden sich zum Teil diametral, so gibt es Verfahren, welche zum einen eine besondere Aktivierung in Bereichen der Tinnitus-Frequenz anstreben, während andere Therapieansätze die betroffene Frequenz aussparen und angrenzende Frequenzen stimulieren. Sämtliche dieser Techniken sind noch in der Erprobung, wenn auch für verschiedene Verfahren bereits kommerziell erwerbbare Systeme zur Verfügung stehen. Ein abschliessender Nachweis der Wirksamkeit in grösseren, randomisierten Studien steht noch aus, sodass hier keine generelle Empfehlung zum routinemässigen Einsatz gegeben werden kann.
UniversitätsSpital Zürich, ORL-Klinik
Frauenklinikstrasse 24
8091 Zürich
UniversitätsSpital Zürich, ORL-Klinik
Frauenklinikstrasse 24
8091 Zürich
UniversitätsSpital Zürich, ORL-Klinik
Frauenklinikstrasse 24
8091 Zürich
tobias.kleinjung@usz.ch
Es besteht kein Interessenskonflikt in Verbindung mit dem vorgelegten Manuskript.
Literatur:
1. Ahmad, N. and M. Seidman, Tinnitus in the older adult: epidemiology, pathophysiology and treatment options. Drugs Aging, 2004. 21(5): p. 297-305.
2. Martines, F., et al., Clinical observations and risk factors for tinnitus in a Sicilian cohort. Eur Arch Otorhinolaryngol, 2015. 272(10): p. 2719-29.
3. Shargorodsky, J., G.C. Curhan, and W.R. Farwell, Prevalence and characteristics of tinnitus among US adults. Am J Med, 2010. 123(8): p. 711-8.
4. Langguth, B., et al., Tinnitus and depression. World J Biol Psychiatry, 2011. 12(7): p. 489-500.
5. Baguley, D., D. McFerran, and D. Hall, Tinnitus. Lancet, 2013. 382(9904): p. 1600-7.
6. Nondahl, D.M., et al., Tinnitus and its risk factors in the Beaver Dam offspring study. Int J Audiol, 2011. 50(5): p. 313-20.
7. Axelsson, A. and A. Ringdahl, Tinnitus–a study of its prevalence and characteristics. Br J Audiol, 1989. 23(1): p. 53-62.
8. Jakes, S.C., et al., A factor analytical study of tinnitus complaint behaviour. Audiology, 1985. 24(3): p. 195-206.
9. Szczepek, A.J., et al., Recommendations on Collecting and Storing Samples for Genetic Studies in Hearing and Tinnitus Research. Ear Hear, 2018.
10. Tyler, R.S. and L.J. Baker, Difficulties experienced by tinnitus sufferers. J Speech Hear Disord, 1983. 48(2): p. 150-4.
11. Bhatt, J.M., H.W. Lin, and N. Bhattacharyya, Prevalence, Severity, Exposures, and Treatment Patterns of Tinnitus in the United States. JAMA Otolaryngol Head Neck Surg, 2016. 142(10): p. 959-965.
12. Coles, R.R., Epidemiology of tinnitus: (1) prevalence. J Laryngol Otol Suppl, 1984. 9: p. 7-15.
13. Hoffman, H.J. and G.W. Reed, Epidemiology of tinnitus. In: Snow JB Jr., ed. Tinnitus: theory and management. 2004(Hamilton, ON, Canada: B.C. Decker): p. 16-42.
14. Nondahl, D.M., et al., Prevalence and 5-year incidence of tinnitus among older adults: the epidemiology of hearing loss study. J Am Acad Audiol, 2002. 13(6): p. 323-31.
15. Demeester, K., et al., Prevalence of tinnitus and audiometric shape. B-ENT, 2007. 3 Suppl 7: p. 37-49.
16. Park, K.H., et al., Prevalence and associated factors of tinnitus: data from the Korean National Health and Nutrition Examination Survey 2009-2011. J Epidemiol, 2014. 24(5): p. 417-26.
17. Bauer, C.A., Tinnitus. N Engl J Med, 2018. 378(13): p. 1224-1231.
18. Tunkel, D.E., et al., Clinical practice guideline: tinnitus executive summary. Otolaryngol Head Neck Surg, 2014. 151(4): p. 533-41.
19. Leitlinie der deutschen Gesellschafft für Hals-Nasen-Ohren-Heilkunde: Chronischer Tinnitus. AWMF Leitlinien Register, 2015. Nr. 017/064.
20. Kreuzer, P.M., V. Vielsmeier, and B. Langguth, Chronischer Tinnitus – eine interdisziplinäre Herausforderung. Dtsch Arztebl Int 2013, 2013. 110(16): : p. 278–84.
21. Elgoyhen, A.B. and B. Langguth, Pharmacological approaches to the treatment of tinnitus. Drug Discov Today, 2010. 15(7-8): p. 300-5.
22. Zenner, H.P., et al., A multidisciplinary systematic review of the treatment for chronic idiopathic tinnitus. Eur Arch Otorhinolaryngol, 2017. 274(5): p. 2079-2091.
23. Kim, J.I., et al., Acupuncture for the treatment of tinnitus: a systematic review of randomized clinical trials. BMC Complement Altern Med, 2012. 12: p. 97.
24. Ngao, C.F., et al., The effectiveness of transmeatal low-power laser stimulation in treating tinnitus. Eur Arch Otorhinolaryngol, 2014. 271(5): p. 975-80.
25. Peter, N. and T. Kleinjung, Neuromodulation for tinnitus treatment: an overview of invasive and non-invasive techniques. J Zhejiang Univ Sci B, 2018.