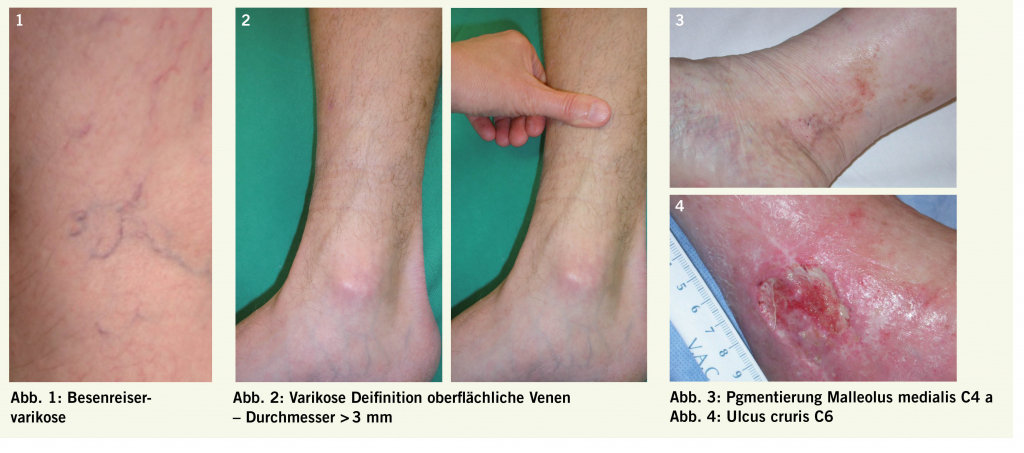
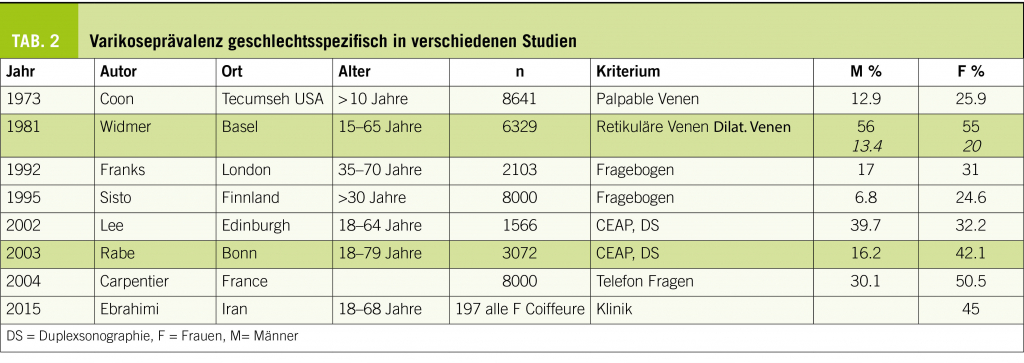
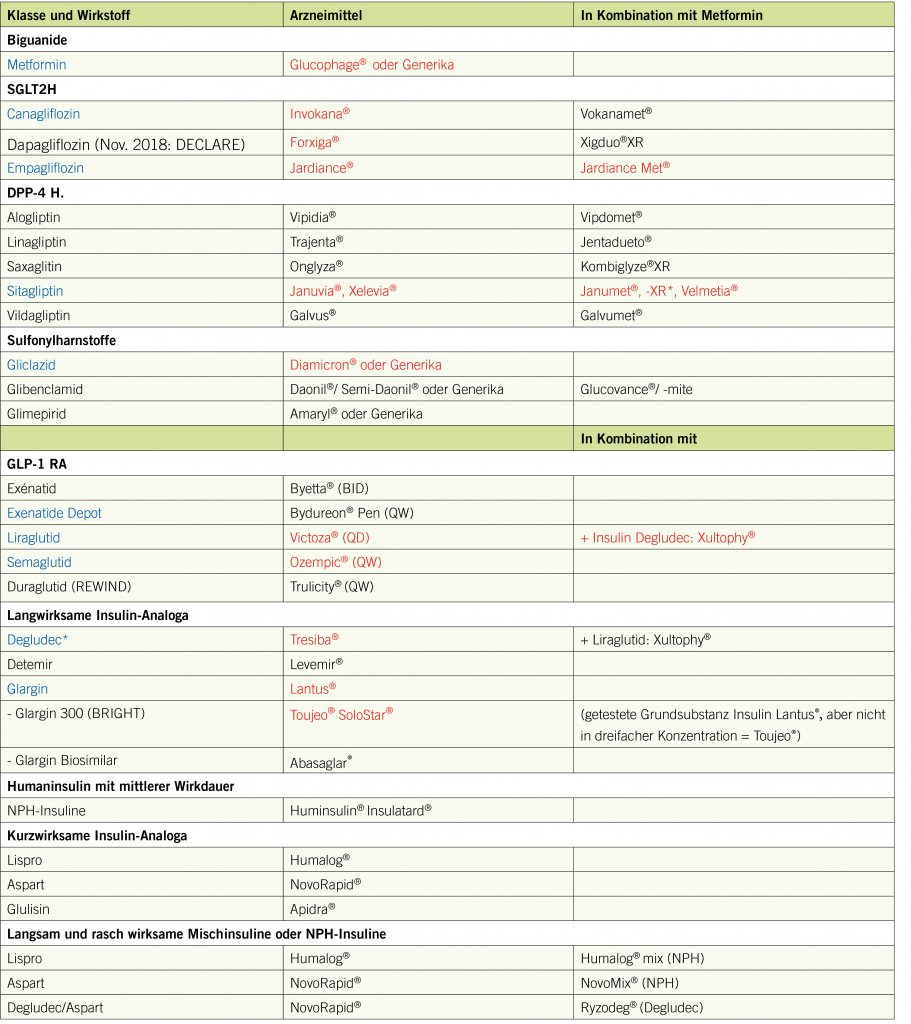
Insuffiziente, auch geradlinig verlaufende tubuläre Venen mit einem Durchmesser von > 3 mm werden als Varizen bezeichnet. Dieser Artikel beschreibt das Krankheitsbild unter besonderer Berücksichtigung von Diagnostik und Therapie.
Varikose wurde als Begriff erstmals von Arnoldi im Jahre 1957 definiert als «jegliche dilatierte, geschlängelte und elongierte subkutane Vene der unteren Extremitäten». Die Definition wurde im Rahmen der CEAP Klassifikation (Clinic Etiology Anatomy Pathophysiology) weiterentwickelt, indem nun auch geradlinig verlaufende tubuläre Venen mit einem Durchmesser von > 3 mm als Varizen gelten. Neu ist auch, dass die Varizen insuffizient sein müssen (siehe Diagnostik). In Tabelle 1 sind die verschiedenen Varizenformen zusammengefasst. Unterschieden wird zwischen der leichteren Form mit Besenreiser- und retikulären Varizen (Abb. 1) und der schwereren Form (der eigentlichen Krankheit) mit Befall der Stammvenen (V.saphena magna und V.saphena parva) (Abb. 2).
Epidemiologie
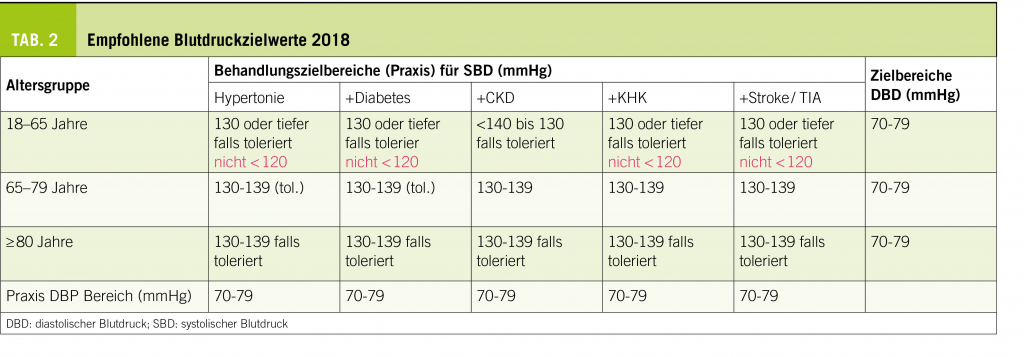
Die Varikose ist ein in der westlichen Zivilisation sehr verbreitetes Leiden, in der Literatur findet man je nach Land und Definition der Varikose Prävalenzen zwischen 10 und 50% (1, 2) (Tab. 2). Frauen sind je nach Literaturangabe gleich häufig wie Männer (Basler, Edinburgh Studie) oder etwas häufiger betroffen. Die Häufigkeit der Erkrankung nimmt mit dem Alter zu.
Klinik und Klassifikation
Die Beschwerden der Patienten sind wenig spezifisch, mit Ausnahme des Pruritus (siehe auch Tab. 3 (3)). Frauen klagen häufiger über Beinbeschwerden als Männer. Die klinisch fassbaren Folgeerscheinungen werden als venöse Insuffizienz bezeichnet. Die CEAP Klassifikation zieht die Beschwerden der Patienten ebenso wie die objektiven Befunde, die Ätiologie, die Lokalisation und die Pathophysiologie in die Beurteilung mit ein (C = Clinic, E = Etiology, A = Anatomy, P = Pathophysiology). Die venöse Insuffizienz wird so umfassender und genauer definiert, was Quervergleiche zwischen verschiedenen Studien erlaubt (4). Die CEAP Klassifikation ist für den täglichen klinischen Gebrauch in vereinfachter Weise anwendbar, indem nur die C 1–6 Einteilung (Tab. 4) (5) angegeben wird.
Anatomie
Die oberflächlichen Venen werden in Stammvenen (V. saphena magna, V. saphena parva) und Astvenen (V. saphena accessoria anterior und posterior am Oberschenkel, V. arcuata anterior und posterior am Unterschenkel) eingeteilt. Multiple Perforansvenen verbinden die oberflächlichen Venen mit den tiefen Beinvenen. Wichtig ist festzuhalten, dass die V. saphena magna am Oberschenkel meist intrafaszial verläuft und dadurch häufig nicht sichtbar oder palpierbar ist. Die neueste heute angewandte Nomenklatur der Venen wird in der Publikation von Caggiati et al zusammengefasst (6).
Pathogenese
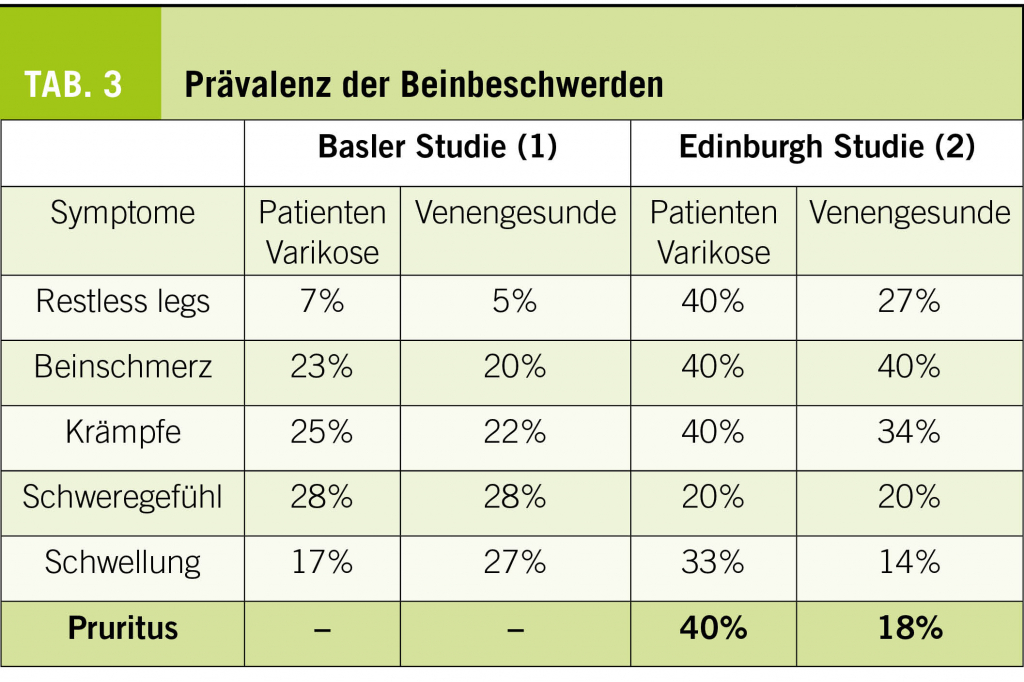
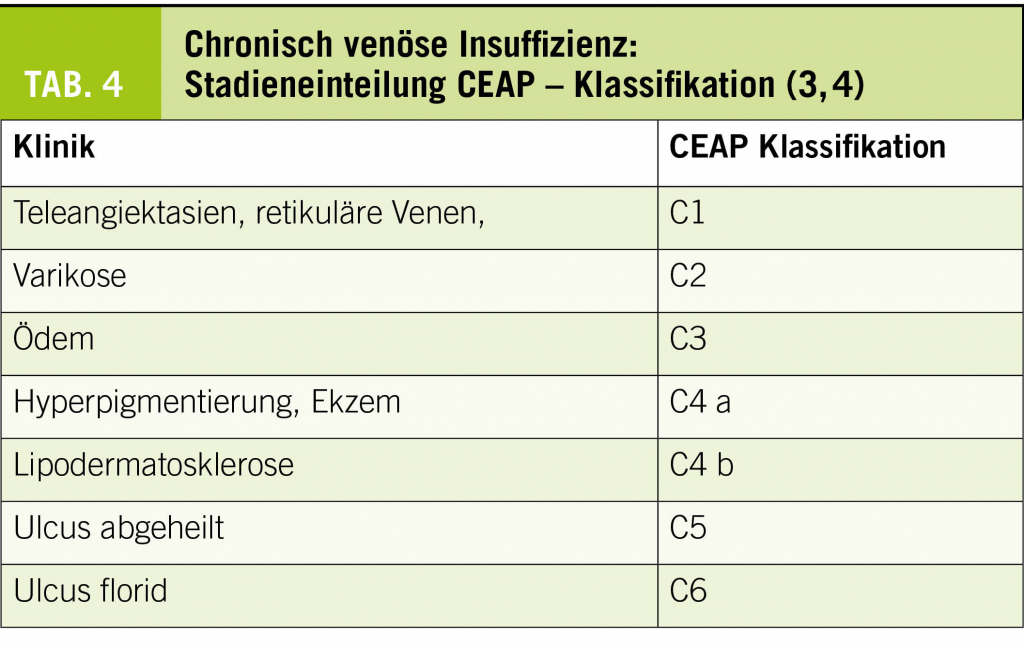
Pathophysiologisch erklärt man sich die Entstehung der Varikose als Folge des erhöhten hydrostatischen Drucks, welcher durch die stillstehende Blutsäule bei nicht optimal schliessenden Klappen oder bei zu dehnbaren Venenwänden zustande kommt. Der unter anderem für den herzwärts gerichteten Rücktransport des Venenblutes zuständige Klappenapparat wird überlastet, zusätzliche Transportmechanismen wie die Wadenmuskelpumpe und die thoraco-abdominale Saug-Druckpumpe genügen nicht mehr, um den vollständigen kardialen Rücktransport des Venenblutes zu gewährleisten. Die erste Folgeerscheinung ist das bei Stehbelastung auftretende perimalleoläre Ödem. Im weiteren Verlauf kommt es zum Austritt von Erythrocyten, was zur Bildung von Pigment, also zu Zeichen der chronisch venösen Insuffizienz Klasse C4 nach CEAP führt (Abb. 3). Die nutritive Versorgung der am stärksten belasteten Region, medial perimalleolär, ist vermindert. Bereits kleinste Verletzungen können dann zu hartnäckigen schlecht heilenden Ulzera führen (Chronisch venöse Insuffizienz C6, Abb. 4).
Aktuelle Diagnostik der Varikose
Mit der Duplexsonographie haben wir eine treffsichere (7) und nicht invasive Methode zur Hand, welche uns zusätzlich zur Lokalisation des Befundes auch Auskunft über die funktionelle Bedeutung der einzelnen Venensegmente gibt.
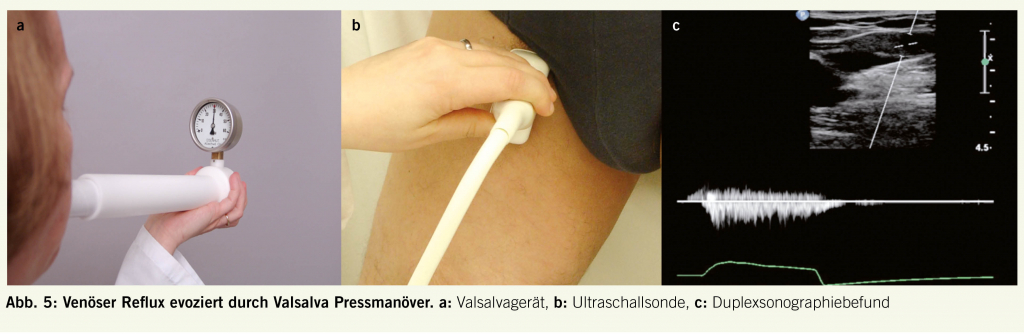
Die duplexsonographische Abklärung der Varikose ersetzt, falls vom entsprechend Ausgebildeten durchgeführt, die präoperative Phlebographie. Die funktionelle Prüfung der Klappenfunktion mit Bestimmung des venösen Refluxes ist ein wichtiger Parameter für die Operationsplanung. Grundsätzlich muss jeder Venenpatient im Stehen untersucht werden. Es stehen uns zwei Messmethoden zur Bestimmung des venösen Refluxes zur Verfügung: die Valsalva- und die Kompressionsmethode. Mittels Valsalva Pressmanöver werden die proximalen Venenklappen (Krosse, V. saphena magna, V. femoralis communis, V. femoralis superficialis) getestet. Der Patient bläst in ein eigens dafür konstruiertes, mit einem Manometer versehenes, geschlossenes Rohr (Abb. 5).
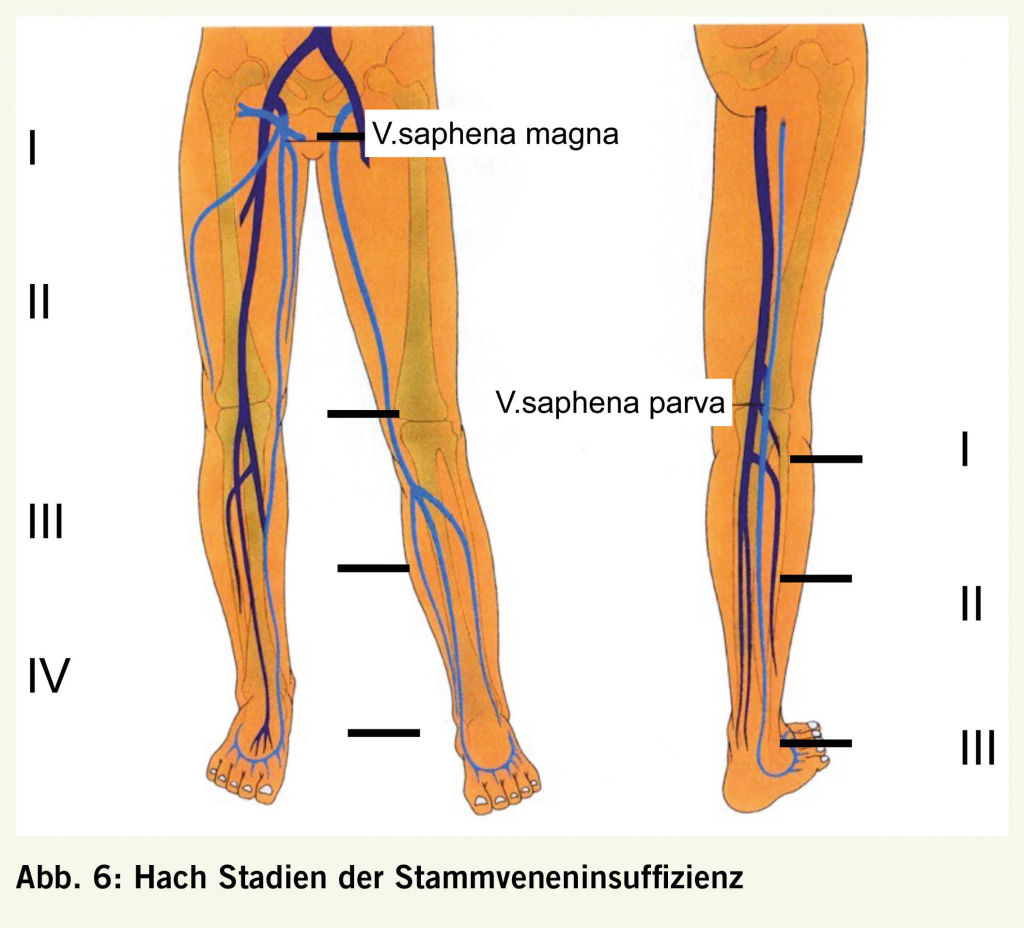
Bei Klappeninsuffizienz fliesst das Blut während des Valsalvamanövers retrograd weiter und kann duplexsonographisch im Dopplerspektrum erfasst werden (siehe Abbildung 5c) (8)). Die distalen Beinvenen werden mit der Kompressionsmethode geprüft. Distal der zu untersuchenden Klappe wird die Vene für einige Sekunden mittels Manschette oder von einer Zweitperson manuell komprimiert. Nach Druckentlastung wird das zurückfliessende Blutvolumen erfasst und die Refluxzeit gemessen. Der allgemein anerkannte Normwert beträgt 0.5 s (9). Die Stammveneninsuffizienz wird nach Hach eingeteilt, in der V.saphena magna in Hach Stadium I–IV und in der V.saphena parva in Hach Stadien I–III (Abb. 6). Die Diagnostik der Perforansvenen ist schwieriger und erfordert Übung. Die Refluxbestimmung hilft uns dort wenig, da der Reflux oft nicht adäquat induzierbar ist (Kniekehlenbereich, Oberschenkel). In der Literatur finden wir Angaben über die Durchmesser bei Fasziendurchtritt, ein Wert von > 3.5 mm wird als pathologisch erachtet (10).
Aktuelle Therapie der Varikose
Die konservative Therapie mit konsequent getragenen Kompressionstrümpfen entspricht einer symptomatischen Therapie, behandelt aber nicht die Ursache der venösen Insuffizienz. Aktuell wird mit der Indikation «venöse Insuffizienz» sowie bei hervorstehenden Varizen, welche bluten könnten, eine interventionelle Therapie empfohlen. Die Indikation «oberflächliche Venenthrombose» wird ebenfalls häufig als Interventionsgrund angegeben, die operative Varizenentfernung verhindert aber leider Rezidivthrombosen nicht. Heutzutage werden die neuen endovenösen thermischen Verfahren wie Laser- und Radiofrequenzablation (11) kombiniert mit Phlebeketomie oder Sklerotherapie mit oder ohne Schaumverödung. Die operative Therapie wird in ausgewählten Fällen z.Bsp. bei aneurysmatisch erweiterter Krosse durchgeführt. Bezüglich spezifischer Lebensqualität nach Varizentherapie konnte bei einem 6-monatigen Follow-up im Rahmen einer randomisierten kontrollierten Studie kein Unterschied zwischen den operativen und endovenösen Methoden gefunden wertden, die Resultate nach Sklerotherapie waren etwas schlechter. Komplikationen wurden in der Gruppe mit Sklerotherapie in 6%, in der Gruppe nach Operation in 7% und nach Laserintervention signifikant weniger häufig mit 1% (12) festgestellt. Eine Metaanlayse zeigte nach 3 Jahren für die einzelnen Therapieformen folgende Erfolgsraten: Krossektomie, Stripping 78%, Schaumsklerotherapie 77%, Radiofrequenzablation 84% und Lasertherapie 94%, wobei für die Lasertherapie lediglich eine Zwei-Jahres-Follow-up Phase beurteilt wurde (13).
Leider muss trotz gut durchgeführter Diagnostik und adäquater operativer Technik mit Rezidiven gerechnet werden. Auch die neueren Verfahren werden mit einem längeren Follow-up höhere Rezidivraten zeigen. Nach der operativen Therapie kennen wir die hohen Rezididvraten an der Krosse, nach 6 Jahren beträgt diese 23% (14).
Angiologie
Med.Universitätsklinik KSBL
4101 Bruderholz
christina.jeanneret@ksbl.ch
Die Autorin hat in Zusammenhang mit diesem Artikel keine Interessenskonflikte deklariert.
Literatur
1. Widmer L. Venenkrankheiten, Häufigkeiten und sozialmedizinische Bedeutung: Basler Studie III. Bern: Huber; 1982.
2. Partsch H. Update on chronic venous insufficiency: from epdiemiology to management. Angiology 2001;52:1-25.
3. Evans C, Fowkes F, Hajivassiliou C, Harper D, Ruckley C. Epidemiology of varicose veins. A review. Int Angiol 1994;13:263-70.
4. Porter J, Moneta G. Reporting standards in venous disease: an update. International Consensus Committee on Chronic Venous Disease. J Vasc Surg 1995;21:635-45.
5. Allegra C, Antignani P, Bergan J, et al. The “C” of CEAP: Suggested definitions and refinements: An international union of phlebology conference of experts. J Vasc Surg 2003;37:129-31.
6. Caggiati A, Bergan JJ, Gloviczki P, Eklof B, Allegra C, Partsch H. Nomenclature of the veins of the lower limb: Extensions, refinements, and clinical application. J Vasc Surg 2005;41:719-24.
7. Eichlisberger R, Frauchiger B, Holtz D, Jäger K. Duplexsonographie bei Verdacht auf tiefe Beinvenenthrombose und zur Abklärung der Varikose. Basel: Karger Verlag; 1995.
8. Jeanneret C, Aschwanden M, Labs K, Jäger K. Assessment of venous reflux with duplexultrasound. In: Hafner J, ed. Current Problems in Dermatology: Karger; 1999.
9. Van Bemmelen P, Bedford G, Beach K, Strandness D. Quantitative segmental evaluation of venous valvular reflux with duplex ultrasound scanning. J Vasc Surg 1989;10:425-31.
10. Hanrahan L, Araki C, Fisher J, et al. Evaluation of the perforating veins of the lower extremity using high resolution duplex imaging. J Cardiovasc Surg 1990;32:87-97.
11. Chandler J, Pichot O, Sessa C, Schuller-Petrovic S, Osse F, JJ. B. Defining the role of extended saphenofemoral junction ligation: a prospective comparative study. J Vasc Surg 2000;32:941-53.
12. Brittenden J, Cotton S, Elders A, et al. A Randomized Trial Comparing Treatments for Varicose Veins. N Engl J Med 2014;317:1218-27.
13. Van den Bos R, Arends L, Kockaert M, Neumann M, Nijsten T. Endovenous therapies of lower extremity varicosities: A meta-analysis. J Vasc Surg 2009;49:230-9.
14. Jeanneret C, Fischer R, Chandler J, Galeazzi R, Jäger K. Great Saphenous Vein Stripping with Liberal Use of Subfascial Endoscopic Perforator Vein Surgery (SEPS). Ann Vasc Surg 2003;17:539-49.