Hintergrund
Multimorbidität und Polypharmazie
Der Anteil an Patienten und Patientinnen mit Multimorbidität, das heisst zwei oder mehr gleichzeitig vorliegenden chronischen Erkrankungen, ist mit knapp einem Viertel hoch und steigt mit dem Alter deutlich an (1). In der Schweiz ist jede/r zweite Patient/-in in der Hausarztpraxis von Multimorbidität betroffen, und im höheren Alter ist Multimorbidität die Regel und nicht die Ausnahme; in der Altersgruppe von 61–80 Jahren liegt der Anteil mit Multimorbidität bei 72 % und steigt bei den > 80-Jährigen auf 86 % an (2). Durch die Zunahme von behandlungsbedürftigen Erkrankungen nimmt auch die Anzahl an regelmässig eingenommen Medikamenten zu.
Die gleichzeitige Verabreichung von mehreren Medikamenten wird als Polypharmazie bezeichnet. Obwohl es keine allgemein gültige Grenze und keine einheitliche Zählweise gibt, wird Polypharmazie am häufigsten als die gleichzeitige Einnahme von fünf oder mehr Medikamenten definiert (3). Polypharmazie ist ein häufiges Phänomen und betrifft gemäss einer Metaanalyse geschätzt 37 % der Patient/-innen. Mit steigendem Alter nimmt die Prävalenz weiter zu, so sind Patient/-innen
≥ 65 Jahre bereits mit 45 % betroffen (3).
Leitliniengetreue Behandlung
Klinische Evidenz ist hauptsächlich auf einzelne Krankheiten ausgerichtet und viele randomisierte kontrollierte Studien (RCTs), welche als Goldstandard für Evidenz gelten, schliessen ältere polymorbide Patient/-innen mit Polypharmazie aus. So ist gemäss der systematischen Review von Van Spall et al. in RCTs das Alter über 65 Jahre bei 38.5 % ein Ausschlusskriterium, eine Polymedikation bei 54.1 % und eine Polymorbidität bei 81.3 % (4). Mit besonders vielen Ausschlusskriterien sind Medikamenteninterventionsstudien assoziiert (relatives Risiko [RR] 1.35 und 1.26). Somit können Erkenntnisse aus RCTs über die zu erwartende Wirksamkeit von Medikamenten nicht auf alle Patientengruppen übertragen werden (4).
Auch Guidelines geben Empfehlungen meist nur zu einzelnen Erkrankungen und befassen sich nicht mit den Bedürfnissen älterer Patient/-innen mit komplexen Komorbiditäten und/oder Polypharmazie. Von den Guidelines zu neun häufigen chronischen Erkrankungen (Diabetes mellitus, arterielle Hypertension, Arthrose, Osteoporose, COPD, Vorhofflimmern, chronische Herzinsuffizienz, Angina pectoris, Hypercholesterinämie), welche in der Hausarztpraxis behandelt werden, geben sieben Empfehlungen für ältere Patient/-innen, sieben für Patient/-innen mit mehreren Erkrankungen, vier für ältere Patient/-innen mit mehreren Erkrankungen; sieben geben spezielle Empfehlungen für Patient/-innen zur Behandlung in Kombination mit einer zusätzlichen Erkrankung und vier zur Behandlung bei mehreren gleichzeitig vorliegenden Erkrankungen (5). Fehlende Empfehlungen für Patient/-innen mit Multimorbidität können zur Verschreibung einer Vielzahl von Medikamenten führen mit kompliziertem Einnahmeschema und hoher Belastung, was folglich die Selbständigkeit und Adhärenz erschwert (6). Die Empfehlungen von Guidelines umfassen zudem häufig den Neustart, jedoch selten das Beenden von Therapien.
Identifikation potenzieller Medikamenteninteraktionen
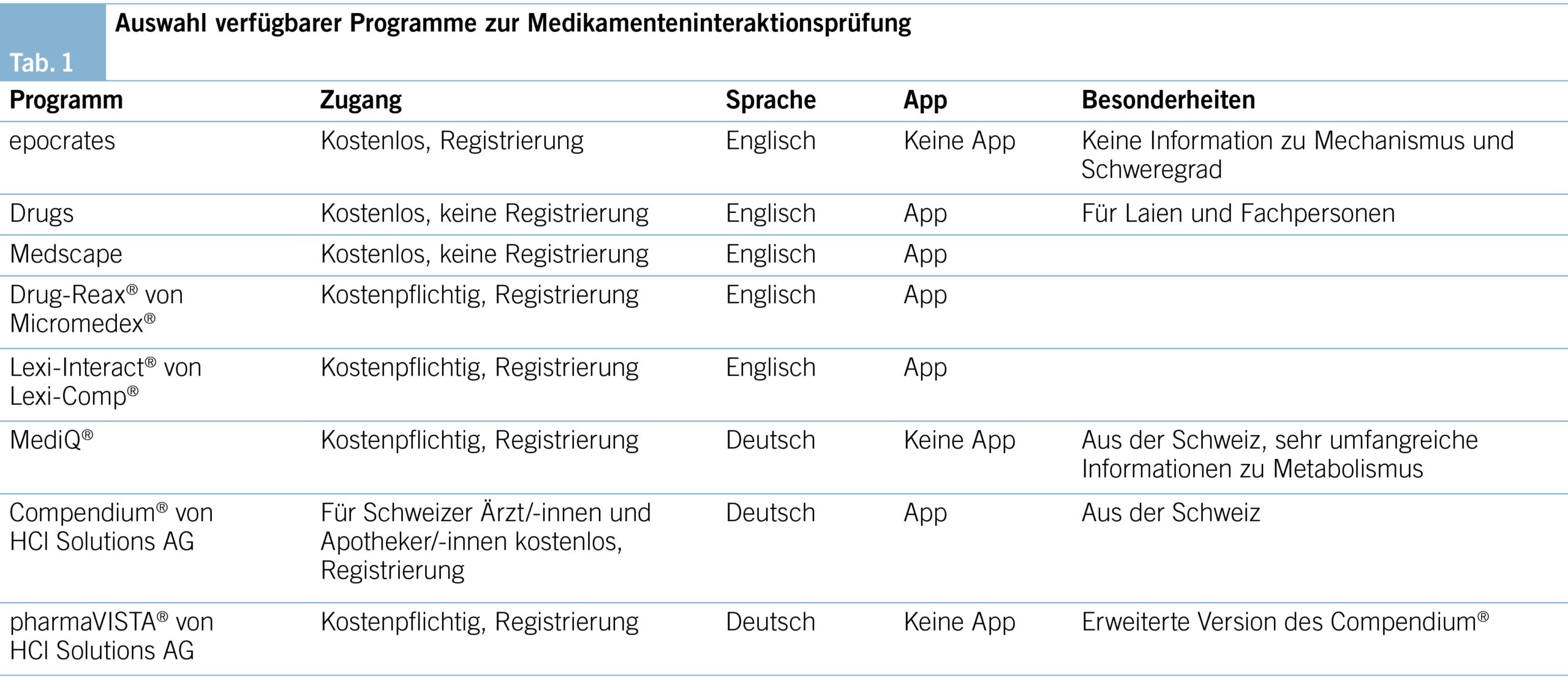
Einige unerwünschte Arzneimittelwirkungen sind nicht vorhersehbar (z. B. erstmalig auftretende allergische Reaktionen) und dadurch nicht vermeidbar. Da Medikamenteninteraktionen hingegen grundsätzlich vorhersehbar und somit vermeidbar sind, gibt es Bestrebungen, diese zu identifizieren und zu reduzieren. Computerprogramme zur Interaktionsprüfung werden zunehmend als klinische Entscheidungshilfen angewendet mit der Absicht, Medikamenteninteraktionen zu verhindern. Es gibt diverse Programme zur Überprüfung von Medikamenteninteraktionen, sowohl als Onlineanwendungen als auch integriert in Klinikinformationssysteme (KIS). Praxisinformationssysteme von Hausarztpraxen haben nicht alle ein integriertes Programm zur Interaktionsprüfung. Die Onlineanwendungen sind zu einem grossen Teil kommerziell, benötigen meistens eine Registrierung, sind teils kostenpflichtig und manchmal auch als Applikation für das Smartphone vorhanden (Tab. 1).
Qualitätsindikator SGAIM
Die Schweizerische Gesellschaft für Allgemeine Innere Medizin (SGAIM) hat 2021 erstmalig sechs Qualitätsindikatoren für die ambulante und stationäre Behandlung veröffentlicht und das Thema «Medikamenteninteraktionen erkennen und Nebenwirkungen verhindern» als Qualitätsindikator im ambulanten Bereich gewählt (7). Zur Qualitätsverbesserung soll der Anteil an Patient/-innen ≥ 65 Jahre mit Einnahme von ≥ 5 Dauermedikamenten mit einer Konsultation dienen, bei denen in den letzten 12 Monaten eine Medikamentenprüfung mit Interaktionsprüfung erfolgte. Ziel der Kampagne ist es, durch die systematische Kontrolle der Medikamente (Medikamentenreview) die korrekte Indikation, die gewünschte Wirkung und mögliche Nebenwirkungen zu hinterfragen und gegeneinander abzuwägen. Mögliche Medikamenteninteraktionen sollen entdeckt werden und durch eine Anpassung der Medikation beseitigt und gegebenenfalls verhindert werden. Patient/-innen sollen in den Entscheidungsprozess miteinbezogen werden, und somit soll die Notwendigkeit und der Zweck ihrer Medikation besser nachvollziehbar sein, was wiederum die Therapieadhärenz fördern soll. Patient/-innen können in diesem Rahmen auch selbst wahrgenommene potenzielle Nebenwirkungen thematisieren und sollen dadurch insgesamt zufriedener mit der Therapie sein (7).
Basierend auf der Kampagne der SGAIM sollen deswegen in dieser Arbeit die Medikamenteninteraktionen und die Interaktionsprüfung im ambulanten (hausärztlichen) Klinikalltag in der besonders betroffenen Gruppe der älteren Patient/-innen mit Polypharmazie analysiert werden. Es gibt aus der Schweiz nur eine Studie zu Medikamenteninteraktionen im ambulanten Bereich (8). Zur Anwendung des SGAIM-Qualitätsfaktors in der Hausarztpraxis gibt es noch keine Daten.
Methode
Setting und Studienpopulation
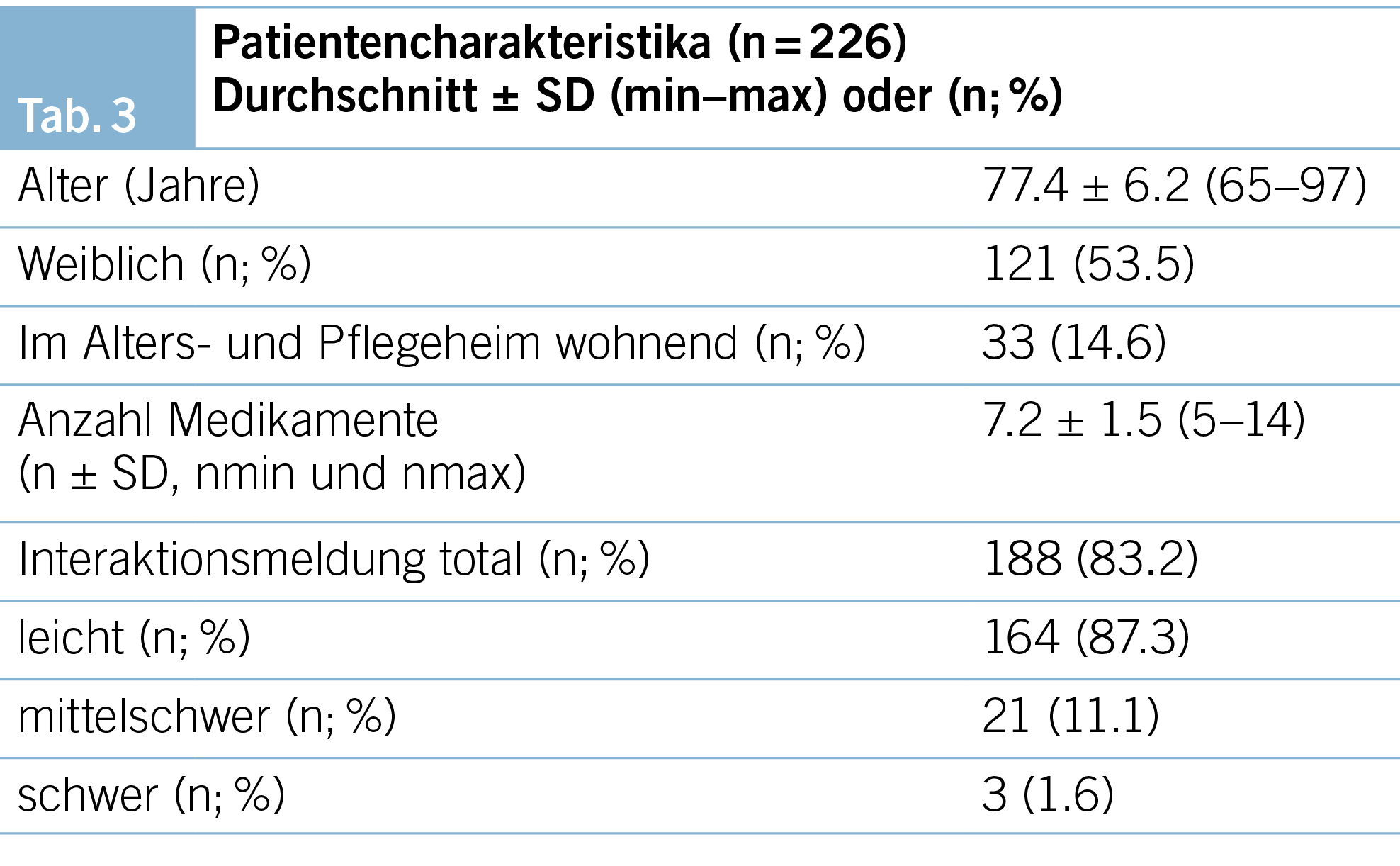
Die Studie wurde in einer Gruppenhausarztpraxis mit sechs praktizierenden Ärzten und Ärztinnen mit dem Facharzttitel Allgemeine Innere Medizin durchgeführt, welche in der Stadt Basel in einem Gebiet mit hoher soziokultureller Durchmischung liegt. Eingeschlossen wurden alle Patient/-innen ≥ 65 Jahre alt mit ≥ 5 Medikamenten, welche einen Sprechstundentermin in der Hausarztpraxis im Zeitraum vom 1.1.2022 bis 31.12.2022 hatten. Die Patient/-innen wurden retrospektiv im Frühjahr 2023 anhand der elektronischen Patientenagenda mit der Praxis Software Vitodata® identifiziert. Die Erfassung der Patientencharakteristika umfasste Alter, Geschlecht, Wohnform (zu Hause oder Alters- und Pflegeheim) und Anzahl Medikamente.
Zum Einschluss führte nur eine Dauermedikation, welche in der elektronischen Krankengeschichte festgehalten war. Bedarfsmedikation und pausierte Medikamente wurden nicht berücksichtigt, ebenso wenig wie nicht rezeptpflichtige «over the counter»-Medikation. Medikamente, die keine oder lediglich geringfügige systemische Wirksamkeit haben, wurden ebenfalls nicht berücksichtigt. Hierzu zählten Inhalativa, Externa (Salben und Gels), Augentropfen, Suppositorien und Vaginalcremes und -zäpfchen. Nahrungsergänzungsmittel und Substitutionstherapien (Eisen-, Calcium- und Magnesiumpräparate, Vitamin D und Vitamin B12).
Software zur Interaktionsprüfung
Zur Erfassung der Medikamenteninteraktionen wurde die Onlineanwendung compendium.ch (nachfolgend Compendium®) verwendet (https://compendium.ch/). Das Compendium® beinhaltet die Arzneimittelinformationen zu den in der Schweiz zugelassenen Medikamenten. Es verfügt mit dem Clinical Decision Support Check (CDS.CE-Check) über eine Anwendung zur Medikamenteninteraktionsprüfung. Alle in der Schweiz zugelassenen Ärzt/-innen können sich mit ihrer Global Location Number (GLN) kostenlos bei Compendium® registrieren und erhalten dadurch Zugang zu den verschiedenen Anwendungen, unter anderem zur Medikamenteninteraktionsprüfung. Interaktionsmeldungen werden vom Compendium® entsprechend dem Schweregrad folgendermassen eingeordnet: Tab. 2.
Statistik
Deskriptive Daten werden präsentiert als Anzahl und Prozent für kategorische Variablen und Durchschnitt mit Standardabweichung (SD) für kontinuierliche Variablen. Multivariate Regression werden als Odds Ratio (OR) mit Konfidenzintervall (CI) und entsprechendem p-Wert angegeben. Ein p-Wert < 0.05 wurde als statistisch signifikant betrachtet. Für die Berechnungen wurde das Statistikprogramm R verwendet.
Resultate
Im untersuchten Zeitraum wurden insgesamt 4546 Patient/-innen von den sechs Arztpersonen behandelt. Davon waren 226 (5.1 %) Patient/-innen ≥ 65 Jahren und hatten zudem eine Dauermedikation mit ≥ 5 Medikamenten. Von den 226 Patient/-innen nahmen 188 (83.2 %) eine Medikamentenkombination ein, welche bei der Überprüfung im Computerprogramm Compendium® eine Interaktionsmeldung auslöste, wobei nur bei 3 Individuen die Interaktion von der Software als «schwer» bewertet wurde. Die Details bezüglich Patientencharakteristika und der Interaktionsmeldungen sind in Tab. 3 dargestellt.
An Interaktionsmeldungen beteiligte Wirkstoffgruppen
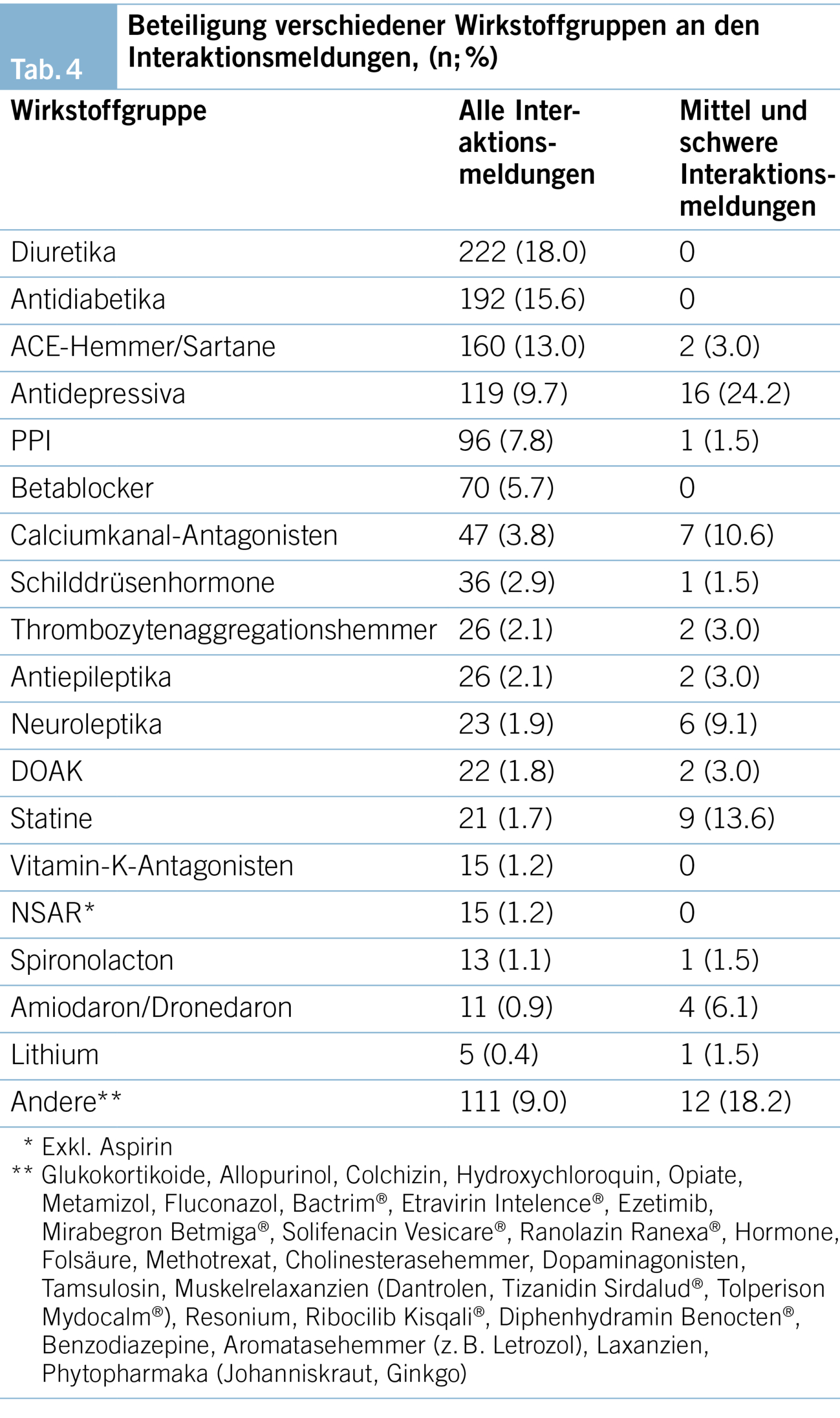
In Tabelle 4 sind die an den Interaktionsmeldungen beteiligten Wirkstoffgruppen aufgelistet. Diuretika sind mit fast einem Fünftel am häufigsten an Interaktionsmeldungen beteiligt. Fast ebenso häufig sind Wirkstoffe, welche nicht als eigene Wirkstoffgruppe aufgeführt wurden («andere»). Bei mittelschweren und schweren Interaktionen sind Antidepressiva am häufigsten identifiziert worden (Tab. 4).
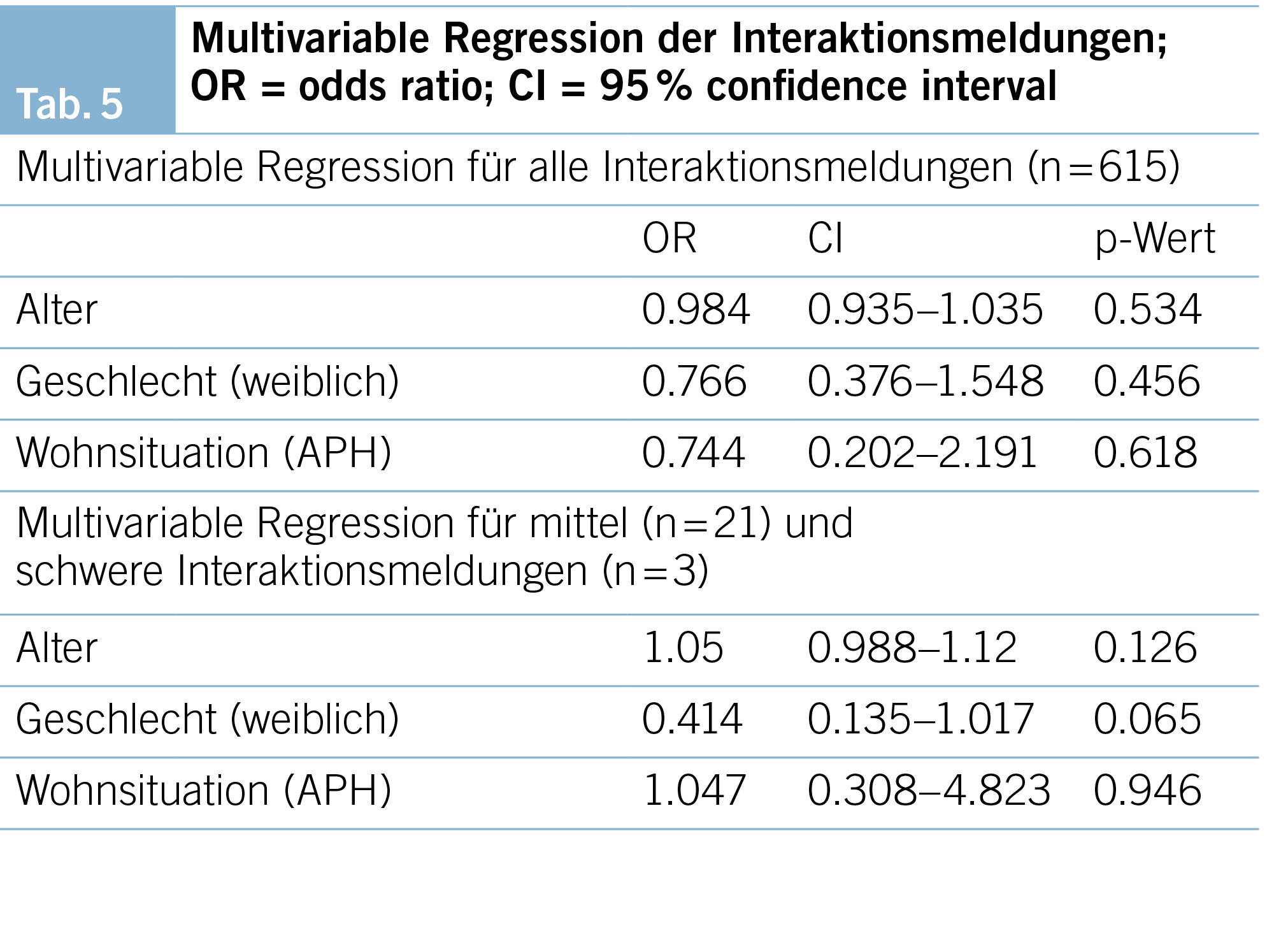
Zur Prüfung von möglichen Assoziationen wurde eine multivariable Analyse durchgeführt. Die Auswertungen ergaben keine statistisch signifikante Assoziation vom Alter, Geschlecht oder von der Wohnsituation zum Vorkommen von Interaktionsmeldungen, auch nicht bezüglich Vorkommen von mittelschweren oder schweren Interaktionsmeldungen (Tab. 5).
Fallbeschreibung einer schweren Interaktion: Amiodaron–Citalopram
Effekt: QT-Zeit-Verlängerung
Es handelte sich um eine Patientin mit mittelschwerer Mitralinsuffizienz und intermittierendem Vorhofflimmern, bei welcher ein Schrittmacher (DDD) implantiert worden war. Sie wurde aufgrund eines Brady-Tachy-Syndroms mit Amiodaron behandelt und war frequenzkontrolliert. Citalopram wurde erst im Verlauf wegen einer depressiven Verstimmung eingesetzt.
Klinische Konsequenz
In diesem Fall war die Interaktionsmeldung mit der Warnung vor einer QT-Zeit-Verlängerung gerechtfertigt. Die Verlängerung der QT-Zeit im EKG gilt als Indikator für ein erhöhtes Risiko für Torsade-de-pointes-Tachykardien. Die behandelnde Arztperson wurde vom Studienteam informiert. Das QTc Intervall war im EKG mit 492 ms verlängert, weswegen Citalopram in dieser Konstellation gestoppt wurde. Das Risiko für eine QT-Zeit-Verlängerung ist eine sehr häufige Interaktion, die Relevanz ist oft unklar. Wichtig zu erwähnen ist, dass bei einer QT-Zeit-Verlängerung eine Substanz nicht zwingend abgesetzt werden muss. EKG-Kontrollen mit Messung der QT-Zeit im Steady State der QT-verlängernden Substanzen ist oft ausreichend (9).
Bei den anderen beiden «schweren» Interaktionen in der untersuchten Population handelte es sich um einen Patienten mit einer Kombinationstherapie von Trazodon und Clozapin und einer Patientin mit Donepezil und Citalopram. Bei beiden Kombinationen kann es zu einer relevanten QT-Zeit-Verlängerung kommen. Als Konsequenz der Datensammlung wurde die entsprechende Arztperson informiert. Trazodon und Donepezil wurden in der Folge abgesetzt.
Diskussion
Diese retrospektive Studie in einer hausärztlichen Gruppenpraxis untersuchte bei Patient/-innen ≥ 65 Jahre und einer Polypharmazie von ≥ 5 Dauermedikamenten anhand der Software Compendium® zur Medikamenteninteraktionsprüfung die Häufigkeit und den Schweregrad von Medikamenteninteraktionen. Diese Überprüfung von Medikamenteninteraktionen wird von der Schweizerischen Gesellschaft für Allgemeine Innere Medizin (SGAIM) als Qualitätsindikator für die Behandlung der Bevölkerung gelistet. Die Software identifizierte bei 9 von 10 Patienten eine Interaktionsmeldung, wobei die überwiegende Mehrheit als leichtgradig und fraglich klinisch relevant eingestuft wurde. Bei den wenigen mittelschwer oder schwer eingestuften Interaktionsmeldungen waren hauptsächlich Antidepressiva und das Klasse-III-Antiarrhythmikum Amiodaron beteiligt.
Bei der Überprüfung mit einer Interaktionssoftware werden jeweils nur Interaktionen zwischen zwei Medikamenten angezeigt, additive Effekte bei mehr als zwei Medikamenten mit derselben Interaktion werden nicht erkannt (zum Beispiel mehr als zwei QT-verlängernde Medikamente). Die Grunderkrankungen des Patienten oder der Patientin und die Indikation zum Medikamenteneinsatz werden nicht erfasst und können somit auch nicht durch die Software überprüft werden. Dies führt dazu, dass Medikamente, welche bei einer Grunderkrankung (zum Beispiel Nieren- oder Leberinsuffizienz, Zytopenie) kontraindiziert sind, nicht angezeigt werden.
Mehrheitlich leichtgradige Interaktionsmeldungen
Die allermeisten Interaktionsmeldungen betrafen leichtgradige Interaktionen. Als Beispiel wird bei der Kombination von einem Betablocker und einem Insulin immer eine Interaktion mit leichtem Schweregrad gemeldet, egal ob es sich um einen kardioselektiven oder nicht kardioselektiven Betablocker handelt. Wenn jedoch eine Indikation für beide Medikamentengruppen besteht, ist die Therapie mit einem kardioselektiven Betablocker medizinisch korrekt und die Meldung somit nicht relevant. Die Interaktionsmeldung ist aufgrund der zu groben Generalisierung, konkret der Zusammenfassung aller Betablocker, in den meisten Fällen überflüssig.
Bei der Kombination von Schilddrüsenhormonen mit Protonenpumpeninhibitoren (PPI) wird die reduzierte Resorption gemeldet. Dies ist korrekt, hat aber in der Praxis dazu geführt, dass Patient/-innen instruiert werden, die Schilddrüsenhormone nüchtern und 30 Minuten vor dem PPI einzunehmen. Wenn dies befolgt wird, fällt die Interaktion weg und ist somit nicht mehr relevant. Die Interaktionsmeldung ist aufgrund des fehlenden Einbezugs des Einnahmezeitpunktes, konkret der nüchternen Einnahme, in den meisten Fällen überflüssig.
Eine weitere häufige Interaktionsmeldung (n = 48) betrifft das erhöhte Risiko einer schweren Hypomagnesiämie bei gleichzeitiger Einnahme von Diuretika und eines PPI. Eine prospektive Studie belegt, dass die Einnahme von PPIs das Risiko einer Hypomagnesiämie in der Allgemeinbevölkerung erhöht, insbesondere bei längerer Einnahmedauer des PPI und gleichzeitiger Einnahme von Schleifendiuretika (10). Eine schwere Hypomagnesiämie tritt aber sehr selten auf, und Hospitalisationen aufgrund einer durch PPI verursachten Hypomagnesiämie sind eine Rarität. Es ist somit fraglich, ob die 2011 durch die Food and Drug Administration (FDA) empfohlene Überwachung der Magnesiumkonzentration im Plasma bei diesen Patient/-innen verhältnismässig ist (11). Die häufigste Meldung in der Interaktionssoftware ist somit ebenso unverhältnismässig.
Bei den schweren und mittelschweren Medikamenteninteraktionen ist oft (Es-)Citalopram beteiligt. Dies ist vor allem darauf zurückzuführen, dass Citalopram wie viele andere Psychopharmaka zur QT-Zeit-Verlängerung führen und dadurch das Risiko für eine Torsade-de-pointes-Tachykardie erhöhen kann. Die Häufigkeit von Torsade-de-pointes-Tachykardien bei Arzneimitteln nicht kardialer Indikation wird in der Fachinformation im Compendium® mit 1:10 000 bis 1:1 000 000 angegeben. Einen Einfluss auf die häufigen Interaktionsmeldungen hat sicher auch, dass Citalopram als Erstlinientherapie für verbreitete Krankheiten wie Depressionen und Angststörungen oft eingesetzt wird, sodass entsprechend viele Interaktionsmeldungen ausgelöst werden. Hinzu kommt, dass fast alle Antidepressiva eine QT-Zeit-Verlängerung verursachen können (Ausnahmen z. B. Agomelatin Valdoxan®, Vortioxetin Brintellix®, Johanniskraut) und es somit wenig Alternativen gibt, wenn eine behandlungsbedürftige Depression vorliegt.
Software zur Interaktionsprüfung nicht perfekt
Da die meiste Software zur Interaktionsprüfung kommerziell und oft kostenpflichtig ist, haben die Anbieter ein Interesse daran, sich juristisch abzusichern. Möglichst keine Interaktionsmeldung zu verpassen, hat daher Priorität vor praxisrelevanten Informationen. Für eine höchstmögliche Sicherheit sind falsch negative (verpasste) Interaktionsmeldungen schwerwiegender als falsch positive (überflüssige), weshalb Sensitivität der Spezifität vorgezogen wird. Dies führt zu einem sehr engmaschigen Netz an Interaktionsmeldungen und einer konservativen Risikoeinschätzung mit vielen Aufforderungen zu Vorsichtsmassnahmen. Der Hersteller der Website des Compendium® verweist ebenfalls darauf, dass die Anwendung nicht benutzt werden darf, um automatische Therapieentscheidungen abzuleiten und die Verantwortung immer bei dem oder der verschreibenden Arzt oder Ärztin liegt.
Eine Studie von Tukukino et al. aus Schweden befasste sich mit der Fragestellung, welche medizinisch gerechtfertigten Handlungen Interaktionswarnungen erfordern und wie mit diesen umgegangen wird (12). Die Autor/-innen konnten zeigen, dass die meisten Interaktionsmeldungen im klinischen Kontext nicht relevant waren oder durch den oder der behandelnden Arzt oder Ärztin bereits angegangen wurden, sei es durch Labor-, EKG- oder klinische Kontrollen. Nur etwa 1 von 10 Interaktionsmeldungen erforderte zusätzlich eine Handlung, vor allem bei schwerwiegenderen Interaktionsmeldungen: bei 44 % in der Kategorie «schwer», bei 16 % der Kategorie C «mittel» im Vergleich zu 0 % in der Kategorie «leicht». Die einzuleitenden Massnahmen umfassten den Wechsel zu einem anderen Medikament der gleichen Wirkstoffgruppe, der getrennten Einnahme der Medikamente, dem Durchführen einer Laboruntersuchung und Einholen von weiteren Informationen (12).
Diese Ergebnisse lassen sich gut mit unseren Erkenntnissen vereinbaren und zeigen, dass viele Interaktionsmeldungen durch weitere patientenspezifische Informationen (Indikation, Co-Medikation, Intervention, Erkrankung, Dosierung, Einnahmezeitpunkt) und bereits bestehende Kontrollen (Labor, EKG, klinische Kontrollen) keine Handlung erfordern und somit die klinische Relevanz kontrolliert ist.
Interaktionsprüfungsprogramme könnten vermutlich bessere und vor allem spezifischere Ergebnisse liefern, wenn sie auf mehr Informationen Zugriff hätten (z. B. Nierenfunktion, Elektrolyte, INR, TSH, Spiegelbestimmungen, QT-Zeit im EKG, Medikamentendosierung, Einnahmezeitpunkt). Es stellt sich dann aber die Frage der Machbarkeit und der Anwenderfreundlichkeit, denn nur wenn diese Daten automatisiert in die Interaktionsprüfung miteinbezogen werden könnten, wäre ein tatsächlicher Nutzen und eine Zeitersparnis vorhanden; die manuelle Eingabe der Daten nimmt mehr Zeit in Anspruch als die Überlegungen zur patientenbezogenen Relevanz durch die behandelnden Ärzt/-innen.
Evidenz zu Medikamenteninteraktionen mehrheitlich im Spital erhoben
Beim Vergleich zum Vorkommen von Medikamenteninteraktionen ist es entscheidend, potenzielle Medikamenteninteraktionen, also Meldungen von Programmen zur Interaktionsprüfung, zu unterscheiden von tatsächlich eingetretenen unerwünschten Arzneimittelwirkungen durch eine Medikamenteninteraktion, denn hier zeigt sich eine deutliche Diskrepanz. Im Spital werden gemäss einer Metaanalyse bei 33 % der Patient/-innen potenzielle Medikamenteninteraktionen gefunden (13). Unerwünschte Arzneimittelwirkungen durch eingetretene Medikamenteninteraktionen sind hingegen für 1.1 % der Spitaleinweisungen verantwortlich und treten bei 1 % der hospitalisierten Patient/-innen auf (14, 15).
Die grosse Differenz an potenziellen Medikamenteninteraktionen und tatsächlich eingetretenem Schaden durch Medikamenteninteraktionen deutet darauf hin, dass Interaktionsmeldungen allein kein idealer Prädiktor für unerwünschte Arzneimittelwirkungen sind. Um unerwünschte Arzneimittelwirkungen durch Medikamenteninteraktionen zu verhindern, reicht es also nicht aus, die Anzahl potenzieller Medikamenteninteraktionen zu überwachen und zu minimieren. Dies würde einen grossen Aufwand bedeuten, ohne dass ein Nutzen dadurch sicher wäre, und könnte auch zu unnötigem Medikamentenwechsel führen.
Pharmakologische Interaktionen wurden bisher grossmehrheitlich im Spital untersucht. Unsere Studie ist die erste, die den Qualitätsindikator der Medikamenteninteraktionsprüfung der SGAIM in der Hausarztpraxis anwendet. Das regelmässige Überprüfen der Medikation auf Interaktionen scheint zunächst ein geeigneter Indikator für eine qualitativ gute medizinische Betreuung zu sein, da unerwünschte Arzneimittelwirkungen durch Medikamenteninteraktionen vermeidbar sind. Der Indikator ist zwar einfach messbar, misst aber nicht die Qualität, sondern ist ein behelfsmässiger Stellvertreter dafür. Es benötigt also immer zwingend die behandelnden Ärzte/-innen, welche mit den vorhandenen Informationen die Interaktionsmeldung überprüfen und mithilfe ihres klinischen Wissens einordnen können.
Stärken und Limitationen
Ein Pluspunkt der Studie ist, dass zur Interaktionsprüfung mit dem Compendium® ein Programm benutzt wurde, das für alle Schweizer Ärzt/-innen kostenlos zugänglich ist und alle in der Schweiz zugelassenen Medikamente beinhaltet. Das Programm wurde (in seiner erweiterten Version Pharmavista) bereits auf seine Qualität geprüft und hat im Vergleich zu anderen international häufig verwendeten Programmen (Drug Interaction Facts, Drug-Reax und Lexi-Interact) gut abgeschnitten (16). Diese Daten stammen allerdings aus dem Jahre 2008, und die damals untersuchten Tools wurden in der Zwischenzeit stetig weiterentwickelt und erweitert. In der Schweiz durchgeführte Studien zu Medikamenteninteraktionen verwendeten ebenfalls die erweiterte Version des Compendium®, sodass sich die Ergebnisse gut untereinander vergleichen lassen (8, 17). Eine nicht in der Studie verwendete Software ist erwähnenswert: Lexicomp von UptoDate. In Lexicomp-interact ist in der Regel sowohl der pathophysiologische Zusammenhang als auch die Quantifizierung mittels Änderung in % der Cmax/AUC kurz angegeben und mit entsprechenden Studien referenziert.
Da nur die Dauermedikation untersucht wurde, sind Medikamentengruppen, welche oft als Bedarfsmedikation oder nur kurzzeitig eingesetzt werden, in dieser Studie nicht genügend untersucht, obwohl diese auch relevante Medikamenteninteraktionen verursachen können, wie zum Beispiel Antibiotika oder Analgetika. NSAR waren die Medikamentengruppe, welche am häufigsten zu Hospitalisationen aufgrund Medikamenteninteraktionen führte (14). Wenn eine jährliche Interaktionsprüfung wie von der SGAIM empfohlen durchgeführt wird, werden zeitlich begrenzt eingesetzte Medikamente jedoch auch nicht erfasst und die entsprechenden Interaktionen nicht gefunden – falls sie nicht sowieso schon bekannt sind. Eine klare Schwäche der Studie ist das Setting in nur einer hausärztlichen Gruppenpraxis in einer urbanen Umgebung. Deswegen sind die Resultate nicht generalisierbar, jedoch ein erster Hinweis, was der von der SGAIM vorgeschlagene Qualitätsindikator in der täglichen Praxis bedeuten kann.
Zukünftige Studien in grösseren Populationen können inskünftig ein klareres Bild zeichnen, welches Potenzial die Empfehlungen der Messung von Medikamenteninteraktionen zur Verbesserung der Behandlungsqualität hat.
Zusammenfassend für die Klinik scheint das regelmässige Überprüfen der Medikation auf Interaktionen zunächst ein geeigneter Indikator für eine qualitativ gute medizinische Betreuung zu sein, da unerwünschte Arzneimittelwirkungen durch Medikamenteninteraktionen vermeidbar sind. Die verschiedenen verfügbaren Programme zur Medikamenteninteraktionsprüfung sind jedoch alle nicht unfehlbar, und es gibt einzelne Interaktionen, welche nicht erkannt und gemeldet werden. Häufig treten Meldungen auf, welche nach klinischer Beurteilung als nicht relevant eingestuft werden und keine Handlung erfordern. Gemessen werden kann also lediglich, ob eine Überprüfung der Medikamenteninteraktionen durchgeführt wurde. Nicht gemessen wird damit, ob ein qualitativ gutes Programm benutzt wurde, ob die Interaktionsmeldungen korrekt interpretiert und eingeordnet wurden, ob die Nutzen-Schaden-Bilanz nachvollziehbar gezogen wurde, alternative Medikamente geprüft und entsprechende Kontrollen veranlasst wurden
Universitätsinstitut für Hausarztmedizin beider Basel (UNIHAM-BB)
Medizinische Fakultät
Universität Basel
4001 Basel
Universitäres Zentrum für Hausarztmedizin beider Basel (uniham-bb),
Basel
Die Autorin und der Autor haben keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
1. Barnett, K., S. W. Mercer, M. Norbury, G. Watt, S. Wyke and B. Guthrie. Epidemiology of multimorbidity and implications for health care, research, and medical education: a cross-sectional study. Lancet 2012; 380(9836): 37-43.
2. Excoffier. S., L. Herzig, A. A. N‘Goran, A. Déruaz-Luyet and D. M. Haller. Prevalence of multimorbidity in general practice: a cross-sectional study within the Swiss Sentinel Surveillance System (Sentinella). BMJ Open 2018;8(3): e019616.
3. Masnoon, N., S. Shakib, L. Kalisch-Ellett and G. E. Caughey. What is polypharmacy? A systematic review of definitions. BMC Geriatr 2017;17(1): 230.
4. Van Spall, H. G., A. Toren, A. Kiss and R. A. Fowler. Eligibility criteria of randomized controlled trials published in high-impact general medical journals: a systematic sampling review. JAMA 2007;297(11): 1233-1240.
5. Guthrie B, Boyd CM. Clinical Guidelines in the Context of Aging and Multimorbidity Public Policy & Aging Report, 2018;28 (4): 143–149
6. Boyd, C. M., J. Darer, C. Boult, L. P. Fried, L. Boult and A. W. Wu. Clinical practice guidelines and quality of care for older patients with multiple comorbid diseases: implications for pay for performance. JAMA 2005;294(6): 716-724.
7. https://www.sgaim.ch/de/qualitaet/qualitaet-in-der-praxis/qualitaetsindikatoren, (accessed 7 June 2024)
8. Bucher, H. C., R. Achermann, N. Stohler and C. R. Meier (). Surveillance of Physicians Causing Potential Drug-Drug Interactions in Ambulatory Care: A Pilot Study in Switzerland. PLoS One 2016;11(1): e0147606.
9. Khatib, Rani et al. “Managing drug-induced QT prolongation in clinical practice.” Postgraduate medical journal vol. 97,1149 (2021): 452-458. doi:10.1136/postgradmedj-2020-138661.
10. Kieboom, B. C., J. C. Kiefte-de Jong, M. Eijgelsheim, O. H. Franco, E. J. Kuipers, A. Hofman, R. Zietse, B. H. Stricker and E. J. Hoorn. Proton pump inhibitors and hypomagnesemia in the general population: a population-based cohort study. Am J Kidney Dis 2015;66(5): 775-782.
11. https://www.fda.gov/drugs/drug-safety-and-availability/fda-drug-safety-communication-low-magnesium-levels-can-be-associated-long-term-use-proton-pump
12. Tukukino, C., N. Parodi López, S. A. Svensson and S. M. Wallerstedt. Drug interaction alerts in older primary care patients, and related medically justified actions. Eur J Clin Pharmacol 2022;78(7): 1115-1126.
13. Zengh W, Richardson LC, L. Li, Day RO, Westbrook JI, Baysari MT. Drug-drug interactions and their harmful effects in hospitalized patients: a systematic review and meta-analysis. Eur J Clin Pharmacol 2018;74:15–27.
14. Krähenbühl-Melcher, A., R. Schlienger, M. Lampert, M. Haschke, J. Drewe and S. Krähenbühl. Drug-related problems in hospitals: a review of the recent literature.“ Drug Saf 2007;30(5): 379-407.
15. Dechanont, S., S. Maphanta, B. Butthum and C. Kongkaew. Hospital admissions/visits associated with drug-drug interactions: a systematic review and meta-analysis. Pharmacoepidemiol Drug Saf 2014;23(5): 489-497.
16. Vonbach P, Dubied A, Krähenbühl S, Beer JH. Evaluation of frequently used drug interaction screening programs. Eur J Intern Med 2008;19(6):413-20.
17. Bertoli, R., M. Bissig, D. Caronzolo, M. Odorico, M. Pons and E. Bernasconi. Assessment of potential drug-drug interactions at hospital discharge. Swiss Med Wkly 2010;140: w13043.