- COVID-19 und das Herzgefäss-System
COVID-19, die durch das SARS-CoV-2-Virus verursachte Krankheit, dominiert gegenwärtig unser berufliches Tun.
Deshalb versuche ich anstelle eines Editorials eine Zusammenfassung der Beteiligung respektive der Auswirkung von COVID-19 auf das Herzkreislaufsystem zu geben.
Obwohl COVID-19 vor allem die oberen Luftwege und die Lunge befällt, kommt es bei einigen Patienten zur schweren kardialen Mitbeteiligung. Zudem werden kardiovaskuläre Faktoren für die Pathogenese und den Krankheitsverlauf mitverantwortlich gemacht. Das Angiotensin-Converting-Enzyme-2 (ACE-2) dient als Rezeptor und Eintrittspforte für das SARS-CoV-2-Virus in die Zelle. Ob ACE-Hemmer oder Angiotensin-Rezeptoren-Blocker (ARB) das ACE-2 modifizieren und dadurch die Infektion begünstigen, ist nicht sicher geklärt. Für den Verlauf der SARS-CoV-2-Infektion könnte die vermehrte Expression von ACE-2 aber eine günstige Wirkung haben. Das von ACE-2 produzierte Angiotensin-(1-7) wirkt dem schädlichen Effekt von Angiotensin-II entgegen und vermindert den Lungenschaden. Die Schädigung des Myokards durch COVID-19 kann direkt oder indirekt erfolgen. Da auch Myozyten ACE-2-Rezeptoren exprimieren, kann es zu einer direkten Infektion des Herzens im Sinne einer Myokarditis kommen. Im Verlauf der schweren COVID-19-Infektion mit ARDS kann eine von Zytokinen vermittelte myokardiale Schädigung auftreten, welche mit einem schlechten Verlauf einhergeht. Patienten mit kardiovaskulären Vorerkrankungen gelten als besonders gefährdet und zählen zur Risikogruppe für eine COVID-19-Infektion. Der Einfluss kardiovaskulärer Vorerkrankungen auf die Infektanfälligkeit oder auf den Verlauf der COVID-19-Krankheit ist aber weitgehend unklar.
Klinische Manifestation von COVID-19
COVID-19 wird durch das Severe Acute Respiratory Syndrome Coronavirus-2 (SARS-CoV-2) verursacht. Es ist das siebte bekannte, für den Menschen pathogene Coronavirus. Vier Coronaviren (229E, OC43, NL63 und HKU1) verursachen einen «gewöhnlichen» Schnupfen. Drei Coronaviren können mit einer, wie es im Namen ausgedrückt ist, schweren Lungenentzündung einhergehen. Das SARS-CoV-Virus war für das Severe Acute Respiratory Syndrome (SARS) des Jahres 2002 und das MERS-CoV-Virus für das Middle East Respiratory Syndrome (MERS) des Jahres 2012 verantwortlich. Das SARS-CoV-2 hat mit dem SARS-CoV- und dem MERS-CoV-Virus gemeinsam, dass es wahrscheinlich von Fledermäusen über einen Zwischenwirt auf den Menschen übertragen wurde. Beim SARS-CoV-2-Virus ist möglicherweise das malaiische Schuppentier dieser Zwischenwirt (1, 2). Zwei Oberflächenproteine der menschlichen Zellen interagieren mit dem SARS-CoV-2-Virus vor dessen Eintritt in die Zelle. Das erste ist eine Proteinase, die transmembrane Proteinase Serin 2 (TMPRSS2), das zweite das Angiotensin-Converting-Enzyme-2 (ACE-2) (3). Die Proteinase (TMPRSS2) aktiviert am Spike-Protein des SARS-CoV-2-Virus die sogenannte rezeptorbindende Domäne. ACE-2 ist eine membrangebundene Aminopeptidase, deren Aufgabe die Spaltung von Angiotensin-II ist. Im Falle einer Infektion mit SARS-CoV-2 dient es aber als Rezeptor für das aktivierte Spike-Protein des Virus. Der ACE-Virus-Komplex gelangt mittels Endozytose in die Zelle. ACE-2 wird in hohem Masse in den alveolären epithelialen Zellen und den Endothelzellen der Lunge, dem Herz, aber auch im Epithel des Magendarmtrakts, dem Endothel und der Niere exprimiert. Das Spike-Protein des SARS-CoV-2-Virus sitzt übrigens wie eine Zacke auf der ovalen Oberfläche des Virus. Im Elektronenmikroskop ergibt dies ein Bild ähnlich einer Krone mit Zacken, daher der Name Coronavirus.
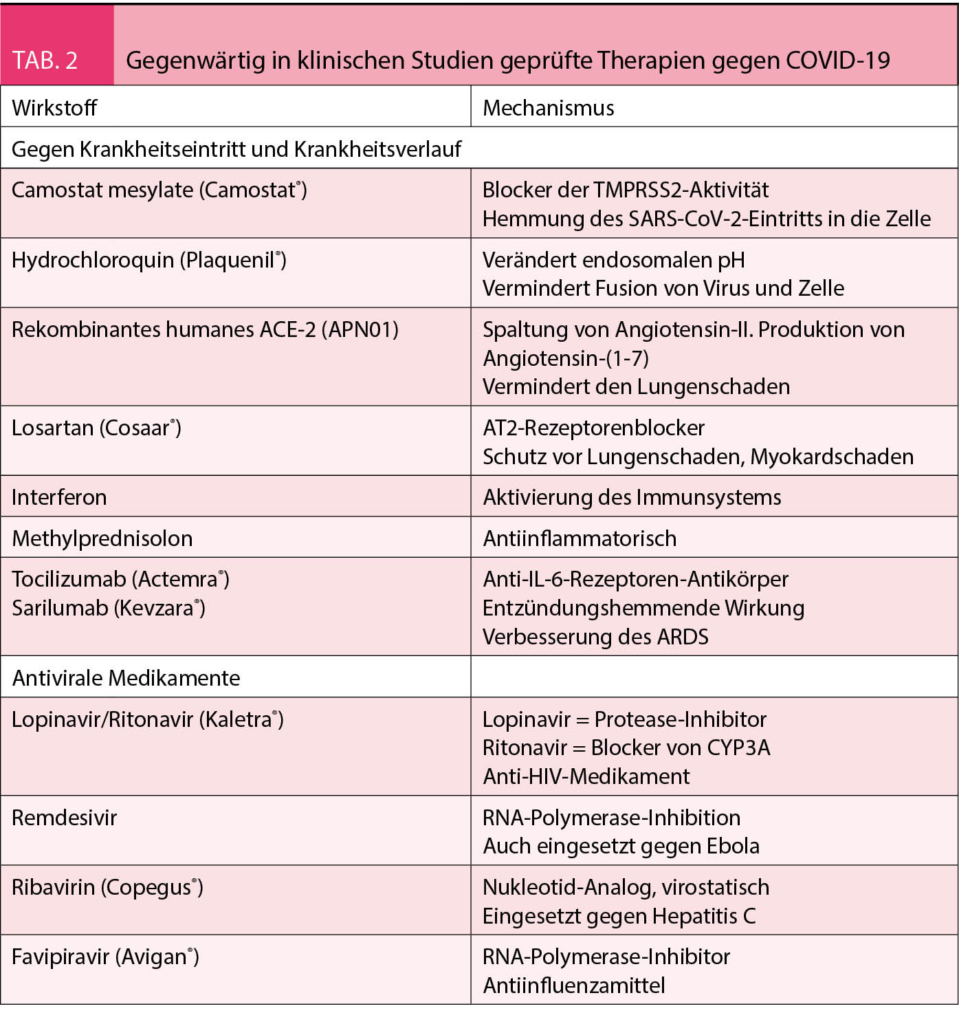
Es wird angenommen, dass die Übertragung vorwiegend über Tröpfchen des Atemsystems erfolgt, ähnlich wie bei der Influenza (4). Die Inkubationszeit variiert zwischen 2-14 Tagen. Angesteckte Individuen bleiben infektiös, d. h. können die Krankheit zwischen acht bis 37 Tage übertragen. Bei über 90% der Infizierten können aber 10 Tage nach Ausbruch der Symptome keine Viren mehr nachgewiesen werden. Wie allgemein bekannt, variiert die Klinik der Krankheit stark und die Schwere der Krankheit ist altersabhängig. Ein unbekannter, vielleicht beträchtlicher Teil der angesteckten Personen kann asymptomatisch bleiben. Interessanterweise finden sich aber auch bei asymptomatischen Patienten in 50% in einer CT-Untersuchung der Lunge die Zeichen der Infektion mit typischen retikulären Zeichen und Verschattungen. Die klinischen Symptome sind in der Tabelle 1 zusammengefasst. Die Krankheit beginnt meist mit Symptomen einer Infektion der oberen Luftwege und des Nasenrachenraums. Selten können Übelkeit und Durchfall die ersten Symptome sein (5). Eine Pneumonie mit Dyspnoe entwickelt sich meist über Tage. Damit einhergehend steigt das Fieber an, welches am Anfang der Infektion fehlen kann. Ausgeprägte Hustenattacken provoziert durch die Passage der Nahrung im Rachenraum kann die Nahrungsaufnahme bei einigen Patienten praktisch verunmöglichen. Hohes Fieber, Tachypnoe und Sättigungsabfall deutlich unter 90% sind die häufigsten Gründe für eine Hospitalisation. Von den wegen der Tachypnoe und Hypoxämie hospitalisierten Patienten müssen 75% intubiert und beatmet werden. Bei 50% der wegen des ARDS beatmeten Patienten kommt es im Verlauf zu einem Nierenversagen, welches eine Hämodialyse erfordert. Gegenwärtig laufen viele klinische Studien mit Medikamenten, die den Krankheitsverlauf in den verschiedenen Stadien günstig zu beeinflussen versuchen. Die wichtigsten sind in der Tabelle 2 aufgeführt. Die Beherrschung der Infektion ist aber schlussendlich nur durch einen potenten Impfstoff möglich.
Das Renin-Angiotensin-Aldosteron-System (RAAS) und COVID-19
Initiale Berichte über eine erhöhte Prävalenz von COVID-19 bei Patienten mit Hypertonie haben Spekulationen geschürt, dass die Therapie mit ACE-Hemmern und Angiotensin-Rezeptoren-Blockern (ARB) die Infektiosität erhöht durch eine Hochregulation des ACE-2 (6). Von einigen Wissenschaftlern, und von der Presse deutlich verstärkt, wurde empfohlen ACE-Hemmer und ARBs durch andere antihypertensive Medikamente zu ersetzen, um die Pandemie zu verlangsamen (6). Die Wirkung des RAAS-Systems und seine Regulation ist jedoch komplex, indem gegen jeden Wirkmechanismus systemeigene gegenregulatorische Mechanismen vorhanden sind. Darum ist ein direkter Zusammenhang zwischen ACE-2-Expression und Infektanfälligkeit nicht so einfach herzustellen. Das ACE-2 ist ein Schlüsselenzym der protektiven Achse des RAAS. Seine Rolle in der COVID-Infektion kann vielleicht am besten als zweischneidiges Schwert bezeichnet werden (7).
Um dies verständlich zu machen, müssen wir uns den Wirkmechanismus des Renin-Angiotensin-Aldosteron-Systems vor Augen halten. Das RAAS wird in der Infektion angeregt und es kommt zur üblichen Spaltung von Angiotensin-I zu Angiotensin-II durch das Angiotensin-Converting-Enzyme. Das Angiotensin-II bindet sich an den AT1-Rezeptor und führt so zu den bekannten Wirkungen, d.h. Vasokonstriktion, Erhöhung der vaskulären Permeabilität, Fibrose, Zellproliferation, Entzündung und damit zu akutem Lungenschaden und unvorteilhaftem myokardialem Remodeling. Diesen Effekten des Angiotensin-II stehen zwei gegenläufige Regelkreise gegenüber. Zum einen bindet sich das Angiotensin-II nicht nur an den AT1-Rezeptor, sondern auch an den AT2-Rezeptor, welcher gegenteilige Effekte auslöst, z.B. zu einer Vasodilatation und Antiproliferation führt. Der wichtigere gegenregulatorische Regelkreis läuft aber über das Angiotensin-Converting-Enzyme-2 (ACE-2). Die Aufgabe von ACE-2 ist es, Angiotensin-II in Angiotensin-(1-7) zu spalten, welches über den Mas-Rezeptor den Wirkungen des Renin-Angiotensin-Systems entgegenwirkt. Das Angiotensin-(1-7) via Mas-Rezeptor hat eine antihypertrophe, antifibrotische, vasodilatierende, antiinflammatorische und antioxidative Wirkung (7). Im Rahmen der SARS-CoV-2-Infektion vermindert es die alveoläre Zellapoptose, die endotheliale Zellaktivierung, die Ödembildung und begrenzt die Bildung von proinflammatorischen und profibrotischen Zytokinen (8). In der COVID-19-Krankheit wird das ACE-2-Regelsystem aber folgendermassen nachhaltig gestört. Das SARS-CoV-2-Virus tritt als Komplex mit dem ACE-2 in die Zelle ein. Durch die gemeinsame Endozytose wird das ACE-2 von der Zelloberfläche entfernt. Dadurch wird potentiell die Wirkung des Angiotensin-II verstärkt und dies kann den Lungenschaden bei der COVID-19-Krankheit verstärken. In der SARS-Krankheit wurde der protektive Effekt von Angiotensin-(1-7) und des ACE-2 als wichtig für einen günstigen Krankheitsverlauf erkannt (9). Es ist gut möglich, dass eine Hochregulation des ACE-2 auch in der COVID-19-Krankheit protektiv ist (7, 10). In Tiermodellen konnte jedenfalls gezeigt werden, dass die Virusinfektion zu einer Abnahme des ACE-2 in den Zellmembranen führte und dass eine erhöhte Angiotensin-II-Aktivität zum Gewebeschaden beitrug. Dieser Gewebeschaden konnte experimentell mit ARBs vermindert werden. Des Weiteren hat die Gabe von rekombinantem ACE-2 in präklinischen Studien zu einer Abnahme des Lungenschadens geführt (11). Dazu sind nun klinische Studien im Gang. Ebenso sind Studien am Laufen, um bei hospitalisierten und nicht hospitalisierten Patienten mittels Losartan den Krankheitsverlauf der COVID-19-Infektion zu verbessern (5) (siehe Tab. 2).
Insgesamt spricht die Evidenz also eher dafür, dass die Therapie mit ACE-Hemmern und ARBs eine günstige Wirkung auf den Verlauf der Krankheit hat und dementsprechend haben die Schweizerische Gesellschaft für Kardiologie und die Schweizerische Gesellschaft für Hypertonie sowie praktisch alle grossen Fachgesellschaften empfohlen, dass diese Medikamente nicht abgesetzt resp. kein Wechsel auf ein anderes antihypertensives Medikament vorgenommen werden soll.
Akuter Myokardschaden
Die COVID-19-Krankheit kann mit einem Myokardschaden einhergehen. Es lassen sich zwei unterschiedliche Muster abgrenzen. Zum einen geht mit der allgemeinen Erkrankung des respiratorischen Systems auch eine kardiale Mitbeteiligung einher. Bei etwa 7-17% der COVID-19-Patienten liegt bei Eintritt eine leichte Troponin-Erhöhung vor. Der Anstieg und die erreichte Höhe des Troponins korrelieren mit der Mortalität der Patienten (12, 5, 13). Obwohl bei einigen Patienten auch elektrokardiographische Veränderungen und in der Echokardiographie eine abnehmende Pumpfunktion festgestellt werden konnten, ist die Ursache der kardialen Mitbeteiligung pathophysiologisch nicht geklärt. Es kann zu einer direkten Infektion der Myozyten kommen, wahrscheinlicher aber sind zytokininduzierte Schädigungen des Myokards (12). Da bei vielen Patienten bei ARDS und Schockzustand eine Niereninsuffizienz auftritt und eine Dialyse nötig ist, kann die Niereninsuffizienz zum Anstieg des Troponins beitragen.
Das SARS-CoV-2-Virus kann auch direkt das Myokard schädigen. Etwa 5-10% der Patienten zeigen denn auch als initiale Symptome Palpitationen und Thoraxschmerzen (13, 12). Bei einigen Patienten kommt es zur fulminanten Myokarditis (14). Die fulminante Myokarditis muss entsprechend einer akuten schweren Herzinsuffizienz behandelt werden. Nach Abklingen der Infektion kann sich die Pumpfunktion wieder normalisieren (14). In einigen Fällen scheint sie allerdings zum Tod zu führen (12).
Kardiovaskuläre Vorerkrankungen und Risiko der COVID-19-Krankheit
In den Berichten aus China werden kardiovaskuläre Vorerkrankungen, insbesondere die Hypertonie, als Risikofaktoren aufgeführt. Allerdings betrug die Prävalenz der Hypertonie in der grössten Studie (15) bei COVID-19-Patienten 15%, was unter der Prävalenz der normalen Bevölkerung in der berichteten Altersgruppe in China liegt.
Dass die Prävalenz der kardiovaskulären Vorerkrankungen und der Hypertonie bei den COVID-19-Patienten nicht höher als in der allgemeinen Population ist spricht eher dafür, dass sie nicht wesentlich die Gefahr einer Ansteckung erhöhen. Es bleibt die Frage zu klären, ob kardiovaskuläre Erkrankungen und die Hypertonie den Krankheitsverlauf beeinflussen. Auch in diesem Bereich gibt es keine guten Daten. Wenn die Patientencharakteristika einer multivariaten Analyse unterzogen wurden, war höheres Alter, aber nicht die kardiovaskulären Risikofaktoren und insbesondere nicht die Hypertonie mit dem Entwickeln eines ARDS in der COVID-19 Krankheit assoziiert (16). Des Weiteren hatten Patienten mit kardiovaskulären Vorerkrankungen keine erhöhte Sterblichkeit gezeigt, im Gegensatz zu Patienten, welche durch die Krankheit einen akuten Myokardschaden erlitten (17). Die durch die Entzündung direkte und durch die Zytokin induzierte indirekte myokardiale Schädigung kommt bei Patienten mit und ohne kardiovaskulären Vorerkrankungen gleich häufig vor und ist ein prognostisch schlechtes Zeichen.
Akutes Koronarsyndrom und COVID-19
Entzündliche Krankheiten begünstigen einen akuten Myokardinfarkt. Bis jetzt gibt es allerdings noch keine Publikationen, dass COVID-19-Patienten akute Myokardinfarkte erlitten haben. Ausnahmsweise präsentieren sich COVID-19-Patienten aber mit den klassischen Symptomen eines akuten Koronarsyndroms (ACS) mit Palpitationen, thorakalem Druckgefühl und gelegentlich leicht erhöhtem Troponin. Sollten Zeichen eines respiratorischen Infekts vorliegen oder keine Hinweise auf eine koronare Ursache der Beschwerden gefunden werden, muss eine SARS-CoV-2-Infektion ausgeschlossen werden. Umgekehrt sollen COVID-19-Patienten mit leicht ansteigendem Troponin nicht zum Ausschluss einer koronaren Herzkrankheit invasiv untersucht werden.
Interessanterweise ist es in den ersten Wochen der Pandemie in allen Ländern zu einem deutlichen Abfall der Myokardinfarktrate gekommen. Es wird vermutet – und die Vermutung kann durch die eigene Erfahrung unterstützt werden – dass Patienten aus Angst vor der COVID-19-Krankheit nicht ins Spital gekommen sind, insbesondere wenn die Symptome des Myokardinfarktes etwas atypisch waren. Es ist im Rahmen der COVID-19-Krankheit aber nicht nur zu einem spürbaren Anstieg des sogenannten patient delay gekommen, es ist vielerorts auch ein system delay eingetreten. Da die Prozesse auf dem Notfall auf die Corona-Epidemie ausgerichtet sind, kann es zu verzögerter Diagnose und zur verzögerten Behandlung beim ST-Hebungsinfarkt kommen (18). Es gilt also wachsam zu sein, um neben der Corona-Epidemie akute Koronarsyndrome rechtzeitig zu erkennen.
Copyright bei Aerzteverlag medinfo AG
Stadtspital Zürich Triemli
Klinik für Kardiologie
Birmensdorferstrasse 497
8063 Zürich
franz.eberli@triemli.zuerich.ch
- Die Rolle von ACE-2 bei der SARS-CoV-2-Infektion ist noch nicht geklärt. ACE-Hemmer und Angiotensin-Rezeptoren-Blocker haben aber eher eine günstige Wirkung und sollen nicht abgesetzt werden.
- Patienten mit typischen Symptomen eines akuten Koronarsyndroms sollen ermutigt werden, sich trotz der Angst vor COVID-19-Krankheit auf die Notfallstation zu begeben.
- Palpitationen und unspezifische thorakale Schmerzen können Symptome der COVID-19-Krankheit sein.
- SARS-CoV-2 kann eine akute fulminante Myokarditis auslösen.
- Hypertonie und kardiovaskuläre Vorerkrankungen werden als Risikofaktor bei der COVID-19-Krankheit überbewertet. Hingegen ist hohes Alter mit sehr schlechtem Krankheitsverlauf verbunden.
1. Andersen K, Rambaut A, Lipkin W, Holmes E and Garry R. The proximal origin of SARS-CoV-2. Nat Med. 2020;doi: 10.1038/s41591-020-0820-9.
2. Zhang T, Wu Q and Zhang Z. Probable Pangolin Origin of SARS-CoV-2 Associated with the COVID-19 Outbreak. Curr Biol. 2020;doi: 10.1016/j.cub.2020.03.022.
3. Hoffmann M, Kleine-Weber H, Schroeder S, Kruger N, Herrler T, Erichsen S, Schiergens TS, Herrler G, Wu NH, Nitsche A, Muller MA, Drosten C and Pohlmann S. SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor. Cell. 2020.
4. McIntosh K, Hirsch M and Bloom A. Coronavirus Disease 19 (COVID-19). UpToDate. 2020.
5. Clerkin KJ, Fried JA, Raikhelkar J, Sayer G, Griffin JM, Masoumi A, Jain SS, Burkhoff D, Kumaraiah D, Rabbani L, Schwartz A and Uriel N. Coronavirus Disease 2019 (COVID-19) and Cardiovascular Disease. Circulation. 2020.
6. Sommerstein R and Gräni C. Preventing a COVID-19. BMJ. 2020:bmj.com/content/368/bmj.m810/rr-2.
7. Wang K, Gheblawi M and Oudit GY. Angiotensin Converting Enzyme 2: A Double-Edged Sword. Circulation. 2020.
8. Santos RAS, Sampaio WO, Alzamora AC, Motta-Santos D, Alenina N, Bader M and Campagnole-Santos MJ. The ACE2/Angiotensin-(1-7)/MAS Axis of the Renin-Angiotensin System: Focus on Angiotensin-(1-7). Physiol Rev. 2018;98:505-553.
9. Kuba K, Imai Y, Rao S, Gao H, Guo F, Guan B, Huan Y, Yang P, Zhang Y, Deng W, Bao L, Zhang B, Liu G, Wang Z, Chappell M, Liu Y, Zheng D, Leibbrandt A, Wada T, Slutsky AS, Liu D, Qin C, Jiang C and Penninger JM. A crucial role of angiotensin converting enzyme 2 (ACE2) in SARS coronavirus-induced lung injury. Nat Med. 2005;11:875-9.
10. Vaduganathan M, Vardeny O, Michel T, McMurray JJV, Pfeffer MA and Solomon SD. Renin-Angiotensin-Aldosterone System Inhibitors in Patients with Covid-19. N Engl J Med. 2020.
11. Zou Z, Yan Y, Shu Y, Gao R, Sun Y, Li X, Ju X, Liang Z, Liu Q, Zhao Y, Guo F, Bai T, Han Z, Zhu J, Zhou H, Huang F, Li C, Lu H, Li N, Li D, Jin N, Penninger JM and Jiang C. Angiotensin-converting enzyme 2 protects from lethal avian influenza A H5N1 infections. Nat Commun. 2014;5:3594.
12. Driggin E, Madhavan MV, Bikdeli B, Chuich T, Laracy J, Bondi-Zoccai G, Brown TS, Nigoghossian C, Zidar DA, Haythe J, Brodie D, Beckman JA, Kirtane AJ, Stone GW, Krumholz HM and Parikh SA. Cardiovascular Considerations for Patients, Health Care Workers, and Health Systems During the Coronavirus Disease 2019 (COVID-19) Pandemic. J Am Coll Cardiol. 2020;doi: https://doi.org/10.1016/j.jacc.2020.03.031.
13. Zheng YY, Ma YT, Zhang JY and Xie X. COVID-19 and the cardiovascular system. Nat Rev Cardiol. 2020;https://doi.org/10.1038/s41569-020-0360-5.
14. Hu H, Ma F, Wei X and Fang Y. Coronavirus fulminant myocarditis saved with glucocorticoid and human immunoglobulin. Eur Heart J. 2020.
15. Guan WJ, Ni ZY, Hu Y, Liang WH, Ou CQ, He JX, Liu L, Shan H, Lei CL, Hui DSC, Du B, Li LJ, Zeng G, Yuen KY, Chen RC, Tang CL, Wang T, Chen PY, Xiang J, Li SY, Wang JL, Liang ZJ, Peng YX, Wei L, Liu Y, Hu YH, Peng P, Wang JM, Liu JY, Chen Z, Li G, Zheng ZJ, Qiu SQ, Luo J, Ye CJ, Zhu SY, Zhong NS and China Medical Treatment Expert Group for C. Clinical Characteristics of Coronavirus Disease 2019 in China. N Engl J Med. 2020.
16. Wu C, Chen X, Cai Y, Xia J, Zhou X, Xu S, Huang H, Zhang L, Zhou X, Du C, Zhang Y, Song J, Wang S, Chao Y, Yang Z, Xu J, Zhou X, Chen D, Xiong W, Xu L, Zhou F, Jiang J, Bai C, Zheng J and Song Y. Risk Factors Associated With Acute Respiratory Distress Syndrome and Death in Patients With Coronavirus Disease 2019 Pneumonia in Wuhan, China. JAMA Intern Med. 2020.
17. Guo T, Fan Y, Chen M, Wu X, Zhang L, He T, Wang H, Wan J, Wang X and Lu Z. Cardiovascular Implications of Fatal Outcomes of Patients With Coronavirus Disease 2019 (COVID-19). JAMA Cardiol. 2020.
18. Tam CF, Cheung KS, Lam S, Wong A, Yung A, Sze M, Lam YM, Chan C, Tsang TC, Tsui M, Tse HF and Siu CW. Impact of Coronavirus Disease 2019 (COVID-19) Outbreak on ST-Segment-Elevation Myocardial Infarction Care in Hong Kong, China. Circ Cardiovasc Qual Outcomes. 2020:CIRCOUTCOMES120006631.
info@herz+gefäss
- Vol. 10
- Ausgabe 2
- April 2020