- Aktuelle antidiabetische Therapie bei Herzerkrankungen
In den letzten Jahren gab es enorme Fortschritte im Bereich der Therapie von Diabetes mellitus Typ 2. Dies ist unter anderem durch die neu entwickelten Medikamente bedingt, welche in kardiovaskulären Endpunktstudien bewiesen, dass sie die Gesamtmortalität und kardiovaskuläre Ereignisse reduzieren, die Entwicklung einer Herzinsuffizienz verlangsamen und die Nierenfunktion schützen.
Diabetes mellitus betrifft weltweit geschätzt einen von elf Erwachsenen. Von den verschiedenen Folgeerkrankungen bei Menschen mit Diabetes kommt der koronaren Herzerkrankung und der Herzinsuffizienz eine immer grössere Bedeutung zu. Die koronare Herzerkrankung hat in den letzten Jahrzehnten bei Diabetes mellitus kontinuierlich abgenommen, ist aber immer noch höher als bei Menschen ohne Diabetes mellitus. Demgegenüber hat sich die Prävalenz der Herzinsuffizienz bei Personen mit Diabetes während dieser Zeitspanne verdreifacht und der Prozentsatz der Patienten mit Diabetes mellitus und Herzinsuffizienz beträgt mindestens 25% (1).
Es gibt zwei Arten der Herzinsuffizienz:
- Herzinsuffizienz mit erhaltener Auswurfsfraktion (HFPEF, «heart failure with preserved ejection fraction»): diese Form macht ¾ aller Fälle von Herzinsuffizienz bei Typ-2-Diabetes aus und zeigt eine linksventrikuläre Auswurfsfraktion > 40%. Die Diagnose in der Praxis von Allgemeininternisten ist aber schwierig, weil sich diese Form praktisch nur mit einer Doppler-Echokardiografie des Herzens durch den Kardiologen zweifelsfrei diagnostizieren lässt.
- Herzinsuffizienz mit reduzierter Auswurfsfraktion (HFREF, «heart failure with reduced ejection fraction»), welche ¼ der Patienten mit Herzinsuffizienz und Diabetes betrifft und häufig symptomatisch ist mit Anstrengungsdyspnoe, Orthopone, sowie Vorhofflimmern.
Obwohl mittlerweile viele wirksame Medikamente verfügbar sind, erreicht lediglich die Hälfte der an Diabetes mellitus erkrankten Patienten ihr individuelles HbA1c-Ziel (2). Gründe hierfür sind vielfältig und umfassen nicht nur die von vielen Patienten praktizierte fehlende Adhärenz zu den verordneten Medikamenten. Auch die mannigfaltigen Therapiemöglichkeiten und Kombinationen machen die medikamentöse Behandlung komplex. Der vorgestellte Behandlungsalgorithmus basiert auf den Empfehlungen der «Schweizerischen Gesellschaft für Endokrinologie und Diabetologie» (SGED), welche 2020 verabschiedet wurden (www.sgedssed.ch).
Kardiovaskuläre Endpunktstudien mit den neueren Medikamentengruppen seit 2008
SGLT2-Hemmer
SGLT2-Hemmer hemmen den Natrium/Glukose-Cotransporter 2 (SGLT2) in den proximalen Tubuli der Nieren, was die Rückresorption von Glukose aus dem Primärurin reduziert. Sie führen nicht zu Hypoglykämien und gehen mit einem Gewichtsverlust einher.
Mit folgenden Substanzen konnten wesentliche Vorteile in Bezug auf 3-Punkte MACE, kardiovaskuläre Mortalität und Herzinsuffizienz gezeigt werden: Empagliflozin (Jardiance®), Canagliflozin (Invokana®) und Dapagliflozin (Forxiga®) (3-6). Ertugliflozin (Steglatro®) wurde als vierter SGLT2-Hemmer zugelassen. Die Wirksamkeit konnte in der «VERTIS MONO» Studie gezeigt werden (7). Die Resultate der «VERTIS CV» Studie zur Beurteilung der kardiovaskulären Sicherheit sind noch ausstehend.
Hinsichtlich renaler Endpunkte zeigte sowohl die «EMPA-REG OUTCOME» Studie für Empagliflozin als auch die «CREDENCE» und «CANVAS» Studien für Canagliflozin eine signifikant langsamere Progression von Nierenerkrankungen. Die «EMPA-REG OUTCOME» und «CREDENCE» Studien zeigten den sicheren Einsatz bis zu einer eGFR von 30 ml/min (8, 9) .
Aufgrund dieser Studienlage kann zum aktuellen Zeitpunkt von einem Klasseneffekt in Bezug auf die Reduktion der kardiovaskulären Morbidität und Mortalität, respektive von einem positiven Effekt auf die Herzinsuffizienz und Nierenfunktion ausgegangen werden.
GLP-1-Rezeptor-Agonisten
Die GLP-1-Rezeptor-Agonisten (GLP-1 RA) binden wie das körpereigene Inkretin GLP-1 an die GLP-1-Rezeptoren und führen zu einer erhöhten Insulinausschüttung und Hemmung der Glukagonsekretion. Daneben hemmen sie den Appetit und führen zu einem Gewichtsverlust.
Die «LEADER» Studie konnte 2016 zeigen, dass Liraglutid (1× täglich, Victoza®) bei Patienten mit Diabetes mellitus Typ 2 und hohem kardiovaskulärem Risiko zu einer signifikanten Reduktion von kardiovaskulären Ereignissen und der Gesamtmortalität führt (10). Im gleichen Jahr zeigte sich bei Semaglutid (1× wöchentlich, Ozempic®) in der «SUSTAIN-6» Studie eine signifikante Reduktion von nicht-tödlichen Schlaganfällen, jedoch keine Reduktion der kardiovaskulären Mortalität (11). Hinsichtlich der kardiovaskulären Ereignisse war die neu entwickelte orale Gabe von Semaglutid in der «PIONEER 4» der subkutanen Gabe nicht unterlegen (12, 13).
Dulaglutid (1× wöchentlich, Trulicity®) senkte in der «REWIND» Studie kardiovaskuläre Ereignisse, hatte jedoch ebenfalls keine Reduktion der kardiovaskulären Mortalität zur Folge (14), aber eine deutliche Reduktion der Apoplexie (15, 16).
Sowohl Liraglutid in der «LEADER» Studie als auch Dulaglutid in der «REWIND» Studie zeigten bessere renale Endpunkte (17, 18). Hinsichtlich der Sicherheit bei Patienten mit eingeschränkter Nierenfunktion können GLP-1-Rezeptor-Agonisten auch bei schwer eingeschränkter Nierenfunktion (eGFR < 30 ml/min) eingesetzt werden und sind in dieser Situation somit eine Alternative zu DPP-4-Hemmern (17).
Im Wesentlichen konnten die humanen GLP-1-Rezeptor-Agonisten positive Effekte in den Endpunktstudien aufweisen, während die kurzwirksamen, von Exenatid abgeleiteten Medikamente, dies nicht belegen konnten. Deshalb sind GLP-1 RA aufgrund der stärkeren Gewichtsreduktion bei übergewichtigen Patienten empfehlenswert (eine Kostenrückerstattung erfolgt nur bei einem BMI ≥ 28 kg/m2 und in Kombination mit Metformin oder Sulfonylharnstoffen).
DDP-4-Hemmer
Die Hemmung der Dipeptidylpeptidase 4 (DPP-4) führt analog zu den GLP-1-RA zu einer verlängerten Inkretin-Wirkung. Aufgrund dessen macht wegen des gleichen Wirkungsmechanismus eine Kombination mit einem GLP-1 RA keinen Sinn.
Insgesamt wiesen die DPP-4-Hemmer Alogliptin (Vipidia®), Linagliptin (Trajenta®) und Sitagliptin (Januvia®) einen neutralen Effekt auf kardiovaskuläre Ereignisse auf (19-22). Zu beachten ist, dass Saxagliptin (Onglyza®) in der «SAVOR-TIMI 53» Studie als bisher einzigen DDP-4-Inhibitor zu häufigeren Hospitalisationen wegen Herzinsuffizienz führte (23). Vorteile der DPP-4-Hemmer sind die Verabreichung selbst bei dialysepflichtiger Niereninsuffizienz und die fehlenden Nebenwirkungen.
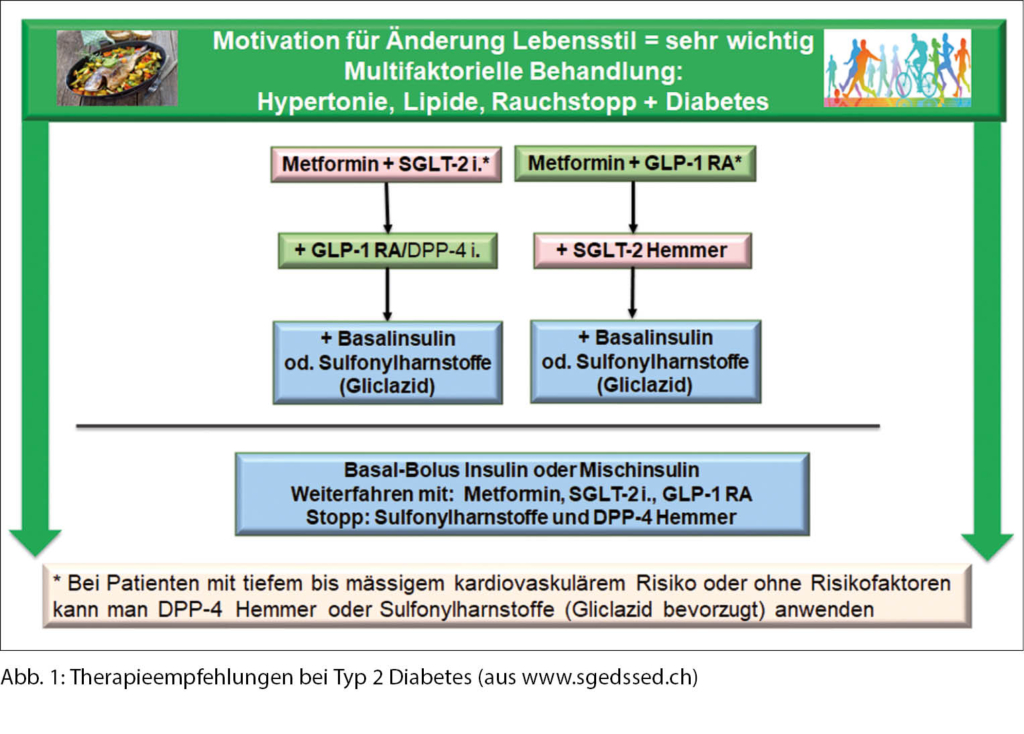
Therapieempfehlungen bei Typ 2 Diabetes mellitus
Wie auf Abbildung 1 ersichtlich ist, ist die primäre Therapie für alle Patienten mit Typ 2 Diabetes eine frühe Kombination von Metformin und SGLT-2 Hemmern oder Metformin und GLP-1-Rezeptor-Agonisten. Diese Empfehlung gilt unabhängig davon, ob der Patient bereits eine kardiovaskuläre Erkrankung hat, denn Patienten mit Typ 2 Diabetes mit einem geringen oder mässigen kardiovaskulären Risiko existieren praktisch nicht (Patienten < 50 Jahre mit einer Diabetesdauer < 10 Jahre) (24).
Initiale Wahl: SGLT2-Hemmer oder GLP-1-Rezeptor-Agonisten?
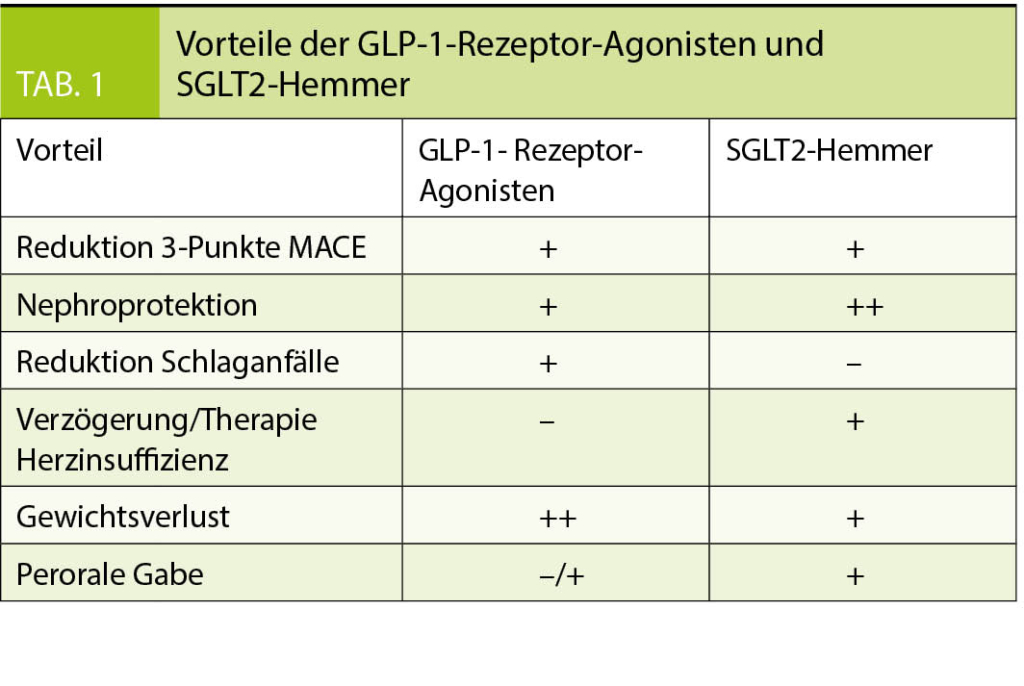
Während beide Klassen die sogenannten 3-Punkte MACE (schwere kardiovaskuläre Komplikationen definiert als nicht tödlichen Schlaganfall, nicht tödlichen Myokardinfarkt und kardiovaskulären Tod) reduzieren, können die Unterschiede gezielt für eine personalisierte Therapie genutzt werden. Wie in Tabelle 1 ersichtlich, führen GLP-1-Rezeptor-Agonisten zu einem stärkeren Gewichtsverlust sowie zu einer Reduktion von Schlaganfällen (11, 15, 16). Hingegen bieten SGLT2-Hemmer eine stärkere Nephroprotektion und eine Verzögerung der Herzinsuffizienz beziehungsweise weniger Hospitalisationen aufgrund einer Herzinsuffizienz (3-6). Aufgrund der vielen Vorteile besteht Hoffnung, dass eine Kombination dieser beiden Medikamentengruppen den grössten Vorteil für Patienten mit Typ 2 Diabetes mellitus bieten könnte, insbesondere bei einer koronaren Herzkrankheit und/oder Herzinsuffizienz (25).
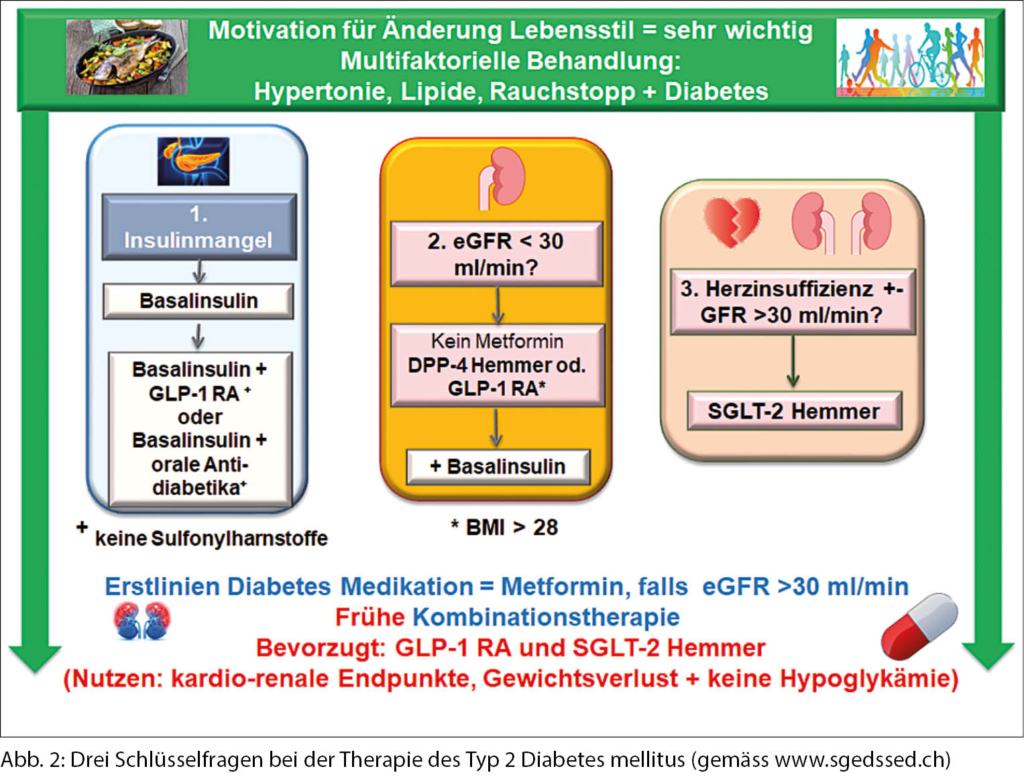
Empfehlungen bei koronarer Herzkrankheit und/oder Herzinsuffizienz
Weil koronare Herzkrankheit und Herzinsuffizienz mit einer langen Diabetesdauer, chronischer Niereninsuffizienz und einer schlechten Blutzuckereinstellung assoziiert sind, müssen drei Kernfragen beantwortet werden, bevor eine individuelle, verbindliche Therapieempfehlung gemacht werden kann (Abb. 2).
Die erste und wichtigste Frage betrifft immer das Insulin: Benötigt der Patient Insulin?
Ist der HbA1c-Wert des Patienten > 10% bei Abwesenheit der Schlüsselmerkmale des metabolischen Syndroms wie viszerale Adipositas und der typischen Dyslipidämie (niedriges HDL-Cholesterin und hohe Triglyzeride), und zeigt der Patient klinische Symptome des Insulinmangels (Gewichtsverlust, Polyurie und Polydipsie), ist die Gabe von Insulin niemals falsch. Nachdem sich die Blutzuckerwerte normalisiert haben, kann entschieden werden, ob Insulin weiterhin verabreicht wird. Bei einem kleinen Prozentsatz der Patienten kann ein Typ 1 Diabetes mellitus (auch bei hohem Alter) oder eine Pankreaserkrankung, wie eine chronische Pankreatitis oder Hämochromatose vorliegen, und deshalb eine Insulintherapie notwendig machen.
Die zweite Frage bezieht sich auf die Nierenfunktion
Dieser Aspekt wirkt sich direkt auf die Wahl des Antidiabetikums aus. 25% aller Patienten mit Typ 2 Diabetes mellitus in der Schweiz haben eine chronische Nierenerkrankung mit einer eGFR < 60 ml/min. (26). Die meisten Medikamente können nicht verschrieben werden, wenn die eGFR unter 30 ml/min liegt (dies ist allerdings ein kleiner Prozentsatz von 2.4% (26). Ist dies der Fall, können SGLT-2 Hemmer, Metformin und Sulfonylharnstoffe nicht mehr eingesetzt werden. DPP-4 Hemmer und GLP-1 RA können in dieser Situation verschrieben werden. Bei den GLP-1 RA ist auf Übelkeit und Erbrechen zu achten, sie sind aber auch bei Dialysebedürftigkeit nicht gefährlich für den Patienten mit Diabetes mellitus.
Die dritte Frage betrifft die Herzinsuffizienz
Die bevorzugte Therapie bei Patienten mit Diabetes und einer Herzinsuffizienz oder zur Prävention der Herzinsuffizienz sind die SGLT-2 Hemmer, welche bis zu einer eGFR von 30 ml/min sicher eingesetzt werden können. Mit Reduktion der Nierenfunktion sinkt zwar der blutzuckersenkende Effekt, die Wirkungen auf 3-Punkte MACE, Erhaltung der Nierenfunktion und Therapie respektive Prävention von Herzinsuffizienz bleiben voll erhalten.
Copyright bei Aerzteverlag medinfo AG
UniversitätsSpital Zürich
Rämistrasse 100
8091 Zurich
Roger.Lehmann@usz.ch
Der Autor deklariert Teilnahme an Advisory Boards und Referentenhonorare von Novo Nordisk, Sanofi, MSD, Boehringer Ingelheim, Servier und Astra Zeneca.
- Mit den SGLT2-Hemmern und den GLP-1-RA gibt es zwei Klassen, welche kardiovaskuläre Ereignisse, die kardiovaskuläre Mortalität und Gesamtmortalität senken sowie eine Nephroprotektion zeigen.
- Der Arzt muss zudem die Patientenpräferenzen wie keine Hypoglykämien und Wunsch nach Gewichtsabnahme berücksichtigen, aber auch die
Verringerung von Mortalität und von kardiovaskulären Ereignissen und Herzinsuffizienz. Sulfonylharnstoffe (21) und DPP-4-Hemmer (19-22) haben in Bezug auf diese harten Endpunkt-Parameter keinen Effekt. - Unter Berücksichtigung der kardiovaskulären Endpunkte, der Nieren-
funktion und des Vermeidens von Hypoglykämien und einer Verminderung des Körpergewichts sind SGLT-2 Hemmer und GLP-1 RA die bevorzugten Medikamente und eine Tripelkombination mit Metformin wäre v.a. bei Patienten mit einer koronaren Herzkrankheit und/oder
einer Herzinsuffizienz zu empfehlen.
1. Boonman-de Winter, L.J., et al., High prevalence of previously unknown heart failure and left ventricular dysfunction in patients with type 2 diabetes. Diabetologia, 2012. 55(8): p. 2154-62.
2. Edelman, S.V. and W.H. Polonsky, Type 2 Diabetes in the Real World: The Elusive Nature of Glycemic Control. Diabetes Care, 2017. 40(11): p. 1425-1432.
3. Zinman, B., et al., Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. N Engl J Med, 2015. 373(22): p. 2117-28.
4. Neal, B., et al., Canagliflozin and Cardiovascular and Renal Events in Type 2 Diabetes. N Engl J Med, 2017. 377(7): p. 644-657.
5. Wiviott, S.D., et al., Dapagliflozin and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med, 2019. 380(4): p. 347-357.
6. McMurray, J.J.V., et al., Dapagliflozin in Patients with Heart Failure and Reduced Ejection Fraction. N Engl J Med, 2019. 381(21): p. 1995-2008.
7. Aronson, R., et al., Long-term efficacy and safety of ertugliflozin monotherapy in patients with inadequately controlled T2DM despite diet and exercise: VERTIS MONO extension study. Diabetes Obes Metab, 2018. 20(6): p. 1453-1460.
8. Wanner, C., et al., Empagliflozin and Progression of Kidney Disease in Type 2 Diabetes. N Engl J Med, 2016. 375(4): p. 323-34.
9. Perkovic, V., et al., Canagliflozin and Renal Outcomes in Type 2 Diabetes and Nephropathy. N Engl J Med, 2019. 380(24): p. 2295-2306.
10. Marso, S.P., et al., Liraglutide and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med, 2016. 375(4): p. 311-22.
11. Marso, S.P., et al., Semaglutide and Cardiovascular Outcomes in Patients with Type 2 Diabetes. N Engl J Med, 2016. 375(19): p. 1834-1844.
12. Husain, M., et al., Oral Semaglutide and Cardiovascular Outcomes in Patients with Type 2 Diabetes. N Engl J Med, 2019. 381(9): p. 841-851.
13. Pratley, R., et al., Oral semaglutide versus subcutaneous liraglutide and placebo in type 2 diabetes (PIONEER 4): a randomised, double-blind, phase 3a trial. Lancet, 2019. 394(10192): p. 39-50.
14. Gerstein, H.C., et al., Dulaglutide and cardiovascular outcomes in type 2 diabetes (REWIND): a double-blind, randomised placebo-controlled trial. Lancet, 2019. 394(10193): p. 121-130.
15. Bellastella, G., et al., Glucagon-Like Peptide-1 Receptor Agonists and Prevention of Stroke Systematic Review of Cardiovascular Outcome Trials With Meta-Analysis. Stroke, 2020. 51(2): p. 666-669.
16. Gerstein, H.C., et al., The effect of dulaglutide on stroke: an exploratory analysis of the REWIND trial. Lancet Diabetes Endocrinol, 2020. 8(2): p. 106-114.
17. Mann, J.F.E., et al., Liraglutide and Renal Outcomes in Type 2 Diabetes. N Engl J Med, 2017. 377(9): p. 839-848.
18. Gerstein, H.C., et al., Dulaglutide and renal outcomes in type 2 diabetes: an exploratory analysis of the REWIND randomised, placebo-controlled trial. Lancet, 2019. 394(10193): p. 131-138.
19. White, W.B., et al., Alogliptin after acute coronary syndrome in patients with type 2 diabetes. N Engl J Med, 2013. 369(14): p. 1327-35.
20. Rosenstock, J., et al., Effect of Linagliptin vs Placebo on Major Cardiovascular Events in Adults With Type 2 Diabetes and High Cardiovascular and Renal Risk: The CARMELINA Randomized Clinical Trial. JAMA, 2019. 321(1): p. 69-79.
21. Rosenstock, J., et al., Effect of Linagliptin vs Glimepiride on Major Adverse Cardiovascular Outcomes in Patients With Type 2 Diabetes: The CAROLINA Randomized Clinical Trial. JAMA, 2019.
22. Green, J.B., et al., Effect of Sitagliptin on Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med, 2015. 373(3): p. 232-42.
23. Scirica, B.M., et al., Saxagliptin and cardiovascular outcomes in patients with type 2 diabetes mellitus. N Engl J Med, 2013. 369(14): p. 1317-26.
24. Mach, F., et al., 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur Heart J, 2019.
25. Jensen, M.H., et al., Risk of Major Adverse Cardiovascular Events, Severe Hypoglycemia, and All-Cause Mortality for Widely Used Antihyperglycemic Dual and Triple Therapies for Type 2 Diabetes Management: A Cohort Study of All Danish Users. Diabetes Care, 2020: p. dc192535.
26. Lamine, F., et al., Chronic kidney disease in type 2 diabetic patients followed-up by primary care physicians in Switzerland: prevalence and prescription of antidiabetic drugs. Swiss Med Wkly, 2016. 146: p. w14282.
der informierte @rzt
- Vol. 10
- Ausgabe 6
- Juni 2020