- Aktuelle Empfehlungen zur Früherkennung des Prostatakarzinoms
Die Früherkennung des Prostatakarzinoms wurde, aufgrund von berechtigten Bedenken vor Überdiagnostik sowie -therapie, lange kontrovers diskutiert. Langzeitdaten der grössten internationalen Studien konnten zeigen, dass das PSA-gesteuerte Screening die Mortalität des Prostatakarzinoms effektiv reduzieren kann, sodass die Europäische Kommission erst kürzlich die Einführung von entsprechenden nationalen Screening-Programmen empfohlen hat. Mittels multiparametrischer Magnetresonanztomographie (MRT) der Prostata können die Anzahl unnötiger Biopsien reduziert und die Erkennungsrate klinisch signifikanter Tumore erhöht werden.
Prostate cancer screening has long been controversial due to legitimate concerns about overdiagnosis and overtreatment. Long-term data from the largest international studies have shown that PSA-guided screening can effectively reduce prostate cancer mortality, and the European Commission has recently recommended the introduction of national screening programs. The multiparametric magnetic resonance imaging (MRI) of the prostate can reduce the number of unnecessary biopsies and simultaneously increased the detection of clinically significant prostate tumours.
Key Words: PSA, Prostate Cancer, Screening, Preventive Medicine
Das Prostatakarzinom stellt bei Männern die häufigste Krebserkrankung und die zweithäufigste krebsbedingte Todesursache in der Schweiz dar. Seit den frühen 1990er Jahren ist anhand der Bestimmung des prostataspezifischen Antigens (PSA) im Serum die Prostatakarzinomfrüherkennung möglich (PSA-Screening). Zeitgleich ist die Sterblichkeit aufgrund des Prostatakarzinoms in den meisten westlichen Ländern zurückgegangen (1), jedoch wurde der Nutzen des Prostatakarzinom-Screenings aufgrund der mit Risiken assoziierten invasiven Diagnostik sowie der Gefahr der Übertherapie klinisch nicht relevanter Prostatakarzinome lange kontrovers diskutiert (2, 3). Im Jahr 2012 veröffentlichte die «US Preventive Services Task Force» (USPSTF) die Empfehlung gegen das PSA-basierte Screening (4). Zur selben Zeit wurde der Stellenwert des PSA-basierten Screenings in der Schweiz ebenso intensiv diskutiert, mit divergierenden Empfehlungen des Swiss Medical Boards sowie der Schweizerischen Gesellschaft für Urologie (5, 6). Seither sind Langzeitdaten der wichtigen europäischen Studie der «European Randomized Study of Screening for Prostate Cancer» (ERSPC) publiziert worden, welche durch PSA-Screening eine signifikante Reduktion der Prostatakarzinom-assoziierten Mortalität nachweisen konnten (7). Diese Daten waren mitunter ausschlaggebend für die Umkehr der Screening-Empfehlung der USPSTF im Jahr 2017, zur individuellen Besprechung eines PSA-Screening mit Männern im Alter von 55-69 Jahren.
Die Bedeutung der Prostatakarzinomvorsorge wurde kürzlich (am 20. September 2022) von der Europäischen Kommission unterstrichen, indem die Empfehlung zur Förderung organisierter Prostatakarzinom-Screenings bei Männern unter 70 Jahren ausgesprochen wurde (8). Im nachfolgenden Artikel wird auf die aktuellen Empfehlungen zur Prostatakarzinomvorsorge näher eingegangen.
Screening
Die primären Ziele des Prostatakarzinom-Screenings sind die Senkung der Sterblichkeit sowie die Erhaltung der Lebensqualität. Entsprechend den Empfehlungen der europäischen Gesellschaft für Urologie (EAU) wird empfohlen, ab dem 50. Lebensjahr mit dem Prostatakarzinom-Screening zu beginnen. Bei erhöhtem Risiko wird ein Screening ab dem 45. Lebensjahr empfohlen, dazu gehören Männer mit relevanter positiver Familienanamnese (Vater oder Bruder vor dem 70. Lebensjahr an Prostatakarzinom erkrankt) und Männer afrikanischer Abstammung. Bei Männern mit BRCA2 Mutation besteht die Empfehlung zum Screening bereits ab dem 40. Lebensjahr (Tab. 1). Da das Prostatakarzinom ein langsam wachsendes Malignom ist, wird das Screening nur bei einer verbleibenden Lebenserwartung von mindestens 10 – 15 Jahren empfohlen. In der Literatur wird daher oftmals die Obergrenze von 70 Jahren aufgeführt, wobei bei biologisch jüngeren, respektive gesünderen Patienten ein Screening auch später sinnvoll sein kann. Umgekehrt sollte bei jüngeren Patienten mit relevanten Komorbiditäten nach entsprechender Abwägung ebenfalls von einer PSA-Bestimmung abgesehen werden (sog. «competing risks»). Diese Überlegungen sollten idealerweise vor einer PSA-Bestimmung durchgeführt werden, um unnötige Tests und die daraus resultierenden Behandlungsentscheidungen zu vermeiden.
Prostatakarzinom
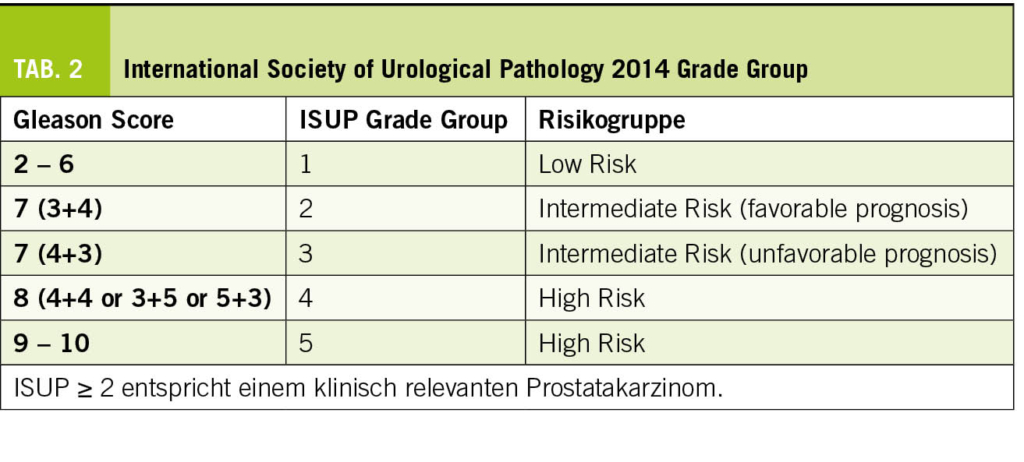
Eine PSA-Elevation, eine suspekte digital-rektale Untersuchung (DRU) oder eine auffällige Magnetresonanztomographie (MRT) der Prostata führen zu einer Prostatabiopsie. Hierbei werden multiple Stanzen aus der Prostata entnommen und anschliessend zur histopathologischen Untersuchung eingeschickt. Im Falle eines Karzinomnachweises wird dies in den «International Society of Urological Pathology» (ISUP) Grade Group 1 bis 5 eingeteilt, was den vorherigen alleinigen Gleason-Score ablöst. ISUP 1 entspricht einem Gleason-Score 3+3=6 Prostatakarzinom und wird als «Niedrigrisiko-Prostatakarzinom» bezeichnet (Tab. 2). Die allermeisten ISUP 1 Prostatakarzinome können mittels aktiver Überwachung betreut werden, sodass Patienten die potenziellen Nebenwirkungen einer kurativen Therapie erspart werden können. Prostatakarzinome welche ISUP 2 und höher sind, werden als sogenannte «klinisch signifikante Prostatakarzinome» beschrieben, für die eine aktive Therapie oftmals indiziert ist. Zwar können streng selektionierte Patienten mit ISUP 2 Tumoren ebenfalls erfolgreich mittels aktiver Überwachung betreut werden (9), aber die Mehrheit der Patienten sollten einer kurativ intendierten Therapie zugeführt werden (10).
PSA
Das PSA ist eine Peptidase, welche ausschliesslich in den epithelialen Zellen («Drüsenzellen») der Prostata produziert wird und in grösseren Mengen im Ejakulat nachweisbar ist, sowie in geringen Konzentrationen auch im Blut. Das PSA verdünnt das Ejakulat und unterstützt die Motilität der Spermien. Im Blut hat das PSA keine Funktion. Die Erstbeschreibung des PSA erfolgte 1979 (11), und die erste Beschreibung zur Verwendung für das Prostatakarzinom-Screening erfolgte 1991 (12). Da das PSA kein tumorspezifischer, sondern ein organspezifischer Biomarker ist, kann der PSA-Wert nicht nur im Rahmen einer Prostatakrebserkrankung erhöht sein, sondern auch bei einer gutartigen Prostatavergrösserung (benigne Prostatahyperplasie [BPH)), einer (oftmals subklinischen) Prostataentzündung, nach sexueller Aktivität sowie durch perinealen Druck (bspw. exzessives Fahrrad fahren).
Die Wahrscheinlichkeit eines Prostatakarzinoms nimmt mit steigendem PSA zu, jedoch ist kein allgemeingültiger PSA-Normwert definiert (13). Der PSA-Wert steigt mit dem Alter, sodass altersspezifische PSA-Normwerte beschrieben sind (bspw. PSA Obergrenze von 2.5 µg/l für Männer im Alter 40 – 49 Jahre, und PSA Obergrenze von 6.5 µg/l für Männer im Alter von 70 – 79 Jahre) (14). Im Falle eines erhöhten PSA-Wertes ist stets eine zweite PSA-Abnahme empfohlen, wobei je nach Empfehlung 3-7 Tage davor auf sexuelle Aktivität oder Fahrrad fahren verzichtet werden sollte, um einen möglichen Einfluss auszuschliessen. In unserer Klinik sprechen wir bei wiederholtem Nachweis eines PSA-Wertes über 3.0 µg/l von einem «erhöhten PSA-Wert» (für Männer bis 50 Jahre: 2.5 µg/l) und empfehlen eine weiterführende Abklärung.
Zusätzlich zu erwähnen ist die PSA-Dichte (PSAD), welche sich aus dem Verhältnis des PSA-Wertes zum Prostatavolumen zusammensetzt. Das Risiko eines klinisch signifikanten Prostatakarzinoms steigt mit zunehmender PSAD, und sinkt mit abnehmender PSAD (4% Risiko eines klinisch signifikanten Prostatakarzinoms bei PSAD <0.09 µg/l/cc) (15).
Digital-rektale Untersuchung
Historisch wurden 18% aller Prostatakarzinome allein aufgrund der digital-rektalen Untersuchung (DRU), unabhängig des PSA-Wertes, diagnostiziert (16). Der positiv-prädiktive Wert eines suspekten Tastbefundes im Falle eines PSA-Wertes <4 µg/l ist 5 – 30% (PSA 0 – 1.0 µg/l: 5%; PSA 1.1 – 2.5 µg/l: 14%; PSA 2.6 – 4.0 µg/l: 30%) (17). Die Daten der ERSPC zeigen, dass die Wahrscheinlichkeit eines Karzinomnachweises bei Männern mit erhöhtem PSA-Wert und suspektem DRU-Befund, im Vergleich zu erhöhtem PSA-Wert allein, verdoppelt ist (48.6% vs. 22.4%) (18). Im Falle einer suspekten digital-rektalen Palpation der Prostata ist, unabhängig vom PSA-Wert, die Zuweisung an einen Urologen zur erneuten klinischen Beurteilung und Evaluation eines multiparametrischen MRTs zur weiterführenden Abklärung empfohlen.
Magnetresonanztomographie (MRT) der Prostata
Die Einführung der multiparametrischen MRT der Prostata hat im letzten Jahrzehnt die Diagnostik des Prostatakarzinoms revolutioniert. Durch die Beurteilung verschiedener Sequenzen werden suspekte Läsionen der Prostata anhand der «Prostate Imaging Reporting and Data System» (PI-RADS) Klassifikation bewertet. Die Skala reicht von 1 (Prostatakarzinom sehr unwahrscheinlich) bis 5 (Prostatakarzinom sehr wahrscheinlich). In der Praxis wird eine Biopsie von PI-RADS 3 Läsionen und höher empfohlen, wobei bei tiefer PSAD in ausgewählten Situation von einer Biopsie bei PI-RADS 3 Läsionen abgesehen werden kann (10). Durch diese Selektion kann die Anzahl an Biopsien um über 30% reduziert werden, ohne dass es zu einer Reduktion der Detektionsrate von klinisch signifikanten Prostatakarzinomen kommt (19). In einer Cochrane Metaanalyse hatte die MRT verglichen mit Saturationsbiopsien (>20 Biopsiestanzen) eine gepoolte Sensitivität von 0,91 (95% CI: 0,83-0,95) und eine gepoolte Spezifität von 0,37 (95% CI: 0,29-0,46) für klinisch signifikante Prostatakarzinome (ISUP ≥ 2) (20). Die MRT ist weniger empfindlich bei der Erkennung von ISUP 1 Prostatakarzinomen (21), was ja eigentlich gewollt ist, da diese Karzinome im Normalfall keine Behandlung benötigen. Diese Bildgebung hilft nicht nur bei der Entscheidung, ob eine Biopsie der Prostata notwendig ist, sondern liefert auch wertvolle räumliche Informationen für die anschliessende Durchführung der Biopsie und gegebenenfalls auch Therapie.
Biopsie der Prostata
Klassischerweise erfolgte die Biopsie der Prostata mittels transrektalen Ultraschalls (TRUS) und transrektaler Entnahme von 12 Stanzbiopsien der Prostata (sogenannte «systematische Biopsie»). Im Anschluss an eine Biopsie der Prostata kann es unter anderem zu Hämatospermie, Hämaturie oder einem Harnverhalt kommen. Weiterhin kann es trotz lokaler Desinfektion und antibiotischer Prophylaxe in bis zu 3% der Fälle zu einem postinterventionellen Harnwegsinfekt/Urosepsis kommen (22), was insbesondere aufgrund der immer häufigeren Antibiotikaresistenzen bei E. Coli ein grosses Problem darstellt. Zur Reduktion der Infektionsrate wird daher empfohlen, wenn immer möglich die Biopsien transperineal zu entnehmen. Die diagnostische Sicherheit ist dieselbe wie bei der transrektalen Biopsie bei deutlich niedrigerem Risiko für einen Harnwegsinfekt.
Wie zuvor erwähnt, werden mittels MRT suspekte Veränderungen in der Prostata identifiziert. Um diese Läsionen gezielt biopsieren zu können bestehen heutzutage diverse Möglichkeiten zur Fusion der MRT- und der TRUS-Bilder, beispielsweise mit spezialisierten Geräten (bspw. Artemis oder BiopSee), oder mittels kognitiver Fusionierung. Hierdurch können «gezielte Biopsien» der suspekten Läsionen entnommen werden, was zu einer deutlich höheren Detektionsrate von klinisch signifikanten Prostatakarzinomen (ISUP ≥ 2) führt. Die Leitlinien der EAU empfehlen daher bei der Erstbiopsie die Durchführung einer gleichzeitigen systematischen und gezielten Biopsie der Prostata (10).
Biomarker
Aufgrund der fehlenden Spezifität des PSAs wurden in den letzten drei Jahrzehnten etliche Blut-, Urin- sowie Gewebe-Biomarker entwickelt. Diese Biomarker verwenden oft klinische Variablen (bspw. Prostatavolumen oder Patientenalter) und können bei der Beurteilung zur Notwendigkeit einer Prostatabiopsie helfen, um eine Überdiagnostik und -therapie zu vermeiden (23). Die Verwendung solcher Biomarker hat bisher in der Schweiz noch keine weitverbreitete Verwendung gefunden. Mögliche Gründe dafür sind die teilweise hohen Kosten der Tests, die fehlende Verfügbarkeit oder die fehlende Deckung durch die Krankenkassen. Aktuell ist die Verwendung von Biomarker für Routine Screening Programme noch nicht empfohlen (10). Für einzelne Patienten können sie jedoch sehr nützlich sein, beispielsweise die Verwendung des SelectMDx® bei Patienten welche nicht mittels MRT untersucht werden können (Klaustrophobie oder Hüftartefakte) (24).
Das freie (f) PSA ist einer der wenigen Biomarker, der verbreitete Verwendung gefunden hat, und in kombinierter Anwendung mit dem totalen (t) PSA hilfreich zur Risikoabschätzung sein kann. Aufgrund der relativen Instabilität des freien PSAs ist die Verwendung der f/t PSA Ratio nur bedingt empfohlen (10). Eine neuere Option, welche auch in der Schweiz verfügbar ist, stellt die Anwendung des Proclarix® Risk Scores dar. Dieser blutbasierte Test schliesst neben Patientenalter, PSA und freiem PSA auch zwei weitere Proteine ein. Es wurde nachgewiesen, dass hiermit die Zahl an notwendigen Biopsien reduziert werden kann (25).
Risikokalkulatoren
Es existieren verschiedene Risikokalkulatoren welche mithilfe von klinischen Parametern (u.a. Alter, DRU und PSA Wert) basierend auf grossen Kohorten (bspw. ERSPC Kohorte (26)) das individuelle Risiko eines Prostatakarzinoms abschätzen können. Der stärkste Prädiktor in den Risikokalkulatoren ist die PSAD (10). Risikokalkulatoren sind sehr nützlich zur Besprechung des individuellen Risikos eines Patienten und können dabei helfen unnötige Biopsien zu vermeiden (27).
Risiken assoziiert mit dem PSA-Screening
Männer müssen über die potenziellen, mit dem PSA-Screening assoziierten Risiken informiert werden. Die unmittelbaren Risiken der PSA-Bestimmung (Blutentnahme) und der digital-rektalen Untersuchung (DRU) sind gering, jedoch können die weiteren Abklärungen Morbidität verursachen. Die Biopsieentnahme zur Gewebeuntersuchung kann zu Komplikationen wie Harnwegsinfekt, Blutung oder Harnverhalt führen (22). Weiter können Nebenwirkungen im Rahmen der Therapie eines diagnostizierten Prostatakarzinoms auftreten, wie Urininkontinenz, erektile Dysfunktion und Schmerzen sowie eine behandlungsassoziierte Mortalität (28).
Zusammenfassung
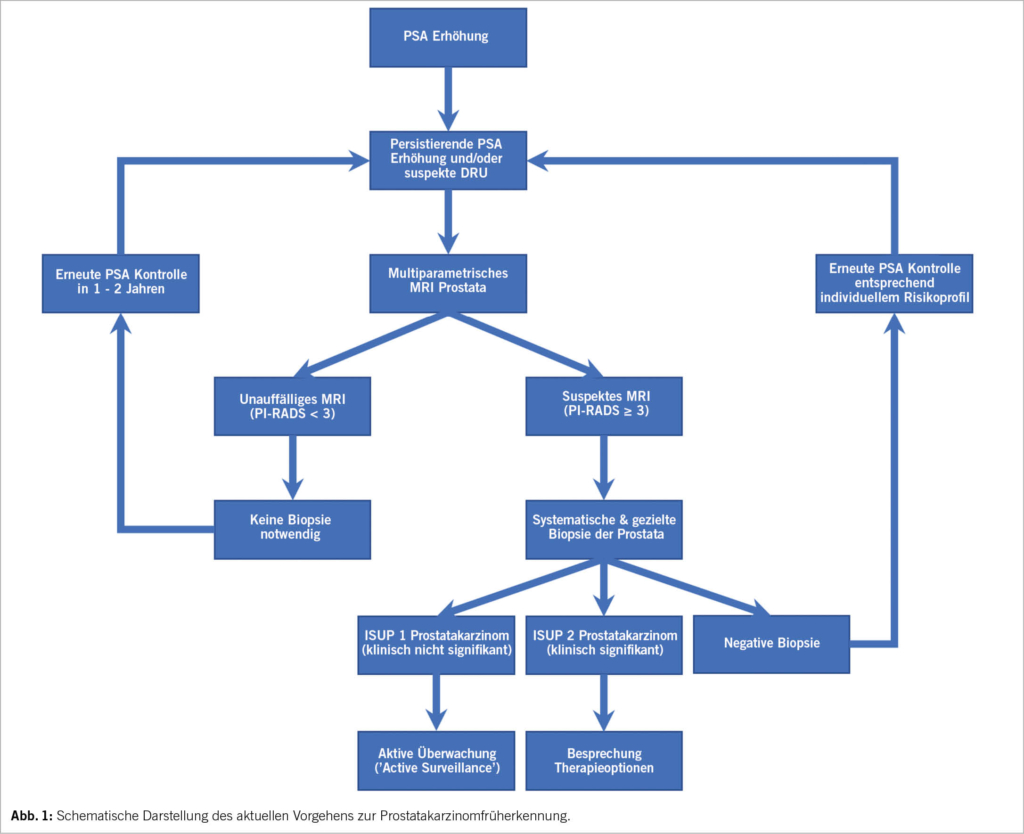
Die Früherkennung des Prostatakarzinoms durch PSA-Screening wurde lange kontrovers diskutiert. Die Langzeitdaten der ERSPC Studie konnten inzwischen zeigen, dass das PSA-Screening die Prostatakarzinom-assoziierte Mortalität signifikant senken kann. Durch die MRT der Prostata konnten unnötige Biopsien der Prostata signifikant reduziert und die diagnostische Sicherheit durch gezielte Biopsien zeitgleich verbessert werden. Ebenso wurde die Gefahr der Übertherapie von entdeckten Niedrigrisiko-Prostatakarzinomen durch die weit verbreitete aktive Überwachung reduziert. Im beiliegenden Flussdiagramm ist die Abklärung eines erhöhten PSA-Wertes dargestellt, basierend auf den Empfehlungen der EAU Prostatakarzinom Leitlinien (10) (Abb. 1). Die Prostatakarzinomvorsorge ist evidenzbasiert, die Entscheidung zum Screening soll erst nach vorheriger Besprechung des potenziellen Nutzens sowie der Risiken erfolgen.
Copyright bei Aerzteverlag medinfo AG
Klinik für Urologie
Kantonsspital St. Gallen
Rorschacher Strasse 95
9007 St. Gallen
Klinik für Urologie
Kantonsspital St. Gallen
Rorschacher Strasse 95
9007 St. Gallen
Die Autoren haben keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
◆ Ein Screening mittels DRU und PSA-Abnahme zur Früherkennung des Prostatakarzinoms ist sinnvoll und evidenzbasiert.
◆ PSA ist ein organspezifischer, aber kein tumor-spezifischer Biomarker und kann deswegen auch aufgrund einer gutartigen Prostatavergrösserung oder Prostataentzündung erhöht sein.
◆ Neuartige Technologien, wie das multiparametrische MRT sowie
Risikokalkulatoren, helfen unnötige Biopsien zu vermeiden und reduzieren hierdurch die Morbidität der Prostatakarzinomfrüherkennung.
1. Loeb S. Guideline of guidelines: prostate cancer screening. BJU Int. 2014;114:323-5.
2. Etzioni R, Gulati R, Cooperberg MR, Penson DM, Weiss NS, Thompson IM. Limitations of basing screening policies on screening trials: The US Preventive Services Task Force and Prostate Cancer Screening. Med Care. 2013;51:295-300.
3. Melnikow J, LeFevre M, Wilt TJ, Moyer VA. Counterpoint: Randomized trials provide the strongest evidence for clinical guidelines: The US Preventive Services Task Force and Prostate Cancer Screening. Med Care. 2013;51:301-3.
4. Moyer VA. Screening for prostate cancer: U.S. Preventive Services Task Force recommendation statement. Ann Intern Med. 2012;157:120-34.
5. Board EdSM. PSA-Test nicht geeignet zur Früherkennung des Prostatakarzinoms. Schweiz Ärztezeitung. 2011;92(48):1857.
6. Recker F ST. Messung des prostataspezifischen A ntigens (PSA-Test) zur F rüherkennung des Prostatakarzinoms Swiss Medical Board oder: «das Kind mit dem Bade ausschütten». Schweiz Ärztezeitung. 2011;92(51):2002–4
7. Hugosson J, Roobol MJ, Månsson M, Tammela TLJ, Zappa M, Nelen V, et al. A 16-yr Follow-up of the European Randomized study of Screening for Prostate Cancer. Eur Urol. 2019;76:43-51.
8. Commission E. European Health Union: A new EU approach on cancer detection – screening more and screening better. 2022.
9. Paudel R, Madan R, Qi J, Ferrante S, Cher ML, Lane BR, et al. The Use and Short-term Outcomes of Men With National Comprehensive Cancer Network Favorable Intermediate-risk Prostate Cancer Managed With Active Surveillance: The Initial Michigan Urological Surgery Improvement Collaborative Experience. Journal of Urology.0:10.1097/JU.0000000000003012.
10. Mottet N, Cornford P, van den Bergh R, De Santis M, Gillessen S, Grummet J, et al. EAU-EANM-ESTRO-ESUR-ISUP-SIOG Guidelines on Prostate Cancer. EAU Guidelines Office, Arnhem, The Netherlands; 2022.
11. Wang MC, Valenzuela LA, Murphy GP, Chu TM. Purification of a human prostate specific antigen. Invest Urol. 1979;17:159-63.
12. Catalona WJ, Smith DS, Ratliff TL, Dodds KM, Coplen DE, Yuan JJ, et al. Measurement of prostate-specific antigen in serum as a screening test for prostate cancer. N Engl J Med. 1991;324:1156-61.
13. Semjonow A, Brandt B, Oberpenning F, Roth S, Hertle L. Discordance of assay methods creates pitfalls for the interpretation of prostate-specific antigen values. Prostate Suppl. 1996;7:3-16.
14. Partin AW, Criley SR, Subong ENP, Zincke H, Walsh PC, Oesterling JE. Standard Versus Age-Specific Prostate Specific Antigen Reference Ranges Among Men With Clinically Localized Prostate Cancer: A Pathological Analysis. The Journal of Urology. 1996;155:1336-9.
15. Yusim I, Krenawi M, Mazor E, Novack V, Mabjeesh NJ. The use of prostate specific antigen density to predict clinically significant prostate cancer. Sci Rep. 2020;10:20015.
16. Richie JP, Catalona WJ, Ahmann FR, Hudson MA, Scardino PT, Flanigan RC, et al. Effect of patient age on early detection of prostate cancer with serum prostate-specific antigen and digital rectal examination. Urology. 1993;42:365-74.
17. Carvalhal GF, Smith DS, Mager DE, Ramos C, Catalona WJ. Digital rectal examination for detecting prostate cancer at prostate specific antigen levels of 4 ng./ml. or less. J Urol. 1999;161:835-9.
18. Gosselaar C, Roobol MJ, Roemeling S, Schröder FH. The role of the digital rectal examination in subsequent screening visits in the European randomized study of screening for prostate cancer (ERSPC), Rotterdam. Eur Urol. 2008;54:581-8.
19. Eklund M, Jäderling F, Discacciati A, Bergman M, Annerstedt M, Aly M, et al. MRI-Targeted or Standard Biopsy in Prostate Cancer Screening. New England Journal of Medicine. 2021;385:908-20.
20. Drost FH, Osses DF, Nieboer D, Steyerberg EW, Bangma CH, Roobol MJ, et al. Prostate MRI, with or without MRI-targeted biopsy, and systematic biopsy for detecting prostate cancer. Cochrane Database Syst Rev. 2019;4:Cd012663.
21. Bratan F, Niaf E, Melodelima C, Chesnais AL, Souchon R, Mège-Lechevallier F, et al. Influence of imaging and histological factors on prostate cancer detection and localisation on multiparametric MRI: a prospective study. Eur Radiol. 2013;23:2019-29.
22. Loeb S, Vellekoop A, Ahmed HU, Catto J, Emberton M, Nam R, et al. Systematic Review of Complications of Prostate Biopsy. European Urology. 2013;64:876-92.
23. Visser WCH, de Jong H, Melchers WJG, Mulders PFA, Schalken JA. Commercialized Blood-, Urinary- and Tissue-Based Biomarker Tests for Prostate Cancer Diagnosis and Prognosis. Cancers. 2020;12:3790.
24. Hendriks RJ, van der Leest MMG, Israël B, Hannink G, YantiSetiasti A, Cornel EB, et al. Clinical use of the SelectMDx urinary-biomarker test with or without mpMRI in prostate cancer diagnosis: a prospective, multicenter study in biopsy-naïve men. Prostate Cancer and Prostatic Diseases. 2021;24:1110-9.
25. Steuber T, Tennstedt P, Macagno A, Athanasiou A, Wittig A, Huber R, et al. Thrombospondin 1 and cathepsin D improve prostate cancer diagnosis by avoiding potentially unnecessary prostate biopsies. BJU Int. 2019;123:826-33.
26. http://www.prostatecancer-riskcalculator.com/seven-prostate-cancer-risk-calculators. Retrieved 23.11.2022.
27. Louie KS, Seigneurin A, Cathcart P, Sasieni P. Do prostate cancer risk models improve the predictive accuracy of PSA screening? A meta-analysis. Annals of Oncology. 2015;26:848-64.
28. Michaelson MD, Cotter SE, Gargollo PC, Zietman AL, Dahl DM, Smith MR. Management of complications of prostate cancer treatment. CA Cancer J Clin. 2008;58:196-213.
der informierte @rzt
- Vol. 12
- Ausgabe 12
- Dezember 2022