- Aktuelle Empfehlungen zur Helicobacter pylori Eradikation
Die Helicobacter pylori Infektion zählt weiterhin zu den häufigsten chronischen Infektionen weltweit. Im Falle einer positiven Testung ist immer eine Eradikationstherapie empfohlen, da die Infektion zu schwerwiegenden gastroduodenalen Pathologien führen kann. Eine grosse Herausforderung in der Eradikationstherapie stellen die steigenden Resistenzraten gegen die üblicherweise eingesetzten Antibiotika – Clarithromycin, Metronidazol und Levofloxacin – dar. Auch in der Schweiz liegen die Resistenzraten dieser Antibiotika bereits weit über 15 %. Folglich wurde die bisher übliche empirische Erstlinientherapie, die Standard Triple-Therapie (Amoxicillin + Clarithromycin + PPI), in den deutschen und europäischen Leitlinien durch die Bismut-haltige Vierfachtherapie, Pylera® (Bismut + Metronidazol + Tetrazyklin + PPI), ersetzt. Erst bei Therapieversagen der empirischen Erstlinientherapie wird eine Resistenzprüfung empfohlen. Letztlich verlangt der dramatische Anstieg der Resistenzraten eine Umstellung auf eine resistenzgerechte Erstlinientherapie. Diese Anpassung ist bereits in der im letzten Jahr erschienenen Schweizer Richtlinie zu finden.
Helicobacter pylori infection is one of the most common chronic bacterial infections worldwide. If a test results positive, treatment should follow because chronic H. pylori gastritis can lead to severe gastroduodenal pathologies. The challenge of eradication therapy is the rising resistance rates to commonly used antibiotics – Clarithromycin, Metronidazole, and Levofloxacin – in H. pylori treatment. In Switzerland as well, resistance rates surpass 15 %. Consequently, in the German and European Guidelines, the customary standard triple therapy (Amoxicillin + Clarithromycin + PPI) has been replaced by the Bismuth-containing Quadruple therapy, Pylera® (Bismuth + Metronidazole + Tetracycline + PPI). Resistance testing is recommended only after treatment failure of empiric first-line therapy. In contrast, the recently published Swiss Guideline recommends first-line eradication therapy only after susceptibility testing. The dramatic increase in antibiotic resistance rates will lead to abandoning empirical antibiotic therapy in favor of prior resistance testing.
Key words: H. pylori infection, susceptibility testing, Bismuth-containing Quadruple therapy
Allgemeines
Die Helicobacter pylori (H. pylori) Infektion zählt weiterhin zu den häufigsten chronischen bakteriellen Infektionen. Spontane Ausheilungen wurden zwar bei Kleinkindern beschrieben, sind jedoch im Jugend- und Erwachsenenalter kaum zu erwarten (1). Üblicherweise wird die H. pylori Infektion in der Kindheit erworben, wobei der genaue Übertragungsweg weiterhin unklar ist. Als Risikofaktoren für eine Infektion sind ein niedriger sozioökonomischer Status, infizierte Familienmitglieder und mangelnde hygienische Verhältnisse bekannt (2, 3). Ein Grossteil (ca. 80 %) der Patienten mit einer H. pylori Infektion sind beschwerdefrei. Symptomatische Patienten beklagen in der Regel epigastrische Schmerzen und dyspeptische Beschwerden oder präsentieren sich mit Blutungskomplikationen (4). Durch die Infektion mit H. pylori entwickelt sich eine chronische Gastritis, was im Verlauf zu schwerwiegenden gastroduodenalen Pathologien führen kann, unter anderem gastrale oder duodenale Ulcera, gastrale MALT (Mukosa-assoziiertes lymphatisches Gewebe) – Lymphome oder Adenokarzinome des Magens (5-7).
Diagnostik
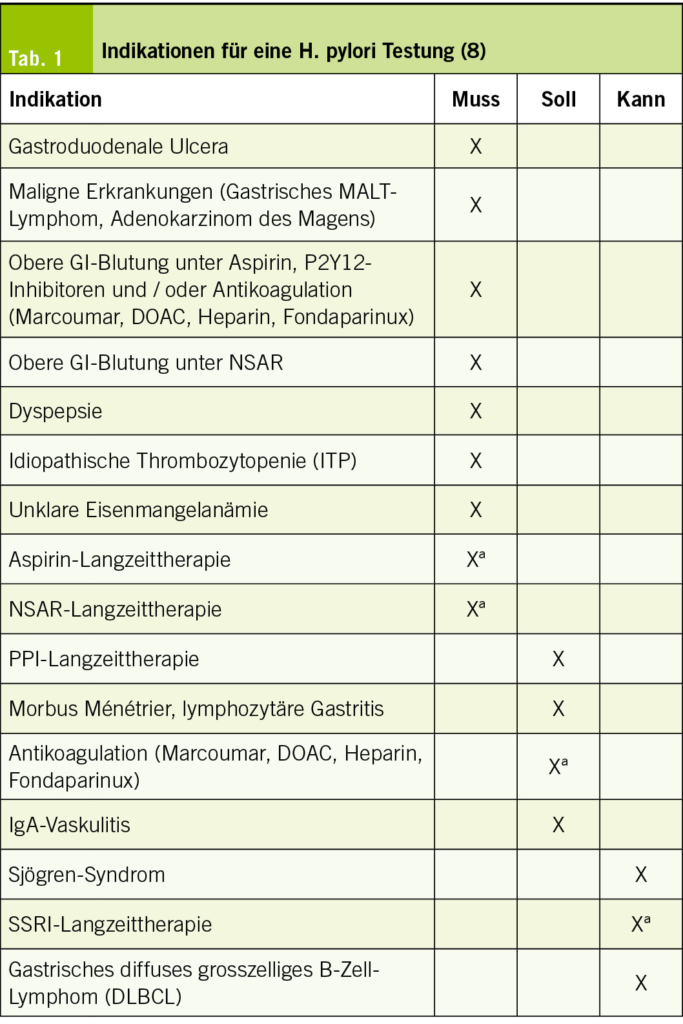
Die aktuelle deutsche Richtlinie unterscheidet zwischen Indikationen einer H. pylori Testung, bei denen getestet werden muss, soll oder kann (Tab. 1). Gastroduodenale Ulcera stellen eine Indikation zur H. pylori Testung dar. Die Diagnose eines gastrischen MALT-Lymphoms oder Adenokarzinom des Magens verlangt ebenfalls eine Testung. Auch bei oberen gastrointestinalen Blutungen unter Aspirin, P2Y12-Inhibitoren, Nicht-steroidalen Antirheumatika (NSAR) oder oraler Antikoagulation muss H. pylori gesucht werden, ebenso bei bisher nicht abgeklärten dyspeptischen Beschwerden. Bei jüngeren Patienten (<50 Jahren) mit dyspeptischen Beschwerden ohne Vorhandensein von Alarmzeichen (z.B. Gewichtsverlust, Anämie, gastrointestinale Blutungsstigmata, Dysphagie, etc.) kann die Testung nicht-invasiv erfolgen. Bei älteren Patienten (>50 Jahre) oder Alarmzeichen muss im Rahmen der Dyspepsie-Abklärung immer eine Gastroskopie erfolgen. Weitere zwingende Indikationen für die H. pylori Testung stellen eine nicht anderweitig erklärte oder Therapie-refraktäre Eisenmangelanämie und die idiopathische thrombozytopene Purpura (ITP) dar. Vor geplanter Aspirin- oder NSAR-Langzeittherapie muss getestet werden, sofern ein Risikoprofil für gastroduodenale Ulcera und Ulcuskomplikationen (u.a. Alter >60 Jahre, bereits Ulcera in der Vergangenheit, Einnahme von NSAR/Aspirin, inflammatorische Erkrankungen des Gastrointestinaltrakts, schwere Grunderkrankungen, etc.) vorliegt. Bei Patienten mit IgA-Vaskulitis, Morbus Ménétrier, lymphozytärer Gastritis sowie geplanter Langzeit Antikoagulation sollte ebenfalls auf H. pylori getestet werden. Eine Langzeit-Therapie mit einem Protonenpumpeninhibitor (PPI) führt im Falle einer H. pylori Infektion zu einer Corpus-dominanten Gastritis und erhöht damit das Risiko für die Entwicklung eines Adenokarzinoms des Magens. Daher sollte auch in diesem Fall getestet werden (8, 9).
Zur Diagnosestellung einer H. pylori Infektion stehen sowohl invasive als auch nicht-invasive Methoden zur Auswahl. Zu den nicht-invasiven Methoden zählen der 13C-Harnstoff-Atemtest, die Stuhlantigentestung und die Bestimmung der IgG-Antikörper im Serum. Als invasive Methoden stehen die mittels Gastroskopie gewonnene Histologie, Urease-Schnelltest, Kultur und PCR zur Verfügung. Vor allem in Ländern mit einer niedrigen H. pylori Prävalenz sind zwei verschiedene positive Tests zur verlässlichen Diagnosestellung empfohlen. Dies ist im klinischen Alltag jedoch nicht immer umsetzbar. Eine Ausnahme besteht für folgende drei Fälle: Bei einer positiven Histologie mit chronisch aktiver Gastritis, einem Duodenalulcus mit einem positiven Testresultat oder bei einer positiven H. pylori Kultur alleine, ist keine zweite Testmethode notwendig, da in diesen Fällen die Spezifität bei nahezu 100 % liegt (8).
Da nicht nur H. plyori eine hohe Urease-Aktivität besitzt, kann es bei Urease-abhängigen Testmethoden (Atemtest, Urease-Schnelltest) im Falle einer bakteriellen Dünndarmfehlbesiedelung zu falsch positiven Resultaten kommen (10). Die Sensitivität aller Testmethoden, mit Ausnahme der Antikörperbestimmung im Serum, ist abhängig von der Bakteriendichte. Im Falle einer niedrigen Bakteriendichte, u.A. durch Therapie mit PPI während des Entnahmezeitpunktes, kürzlicher Antibiotikatherapie, bei Nachweis eines Magenkarzinoms/MALT-Lymphoms, grossflächiger mukosaler Atrophie und intestinaler Metaplasie sowie nach Magenteilresektionen, ist die Sensitivität der Testmethoden reduziert (11-13). Eine PPI-Therapie sollte optimalerweise zwei Wochen vor Testung gestoppt werden (8). Des Weiteren wird durch eine akute obere gastrointestinale Blutung die Sensitivität um 5-30 % reduziert (14). Einzig die Antikörperbestimmung im Serum wird nicht beeinflusst durch eine gastrointestinale Blutung oder herabgesetzte Bakteriendichte. Dennoch ist die Antikörperbestimmung nicht als Eradikationskontrolle, generell und in Ausnahmefällen (z.B. niedrig-Endemiegebiete), zu empfehlen, da die Antikörper für mehrere Jahre positiv bleiben (9). Zusammenfassend sind sowohl die H. pylori Stuhl Antigenbestimmung und der 13C-Harnstoff-Atemtest die nicht-invasiven Testmethoden der Wahl.
Wird H. pylori nachgewiesen, ist immer eine Eradikationstherapie empfohlen (15). Ein Spezialfall stellt das gastrische MALT-Lymphom dar. Hier wird unabhängig vom H. pylori Status eine Eradikationstherapie durchgeführt (16). Nach jeder H. pylori Therapie muss auch eine Eradikationskontrolle erfolgen. Die Kontrolle sollte mittels Stuhlantigenbestimmung oder 13C-Harnstoff-Atemtest durchgeführt werden, frühestens vier Wochen nach Beendigung der antibiotischen Therapie und zwei Wochen nach Absetzen der PPI Therapie (8, 9).
Rolle der Protonenpumpeninhibitoren in der Eradikationstherapie
Bei der Eradikation des H. pylori spielen neben Antibiotika auch hoch dosierte PPI eine relevante Rolle. H. pylori überlebt zwar zwischen pH 4 und pH 8, die aktive Replikation findet jedoch hauptsächlich bei pH-Werten zwischen 6 und 7 statt. Da H. pylori nur in der Teilungsphase empfindlich für Amoxicillin und Clarithromycin (CLR) ist, ist eine Erhöhung des pHs im Magen durch PPIs essentiell für eine erfolgreiche Eradikationstherapie (17). Es wird eine Hochdosistherapie mit möglichst hochpotenten PPIs (z. B. Esomeprazol, Rabeprazol oder Dexlansoprazol), mindestens 30 Minuten vor dem Essen empfohlen (18).
Der Kalium-kompetitive Säureblocker, Vonoprazan, unterscheidet sich von den klassischen PPIs unter anderem durch den rascheren Wirkungseintritt, eine längere Wirkdauer sowie eine reversible Bindung. Internationale Studien zeigten höhere Eradikationsraten der Vonoprazan-basierten Triple-Therapie im Vergleich zur konventionellen Triple-Therapie (Amoxicillin (AMX), Clarithromycin (CLR) + Lansoprazol). Obwohl in Japan bereits seit 2015 und in den USA seit 2022 zugelassen, ist das Produkt in der Schweiz zurzeit nicht erhältlich (19).
Antibiotische Therapie und damit verbundene Herausforderungen
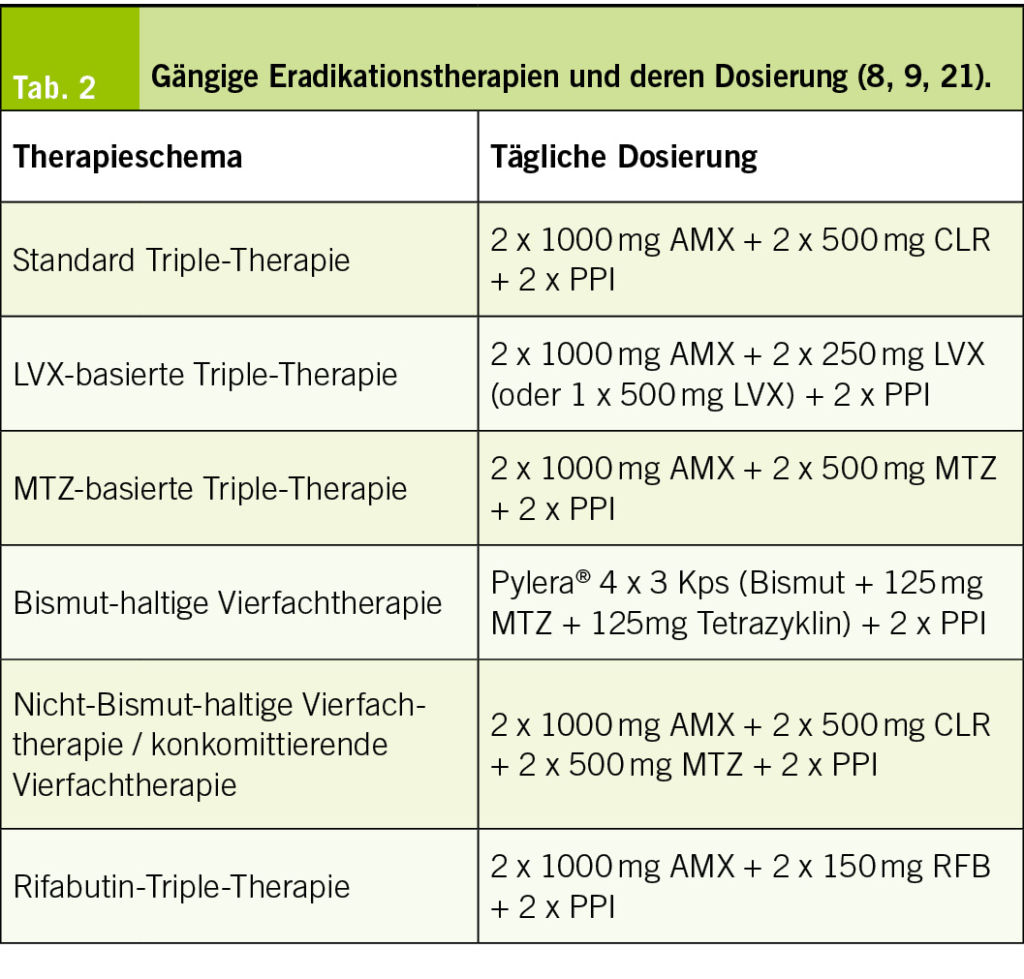
Für die H. pylori Eradikation stehen verschiedene Therapieschemata zur Verfügung (Tab. 2). Als gängiges Schema kommt die Standard-Triple-Therapie aus AMX, CLR und PPI zum Einsatz, wobei CLR alternativ durch Levofloxacin (LVX) ersetzt werden kann. Die LVX-basierte Triple-Therapie kann auch um Bismut zur Vierfachtherapie erweitert werden. Alternativ kann eine Metronidazol (MTZ)-basierte Triple-Therapie mit AMX, MTZ und PPI erfolgen. Eine weitere Option stellt die Bismut-haltige Vierfachtherapie aus Bismut, Tetrazyklin und MTZ plus PPI dar. Hier steht das 3-in-1 Kombinationspräparat, Pylera®, zur Verfügung. Unter der konkomittierenden Vierfachtherapie, auch Nicht-Bismut-haltige Vierfach-therapie genannt, versteht man eine Kombination aus PPI, CLR, AMX und MTZ. Weiters besteht die Option einer Rifabutin (RFB)-Triple-Therapie aus RFB, AMX und PPI. Für die Triple-Therapien und konkomittierende Vierfachtherapie ist klar eine Therapiedauer von 14 Tagen empfohlen, da mit einer längeren Therapiedauer höhere Eradikationserfolge erzielt werden können (8, 9). Für die Bismut-haltige Vierfachtherapie wird eine Therapiedauer von 10 bis 14 Tagen empfohlen, wobei hinsichtlich hoher MTZ-Resistenzraten ebenfalls eine längere Therapiedauer präferiert werden sollte (9, 20).
Die grösste Herausforderung der Eradikationstherapie stellen die steigenden H. pylori Resistenzraten gegen CLR, LVX und MTZ dar. Bereits seit vielen Jahren liegen die Resistenzraten dieser Antibiotika in den meisten europäischen Ländern deutlich über 15 % (22). In der Schweiz liegt die Resistenzrate für CLR bei bereits 41%, für LVX bei 26 % und für MTZ bei 44 %, wobei bei diesen Daten nicht zwischen Therapie-naiven und vorbehandelten Personen unterschieden wird (23). Gleichzeitig sinkt die Wahrscheinlichkeit einer erfolgreichen Eradikation deutlich mit jeder vorausgegangenen frustranen empirischen Eradikationstherapie sowie bei früherem Antibiotika-Einsatz aus anderer Indikation (24). Dennoch zeigen Daten des europäischen Registers, «European Registry on Helicobacter pylori management» (Hp-EuReg), dass die Standard-Triple-Therapie aus AMX, CLR und PPI mit 39.4 % weiterhin die häufigste rezeptierte Eradikationstherapie darstellt, wobei damit nur eine Eradikationsrate von 84% erzielt wird (25). Wenn man zwischen CLR-sensiblen und CLR-resistenten Stämmen unterscheidet, finden sich für die 14-tägige Standard-Triple-Therapie Eradikationsraten von 90.2 % (sensibel), gegenüber 46.2 % (resistent) (25). Eine systematische Erhebung der CLR-Resistenzen würde eine Standard-Triple-Therapie bei 60–90 % der Patienten ermöglichen, wodurch die Nachteile (schlechte Verträglichkeit, hohe Tablettenanzahl) der Bismut-haltigen Vierfachtherapie umgangen werden können (9).
Eine weitere Herausforderung stellt die Patientencompliance bei der Vierfachtherapie mit Bismut, Tetrazyklin, MTZ und PPI dar. Sowohl die hohe Anzahl der Tabletten (min. 14 Tabletten täglich), als auch die häufige Einnahme (4 x täglich) und das häufige Auftreten von Nebenwirkungen (v.a. gastrointestinal) können die Therapieadhärenz beeinflussen (26). Dennoch zeigt die Bismut-haltige Vierfachtherapie als empirische Erstlinientherapie Eradikationsraten von über 90 % (27). Das fixe Kombinations-Präparat, Pylera®, ist derzeit in einer Packungsgrösse für eine 10-tägige Therapie erhältlich. Da jedoch eine Therapie-dauer von 14 Tagen präferiert werden sollte, entstehen hier zusätzliche Kosten (9).
Resistenztestung
Eine Resistenztestung ist sowohl aus Magenbiopsien (Kultur oder molekulare Testung), als auch aus einer nativen Stuhlprobe (molekulare Testung) möglich (28). Leider wird eine Resistenztestung aus Stuhlproben bisher von keinem Schweizer Labor angeboten. Sofern nach Magenbiopsie eine Kultivierung von H. pylori gelingt, kann eine Empfindlichkeitstestung auf CLR, LVX, MTZ, AMX, Tetrazyclin und RFB erfolgen. Bei der molekularen Resistenzprüfung hingegen kann Polymerasekettenreaktion (PCR)-basiert auf CLR- und LVX-Resistenzen getestet werden (21, 28).
Eradikationstherapie gemäss aktuellen Leitlinien
Das Ziel der antibiotischen Therapien ist eine Eradikationsrate von ≥90 %, optimalerweise ≥95 %, zu erreichen, um Resistenzentwicklung zu vermeiden und Patienten nicht unnötig zu belasten (29). Die weltweite Zunahme der Antibiotikaresistenzen und das schlechtere Ansprechen auf die üblichen empirischen Eradikationstherapien führten dazu, dass die Standard-Triple-Therapie als empirische Erstlinientherapie durch die Bismut-haltige Vierfachtherapie abgelöst wurde und der Trend in Richtung resistenzgerechte Eradikationstherapien geht (8, 9, 21).
So wird im Vergleich zu der vorausgegangenen europäischen Leitlinie von 2017 in der aktuellen Version von 2022 die Durchführung einer Resistenzprüfung (Kultur oder molekulargenetisch) vor der Erstlinientherapie und eine anschliessende resistenzgerechte Therapie als sinnvoll erachtet. Wenn eine Resistenzprüfung nicht möglich ist, sollte sich die empirische Therapie nach den lokalen Resistenzlagen richten. Wenn diese nicht bekannt sind, so muss von einer hohen Prävalenz an CLR-Resistenzen ausgegangen werden. Im Falle einer erwarteten hohen (>15 %) CLR-Resistenzlage, so wie in der Schweiz, wird als Erstlinientherapie die Bismut-haltige Vierfachtherapie oder alternativ die nicht-Bismut-haltige (konkomittierende) Vierfachtherapie empfohlen. Als Zweitlinientherapie wird je nach vorangegangener Erstlinientherapie die LVX-basierte oder die Bismut-haltige Vierfachtherapie empfohlen. Als Drittlinientherapie kommt unter anderem die Rifabutin-Triple-Therapie in Frage (9, 30).
Die deutsche Leitlinie empfiehlt weiterhin eine empirische Erstlinientherapie. Erst im Falle eines Therapieversagens unter der Bismut-haltigen Vierfachtherapie soll eine antibiotische Resistenztestung mit anschliessend resistenzgerechter Zweitlinientherapie erfolgen. Bei Wahl der Erstlinientherapie wird nicht mehr, wie in der älteren Version von 2016, zwischen einer hohen und tiefen CLR-Resistenzlage unterschieden (8, 31).
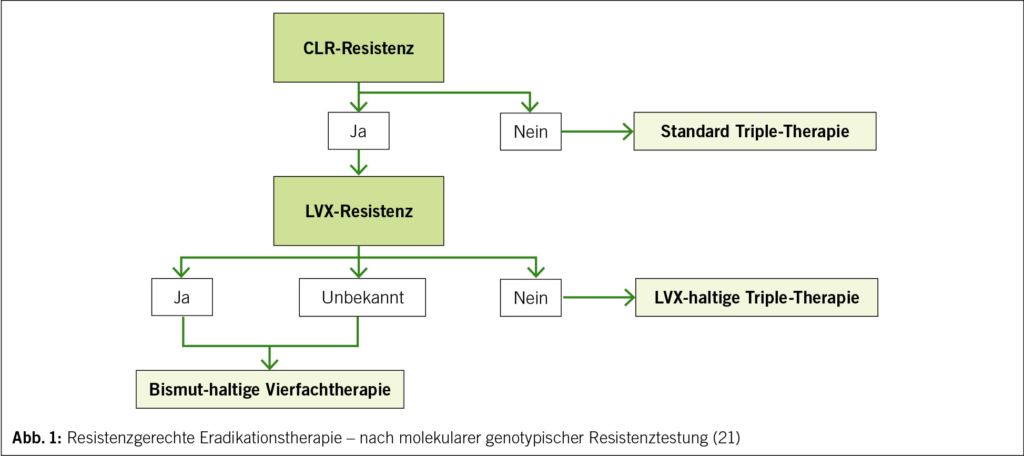
Die im letzten Jahr erschienene schweizerische Richtlinie empfiehlt klar eine resistenzgerechte Erstlinientherapie. Es wird zwischen der molekularen genotypischen Resistenztestung (zwei Antibiotika) und der phänotypischen Resistenztestung (sechs Antibiotika nach Kultur von H. pylori) unterschieden. Nach molekularer Resistenztestung ohne Nachweis einer CLR-Resistenz ist eine Standard-Triple-Therapie empfohlen (Abb. 1). Im Falle einer CLR-Resistenz und LVX-Sensibilität sollte eine LVX-basierte Triple-Therapie gewählt werden. Bei CLR-Resistenz und unbekannter LVX Resistenzlage sowie bei CLR- und gleichzeitiger LVX-Resistenz ist eine Bismut-haltige Vierfachtherapie empfohlen. Vorteil der phänotypischen Resistenztestung ist, dass auf vier weitere Antibiotika getestet werden kann, was vor allem bei vorangegangenen, nicht erfolgreichen Eradikationstherapien sinnvoll ist. Die vollständige Tabelle mit Therapieempfehlungen nach phänotypischer Resistenztestung kann in der aktuellen Richtlinie der Schweizer Gesellschaft für Infektiologie eingesehen werden (21).
Ein Spezialfall bei der H. plyori Eradikation ist die Penicillin-Allergie. Es ist davon auszugehen, dass nur ein kleiner Teil (<5 %) der Patienten mit anamnestischer Penicillin-Allergie auch tatsächlich eine immunmediierte Hypersensitivität aufweisen, so dass sich eine vorherige Allergie-Testung lohnen kann, um Patienten nicht unnötig von optimalen Therapien auszuschliessen (32). Im Falle einer «echten» Penicillin-Allergie kann auf die Bismut-haltige Vierfach-therapie oder eine Fluorchinolon-haltige Triple-Therapie, z.B. PPI mit LVX und CLR, zurückgegriffen werden (9).
Fazit
Obwohl in den deutschen und europäischen Richtlinien weiterhin die empirische Erstlinientherapie der H. pylori Infektion verankert ist, zeigt sich ein klarer Trend in Richtung resistenzgerechte Eradikationstherapien. Die kürzlich publizierte Schweizer Richtlinie empfiehlt bereits eine resistenzgerechte Erstlinientherapie. Es ist davon auszugehen, dass in den nächsten Jahren auch die internationalen Richtlinien in diese Richtung angepasst werden.
Copyright Aerzteverlag medinfo AG
Kantonsspital Baselland, Zentrum Bauch,
Universitäres Zentrum Innere Medizin
Rheinstrasse 26
4410 Liestal
Kantonsspital Baselland, Zentrum Bauch,
Universitäres Zentrum Innere Medizin
Rheinstrasse 26
4410 Liestal
Die Autorenschaft hat keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
1. Goodman KJ, O’Rourke K, Day RS, Wang C, Nurgalieva Z, Phillips CV, et al. Dynamics of Helicobacter pylori infection in a US-Mexico cohort during the first two years of life. Int J Epidemiol. 2005;34(6):1348-55.
2. Nurgalieva ZZ, Malaty HM, Graham DY, Almuchambetova R, Machmudova A, Kapsultanova D, et al. Helicobacter pylori infection in Kazakhstan: effect of water source and household hygiene. Am J Trop Med Hyg. 2002;67(2):201-6.
3. Rocha GA, Rocha AM, Silva LD, Santos A, Bocewicz AC, Queiroz Rd Rde M, et al. Transmission of Helicobacter pylori infection in families of preschool-aged children from Minas Gerais, Brazil. Trop Med Int Health. 2003;8(11):987-91.
4. Malfertheiner P, Camargo MC, El-Omar E, Liou JM, Peek R, Schulz C, et al. Helicobacter pylori infection. Nat Rev Dis Primers. 2023;9(1):19.
5. Malfertheiner P, Chan FK, McColl KE. Peptic ulcer disease. Lancet. 2009;374(9699):1449-61.
6. Wotherspoon AC, Ortiz-Hidalgo C, Falzon MR, Isaacson PG. Helicobacter pylori-associated gastritis and primary B-cell gastric lymphoma. Lancet. 1991;338(8776):1175-6.
7. Helicobacter, Cancer Collaborative G. Gastric cancer and Helicobacter pylori: a combined analysis of 12 case control studies nested within prospective cohorts. Gut. 2001;49(3):347-53.
8. Fischbach W, Bornschein J, Hoffmann JC, Koletzko S, Link A, Macke L, et al. Update S2k-Guideline Helicobacter pylori and gastroduodenal ulcer disease of the German Society of Gastroenterology, Digestive and Metabolic Diseases (DGVS). Z Gastroenterol. 2024;62(2):261-321.
9. Malfertheiner P, Megraud F, Rokkas T, Gisbert JP, Liou JM, Schulz C, et al. Management of Helicobacter pylori infection: the Maastricht VI/Florence consensus report. Gut. 2022.
10. Brandi G, Biavati B, Calabrese C, Granata M, Nannetti A, Mattarelli P, et al. Urease-positive bacteria other than Helicobacter pylori in human gastric juice and mucosa. Am J Gastroenterol. 2006;101(8):1756-61.
11. Rautelin H, Lehours P, Megraud F. Diagnosis of Helicobacter pylori infection. Helicobacter. 2003;8 Suppl 1:13-20.
12. Lehours P, Ruskone-Fourmestraux A, Lavergne A, Cantet F, Megraud F, Groupe d’Etude des Lymphomes Digestifs for the Federation Francaise de Cancerologie D. Which test to use to detect Helicobacter pylori infection in patients with low-grade gastric mucosa-associated lymphoid tissue lymphoma? Am J Gastroenterol. 2003;98(2):291-5.
13. Capurso G, Carnuccio A, Lahner E, Panzuto F, Baccini F, Delle Fave G, et al. Corpus-predominant gastritis as a risk factor for false-negative 13C-urea breath test results. Aliment Pharmacol Ther. 2006;24(10):1453-60.
14. Vorhendi N, Soos A, Anne Engh M, Tinusz B, Szakacs Z, Pecsi D, et al. Accuracy of the Helicobacter pylori diagnostic tests in patients with peptic ulcer bleeding: a systematic review and network meta-analysis. Therap Adv Gastroenterol. 2020;13:1756284820965324.
15. Chey WD, Leontiadis GI, Howden CW, Moss SF. ACG Clinical Guideline: Treatment of Helicobacter pylori Infection. Am J Gastroenterol. 2017;112(2):212-39.
16. Zucca E, Arcaini L, Buske C, Johnson PW, Ponzoni M, Raderer M, et al. Marginal zone lymphomas: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2020;31(1):17-29.
17. Graham DY, Fischbach L. Helicobacter pylori treatment in the era of increasing antibiotic resistance. Gut. 2010;59(8):1143-53.
18. Graham DY, Lu H, Dore MP. Relative potency of proton-pump inhibitors, Helicobacter pylori therapy cure rates, and meaning of double-dose PPI. Helicobacter. 2019;24(1):e12554.
19. Chey WD, Megraud F, Laine L, Lopez LJ, Hunt BJ, Howden CW. Vonoprazan Triple and Dual Therapy for Helicobacter pylori Infection in the United States and Europe: Randomized Clinical Trial. Gastroenterology. 2022;163(3):608-19.
20. Salazar CO, Cardenas VM, Reddy RK, Dominguez DC, Snyder LK, Graham DY. Greater than 95% success with 14-day bismuth quadruple anti- Helicobacter pylori therapy: a pilot study in US Hispanics. Helicobacter. 2012;17(5):382-90.
21. Weber R BJ, Bosshard S, Brugger SD, Colin-Benoit E, Egli A, Imkamp F, Keller PM, Müllhaupt B, Plate A, Chmiel C, Kuster SP, Guideline Committee of the Swiss Society for Infectious Diseases. Helicobacter pylori Infektion: Grundlagen für eine rationale Therapie. SGInf H pylori Guidelines: Swiss Society of Infectious Diseases 2023.
22. Megraud F, Bruyndonckx R, Coenen S, Wittkop L, Huang TD, Hoebeke M, et al. resistance to antibiotics in Europe in 2018 and its relationship to antibiotic consumption in the community. Gut. 2021;70(10):1815-22.
23. InfectAMR. Available from: https://infect.swiss/.
24. Wüppenhorst N, Draeger S, Stüger HP, Hobmaier B, Vorreiter J, Kist M, et al. Prospective multicentre study on antimicrobial resistance of Helicobacter pylori in Germany. J Antimicrob Chemother. 2014;69(11):3127-33.
25. Nyssen OP, Bordin D, Tepes B, Perez-Aisa A, Vaira D, Caldas M, et al. European Registry on Helicobacter pylori management (Hp-EuReg): patterns and trends in first-line empirical eradication prescription and outcomes of 5 years and 21 533 patients. Gut. 2021;70(1):40-54.
26. Malfertheiner P, Bazzoli F, Delchier JC, Celiñski K, Giguère M, Rivière M, et al. Helicobacter pylori eradication with a capsule containing bismuth subcitrate potassium, metronidazole, and tetracycline given with omeprazole versus clarithromycin-based triple therapy: a randomised, open-label, non-inferiority, phase 3 trial. Lancet. 2011;377(9769):905-13.
27. Nyssen OP, Bordin D, Tepes B, Pérez-Aisa Á, Vaira D, Caldas M, et al. European Registry on. Gut. 2021;70(1):40-54.
28. Graham DY, Moss SF. Antimicrobial Susceptibility Testing for Helicobacter pylori Is Now Widely Available: When, How, Why. Am J Gastroenterol. 2022;117(4):524-8.
29. Graham DY, Liou JM. Primer for Development of Guidelines for Helicobacter pylori Therapy Using Antimicrobial Stewardship. Clin Gastroenterol Hepatol. 2022;20(5):973-83 e1.
30. Malfertheiner P, Megraud F, O’Morain CA, Gisbert JP, Kuipers EJ, Axon AT, et al. Management of Helicobacter pylori infection-the Maastricht V/Florence Consensus Report. Gut. 2017;66(1):6-30.
31. Fischbach W, Malfertheiner P, Lynen Jansen P, Bolten W, Bornschein J, Buderus S, et al. [S2k-guideline Helicobacter pylori and gastroduodenal ulcer disease]. Z Gastroenterol. 2016;54(4):327-63.
32. Castells M, Khan DA, Phillips EJ. Penicillin Allergy. N Engl J Med. 2019;381(24):2338-51.
der informierte @rzt
- Vol. 14
- Ausgabe 9
- September 2024