- Algorithmische Entscheidungshilfe zum Management von Lungenembolien
Lungenembolien zeigen ein sehr breites klinisches Spektrum wodurch eine angepasste Entschiedenheit des diagnostischen und therapeutischen Vorgehens erforderlich ist. Hierfür wurden diverse Hilfestellungen wie z.B. Scores entwickelt und geprüft die zwar validiert sind, aber oft nicht richtig eingesetzt werden oder nur Untergruppen von Patienten zugutekommen. Ein standardisiertes Vorgehen bei der Abklärung und Therapie ist also unerlässlich.
Für die meist knappe Zeit und Fülle an Informationen und Scores soll hier ein Evidenz-basiertes, schlankes Vorgehen aufgezeigt werden, um möglicherweise unnötige, sowie zeit- und kostenintensive Diagnostik zu vermeiden.
The clinical pattern of pulmonary embolism shows a very broad clinical spectrum, on which the determination of diagnostics and therapies are oriented. There are various scores for this purpose, developed, tested and validated, but often not used correctly or giving benefit only to subgroups of patients. A standardized procedure for clarification and therapy is therefore essential.
Given the limited time and abundance of information and scores, we show an evidence-based, streamlined procedure in order to avoid possibly harmful as well as time- and cost-intensive diagnostics.
Key Words: Lungenembolie, Pulmonary Embolism, Thrombembolie, Thrombembolism, Scores, Risikoabschätzung, Risk Assessment
Die meisten Leserinnen und Leser dieses Artikels werden sie schon mehrfach diagnostiziert und behandelt haben: Lungenembolien sind mit einer weltweiten Inzidenz von ca. 10 Millionen Fällen pro Jahr die dritthäufigste kardiovaskuläre Erkrankung (nach Myokardinfarkt und Schlaganfall), wofür bereits ab einem Alter von 40 Jahren ein deutlich erhöhtes Risiko besteht, welches sich ab 60 Jahren mit jeder zusätzlichen Dekade verdoppelt. Wahrscheinlich sind Lungenembolien die Ursache für 8-13% der ungeklärten Herzstillstände (1) sowie eine der häufigsten Todesursachen von Schwangeren in der westlichen Welt (2).
Das Vorgehen bei Verdacht auf Lungenembolie wird dabei – abhängig von Risiko und Klinik – stufenweise angepasst (3). Zu Beginn steht immer die Risikoeinschätzung gemäss klinischem Bild! Für ein hohes Risiko sprechen Schock, Blutdruckabfall oder Reanimationsbedürftigkeit.
Non-High Risk
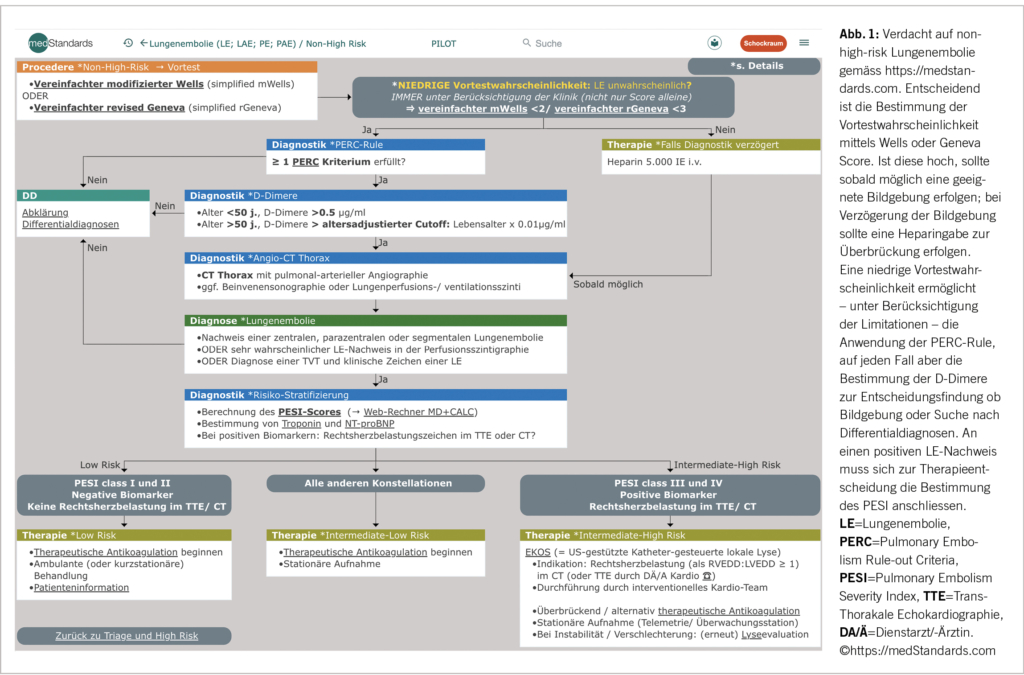
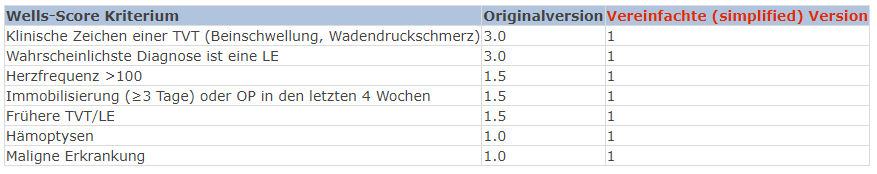
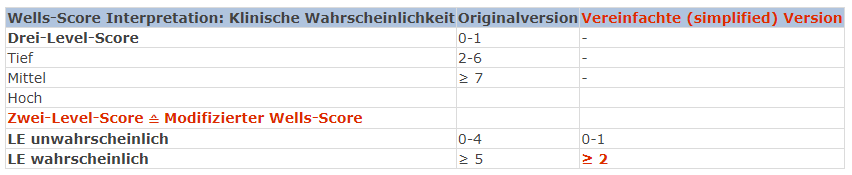
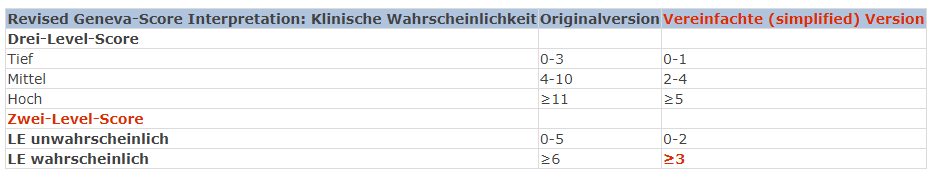
Bei den (in der Hausarztpraxis wohl am häufigsten vorstelligen) zunächst «stabilen», nicht-Hochrisikokonstellationen schliesst sich unmittelbar an die Risikoeinschätzung die Bestimmung der Vortestwahrscheinlichkeit an (Abb. 1). Hierbei helfen der vereinfachte modifizierte Wells (simplified modified Wells Score (simplified mWells), beinhaltet: klinische Zeichen TVT, LE wahrscheinlicher als andere Diagnose, frühere LE/TVT, Puls, St. n. Operation/Immobilisierung, Malignom, Hämoptysen) oder der vereinfachte revidierte Geneva Score (simplified revised Geneva (simplified rGeneva); hier wird zusätzlich das Alter berücksichtigt). Daneben muss immer auch die klinische Präsentation zur Bestimmung der Vortestwahrscheinlichkeit mit einbezogen werden. Dies kann z.B. bereits mittels der einfachen Frage: «Ist eine Lungenembolie für mich aufgrund der klinischen Präsentation wahrscheinlich?» geschehen; bei «ja» (z.B. bei geschwollenem Bein) ist eine Lungenembolie nicht mehr unwahrscheinlich!
Kommt man mittels oben genannten Scores und Klinik auf eine niedrige Vortestwahrscheinlichkeit von <15% (4) (und nur dann!) kann man mit der PERC Rule (beinhaltet: Alter, Puls, Sauerstoffsättigung, einseitige Beinschwellung, Hämoptysen, St. n. Trauma/Operation, St. n. venöser Thromboembolie, Hormontherapie) für Lungenembolien weiterfahren (5). Zu beachten ist hier die eher niedrige Prävalenz der Validierungsstudien.
Ansonsten schliesst sich die Bestimmung der D-Dimere an. Je nach Resultat und Patientenalter (>50 Jahre altersadjustierter Cutoff: Lebensalter x 0.01 µg/ml) entscheidet sich die Notwendigkeit einer Bildgebung (6). Wichtig ist hier jedoch zu beachten, dass D-Dimere vor allem für ein akutes Geschehen aussagekräftig sind! Liegt das thrombotische Geschehen bereits einige Tage zurück können negative D-Dimere auch bei Low-Risk Konstellationen nicht zur Entscheidung herangezogen werden (für High-Risk Situationen ist die Sensitivität ohnehin nicht ausreichend).
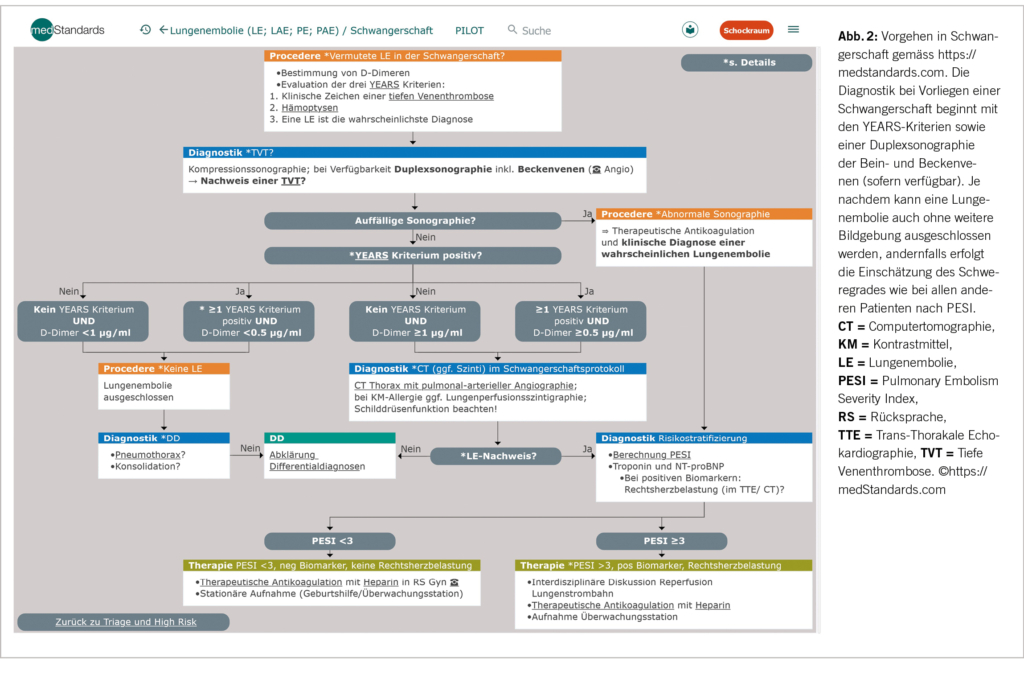
Als vereinfachtes Diagnoseinstrument können gegebenenfalls die Years Kriterien (2) (beinhaltet: Klinik, Hämoptysen, Wahrscheinlichkeit) mit einbezogen werden. Dies vor allem in der Schwangerschaft (Abb. 2), oder um sich bei Nicht-Schwangeren einen zeitsparenden Überblick zu verschaffen. Diese Kriterien benötigen allerdings ausserhalb einer Schwangerschaft sicher noch weiterer Evaluation (3).
Intermediate Risk
Bei Risikofaktoren in der initialen Beurteilung, respektive keiner niedrigen Vortestwahrscheinlichkeit und falls die weitere Diagnostik nicht unmittelbar zur Verfügung steht, sollte die Gabe von Heparin 5.000 IE i.v. erfolgen, um ein Fortschreiten des vermuteten thrombembolischen Geschehens zu verhindern.
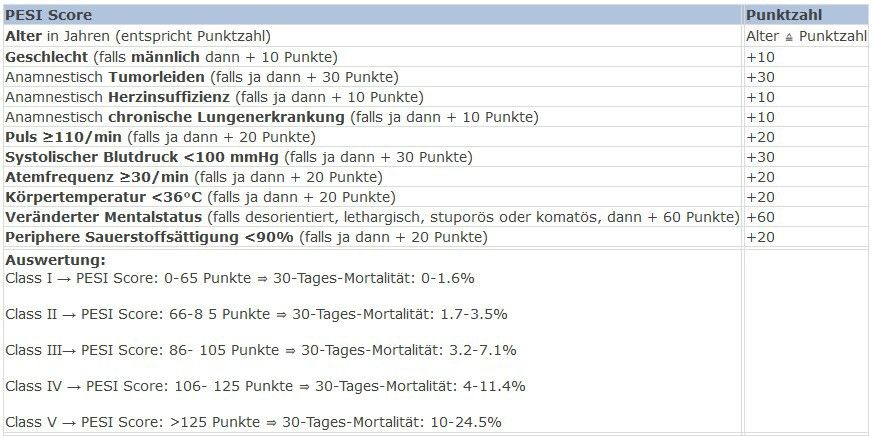
Wird in der darauffolgenden Bildgebung eine Lungenembolie gefunden, folgt bei hämodynamischer Stabilität die Interpretation unter Berücksichtigung von Klinik und Komorbiditäten. Dazu ist die Schweregrad-Einteilung beziehungsweise Risiko-Klassifizierung hinsichtlich Mortalitätsrisiko in Low Risk, Intermediate-Low Risk, Intermediate-High Risk (und High Risk = Instabilität, hohes Mortalitätsrisiko) wichtig. Dies geschieht durch Berechnung des (simplified) PESI Scores mittels klinischer und anamnestischer Faktoren (Alter, Geschlecht, Vitalparameter, Vorgeschichte).
Zusätzlich zum PESI Score braucht es für die definitive Therapieentscheidung aber noch die Bestimmung von Troponin und NT-proBNP und im Falle positiver Biomarker auch eine transthorakale Echokardiografie (TTE) mit Frage nach Rechtsherzbelastungszeichen oder Beurteilung der Computertomografie (CT) hinsichtlich indirekten Zeichen der Rechtsherzbelastung.
High Risk
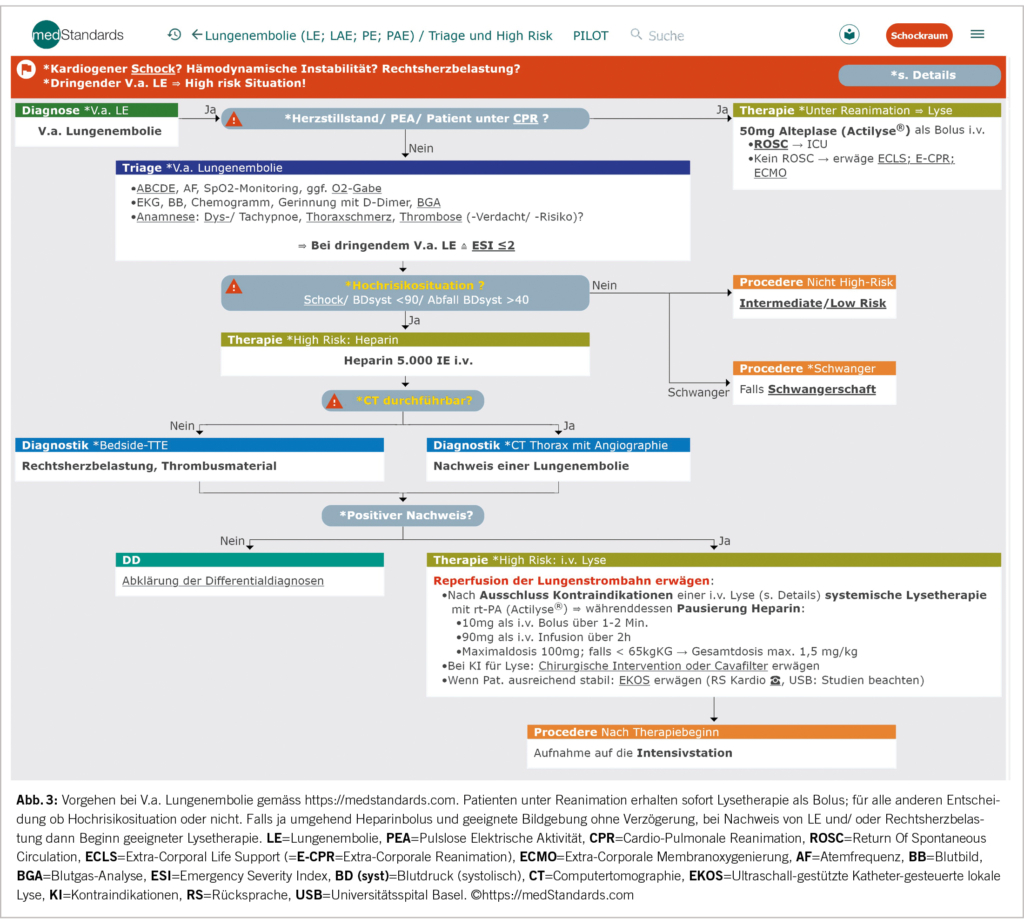
Schnelligkeit und Entschiedenheit zeichnen das Vorgehen bei klinischen Hochrisikopatientinnen und -patienten (Reanimationsbedürftigkeit, Schock) und Abwesenheit anderer wahrscheinlicherer Differenzialdiagnosen aus (Abb. 3). Diese Konstellation spricht für eine relevante Verlegung der Lungenarterienstrombahn durch einen embolisierten Thrombus.
In einer Reanimationssituation und Verdacht auf Lungenembolie ist umgehend ohne weitere Diagnostik zu lysieren (50mg Alteplase i.v. als Bolus ohne die Reanimation zu unterbrechen) um das Outcome massgeblich positiv zu beeinflussen (schnelleres Wiedererlangen eines Spontankreislaufs – ROSC), gefolgt von einem Bolus über 5.000 E Heparin i.v. (1).
Auch bei Endorgandysfunktion mit systolischem Blutdruck <90mmHg und/oder passagerer Hypotension liegt bereits eine Hochrisikosituation vor. Bei Vorliegen solch einer wahrscheinlichen «High Risk» Lungenembolie jedoch ohne Reanimationsbedürftigkeit sollte zunächst unmittelbar die Gabe von Heparin 5.000 IE i.v. erfolgen.
Ein CT-Thorax mit Angiographie erfolgt danach nur, wenn dieses unmittelbar und ohne relevante Zeitverzögerung im Vergleich zum TTE zugänglich ist. Für die Therapieentscheidung ist neben dem bildgebenden Nachweis einer Lungenembolie, Zeichen der Rechtsherzbelastung oder Infarktpneumonie auch eine direkte Visualisierung von Thrombusmaterial im TTE ausreichend (3). Gelingt dies, müssen in der „High Risk“ Situation geeignete Massnahmen zur Reperfusion der Lungenstrombahn erwogen werden. In jedem Fall benötigt es eine entsprechende Überwachung, beispielsweise auf einer Intensivstation.
Therapie
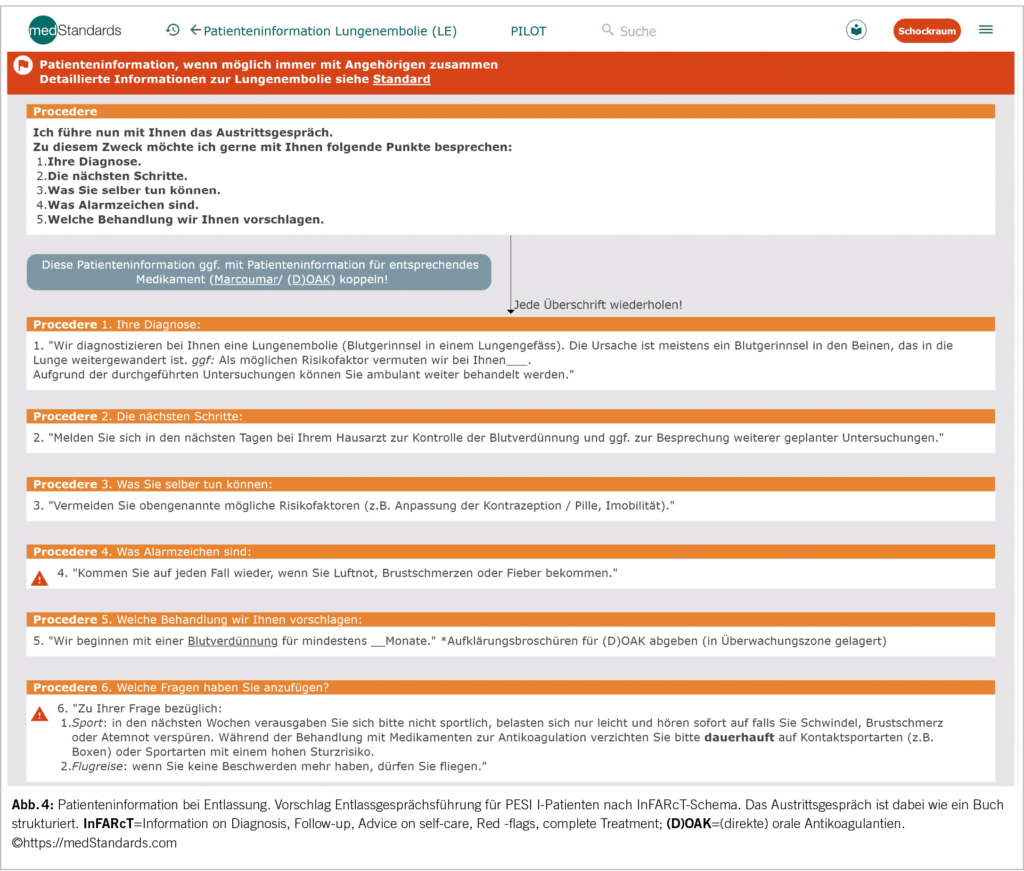
Für die Therapieentscheidung sollte immer auch die Gebrechlichkeit (z.B. Clinical Frailty Scale – CFS) berücksichtigt werden. Für eine ambulante Behandlung ist neben der Risikoeinschätzung ebenso die Patienteninformation vor Austritt bedeutend (Abb. 4).
Bei PESI III und IV muss eine stationäre Aufnahme, gegebenenfalls auf eine Überwachungsstation, erfolgen. Die Wahl der Lysetherapie entscheidet sich anhand Stabilität und Verfügbarkeit der Verfahren (Abb.1). Bei Verschlechterung oder fehlender klinischer Besserung kann und soll eine Lyse erneut evaluiert werden.
Nach der initialen Therapie (5-21 Tage) schliesst sich die Erhaltungstherapie für 3 Monate an. Bei unprovozierter Lungenembolie erfolgt dann eine individuelle Evaluation der Antikoagulation nach 3-6 Monaten (unter Berücksichtigung von Vorteilen, Risiken, Patientensituation) sowie ein jährliches Follow-up (Rezidiv, pulmonale Hypertonie, Blutungskomplikationen, Malignom?).
Dr. med. Mascha Bethke
Prof. Dr. Roland Bingisser
medStandards, Universitätsspital Basel
Petersgraben 4, 4031 Basel
Copyright bei Aerzteverlag medinfo AG
medStandards
Universitätsspital Basel
Petersgraben 4
4031 Basel
Die Autor/-innen haben keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
◆ In diesem Artikel geht es nicht darum, neue diagnostische Errungenschaften oder Therapien aufzuzeigen. Vielmehr lohnt sich bei dem regelrechten Dschungel an Scores ein klarer, leitliniengerechter und pragmatischer Weg: Risikoeinschätzung (bei Triage/Erstkontakt), Vortestwahrscheinlichkeit (in Non-High-Risk Situationen), Schweregrad und Mortalitätsrisiko (nach Diagnosestellung). PERC-Rule und YEARS-Kriterien können – jedoch nur in spezifischen Situationen – den Algorithmus abkürzen.
1. Sharifi M, Berger J, Beeston P, Bay C, Vajo Z, Javadpoor S; “PEAPETT” investigators. Pulseless electrical activity in pulmonary embolism treated with thrombolysis (from the “PEAPETT” study). Am J Emerg Med. 2016;34(10):1963-1967
2. van der Pol LM, Tromeur C, Bistervels IM, Ni Ainle F, van Bemmel T, Bertoletti L, Couturaud F, van Dooren YPA, Elias A, Faber LM, Hofstee HMA, van der Hulle T, Kruip MJHA, Maignan M, Mairuhu ATA, Middeldorp S, Nijkeuter M, Roy PM, Sanchez O, Schmidt J, Ten Wolde M, Klok FA, Huisman MV; Artemis Study Investigators. Pregnancy-Adapted YEARS Algorithm for Diagnosis of Suspected Pulmonary Embolism. N Engl J Med. 2019;380(12):1139-1149
3. Konstantinides SV, Meyer G, Becattini C, Bueno H, Geersing GJ, Harjola VP, Huisman MV, Humbert M, Jennings CS, Jiménez D, Kucher N, Lang IM, Lankeit M, Lorusso R, Mazzolai L, Meneveau N, Áinle FN, Prandoni P, Pruszczyk P, Righini M, Torbicki A, Van Belle E, Zamorano JL; 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS): The Task Force for the diagnosis and management of acute pulmonary embolism of the European Society of Cardiology (ESC). Eur Respir J. 2019;54(3):1901647
4. Kline JA, Courtney DM, Kabrhel C, Moore CL, Smithline HA, Plewa MC, Richman PB, O’Neil BJ, Nordenholz K. Prospective multicenter evaluation of the pulmonary embolism rule-out criteria. J Thromb Haemost. 2008;6(5):772-80
5. Malavolta D, Quatela V, Moffat J, Ottolini BB; GrAM (Gruppo di Autoformazione metodologica). Effect of the Pulmonary Embolism Rule-Out Criteria on subsequent thromboembolic events among low-risk emergency department patients: the PROPER randomized clinical trial. Intern Emerg Med. 2019;14(2):309-310
6. Freund Y, Chauvin A, Jimenez S et al. Effect of a Diagnostic Strategy Using an Elevated and Age-Adjusted D-Dimer Threshold on Thromboembolic Events in Emergency Department Patients With Suspected Pulmonary Embolism: A Randomized Clinical Trial. JAMA 2021; 326: 2141–2149 7.
Abbildungen und Algorithmus aus https://medStandards.com. Dank an Dr. med. Lucas Dratz für die erste Version in medStandards.
der informierte @rzt
- Vol. 13
- Ausgabe 9
- September 2023