- Anti-Amyloid-Therapien in der Alzheimerbehandlung: Licht und Schatten
Die Alzheimer-Krankheit ist eine schwere und häufige Erkrankung, bei der die derzeitigen Behandlungsmethoden nur symptomatisch wirken und den Krankheitsverlauf nicht beeinflussen. Im Juli 2023 und Juli 2024 wurden Behandlungen mit monoklonalen Antikörpern, die auf eines der an der Pathophysiologie der Krankheit beteiligten Proteine, das ss-Amyloid, wirken, von der FDA in den USA zugelassen und werden derzeit in der Schweiz geprüft. Diese Behandlungen, die einen statistisch signifikanten klinischen Nutzen gezeigt haben, sind mit Nebenwirkungen verbunden, die durch Ödeme oder Hirnblutungen gekennzeichnet sind und als ARIA für Amyloid Related Imaging Abnormalities bezeichnet werden. Eine strenge Auswahl der Patienten und eine sorgfältige Überwachung sind daher unerlässlich, um ein günstiges Nutzen-Risiko-Verhältnis zu erzielen.
Alzheimer’s disease is a serious and common illness, and current treatments have only a symptomatic effect and have no influence on its progres- sion. In July 2023 and July 2024, monoclonal antibody treatments acting on one of the proteins involved in the pathophysiology of the disease, B-amyloid, were approved by the FDA in the United States and are currently being evaluated in Switzerland. These treatments, which have shown a statistically significant clinical benefit, are associated with side effects characterised by cerebral oedema or haemorrhage, known as ARIA for Amyloid Related Imaging Abnormalities. Careful patient selection and monitoring will therefore be essential if the benefit-risk ratio is to be favourable.
Key words: Alzheimer, Anti-Amyloid, ARIA
Einführung
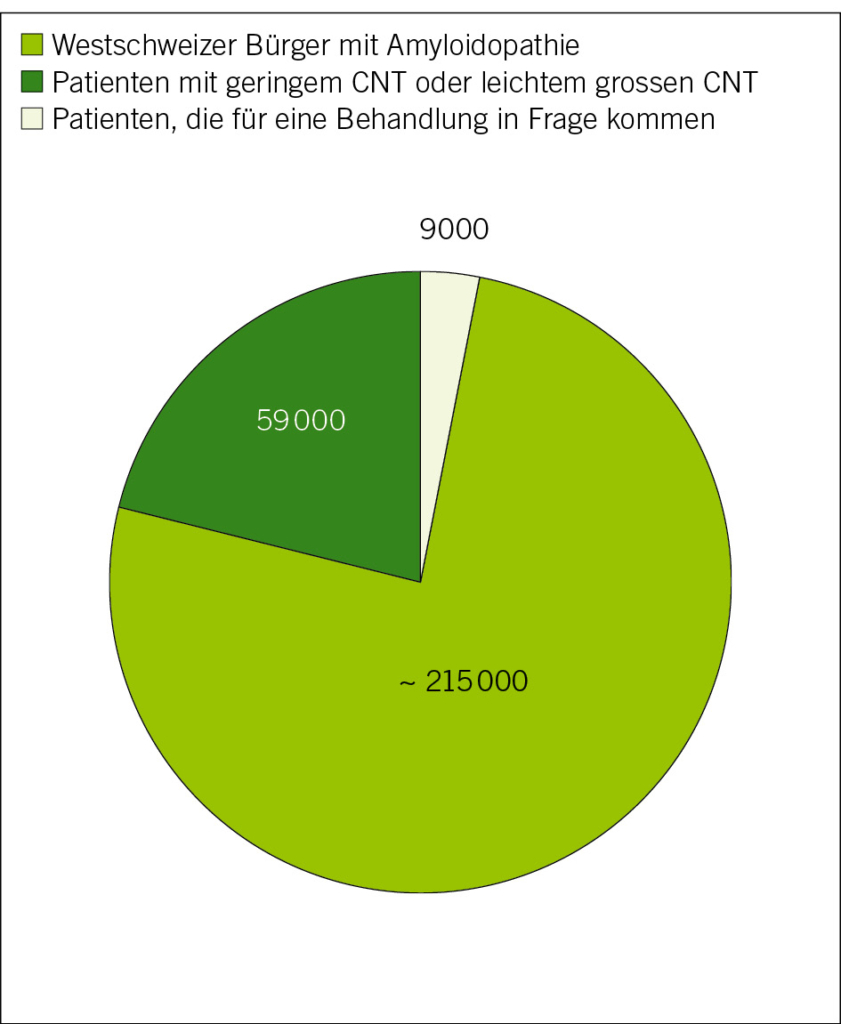
Die Alzheimer-Krankheit ist eine neurodegenerative Erkrankung des Gehirns und die häufigste Ursache für neuro-kognitive Störungen, die meist nach dem 65. Lebensjahr auftreten. Weltweit sind derzeit 50 Millionen Menschen von der Krankheit betroffen, davon etwa 25 000 in der französischsprachigen Schweiz. Aufgrund der Alterung der Bevölkerung wird diese Zahl voraussichtlich weiter steigen, wobei bis 2050 mit 152 Millionen Patienten weltweit gerechnet wird. Die Alzheimer-Krankheit hat nicht nur Auswirkungen auf die Patienten selbst, sondern auch auf deren Familien, die Gesundheitssysteme, die psychosozialen Systeme und den Arbeitsmarkt, wobei die weltweiten Kosten auf 1 Billion US-Dollar pro Jahr geschätzt werden (1).
Zu den häufigen klinischen Erscheinungsformen der Krankheit gehören Amnesie, Sprache (primär progressive logopenische Aphasie) oder visuelle Formen (posteriore kortikale Atrophie). Diese behindernden Symptome führen zu einem fortschreitenden Verlust der Selbstständigkeit aufgrund progressiv globaler kognitiver Störungen und zu einer verkürzten Lebenserwartung. Nach der Erstbeschreibung im Jahr 1906 durch Alois Alzheimer wurde nachgewiesen, dass diese Erkrankung insbesondere durch die fortschreitende extrazelluläre Akkumulation von Beta-Amyloid-Proteinen in abnormaler Konformation und die intrazelluläre Akkumulation von Neurofibrillen aus phosphoryliertem Tau-Protein gekennzeichnet ist, was zu zellulärer Dysfunktion und neuronalem Tod führt. Die Symptome treten jedoch erst Jahre nach Beginn dieser Proteinveränderungen auf, die Synergien und Wechselwirkungen mit mikroglialer und vaskulärer Aktivität aufweisen.
Derzeit zielen die Behandlungen für die Alzheimer-Krankheit hauptsächlich darauf ab, die Symptome zu lindern. Die beiden wichtigsten Medikamentenklassen sind Anticholinesterasehemmer wie Donepezil, Galantamin und Rivastigmin, die den Acetylcholinspiegel im Gehirn erhöhen, und Memantin, das die Aktivität von Glutamat, den Neurotransmittern, die am Lernen und Gedächtnis beteiligt sind, reguliert. Diese Behandlungen bieten jedoch oft nur einen geringen Nutzen und verändern die Pathophysiologie der Krankheit nicht.
Aufgrund der Häufigkeit und Schwere dieser Krankheit versucht die Wissenschaft seit Jahrzehnten, Behandlungen zu entwickeln, die diese Krankheit behandeln oder ihren Verlauf deutlich verlangsamen können.
Anti-Amyloid-Behandlungen
Nach der Entdeckung der senilen Plaques und dem Vorschlag der Hypothese der Amyloidkaskade durch Hardy et al. im Jahr 1992 (2) wurden zahlreiche klinische Studien durchgeführt, um «disease-modifying»-Therapien zu entwickeln, die auf die an den Krankheitsmechanismen beteiligten Proteine abzielen. Seit den ersten vielversprechenden Ergebnissen bei Mäusen von Schenk et al. im Jahr 1999 wurden mehrere Versuche beim Menschen durchgeführt, die jedoch aufgrund von Komplikationen, ungeeigneten Zielstrukturen oder dem Fehlen pathophysiologischer Biomarker nicht erfolgreich waren. In der Folgezeit führten eine bessere Auswahl der therapeutischen Ziele, verbesserte diagnostische Methoden (insbesondere der Zugang zu Amyloid-PET und die Bestimmung von Proteinen im Liquor) und höhere Dosierungen zu einer schrittweisen Verbesserung der Ergebnisse, bis 2021 die erste Anti-Amyloid-Therapie, Aducanumab, zugelassen wurde (und 2024 wieder zurückgenommen wurde). Seitdem wurde 2023 ein zweites Medikament, Lecanemab, und im Juni 2024 eine weitere Behandlung, Donanemab, zugelassen. Die beiden letztgenannten Medikamente werden derzeit von den Regulierungsbehörden in der Schweiz geprüft. Eine Nutzen-Risiko-Abwägung ist für die Beratung von Patienten und die Überwachung von Nebenwirkungen von entscheidender Bedeutung. In diesem Artikel geben wir einen Überblick über die Behandlungen, die sich im Zulassungsverfahren befinden, und diskutieren die erwarteten Vorteile und die damit verbundenen Risiken.
Bei diesen Molekülen handelt es sich um menschliche monoklonale Antikörper, die zielen selektiv auf Beta-Amyloid ab und induzieren eine mikrogliale Aktivierung, die zur Phagozytose und zum Abbau des toxischen Proteins führt. Obwohl diese Moleküle auf das gleiche Protein abzielen, verleihen ihre unterschiedlichen Wirkmechanismen Aducanumab eine höhere Affinität zu Oligomeren, Lecanmab mit Protofibrillen und Donanemab mit Amyloid-Plaque.
Nach einer Phase-2-Studie mit vielversprechenden Wirksamkeitsergebnissen wurde Aducanumab in zwei randomisierten klinischen Studien der Phase 3 (ENGAGE und EMERGE) mit über 3200 Patienten in 20 Ländern untersucht. Die Studien zeigten eine deutliche dosisabhängige Senkung der Amyloid- und Tau-Belastung sowie eine Verlangsamung des Rückgangs des CDR-Scores um 18 % über 18 Monate in der EMERGE-Studie und um 15 % über 18 Monate in der ENGAGE-Studie, wobei nur in der ersten Studie signifikante Ergebnisse erzielt wurden (3).
Ähnliche Ergebnisse wurden in den Phase-3-Studien CLARITY-AD und TRAILBLAZER-ALZ 2 mit Lecanemab bzw. Donanemab erzielt. Die erste Studie ergab eine Verlangsamung des kognitiven Verfalls um 27 % auf der CDR-SB-Skala nach 18 Monaten zwischen der Experimental- und der Placebogruppe, die zweite um 36 % auf der CDR-Skala und um 41 % beim Verlust der Selbstständigkeit bei den Aktivitäten des täglichen Lebens.
Neben der ähnlichen Wirkungsweise unterscheiden sich diese Behandlungen auch in der Art der Verabreichung. Lecanemab wird zweimal im Monat intravenös verabreicht. Donanemab wurde einmal im Monat intravenös verabreicht.
Diese Studien betrafen Patienten in frühen Stadien der Krankheit (MMSE > 22/30), mit einem gemeinsamen Phänotyp (Amnesie) und mit einer Pathophysiologie der pro- uvativen Alzheimer-Krankheit (Amyloid-positiv).
Diese positiven Ergebnisse für die primären Outcomes rechtfertigten die Zulassung durch die US-Behörden. Die klinische statistische Signifikanz und der pathophysiologische Proof of Concept sind unbestreitbar. Das klinische Ausmass des beobachteten Effekts und der langfristige Nutzen bleiben jedoch angesichts des Studiendesigns und der auf 18 Monate begrenzten Dauer bei einer wenig symptomatischen Population fraglich. Die ersten gemeldeten Ergebnisse der Erweiterungsphase und die günstigen Daten zu den Biomarkern der Krankheit (Tau-Protein) deuten auf einen langfristigen krankheitsmodifizierenden Effekt hin.
Dieser biologische Effekt wurde bei mehr als 30 % der behandelten Patienten mit klinischen und radiologischen Nebenwirkungen in Verbindung gebracht, die grösstenteils asymptomatisch waren.
Unerwünschte Wirkungen – ARIAs
Die wichtigsten Nebenwirkungen im Zusammenhang mit Anti-Amyloid-Behandlungen sind die sogenannten «Amyloid Related Imaging Abnormalities», kurz ARIAs genannt. Diese Abnormitäten, die durch bildgebende Verfahren im Gehirn (MRT) festgestellt werden, werden durch die Behandlung zur Entfernung von Amyloid-Plaques begünstigt. Es gibt zwei Arten von ARIAs: ARIA-E, die durch vasogene Ödeme bedingte Anomalien aufweisen, und ARIA-H, bei denen es sich um Mikroblutungen oder oberflächliche Hämosiderose handelt. Obwohl die eigentliche Physiopathologie der ARIAs nicht bekannt ist, scheint die Schädigung der Gefässwandintegrität zu Beginn der Immunisierung (in den ersten 3–6 Monaten der Behandlung), die durch die Eliminierung der pathologischen Proteine durch die Antikörper verursacht wird, signifikant damit in Verbindung zu stehen.
Neben der Behandlung und einer prävalenten Amyloidangiopathie ist das Vorhandensein eines ε4/ε4-APOE-Protein-Allels der dritte Faktor, der das Risiko für ARIAs signifikant erhöht. Obwohl in den meisten Fällen asymptomatisch, können sich diese Anomalien durch ungewöhnliche Kopfschmerzen, Verwirrung oder Schwindel bemerkbar machen. In schwereren Fällen können sie zu fokalen neurologischen Zeichen, Bewusstseinsstörungen, epileptischen Anfällen oder zum Tod führen.
Seit ihrer Beschreibung in den Bapineuzumab-Studien von Sperling et al. im Jahr 2011 haben Expertenausschüsse Empfehlungen für die Nachsorge von Patienten, die mit Anti-Amyloid-Medikamenten behandelt werden, und für den Umgang mit möglichen ARIAs formuliert (4, 5).
Welche Empfehlungen zur Nutzung gibt es?
In der Schweiz werden derzeit Empfehlungen für eine angemessene Anwendung erarbeitet, die auf den Kriterien der CLARITY-Studie und den von Cummings 2023 veröffentlichten Empfehlungen basieren.
(6). Die Behandlungen werden in geeigneten Einrichtungen durchgeführt, die über das nötige Fachwissen und die technischen Voraussetzungen für die Durchführung und den Umgang mit möglichen Nebenwirkungen verfügen. Die wichtigsten Elemente, die Sie kennen sollten, sind die folgenden:
1. Auswahl der Patienten
In Frage kommen Patienten mit Alzheimer-Krankheit im Frühstadium und Amyloid-Biologie. Diejenigen mit dem höchsten Risiko für Behandlungskomplikationen, wie z. B. Patienten, die Antikoagulantien einnehmen, die einen ischämischen Schlaganfall innerhalb eines Jahres erlitten haben, die eine schwere Leukaroidose oder eine wahrscheinliche Amyloidangiopathie haben, sowie Patienten mit schweren somatischen oder psychiatrischen Komorbiditäten (z. B. Krebs oder instabile Organinsuffizienz) müssen entsprechend behandelt werden. Es wird geschätzt, dass weniger als 10 % der Alzheimer-Patienten, die in Gedächtniszentren behandelt werden, Zugang zu einer Behandlung haben werden (7).
2. Nachverfolgung von Patienten
Patienten unter Behandlung sollten regelmässig radiologisch mittels MRT überwacht werden und bei Symptomen, die auf eine ARIA hindeuten, sofort eine Bildgebung erhalten. Bei Auftreten einer leichten, asymptomatischen ARIA kann die Behandlung unter engmaschiger Überwachung fortgesetzt werden. In den anderen Fällen sollte die Behandlung ausgesetzt werden, wobei eine regelmässige radiologische Überwachung erfolgen sollte, bis die Anomalien und Symptome abgeklungen sind. Bei schweren Symptomen, Rezidiven oder schweren ARIAs sollte die Behandlung gemäss den Empfehlungen der Arbeitsgruppe ADRD Therapeutics (6) endgültig abgebrochen werden.
3. Umgang mit symptomatischen ARIAs
Bei ARIAs wird eine neurologische Beratung empfohlen, sowie gegebenenfalls eine Krankenhauseinweisung. Je nach Symptomen kann eine Behandlung mit Kortikoiden oder Antikonvulsiva in Betracht gezogen werden (6).
Schlussfolgerung
Anti-Amyloid-Therapien sind die ersten krankheitsmodifizierenden Therapien, die für die Behandlung der Alzheimer-Krankheit im Frühstadium zugelassen wurden, und bieten neue Hoffnung für diese häufige und schwere Krankheit, die Millionen von Familien auf der ganzen Welt betrifft. Trotz dieser Hoffnung sind die bislang beobachteten Vorteile in den ersten Studien jedoch relativ bescheiden und die Auswirkungen auf die Gesundheit sind noch nicht absehbar.
Die Nebenwirkungen können schwerwiegend sein. Eine sorgfältige Auswahl von Patienten mit einem günstigen Ansprechprofil und einem geringen Risiko von Nebenwirkungen sowie eine sorgfältige Nachsorge durch spezialisierte Zentren sind daher unerlässlich, um eine optimale Behandlung zu gewährleisten.
Copyright Aerzteverlag medinfo AG
Übersetzung aus la gazette médicale 09/2024
Centre Leenaards de la mémoire
Abteilung für klinische Neurowissenschaften,
CHUV und UNILL
Chemin de Mont-Paisible 16
1011 Lausanne
Centre Leenaards de la mémoire
Abteilung für klinische Neurowissenschaften,
CHUV und UNILL
Chemin de Mont-Paisible 16
1011 Lausanne
Centre Leenaards de la mémoire
Abteilung für klinische Neurowissenschaften,
CHUV und UNILL
Chemin de Mont-Paisible 16
1011 Lausanne
Die Autoren haben keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
1. Breijyeh Z, Karaman R. Comprehensive Review on Alzheimer’ s Disease: Causes and Treatment. Molecules. 2020 Dec 8;25(24):5789. doi: 10.3390/molecules25245789. PMID: 33302541; PMCID: PMC7764106.
2. Hardy JA, Higgins GA. Alzheimer’ s disease: the amyloid cascade hypothesis. Science. 1992 Apr 10;256(5054):184-5. doi: 10.1126/science.1566067. PMID: 1566067.
3. Budd Haeberlein S, Aisen PS, Barkhof F, Chalkias S, Chen T, Cohen S, Dent G, Hansson O, Harrison K, von Hehn C, Iwatsubo T, Mallinckrodt C, Mummery CJ, Muralidharan KK, Nestorov I, Nisenbaum L, Rajagovindan R, Skordos L, Tian Y, van Dyck CH, Vellas B, Wu S, Zhu Y, Sandrock A. Two Randomized Phase 3 Studies of Aducanumab in Early Alzheimer’ s Disease. J Prev Alzheimers Dis. 2022;9(2):197-210. doi: 10.14283/jpad.2022.30. PMID: 35542991.
4. Cummings J, Aisen P, Apostolova LG, Atri A, Salloway S, Weiner M. Aducanumab: Appropriate Use Recommendations. J Prev Alzheimers Dis. 2021;8(4):398-410. doi: 10.14283/jpad.2021.41. PMID: 34585212; PMCID: PMC8835345.
5. Cummings J, Rabinovici GD, Atri A, Aisen P, Apostolova LG, Hendrix S, Sabbagh M, Selkoe D, Weiner M, Salloway S. Aducanumab: Appropriate Use Recommendations Update. J Prev Alzheimers Dis. 2022;9(2):221-230. doi: 10.14283/jpad.2022.34. PMID: 35542993; PMCID: PMC9169517.
6. Cummings J, wstolova L, Rabinovici GD, Atri A, Aisen P, Greenberg S, Hendrix S, Selkoe D, Weiner M, Petersen RC, Salloway S. Lecanemab: Appropriate Use Recommendations. J Prev Alzheimers Dis. 2023;10(3):362-377. doi: 10.14283/jpad.2023.30. PMID: 37357276; PMCID: PMC10313141.
7. Chiabotti PS, Rouaud O, Allali G. Reader Response: Eligibility for Anti-Amyloid Treatment in a Population-Based Study of Cognitive Aging. Neurology. 2024 May 14;102(9):e209375. doi: 10.1212/WNL.0000000000209375. Epub 2024 Apr 22. PMID: 38648577.
News: der informierte @rzt
- Vol. 15
- Ausgabe 1
- Januar 2025










