- Autoimmune Lebererkrankungen – eine Übersicht mit Fokus auf «neue» Differentialdiagnosen
Autoimmune Lebererkrankungen gehen über die weitläufig bekannten Entitäten hinaus. Die sogenannten autoimmun-ähnlichen Hepatitiden (AIH-like) umfassen die arzneimittelinduzierte AIH-like Hepatitis sowie die Immun-Checkpoint-Inhibitor Hepatitis. Beide stellen Kliniker aufgrund Überschneidung klinischer Merkmale mit anderen Lebererkrankungen vor eine diagnostische Herausforderung. Infolge einer Polypharmazie unserer alternden Gesellschaft, respektive dem Einsatz moderner, (vor allem) onkologischer Therapieansätze, werden AIH-like Hepatitiden in Zukunft von zunehmender Bedeutung sein. Im folgenden Artikel wird deshalb besonderes Augenmerk auf die AIH-like Hepatitiden, insbesondere hinsichtlich des klinischen Erscheinungsbildes und der Diagnostik sowie der grundlegenden Therapieansätze gelegt.
Autoimmune liver diseases go beyond the widely known entities. The so-called autoimmune-like hepatitis (AIH-like) include drug-induced AIH-like hepatitis and immune checkpoint inhibitor hepatitis. Both present diagnostic challenges to clinicians due to overlap of clinical features with other liver diseases. As a result of a polypharmacy of our aging society, respectively the use of modern, (mainly) oncological therapy approaches, AIH-like hepatitis will be of increasing importance in the future. Therefore, in the following article, special attention will be paid to AIH-like hepatitis, especially with regard to clinical presentation and diagnostics as well as basic therapeutic approaches.
Key Words: liver disease, hepatitis, autoimmune-like hepatitis
Unter autoimmunen Lebererkrankungen wird gemeinhin die Autoimmune Hepatitis (AIH), die primär biliäre Cholangitis (PBC) und die primär sklerosierende Cholangitis (PSC) verstanden (ein Abkürzungsverzeichnis findet sich am Ende des Artikels). Durch einen unbekannten Trigger wird ein chronisch verlaufender Entzündungsprozess ausgelöst. Hier werden im klassischen Sinne einer Autoimmunerkrankung Antikörper vermittelte Abwehrreaktionen gegen eigene Leberzellen ausgelöst. Die chronische Entzündung führt unbehandelt zu einer fortgeschrittenen Hepatopathie mit dem Bild einer Zirrhose inklusive portaler Hypertension. Ebenso durch autoimmune Prozesse vermittelt, kommt es bei der PBC zu einer chronischen Entzündung vornehmlich der kleinen Gallenwege. Die PBC ist von allen autoimmunen Hepatopathien am häufigsten mit anderen autoimmunen Erkrankungen wie Sjögren-Syndrom, Thyreoiditis, Sklerodermie und rheumatoider Arthritis vergesellschaftet.
Ebenso ist die primär sklerosierende Cholangitis (PSC) im Formenkreis der autoimmunen Hepatopathien anzusiedeln, wobei hier der Mechanismus der immun-vermittelten Erkrankung ebenso unklar ist. Diskutiert werden genetische und exogene Faktoren. Auffällig oft sind diese Erkrankungen zudem mit chronisch-entzündlichen Darmerkrankungen (CED) assoziiert.
Aus dem Formenkreis der autoimmunen Lebererkrankungen ist die am wenigsten bekannte, seltene und erst in jüngster Zeit beschriebene Entität die autoimmune Cholangiopathie, welche der PSC zwar ähnelt, aber zur Autoimmunpankreatitis Typ I/II zu zählen ist.
Obige Entitäten sind weitgehend bekannt und definiert in Hinblick auf Diagnostik, Therapie, Remissions-Erhaltung, Begleiterkrankungen, Überwachungsstrategien und eine allfällige Lebertransplantationsabklärung. Unzählige Übersichtsartikel in deutscher und englischer Sprache sind verfügbar, sodass wir in diesem Artikel den Focus auf «neuere» Differentialdiagnosen gelegt haben.
Auf Grund der ständig wachsenden Anzahl von Medikamenten und neuen Wirkmechanismen, v.a. in der Tumortherapie und bei der Behandlung von extrahepatischen Autoimmunerkrankungen, gewinnt die Gruppe der AIH-like Hepatitiden als Differentialdiagnose zunehmend an Bedeutung.
In der folgenden Übersicht möchten wir für diese Erkrankungen sensibilisieren. Auf der nächsten Seite wird eine Auswahl der verschiedenen Subgruppen zusammengefasst: Immun-Checkpoint-Inhibitor (ICI)-Hepatitis, autoimmune arzneimittelinduzierte (drug induced) Hepatitis (DI-AIH), Drug Induced Liver Injury (DILI) sowie die möglicherweise durch SARS-CoV-2-Vakzine induzierte Hepatitis.
Fallvorstellung
Ein 76-jähriger Patient mit einem metastasierten nicht-kleinzelligen Lungenkarzinom wird seit 3 Jahren mit Pembrolizumab therapiert. Das Karzinom konnte mit diesem monoklonalen Antikörper gegen PD-1-Rezeptoren innert 24 Monaten in eine komplette bildmorphologische Remission ohne metabole Aktivität im PET gebracht werden. In der Folge entwickelte sich eine Hepatitis mit einem Anstieg der Transaminasen (AST 204 U/l, ALT 325U/l) und vor allem der γ-GT (832 U/l). Klinisch bestand Fatigue, jedoch präsentierte sich der Patient nicht ikterisch und die Lebersynthesefunktion (INR, Albumin) war immer normal. Die Hepatopathie-spezifische Abklärung schloss akute und chronische virale Hepatitiden (A, B, C und E) aus. Gesamt-IgG/M zeigte normale Werte und das Autoimmunhepatitis-Panel (ANA, Anti-SMA, -LKM-1, -SLA) war ebenfalls negativ. Das Labormuster entsprach einer autoimmunen Hepatitis, bei jedoch fehlenden AK und normaler IgG-Konzentration. Eine perkutane Leberbiopsie zeigte nur subtile Veränderungen, vermutlich bei bereits seit 2 Wochen bestehender oraler Kortikosteroidtherapie von 50mg/d. Die Histologie zeigte wenig Interphasen-Hepatitis, ein Entzündungsinfiltrat und eine makrovesikuläre Steatose von 60%. Die Transaminasen normalisierten sich prompt innert Wochen, wobei es nach Stoppen der Steroidtherapie immer wieder (insgesamt 3-malig) zu neuerlichen Transaminasen-Anstiegen (=Flair) kam. Letztlich wurde eine sogenannte ICI-Hepatitis als Nebenwirkung von Pembrolizumab postuliert und das Medikament bei persistierender Tumor-Remission gestoppt. Anschliessend kam es zu keinem weiteren Flair, so dass erst durch das Stoppen von Pembrolizumab eine Antikörper-negative AIH von einer Immune Checkpoint-Inhibitor Hepatitis (ICI-Hepatitis) diskriminiert werden konnte.
Autoimmunhepatitis
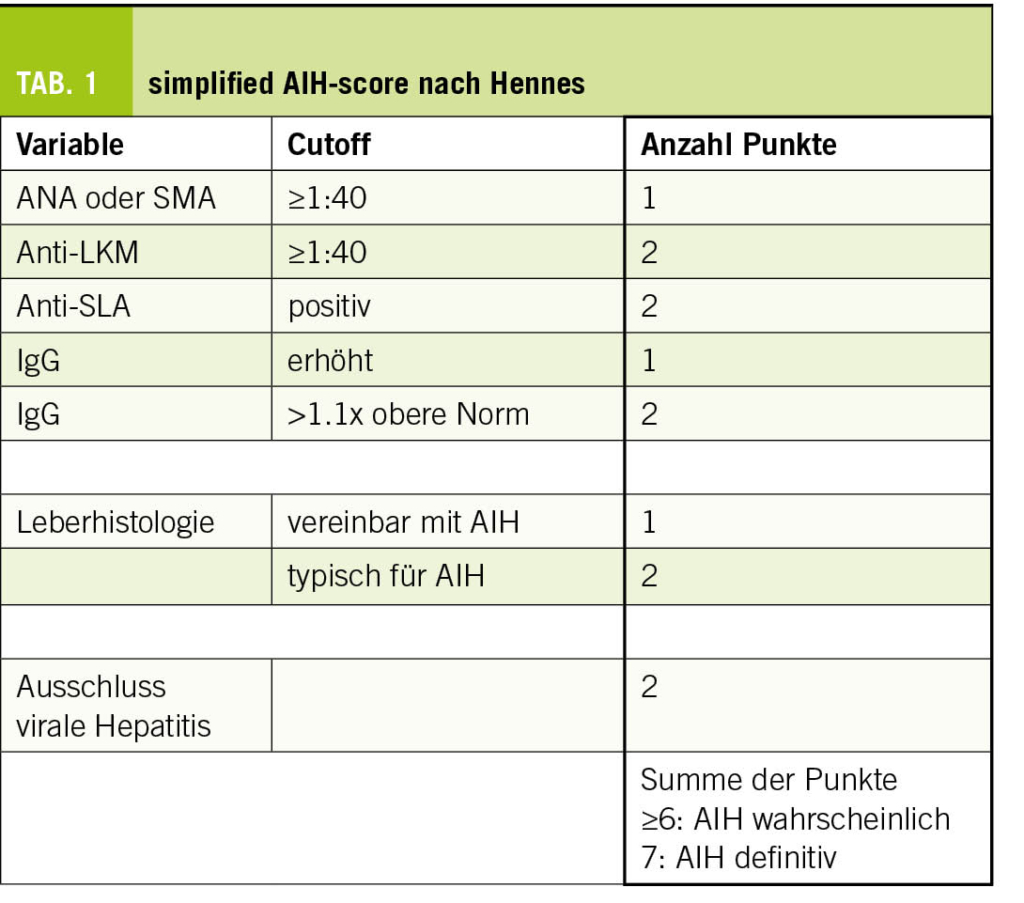
Die klassische Autoimmunhepatitis betrifft häufiger Frauen (w:m = 4:1) und weist zwei Altersgipfel auf: in der Pubertät und in der 5. - 7. Lebensdekade. Die klinischen Symptome reichen von einem asymptomatischen Verlauf bis zu schwerer Hepatitis. Je nach Antikörperprofil können drei Subtypen definiert werden, obwohl die Diagnostik und Therapie identisch sind. Eine Leberbiopsie gehört zur diagnostischen Aufarbeitung, obwohl die Histologie nicht pathognomonisch ist. Notabene gibt es seltener auch Mischbilder, sogenannte Overlap-Syndrome, mit der PBC oder PSC. Die Diagnose wird anhand von Labor und Histologie mit Hilfe eines Scores gestellt. Meist wird der vereinfachte AIH-Score nach Hennes verwendet (Tab. 1) (1). Die Therapie besteht aus einer Remissionsinduktion mit Kortikosteroiden, gefolgt von einer Remissionserhaltung mit primär Azathioprin. Zweite Wahl bei Unverträglichkeit kann Mycophenolat-Mofetil sein. Diese Therapie muss langfristig (häufig lebenslang), aber mindestens 4-5 Jahre eingenommen werden. Ein Relapse ist sehr häufig (>80%) nach Absetzen. AIH-Patienten bedürfen somit einer lebenslangen hepatologischen Betreuung mit 2-4 Kontrollen pro Jahr in Remission.
AIH-like Hepatitiden
a. Arzneimittelinduzierte autoimmunähnliche Hepatitis
Die arzneimittelinduzierte (drug induced) autoimmunähnliche Hepatitis (DI-AIH) kann das vorherrschende Muster einer idiosynkratischen medikamentösen Leberschädigung (Englisch: Drug induced liver injury, DILI) sein (2). Es wird geschätzt, dass 2% bis 18% der AIH-Fälle und rund 3% bis 9% aller DILI auf eine DI-AIH zurückzuführen sind (3, 4). Bei einer idiosynkratischen DILI handelt es sich um eine unerwünschte Reaktion der Leber, welche aufgrund der pharmakologischen Wirkung des verabreichten Arzneimittels unerwartet ist. Die Latenzzeit ist variabel und beträgt im Falle der DI-AIH oft zwei Monate oder mehr (5). Vom idiosynkratischen DILI unterschieden wird die intrinsische DILI, bei der man von einer direkten Hepatotoxizität ausgeht. Das auslösende Agens verursacht dabei reproduzierbar und vorhersehbar eine dosisabhängige DILI. Die Latenzzeit ist dabei kurz und oft unmittelbar. Ein Beispiel hierfür ist Paracetamol. Diese Einteilung ist nicht nur akademischer Natur, da sich hierdurch eine Einschätzung der Plausibilität über ein mögliches auslösendes Agens machen lässt. Hilfreich sind hierbei Datenbanken, z.B. LiverTox® (5).
Prädisponierende Faktoren und auslösende Medikamente
Es wird davon ausgegangen, dass reaktive Metaboliten, die beim hepatischen Stoffwechsel einiger Arzneimittel entstehen, an zelluläre Proteine wie Cytochrom P450 binden. Diese können dann vom Immunsystem als Neoantigene erkannt werden und eine DI-AIH auslösen (4). Begünstigende Faktoren sind die Dosierung und Pharmakokinetik des auslösenden Medikamentes, genetische Polymorphismen (z.B. CYP, HLA-Allele usw.), Interaktionen mit anderen Medikamenten, Alkohol, demographische Faktoren (Alter, Geschlecht) und zugrunde liegende Lebererkrankungen (2-4, 6).
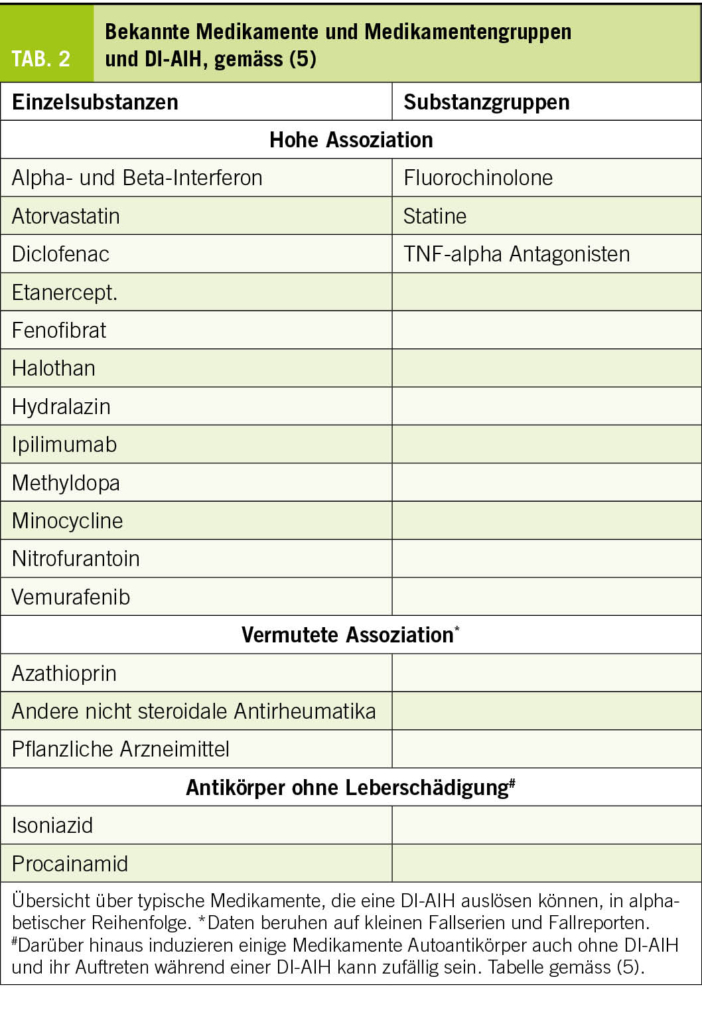
Eine steigende Anzahl an Medikamenten wird mit einer DI-AIH in Verbindung gebracht. Dabei wird zwischen Medikamenten mit hoher Assoziation, z.B. Minocyclin, Nitrofurantoin, Infliximab, Atorvastatin, Diclofenac, vermuteter, z.B. Rosuvastatin, Etanercept und möglicher Assoziation unterschieden (Tab. 2) (5, 7).
Symptomatik
Eine DI-AIH ist anhand der Klinik oder Serologie nicht von einer «klassischen» AIH zu unterscheiden (4). Bei mehr als der Hälfte der DI-AIH liegt eine akute Leberschädigung vor, die in 70-75% der Fälle mit einem Ikterus einhergeht. Die Patienten weisen erhöhte Aminotransferasewerte (ALT, AST) häufig zusammen mit erhöhten Gammaglobulinwerten (Gesamt IgG) auf. In 70-80% der Fälle finden sich antinukleäre Antikörper (ANA) und/oder Antikörper gegen glatte Muskulatur (anti-SMA, 50% der Fälle) oder Antikörper gegen Leber-Nieren-Mikrosomen (anti-LKM) (4). Letztlich unterscheidet nur das Ausbleiben eines Rückfalls (bei klassischer AIH >80% der Fälle) nach Abklingen der Leberschädigung mit oder ohne immunsuppressive Therapie die DI-AH von der AIH, wobei auch bei der DI-AIH, wenn auch seltener, Rückfälle auftreten (siehe Fallvorstellung zu Beginn des Artikels).
Komplizierend kommt hinzu, dass einzelne Wirkstoffe ein oder mehrere Schädigungsmuster hervorrufen können. Die Schädigungsmuster werden anhand des R-Wertes in ein hepatozelluläres (R>5), cholestatisches (R<2) und ein gemischtes Schädigungsmuster unterschieden. Der R-Wert beschreibt das Verhältnis der ALT zur alkalischen Phosphatase (AP) im Verhältnis zum jeweiligen oberen Grenzwert (ULN) und wird nach der Formel: (ALT/ALT ULN) ÷ (AP/ AP ULN), berechnet. Diese Formel kann in der Praxis angewandt werden, um ein Schädigungsmuster bei einem Patienten mit dem zu erwartenden Muster eines bestimmten Medikamentes zu vergleichen und damit eine Kausalität zu erhärten. Bei Patienten, bei denen eine DI-AIH plausibel ist, aber mehrere differentialdiagnostische Erklärungen existieren, kann mit dem R-Wert zudem die Differentialdiagnose eingegrenzt werden (8).
Die DI-AIH bzw. AIH sollten bei Patienten mit einem hepatozellulären Muster (R>5) als Differenzialdiagnose in Betracht gezogen werden, da eine DI-AIH nur in zirka 8% der Fälle mit einem cholestatischen oder gemischten Schädigungsmuster verbunden ist (Tab. 3) (9).
Differentialdiagnostisches Vorgehen
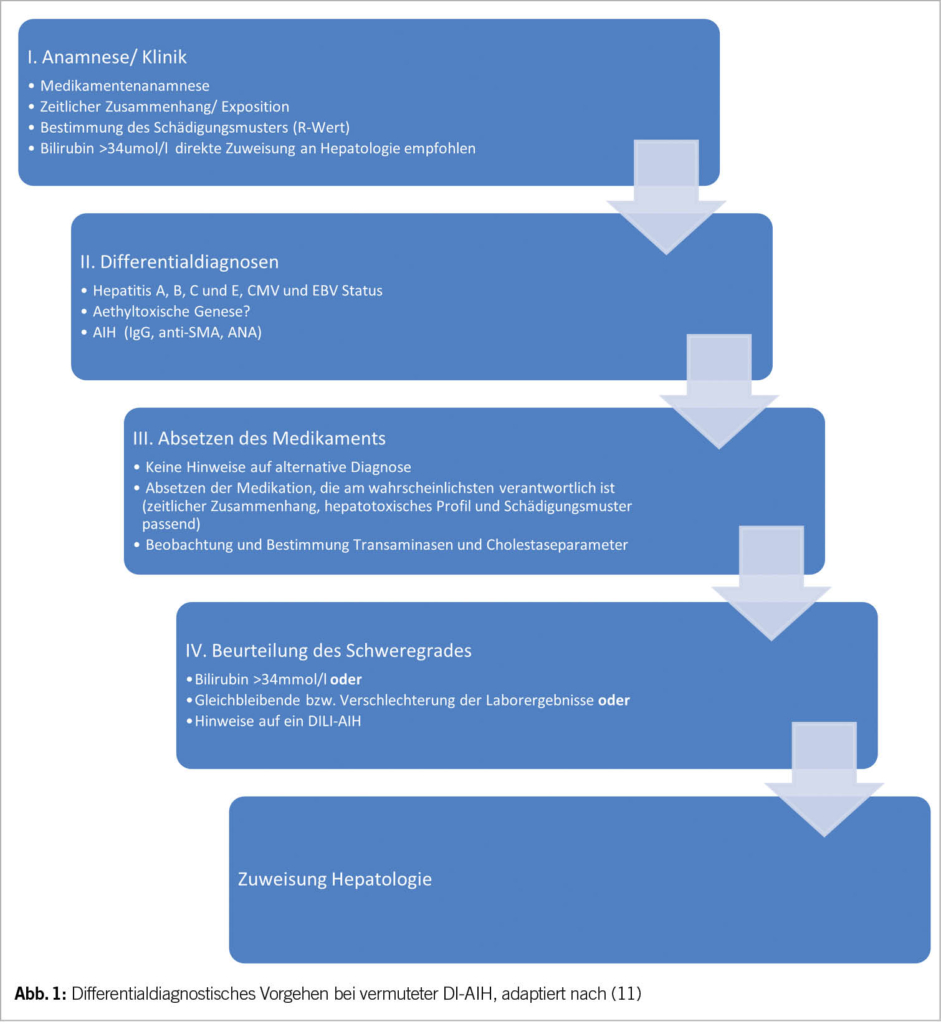
Es existieren keine etablierten diagnostischen Kriterien für die DI-AIH. Aufgrund der Ähnlichkeit mit der AIH sollen jedoch die folgenden Elemente für die Diagnose hervorgehoben werden (Tab. 3 und Abb. 1).
Eine ausführliche Medikamentenanamnese mit Schwerpunkt auf die jüngste Medikamentenexposition, einschliesslich komplementärer alternativer Arzneimittel, ist unerlässlich. Die Latenzzeit der Medikamentenexposition bei DI-AIH ist in der Regel länger als bei anderen Arten von DILI, in einigen Fällen mit einer Latenzzeit von mehr als einem Jahr, z.B. bei Nitrofurantoin und Minocyclin.
Eine Seropositivität für ANA, anti-SMA, anti-LKM und/oder ein erhöhtes IgG im Serum deutet auf eine DI-AIH hin. Allerdings trifft dies nicht für alle Patienten zu, da ein Teil der Patienten mit DI-AIH keine nachweisbaren AIH-Antikörper aufweist (3, 9). Bei Vorliegen von AIH-Antikörpern oder erhöhtem IgG ist ein AIH-Scoring, z.B. mittels «simplified AIH score» sinnvoll (Tab. 1).
Bewertungsinstrumente für die Kausalität können verwendet werden, um die Stärke des Zusammenhangs zwischen Arzneimittelexposition und klinischer Manifestation zu ermitteln, z.B. Roussel Uclaf Causality Assessment Method (RUCAM) (10).
Die Leberbiopsie ist relevant für die Diagnose der DI-AIH, v.a. um diese gegen eine DILI abzugrenzen. Sie sollte in Betracht gezogen werden, wenn sich eine nicht abklingende oder sich verschlimmernde Leberschädigung trotz Absetzen des Medikamentes zeigt oder wenn eine Seropositivität für AIH-Antikörper, ein erhöhtes IgG oder eine mögliche AIH auf der Grundlage des «simplified AIH score» besteht (7). Gegenüber der AIH ist eine histologische Abgrenzung schwierig. Der histologisch fehlende Nachweis einer Fibrosierung oder Zirrhose kann Hinweis auf das Vorliegen einer DI-AIH sein.
Therapie
Der erste Schritt bei der Behandlung der DI-AIH ist zunächst das Absetzen des ursächlichen Medikaments. In den bisher veröffentlichten Publikationen zu diesem Thema war dies neben dem rückfallfreien Verlauf das wichtigste Unterscheidungsmerkmal zwischen DI-AIH und AIH (7). Sollte dies nicht zum Abklingen der Symptomatik und zum Rückgang der Transaminasen und AIH-Seropositivität führen oder ein schwerwiegender Verlauf vorliegen, werden in der Regel Kortikosteroide analog zur Behandlung der AIH eingesetzt (11).
Prognose
Die Prognose einer DILI-AIH ist gut, wobei prinzipiell eine cholestatische DILI eine bessere Prognose hat. Bei einem Bilirubinwert >2 ULN sollte hepatologischer Rat eingeholt werden, da eine erhöhte Mortalität besteht (11). Sowohl DI-AIH als auch AIH sprechen hervorragend auf Kortikosteroide an, wobei die Remissionsrate bei mehr als 90% liegt und bei der DI-AIH ein rascheres Ansprechen innerhalb von vier Wochen mit einem Rückgang der ALT um 50% in den ersten zwei Wochen erwartet werden kann (5, 7). Bei 30-35% der Patienten mit anfänglicher AIH-Seropositivität besteht diese bei der DI-AIH unabhängig von der Behandlung mit Kortikosteroiden nach sechs Monaten nicht mehr (3). Es besteht jedoch kein Konsens über die Behandlungsdauer. Eine Studie hat gezeigt, dass das Absetzen der Immunsuppressiva innerhalb von 3-17 Monaten ohne Anzeichen eines Rückfalls erfolgreich war (7).
b. Immun-Checkpoint-Inhibitor-Hepatitis (ICI-Hepatitis)
Die Anwendung von Immun-Checkpoint-Inhibitoren (ICI) bei fortgeschrittenen Krebserkrankungen hat in den letzten zehn Jahren stark zugenommen. Die Indikationen für ICI erweitern sich ständig. Aufgrund ihrer Wirkung auf das menschliche Immunsystem führen ICI jedoch zu immunbedingten unerwünschten Ereignissen (irAE), die bei herkömmlichen Chemotherapien nicht beobachtet wurden (12). Mit der zunehmenden Anwendung haben sich diese Ereignisse, so auch die Immun-Checkpoint-Inhibitor-bedingte Hepatitis (ICH), zu einem klinischen Problem entwickelt. Die Inzidenz der ICH schwankt zwischen 1% und 20% (13).
ICI stellen die Funktion der T-Zellen gegen tumorspezifische Antigene wieder her, indem sie den «programmed death-1 receptor -1-Rezeptor» (PD-1), seinen Liganden (PD-L1) oder das zytotoxische T-Lymphozyten-assoziierte Antigen 4 (CTLA-4) blockieren. Dabei hängt die Entwicklung einer ICH von der Dosis, der Art und der Dauer der Immuntherapie ab. Die ICH tritt meist 4-6 Wochen nach dem Beginn der ICI-Therapie auf (13). Die Häufigkeit einer fulminanten Hepatitis wird mit <1% angegeben (14).
Diagnose
Ein Verdacht auf eine ICH besteht bei einer Erhöhung der Aminotransferasewerte unter ICI-Therapie. Es besteht meist ein hepatozelluläres Schädigungsmuster. In der Mehrzahl der Fälle besteht keine Symptomatik, in schwerwiegenderen Fällen entsteht jedoch eine Hepatopathie typische Symptomatik mit Fatigue, Ikterus oder unspezifischen Abdominalschmerzen und Erbrechen. Die Diagnose einer ICH kann eine Herausforderung darstellen, da sich die klinischen Merkmale mit anderen Lebererkrankungen überschneiden und somit der Ausschluss einer DILI, einer Virushepatitis, einer AIH und einer metastasierten Lebererkrankung erforderlich ist. Entsprechend wird eine serologische und bildgebende Diagnostik empfohlen (15).
Die Leberhistologie ist wichtig, um den Schweregrad der Lebergewebeschäden zu beurteilen und Differentialdiagnosen auszuschliessen (16). Dies ist z.B. im Fall von Nivolumab, das sowohl eine DI-AIH als auch eine ICH auslösen kann, sinnvoll.
Therapie
Der Schweregrad der ICH kann auf der Grundlage von zwei Skalen kategorisiert werden (15, 17), die eine Kombination von Leberenzymen, Bilirubin und Gerinnungsuntersuchungen verwenden. Je nach Schweregrad der ICH erfolgt eine Fortführung der Medikation unter engmaschiger Kontrolle der Transaminasen (Grad 1: asymptomatisch, AST o. ALT u./o. Bilirubin ≥ ULN), ein Pausieren der ICI-Therapie und eine Behandlung mit oralen Glukokortikoiden kann in Betracht gezogen werden, wenn die Leberschädigung 3-5 Tage nach Beendigung der Therapie fortbesteht oder signifikante klinische Symptome auftreten (Grad 2: asymptomatisch, AST o. ALT ≥3 ULN u./o. Bilirubin ≥1.5 ULN). Die meisten Patienten mit ICH erholen sich und können die ICI-Therapie sicher wiederaufnehmen.
Bei einer drittgradigen ICH (symptomatisch, AST o. ALT ≥5 ULN u./o. Bilirubin ≥3 ULN) müssen die ICI pausiert und eine Glukokortikoid-Therapie begonnen werden. Eine Wiederaufnahme derselben ICI-Therapie ist von Fall zu Fall möglich. Eine ICH Grad 4 (symptomatisch, AST o. ALT ≥20 ULN u./o. Bilirubin ≥10 ULN) rechtfertigt eine dauerhafte Unterbrechung der ICI-Therapie, die Verabreichung von hochdosierten Glukokortikoiden und bei steroidrefraktären Fällen die Gabe von Mycophenolat-Mofetil oder Tacrolimus. Zudem ist eine engmaschige Kontrolle auf (opportunistische) Infektion notwendig (15, 17). Ein Wechsel der ICI-Therapie auf eine andere Checkpoint-Inhibitor-Therapie ist erfolgsversprechend, da es sich bei der ICH häufig um eine substanzspezifische Nebenwirkung handelt.
Da eine schwere ICH allerdings sehr selten ist, gibt es auch Autoren, die die Meinung vertreten, dass durch diesen Ansatz medizinisch nicht indizierte hohe Dosen von Glukokortikoiden verabreicht werden (16). Eine ICH sollte daher von einem erfahrenen multidisziplinären Team behandelt werden.
c. SARS-CoV-2-Impfung induzierte Hepatitis?
Nach verschiedenen SARS-CoV-2-Impfungen wurden Neu-Manifestationen oder eine Verstärkung vorbestehender Autoimmunerkrankungen beobachtet (18). Neben den während des Zulassungsprozesses beschriebenen seltenen Nebenwirkungen, wie der immunogenen thrombotischen Thrombozytopenie, Myokarditis oder Anaphylaxie, wurde beobachtet, dass mRNA-Impfstoffe den Interferon-Signalweg aktivieren können, sodass die Vermutung besteht, dass hierüber verschiedene Immunphänomene ausgelöst werden könnten (19). Der Anteil an Patienten mit einem Anstieg der Aminotransferasen wird mit <1% angegeben. Wie bei der DILI-AIH finden sich eine Seropositivität für ANA, anti-SMA, anti-LKM und ein erhöhtes IgG (20).
Die akute Hepatitis trat im Median 24 Tage nach der Impfung und in der Mehrzahl der Fälle nach der zweiten Dosis auf. Patienten mit Status nach mRNA-Impfung wiesen dabei eine stärkere Transaminasenerhöhung auf. Eine fulminante Hepatitis wurde bei einem Patienten beobachtet. (vergleiche Abschnitt «a. Arzneimittelinduzierte autoimmunähnliche Hepatitis») (18). Die meisten Patienten wurden mit Steroiden mit oder ohne Azathioprin behandelt. In zweidrittel der Fälle zeigte sich eine Normalisierung der Leberenzyme nach sechs Monaten (18).
Bisher kann ein kausaler Zusammenhang zwischen SARS-CoV-2-Impfstoffen und Leberschäden mit autoimmunen Merkmalen weder bewiesen noch widerlegt werden. Wenn ein hoher Anteil der Weltbevölkerung innerhalb weniger Monate geimpft wird, steigt die Wahrscheinlichkeit, dass seltene Erkrankungen wie die AIH oder DI-AIH (aufgrund anderer Medikamente) zufällig in zeitlicher Nähe zu einer SARS-CoV-2-Impfung diagnostiziert werden. Durch phasenweise bestehende Überlastung der Gesundheitssysteme wird eine von der Impfung unabhängige Verschlechterung einer bestehenden Autoimmunerkrankung möglicherweise übersehen oder eine Erstdiagnose zu spät gestellt. Dies wäre z.B. eine Erklärung für die niedrigere Anzahl an neu diagnostizierten AIH während der Pandemie in Deutschland (21).
Entsprechend der Empfehlungen bei der DI-AIH und ICH ist aufgrund der aktuellen Datenlage eine gründliche und sorgfältige Nachsorge der Patienten und bei schweren Verläufen eine frühzeitige hepatologische Beurteilung indiziert.
Primär biliäre Cholangitis und primär sklerosierende Cholangitis
Die primär biliäre Cholangitis (PBC) und die primär sklerosierende Cholangitis (PSC) sind seltene autoimmune Lebererkrankungen. Pathophysiologisch kommt es bei der PBC zu einer progredienten Entzündung der kleinen, intrahepatischen Gallengängen, wohingegen bei der PSC die grösseren, sowohl intra- als auch extrahepatischen Gallengänge betroffen sind. Beiden Entitäten gemeinsam ist der chronisch-progrediente Charakter, der im Endstadium zu einer Leberzirrhose führen kann.
Die Ätiologie beider Erkrankungen ist bislang unzureichend verstanden. Im Gegensatz zur PSC (w:m = 1:2), tritt die PBC überwiegend bei Frauen mittleren Alters auf. Die PBC tritt gehäuft mit anderen Autoimmunerkrankungen, wie z.B. der Zöliakie, der rheumatoiden Arthritis oder einer Thyreopathie auf. Nach Diagnose einer PSC gilt es eine gleichzeitig bestehende chronisch entzündliche Darmerkrankung auszuschliessen.
Sowohl die PBC als auch die PSC fallen klinisch durch Hepatopathie-spezifische Beschwerden und laborchemisch durch eine cholestatische Hepatopathie auf. Bei entsprechendem Verdacht kann die PBC mittels Bestimmung der antimitochondrialen Antikörper (AMA; im Speziellen AMA-M2) diagnostiziert werden. Bei der Diagnostik der PSC ist die Bestimmung von pANCA hilfreich, wobei die Diagnose letztlich anhand typischer Kontrastmittelanreicherungen in der Magnetresonanz-Cholangiopankreatikographie (MRCP) und/oder der endoskopischen retrograden Cholangiopankreatikographie (ERCP) gestellt werden kann.
Die therapeutischen Ansätze sind sowohl bei PBC als auch bei PSC eingeschränkt. Im Fall der PBC besteht die Indikation zur gewichtsadaptierten Therapie mit Ursodeoxycholsäure (UDCA), durch welche sowohl Symptome als auch die cholestatischen Laborveränderungen positiv beeinflusst werden können. Im Gegensatz zur PSC, verzögert eine frühzeitige UDCA-Therapie bei der PBC zudem eine Fibrosierung. Im Falle der PSC werden dominante Stenosen interventionell behandelt. Im Endstadium bedarf es bei beiden Erkrankungen häufig einer Lebertransplantation.
Copyright bei Aerzteverlag medinfo AG
Gastroenterologie & Hepatologie
Stadtspital Zürich
Birmensdorferstrasse 497
8063 Zürich
Gastroenterologie & Hepatologie
Stadtspital Zürich
Birmensdorferstrasse 497
8063 Zürich
Gastroenterologie & Hepatologie
Stadtspital Zürich
Birmensdorferstrasse 497
8063 Zürich
Die Autoren haben keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
◆ Die klassische Autoimmunhepatitis bedarf der Bestimmung des
Antikörper-Panels, IgG und einer Leberbiopsie.
◆ Kortison bleibt das Medikament der Wahl zur Induktion der Remission.
◆ AIH-like Hepatitiden treten zunehmend häufiger auf.
◆ Immun-Checkpoint-Inhibitoren, Statine und TNF-alpha-AK sind
nachgewiesene Auslöser der AIH-like Hepatitiden.
1. Hennes, E.M., et al., Simplified criteria for the diagnosis of autoimmune hepatitis. Hepatology, 2008. 48(1): p. 169-76.
2. Aithal, G.P., et al., Case definition and phenotype standardization in drug-induced liver injury. Clin Pharmacol Ther, 2011. 89(6): p. 806-15.
3. de Boer, Y.S., et al., Features of Autoimmune Hepatitis in Patients With Drug-induced Liver Injury. Clin Gastroenterol Hepatol, 2017. 15(1): p. 103-112.e2.
4. Bjornsson, E., et al., Drug-induced autoimmune hepatitis: clinical characteristics and prognosis. Hepatology, 2010. 51(6): p. 2040-8.
5. in LiverTox: Clinical and Research Information on Drug-Induced Liver Injury. 2012: Bethesda (MD).
6. Castiella, A., et al., Drug-induced autoimmune liver disease: A diagnostic dilemma of an increasingly reported disease. World J Hepatol, 2014. 6(4): p. 160-8.
7. Tan, C.K., et al., Drug-induced autoimmune hepatitis: A minireview. World J Gastroenterol, 2022. 28(24): p. 2654-2666.
8. Bénichou, C., Criteria of drug-induced liver disorders. Report of an international consensus meeting. J Hepatol, 1990. 11(2): p. 272-6.
9. Licata, A., et al., Clinical features and outcomes of patients with drug-induced autoimmune hepatitis: a retrospective cohort study. Dig Liver Dis, 2014. 46(12): p. 1116-20.
10. Danan, G. and C. Benichou, Causality assessment of adverse reactions to drugs–I. A novel method based on the conclusions of international consensus meetings: application to drug-induced liver injuries. J Clin Epidemiol, 1993. 46(11): p. 1323-30.
11. Leise, M.D., J.J. Poterucha, and J.A. Talwalkar, Drug-induced liver injury. Mayo Clin Proc, 2014. 89(1): p. 95-106.
12. Nishida, N. and M. Kudo, Liver damage related to immune checkpoint inhibitors. Hepatol Int, 2019. 13(3): p. 248-252.
13. Bolte, F.J., R.D. Hall, and N.L. Shah, Immune checkpoint inhibitor–related liver toxicity. Clinical Liver Disease, 2022. 20(3): p. 93-96.
14. Wang, D.Y., et al., Fatal Toxic Effects Associated With Immune Checkpoint Inhibitors: A Systematic Review and Meta-analysis. JAMA Oncol, 2018. 4(12): p. 1721-1728.
15. Schneider, B.J., et al., Management of Immune-Related Adverse Events in Patients Treated With Immune Checkpoint Inhibitor Therapy: ASCO Guideline Update. J Clin Oncol, 2021. 39(36): p. 4073-4126.
16. De Martin, E., et al., Liver toxicity as a limiting factor to the increasing use of immune checkpoint inhibitors. JHEP Rep, 2020. 2(6): p. 100170.
17. Haanen, J., et al., Management of toxicities from immunotherapy: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol, 2018. 29(Suppl 4): p. iv264-iv266.
18. Codoni, G., et al., Histological and serological features of acute liver injury after SARS-CoV-2 vaccination. JHEP Rep, 2023. 5(1): p. 100605.
19. Teijaro, J.R. and D.L. Farber, COVID-19 vaccines: modes of immune activation and future challenges. Nature Reviews Immunology, 2021. 21(4): p. 195-197.
20. Guardiola, J., et al., Unexplained liver test elevations after SARS-CoV-2 vaccination. J Hepatol, 2022. 77(1): p. 251-253.
21. Rüther, D.F., et al., Autoimmune hepatitis and COVID-19: No increased risk for AIH after vaccination but reduced care. Journal of Hepatology, 2022. 77(1): p. 250-251.
der informierte @rzt
- Vol. 13
- Ausgabe 4
- April 2023