- Behandlung der Osteoporose
Osteoporose ist häufig und die Therapieindikation richtet sich nach dem geschätzten Fraktur-Risiko. Hierfür stehen Medikamente unterschiedlicher Potenz und Wirkweise (antiresorptiv bzw. osteoanabol) zur Verfügung. Die Auswahl der Substanz sollte unter Berücksichtigung des Ausgangs-Fraktur-Risikos getroffen werden. Der chronische Charakter der Erkrankung einerseits und die pharmakologischen Eigenschaften der unterschiedlichen Substanzen andererseits machen in den meisten Fällen eine sequentielle Behandlung erforderlich. Die sinnvolle Umsetzung solcher Therapie-Sequenzen setzt wiederum Kenntnisse über die eingesetzten Osteoporose-Medikamente voraus, die in diesem Beitrag vermittelt werden sollen.
Osteoporosis is common and requires specific drug therapy dependent on estimated fracture risk. Medications with differing potency and mode of action (antiresorptive or osteoanabolic) are available. The choice of substance should be based on the initial fracture risk. Owing to the chronic nature of the disease on the one hand and the pharmacological characteristics of the available drugs on the other, a sequential treatment strategy is usually necessary. This article aims to address and provide insights into the knowledge available in order to facilitate appropriate implementation of anti-osteoporotic drug therapy.
Key Words: estimated fracture risk, major osteoporotic fracture, antiresorptive drugs, osteoanabolic drugs, sequential therapy
Im Jahr 2019 waren in der Schweiz ca. 524‘000 Patient/-innen von einer Osteoporose betroffen, mit einem Frauenanteil von knapp 80%. Besonders eindrücklich sind die damit verbundenen 82‘000 neuen Frakturen entsprechend 9,4 Frakturen pro Stunde! Die Schweiz ist zudem Spitzenreiter in Europa, was die Kosten durch osteoporotische Frakturen angeht (ca. 3,4 von ges. 74,9 Milliarden Euro) (1). Trotz Zunahme medikamentöser Behandlungsmöglichkeiten in den letzten Jahren ist immer noch von einer erheblichen Behandlungslücke auszugehen (2).
Therapie-Indikation
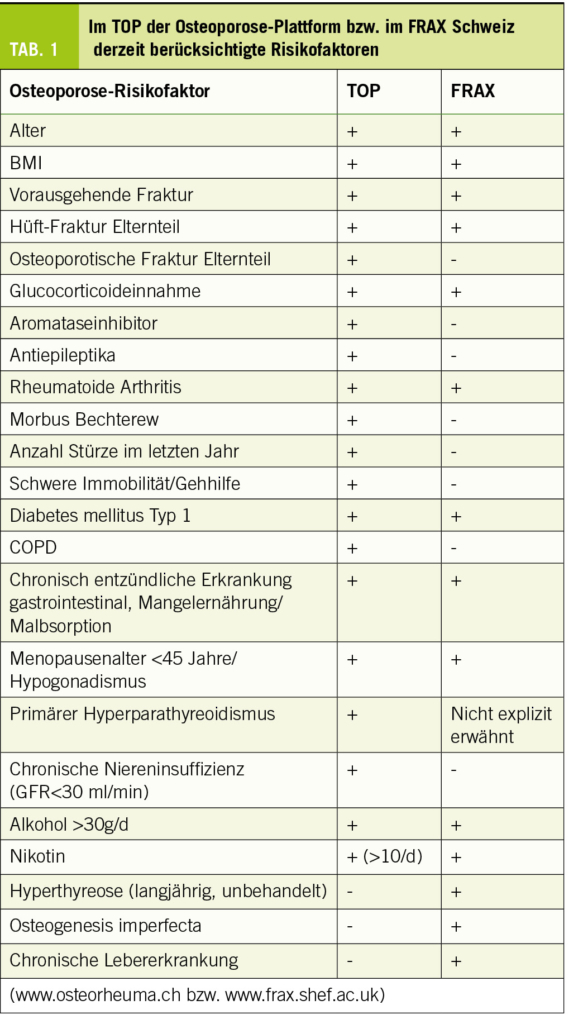
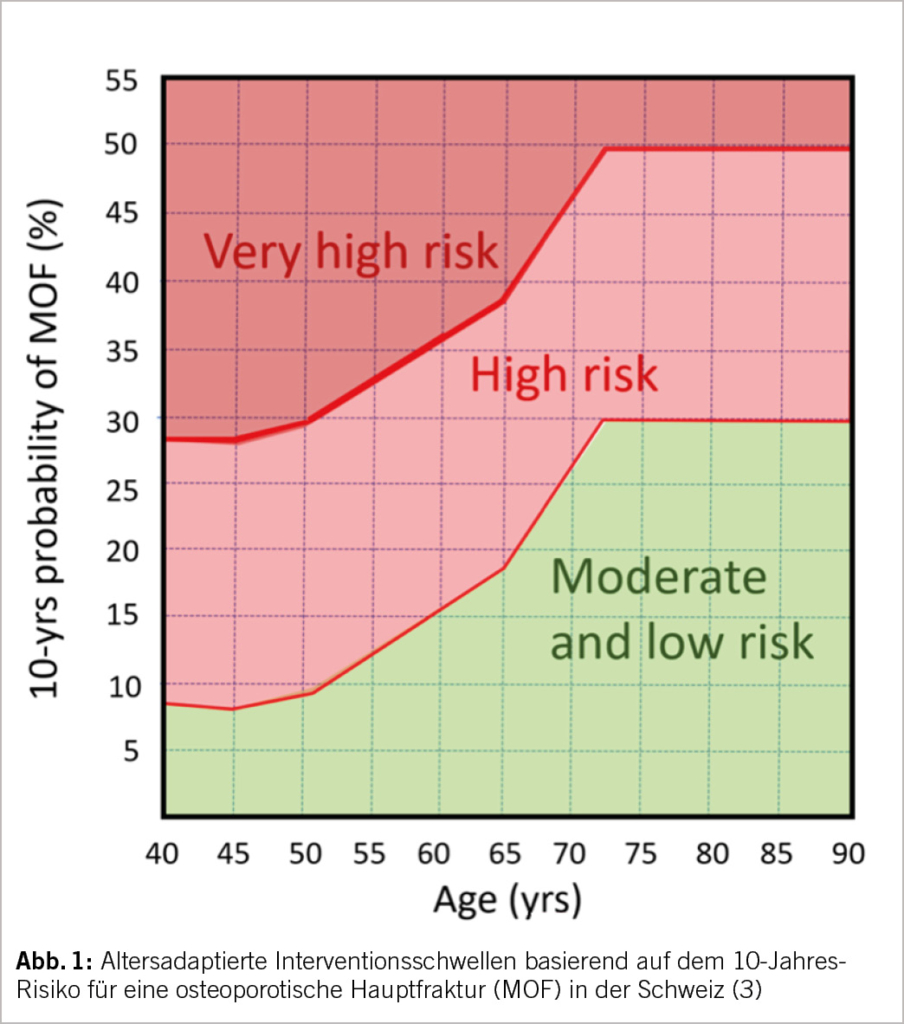
Die Indikation für eine Osteoporose-Therapie wird heutzutage anhand des geschätzten Frakturrisikos gestellt. Die Abschätzung erfolgt durch Eingabe der zu erfragenden Risikofaktoren (Tab. 1) und des minimalen T-Scores an LWS, Gesamthüfte bzw. Schenkelhals nach DXA-Messung in einen Kalkulator (z.B. FRAX der WHO oder «Tool der Osteoporose-Plattform», TOP). In erster Linie relevant für die Therapieindikation ist das geschätzte Risiko für eine osteoporotische Hauptfraktur (englisch «major osteoprotic fracture», kurz MOF), d.h. Wirbel-, Hüft-, proximale Humerus- oder distale Radius-Fraktur. Eine altersadaptierte Interventionsschwelle, wie sie die Schweizerische Vereinigung gegen Osteoporose (SVGO) vorsieht (Abb. 1), wird gegenüber einer fixen Interventionsschwelle (z.B. 10-Jahres-Risiko 20-25%) kontrovers diskutiert. Für die Prophylaxe bei systemischer Glucocorticoid- oder hormonablativer Therapie sind gesonderte Empfehlungen zu beachten, die in diesem Beitrag aus Gründen des Umfangs nicht abgehandelt werden.
Unterschiedliche Erstlinien-Therapie je nach Ausgangsrisiko
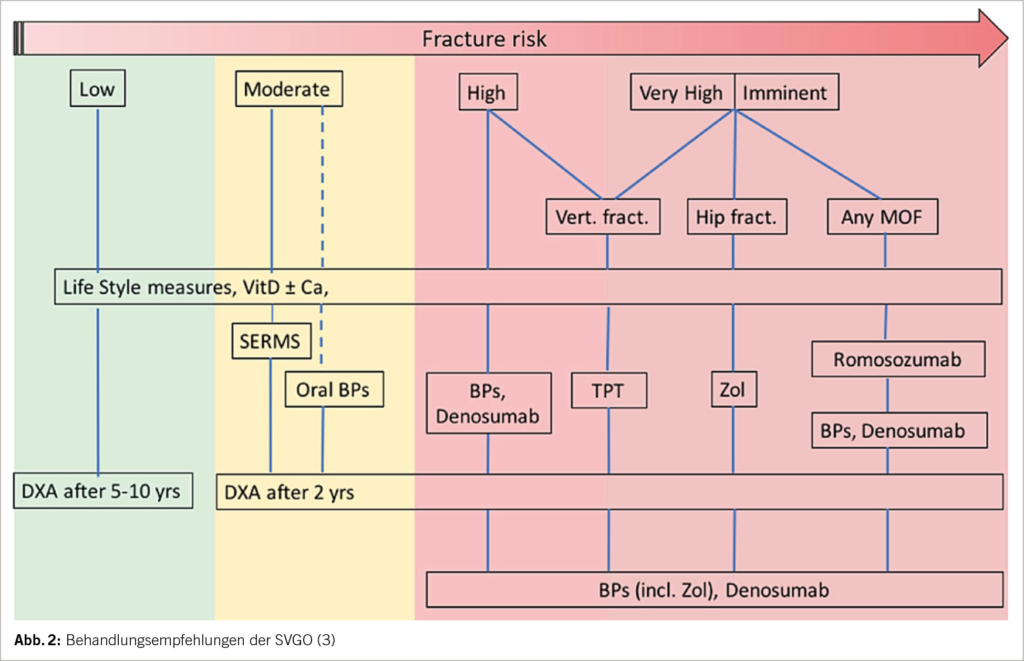
Die SVGO hat im Jahr 2020 Behandlungs-Empfehlungen publiziert (3), die auf einer Stratifizierung nach Risikogruppen basieren (Abb. 2). Bei tiefem (densitometrisch Osteopenie ohne weitere Risikofaktoren) bzw. moderatem Risiko (densitometrisch Osteoporose, Frakturrisiko unterhalb der Interventionsschwelle) steht neben einer generell empfohlenen genügenden Calcium- und Vitamin-D-Versorgung die Prävention mittels Hormonersatz, selektiven Östrogen-Rezeptormodulatoren (SERM) oder optional oralen Bisphosphonaten im Vordergrund. Unverzichtbar ist eine knochenspezifische Behandlung bei hohem (Risiko über der Interventionsschwelle), sehr hohem (Risiko mindestens 20% über der Interventionsschwelle) oder imminentem Frakturrisiko. Letzteres liegt dann vor, wenn bei über 65-jährigen Patient/-innen eine MOF innerhalb der letzten 2 Jahre aufgetreten ist (3). Wie in Abbildung 2 ersichtlich, werden bei prävalenter osteoporotischer Fraktur konkrete Empfehlungen zur Erstlinien-Behandlung gemacht: Teriparatid bei vertebraler Fraktur, Zoledronat bei Hüft-Fraktur und Romosozumab bei anderen MOF. Grundlage hierfür bildet die Evidenz, dass entsprechende Medikamente in vorliegenden Ausgangssituationen eine gute bzw. gegenüber oralen Bisphosphonaten überlegene Wirksamkeit aufweisen (4, 5, 6). Zudem ist als Rationale für den Erstlinien-Einsatz von Teriparatid bzw. Romosozumab die Erkenntnis anzuführen, dass der unter osteoanaboler Therapie erreichte Dichtezuwachs ohne antiresorptive Vortherapie höher ausfällt. Es sei aber darauf hingewiesen, dass sich die Limitationen für die Kostenübernahme der einzelnen Medikamente in der Schweiz nicht grundsätzlich mit den SVGO-Empfehlungen decken.
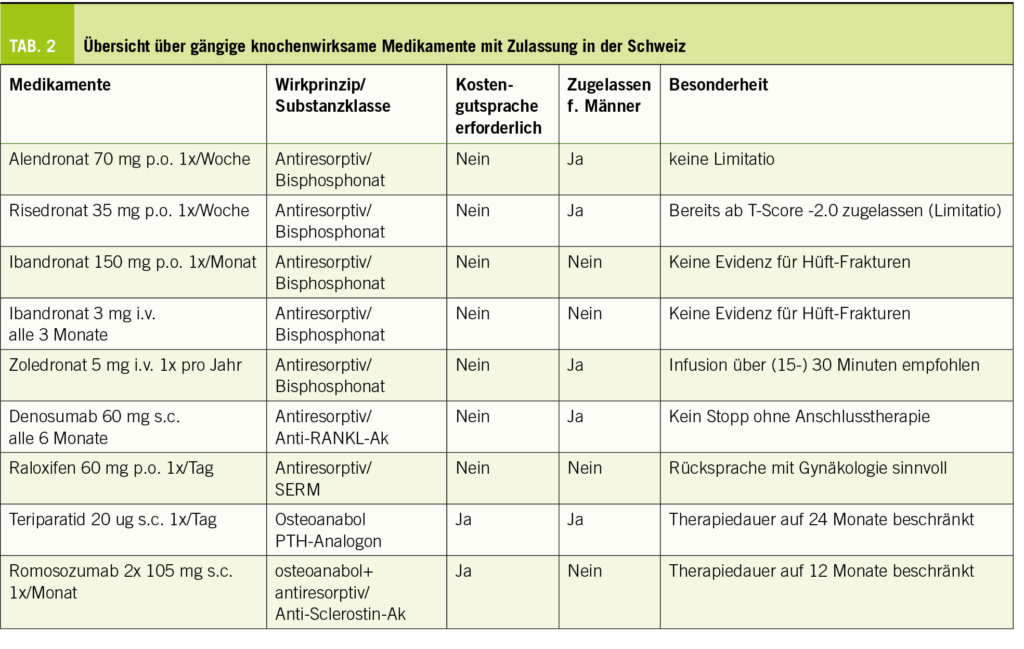
Die Medikamente (siehe auch Tabelle 2)
Antiresorptiva
Bisphosphonate wirken antiresorptiv durch Osteoklastenhemmung und werden seit ca. 30 Jahren zur Osteoporose-Therapie eingesetzt. Gängige Präparate sind in Tabelle 2 aufgeführt. Aufgrund ihrer Wirkweise durch Anlagerung an die Knochenoberfläche hält der antiresorptive Effekt noch nach Pausierung/Beendigung an, was die Bisphosphonate von allen anderen Osteoporose-Medikamenten unterscheidet. Am ausgeprägtesten ist dieser sogenannte «Tail-Effekt» bei Zoledronat. Seltene Nebenwirkungen sind Kieferosteonekrosen und atypische (=subtrochantäre) Femurfrakturen, wobei das jeweilige Risiko mit der Dauer der Therapie steigt. Entsprechend ist nach 3- bis 5-jähriger Bisphosphonat-Therapie eine Pause zu erwägen, zumal die Knochendichte nach dieser Behandlungsdauer trotz fortgesetzter Behandlung normalerweise nicht weiter zunimmt (7). Bisphosphonate sind kontraindiziert bei Schwangerschaft/Stillzeit und Niereninsuffizienz (GFR<35 ml/min). Denosumab (Prolia®) ist ein vollhumaner monoklonaler Antikörper gegen RANK-Ligand und wirkt via Osteoklastenhemmung. Im Unterschied zu den Bisphosphonaten zeigt sich auch nach 10-jähriger Anwendung kein Plateau des Knochendichteanstieges (8). Allerdings kommt es nach Beendigung bzw. verzögerter Anwendung unmittelbar zu einem überschiessenden Knochenabbau (sog. «Rebound-Phänomen»), welcher mit einem erhöhten Risiko für das Auftreten multipler Wirbelkörper-Frakturen einhergeht (9). Denosumab eignet sich daher primär zur Langzeittherapie und sollte keinesfalls ohne Anschlusstherapie gestoppt oder verzögert verabreicht werden. Da die Datenlage für die sichere Langzeitanwendung von Denosumab auf 10 Jahre beschränkt ist (8), sollte die Indikation bei jüngeren Patient/-innen zurückhaltend gestellt werden. Sollte eine Beendigung von Denosumab dennoch nötig werden, hat sich insbesondere Zoledronat als Anschlusstherapie aufgrund seiner antiresorptiven Potenz etabliert. Hiermit lässt sich der Rebound zwar reduzieren, aber meist nicht gänzlich verhindern. Bezüglich optimaler Umsetzung der Anschlusstherapie ist die Datenlage noch ungenügend. Sowohl bei Bisphosphonaten als auch bei Denosumab sollten vor Therapieeinleitung eine Hypolcalcämie sowie ein relevanter Vitamin-D-Mangel ausgeschlossen werden. Zudem ist zur Reduktion des Risikos von Kieferosteonekrosen auf eine gründliche Zahnpflege zu achten; chirurgische Eingriffe am Kieferknochen (Zahn-Extraktion, Implantat) sollten unter etablierter Therapie möglichst vermieden werden.
Osteoanabolika
Teriparatid ist eine rekombinante Form des humanen Parathormons. Vor Anwendung bedarf es einer Kostengutsprache durch die Krankenkasse. Es wirkt osteoanabol durch Stimulation der Osteoblasten-Proliferation und -Differenzierung. Die Therapiedauer ist auf 24 Monate limitiert, das Präparat muss täglich subcutan gespritzt werden. Neben dem Originalpräparat Forsteo® existieren mittlerweile diverse (kostengünstigere) Biosimilars. Teriparatid ist u.a. kontraindiziert bei malignen Knochenerkrankungen oder vorausgegangener Strahlentherapie des Skeletts. Nach Abschluss von Teriparatid bedarf es einer antiresorptiven Anschlussbehandlung, da der erreichte Dichtezuwachs andernfalls vollständig reversibel ist.
Romosozumab (Evenity®) ist ein humanisierter Antikörper gegen Sclerostin und die zweite in der Schweiz zugelassene osteoanabol wirksame Substanz. Neben der knochenaufbauenden Wirkung besteht auch ein antiresorptiver Effekt; dieser duale Wirkmechanismus hebt die Substanz von allen anderen zugelassenen knochenwirksamen Medikamenten ab. Die Behandlung erfolgt durch monatliche subkutane Injektionen, die Dauer ist auf 1 Jahr beschränkt. Auch für Romosozumab ist eine Kostengutsprache durch die Krankenkasse nötig. Die Substanz ist nur für postmenopausale Frauen zugelassen und kontraindiziert bei Vorgeschichte eines Herzinfarkts oder Schlaganfalls. Auch die unter Romosozumab gewonnene Knochendichte verliert sich nach Therapieabschluss, sofern keine antiresorptive Anschlusstherapie erfolgt.
Sequentielle Therapie
Aus den Eigenschaften der genannten Medikamente ergibt sich, dass in der Langzeittherapie einer Osteoporose eine sequentielle Behandlungsstrategie häufig unumgänglich ist. Hierzu 2 Fall-Beispiele. Im zweiten Fall wird auch auf die Möglichkeit einer Kombinationstherapie eingegangen.
Fall 1: Eine 62-jährige, postmenopausale, internistisch gesunde Patientin mit frischer LWK1-Fraktur und einem T-Score in der DXA von -4.4 SD an der LWS bzw. -3.3 SD am Schenkelhals erhält bei imminentem Frakturrisiko eine osteoanabole Erstlinien-Behandlung mit Romosozumab. Nach 1-jähriger Behandlung beträgt der T-Score jeweils -2.9 SD an LWS und Schenkelhals; neue Frakturen sind nicht aufgetreten. Aufgrund der Lebenserwartung der Patientin von deutlich über 10 Jahren entscheidet man sich für eine Anschlussbehandlung mit einem Bisphophonat für 3 bis 5 Jahre. Da die Patientin nach Abschluss der Anschlussbehandlung immer noch unter 70 sein wird, ist mit einer erneuten Behandlungsindikation zu einem späteren Zeitpunkt im Leben der Patientin zu rechnen.
Fall 2: Eine 83-jährige, rüstige Patientin erleidet eine Sakrum-Fraktur nach Sturz aus Standhöhe. In der DXA ist der T-Score der Wirbelsäule aufgrund degenerativer Veränderungen nicht aussagekräftig, an der Gesamthüfte beträgt der T-Score -1.3 SD und am Schenkelhals -1.6 SD. In dieser Konstellation ist die Limitatio weder für Teriparatid noch für Romosozumab erfüllt, so dass eine Erstlinienbehandlung mit einem Bisphosphonat oder Denosumab bleibt. In vorliegender Situation fiel der Entscheid aufgrund des Lebensalters >80 auf eine Behandlung mit Denosumab. Nach 4-jähriger Behandlung mittels Denosumab kommt es zu einer spontanen BWK11-Fraktur, weshalb die Optionen einer Therapieeskalation zu prüfen sind. Die Umstellung auf ein Bisphosphonat würde in puncto Wirkpotenz keine Eskalation darstellen, zumal der Rebound nach Beendigung von Denosumab durch ein Bisphosphonat wie erwähnt meist nur unvollständig verhindert wird. Im Falle einer Umstellung von Denosumab auf Teriparatid ist ein ausgeprägtes Rebound-Phänomen beschrieben, so dass diese Sequenz grundsätzlich zu vermeiden ist (10). Für die Sequenz Denosumab gefolgt von Romosozumab ist die Datenlage ungenügend. In vorliegender Situation ist die wirksamste Option eine Kombination von Denosumab mit Teriparatid (10) für 2 Jahre mit nachfolgender Weiterführung von Denosumab bis zum Lebensende.
Copyright bei Aerzteverlag medinfo AG
Leitender Arzt Rheumatologie
Luzerner Kantonsspital
Co-Präsident Osteoporose-Plattform
Spitalstrasse
6000 Luzern 16
Der Autor hat keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
◆ Die Behandlungsindikation der Osteoporose basiert auf dem geschätzten Frakturrisiko, das sich aus dem tiefsten T-Score in der DXA (LWS, Gesamthüfte, Schenkelhals) und den erfassten Risikofaktoren unter Verwendung eines Risikokalkulators ermitteln lässt.
◆ Es stehen mehrere knochenwirksame Medikamente zur Verfügung, die sich neben der Wirkweise auch in ihrer Wirkpotenz unterscheiden.
◆ Bei der Auswahl des Medikamentes ist das geschätzte Ausgangsrisiko zu berücksichtigen, wobei bei sehr hohem/imminentem Risiko auch der Erstlinieneinsatz von Osteoanabolika erwogen werden sollte.
◆ Die Langzeitbehandlung der Osteoporose bedarf häufig einer sequentiellen Behandlungsstrategie.
1. Kanis JA, Norton N, Harvey NC, Jacobson T, Johansson H, Lorentzon M, McCloskey EV, Willers C, Borgström F. SCOPE 2021: a new scorecard for osteoporosis in Europe. Arch Osteoporos. 2021 Jun 2;16(1):82.
2. Lippuner K, Moghadam BY, Schwab P. The osteoporosis treatment gap in Switzerland between 1998 and 2018. Arch Osteoporos. 2023 Jan 18;18(1):20.
3. Ferrari S, Lippuner K, Lamy O, Meier C. 2020 recommendations for osteoporosis treatment according to fracture risk from the Swiss Association against Osteoporosis (SVGO). Swiss Med Wkly. 2020 Sep 29;150:w20352.
4. Kendler DL, Marin F, Zerbini CAF, Russo LA, Greenspan SL, Zikan V, et al. Effects of teriparatide and risedronate on new fractures in post- menopausal women with severe osteoporosis (VERO): a multicentre, double-blind, double-dummy, randomised controlled trial. Lancet. 2018;391(10117):230–40.
5. Saag KG, Petersen J, Brandi ML, Karaplis AC, Lorentzon M, Thomas T, et al. Romosozumab or Alendronate for Fracture Prevention in Women with Osteoporosis. N Engl J Med. 2017;377(15):1417–27.
6. Lyles KW, Colón-Emeric CS, Magaziner JS, Adachi JD, Pieper CF, Mautalen C, et al.; HORIZON Recurrent Fracture Trial. Zoledronic acid and clinical fractures and mortality after hip fracture. N Engl J Med. 2007;357(18):1799–809.
7. Black DM, Reid IR, Cauley JA, Cosman F, Leung PC, Lakatos P, Lippuner K, Cummings SR, Hue TF, Mukhopadhyay A, Tan M, Aftring RP, Eastell R. The effect of 6 versus 9 years of zoledronic acid treatment in osteoporosis: a randomized second extension to the HORIZON-Pivotal Fracture Trial (PFT). J Bone Miner Res. 2015 May;30(5):934-44.
8. Bone HG, Wagman RB, Brandi ML, Brown JP, Chapurlat R, Cummings SR, Czerwinski E, Fahrleitner-Pammer A, Kendler DL, Lippuner K, Reginster JY, Roux C, Malouf J, Bradley MN, Daizadeh NS, Wang A, Dakin P, Pannacciulli N, Dempster DW, Papapoulos S. 10 years of denosumab treatment in postmenopausal women with osteoporosis: results from the phase 3 randomised FREEDOM trial and open-label extension. Lancet Diabetes Endocrinol. 2017 Jul;5(7):513-523.
9. Anastasilakis AD, Polyzos SA, Makras P, Aubry-Rozier B, Kaouri S, Lamy O. Clinical Features of 24 Patients With Rebound-Associated Vertebral Fractures After Denosumab Discontinuation: Systematic Review and Additional Cases. J Bone Miner Res. 2017 Jun;32(6):1291-1296.
10. Leder BZ, Tsai JN, Uihlein AV, Wallace PM, Lee H, Neer RM, Burnett-Bowie SA. Denosumab and teriparatide transitions in postmenopausal osteoporosis (the DATA-Switch study): extension of a randomised controlled trial. Lancet. 2015 Sep 19;386(9999):1147-55.
der informierte @rzt
- Vol. 14
- Ausgabe 2
- Februar 2024