- Behandlungsmöglichkeiten des Lungenemphysems
Die chronisch obstruktive Lungenkrankheit (COPD) ist die häufigste Ursache eines fortgeschrittenen Lungenemphysems. Dieses kann bei symptomatischen Patienten mit schwer eingeschränkter Lungenfunktion (FEV1 < 45%), deutlicher Überblähung (RV > 200%) und eingeschränkter Leistungsfähigkeit (6-Minuten-Gehleistung weniger als 450 Meter) auf sorgfältige Indikationsstellung hin mit einer Lungenvolumenreduktion therapeutisch angegangen werden. Die chirurgische Lungenvolumenreduktion, die Induktion einer Lappenatelektase mittels Einlage von Ventilen und die Raffung des Lungengewebes mittels Coils, idealerweise beidseits, sind die in der Schweiz aktuell angewandten Verfahren.
Die chronisch obstruktive Lungenkrankheit (COPD) ist eine Volkskrankheit mit hoher Mortalität und Morbidität. Gemäss der WHO wird die COPD im Jahre 2030 zur 3. häufigsten Todesursache weltweit aufsteigen. Global leiden geschätzte 65 Millionen Menschen an einer moderaten bis schweren COPD (1). Es kommt hinzu, dass die Einschränkung, welche mit einer COPD im Alltag einhergeht, substantiell ist. In den USA nimmt die COPD in Bezug auf die Lebensjahre, welche mit einer Behinderung einhergehen, den 6. Rang ein (2). In der Schweiz betrug die Prävalenz der COPD GOLD Stufe II oder höher im Jahre 2010 5.1%. Dies entspricht 200’000 bis 300’000 Patienten (3). Obwohl das Zigarettenrauchen die häufigste Ursache der COPD ist, tragen weltweit gesehen auch der Rauch, welcher bei der offenen Verbrennung von Biomass Fuels (Holz, Kohle, Dung etc.) beim Heizen und Kochen entsteht, und berufliche Exposition gegenüber inhalativen Schadstoffen zur hohen Prävalenz der Krankheit bei (1).
Bei der COPD handelt es sich um eine irreversible, in unterschiedlichem Ausmasse fortschreitende Krankheit. Die Inhalation von Noxen führt zu einer Entzündungsreaktion. Dabei kommt es je nach Phänotyp zu einem Umbau und Verlust der kleinen Atemwege und des Lungenparenchyms, was zu einer Zunahme des Atemwegswiderstandes und einem Verlust der Gasaustauschfläche führt. Die dabei entstehende Überblähung, welche unter Belastung noch verstärkt wird (dynamische Überblähung), führt zu einer Abflachung und damit Dysfunktion vor allem des Zwerchfells als wichtigstem Atemmuskel und zu einer Kompression des benachbarten Lungenparenchyms, was den Gasaustausch weiter beeinträchtigt. Durch den Verlust der elastischen Rückstellkräfte (elastic recoil) im Rahmen der Überblähung und des emphysematösen Lungenparenchymumbaus steigt der Atemwiderstand zusätzlich an, was die Atemarbeit noch mehr erhöht (4). Am Ende dieses pathologischen Prozesses steht die Atemnot als Leitsymptom. Die Verteilung des Emphysems ist beim Raucher häufig heterogen in den Oberlappen betont, kann aber auch homogen oder Unterlappen betont sein.
Die prognostisch wichtigste Massnahme ist der Rauchstopp. Neben der inhalativen Therapie mit Bronchodilatatoren bildet die pulmonale Rehabilitation zur Verbesserung der Leistungsfähigkeit die Grundlage der Behandlung. Fortgeschrittene Krankheitsstadien lassen sich trotz Ausschöpfen dieser konservativen Massnahmen häufig nur unbefriedigend behandeln. Daher können bei ausgeprägter Symptomatik des Patienten auch invasive Verfahren zur Behandlung der Dyspnoe indiziert sein (4).
Lungenvolumenreduktion
Obwohl bereits 1954 beschrieben (5) fand die Lungenvolumenreduktionschirurgie wegen der hohen perioperativen Mortalität erst wieder in den 1990er Jahren Beachtung. Es konnte gezeigt werden, dass die beidseitige Resektion von überblähtem Lungengewebe zu einer Verbesserung der Lungenfunktion und einer Abnahme der Atemnot führte(6). Der 2003 publizierte und viel zitierte NETT (National Emphysema Treatment Trial) konnte zeigen, dass bei oberlappenbetontem Emphysem sowohl eine signifikante Verbesserung der Lebensqualität und Leistungsfähigkeit, wie auch eine Verbesserung der Mortalität erreicht werden kann (7). Diesen positiven Resultaten steht jedoch eine nicht unerhebliche postoperative Mortalität nach 90 Tagen von über 5% (7) und eine mediane Hospitalisationszeit von 12 Tagen gegenüber (8). Daher kam es zur Entwicklung von minimal-invasiven endoskopischen Lungenvolumenreduktionsverfahren mit dem Ziel, vergleichbare klinische und lungenfunktionelle Resultate zu erreichen, ohne die respiratorisch limitierten Patienten einem chirurgischen Eingriff auszusetzten. In den vergangenen Jahren wurden verschieden Techniken der endoskopischen Lungenvolumenreduktion entwickelt. Ihnen gemein ist, dass sie bei fortgeschrittenem Lungenemphysem mit deutlicher Überblähung (FEV1 von unter 45% des Solls, Residualvolumen von über 200% des Solls) eingesetzt werden. Die Verfahren unterscheiden sich durch das Indikationsspektrum, den Wirkungsmechanismus, die Reversibilität und die Komplikationen. Im Vordergrund stehen die endobronchiale Einlage von Ventilen und die Implantation von Coils. Auf diese beiden Verfahren wird im Folgenden näher eingegangen.
Die bronchoskopische Thermoablation, bei welcher durch Instillation von Wasserdampf in das destruierte Lungengewebe durch Induktion einer Entzündung eine Schrumpfung des Gewebes erreicht wird, wird in der Schweiz nicht angewandt. Bei der biologischen Lungenvolumenreduktion wurde versucht, durch die Applikation einer Art biologischen Klebers das emphysematöse Lungengewebe zu schrumpfen. Nach ersten Pilotstudien mussten diese aber wieder abgebrochen werden wegen dem Auftreten von Todesfällen und ausgeprägter morbider Inflammation.
Endobronchiale Ventileinlage
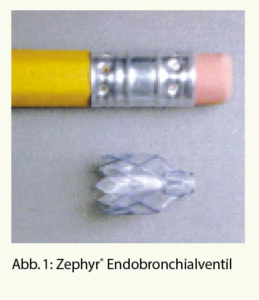
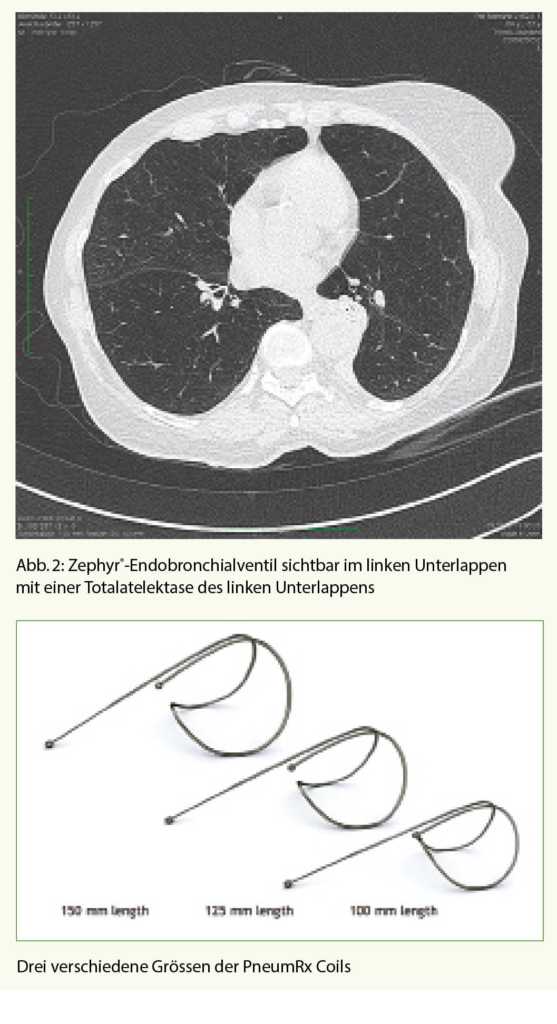
Das Ziel dieser Methode ist es, eine komplette Atelektase eines Lungenlappens zu erreichen und damit die Überblähung zu vermindern. Mittels Einlage von Einweg-Ventilen (Abb. 1) in den Segment- und Subsegmentbronchien in dem am meisten vom Emphysem betroffenen Lungenlappen wird ein unidirektionaler Luftfluss erzwungen. Das heisst, die Luft kann wohl während der Exspiration aus dem Lappen strömen, wird aber durch die Ventile bei der Inspiration blockiert, so dass es zu einer kontinuierlichen Entleerung des behandelten Lungenlappens kommt, im besten Fall zu einer Totalatelektase (Abb. 2).
Eine Atelektase kann sich aber nur bilden, wenn keine Luft von benachbarten Lungenbereichen (Kollateralventilation) einströmen kann. In der HR-CT, welches für die Planung Voraussetzung ist, kann dies im Rahmen der Fissuranalyse vorausgesagt werden. Intakte Fissuren, also intakte Grenzen zwischen den Lungenlappen, sprechen deutlich gegen eine Kollateralventilation. Im Zweifel kann die Kollateralventilation auch mittels der Chartis-Methode gemessen werden. Dabei wird der zu behandelnde Lungenlappen bronchoskopisch mittels eines aufblasbaren Ballonkatheters vollständig verschlossen und der Atemfluss distal an der Katheterspitze gemessen.
Die häufigste Komplikation ist eine akute Exazerbation der COPD, welche in den ersten 90 Tagen nach Ventileinlage zu ca. 10% auftritt. Meistens ist dann eine kurzfristige Therapie mit systemischen Steroiden und einem Antibiotikum notwendig. Die häufigste periinterventionelle Komplikation (ca. 20% der Fälle) ist der Pneumothorax, welcher typischerweise in 90% der Fälle in den ersten 5 Tagen auftritt und meistens eine Thoraxdrainage nötig macht. Die Ursache liegt in der raschen Ausbildung der Atelektase, was zu Zugkräften am peripheren Lungengewebe führt. Tatsächlich profitieren aber gerade diese Patienten am meisten. Wegen des Pneumothorax-Risikos empfiehlt sich eine Hospitalisationszeit von 5 bis 7 Tagen. Durchschnittlich werden 5 Ventile benötigt. Die Einlage erfolgt mittels eines Kathetersystems über ein flexibles Bronchoskop entweder in Narkose oder aber auch nur unter Sedation beim spontan atmenden Patienten.
Mittlerweile gibt es einige randomisiert kontrollierte Studien (RCT), welche eine signifikante Verbesserung bewiesen. Bei richtiger Patientenselektion kann ein Anstieg des FEV1 um 160ml (20%) und eine Verbesserung im 6-Minuten-Gehtest von 60 Metern (20%) nach 6 Monaten erwartet werden (9). Auch nach 12 Monaten hält die Verbesserung signifikant an (10). Ebenfalls konnten ähnliche Resultate auch für homogen verteilte Lungenemphyseme gezeigt werden (11). Wie bereits erwähnt ist eine fehlende Kollateralventilation Voraussetzung für den Therapieerfolg. Die Ventileinlage ist die einzige Form der Lungenvolumenreduktion, welche reversibel ist.
Implantation von Spiralen (Coils)
Einen anderen Ansatz der Volumenreduktion verfolgt die Coil-Therapie. Diese Coils (Abb. 3) entfalten ihre Wirkung durch Raffung des Lungengewebes über Zug an den Atemwegen.
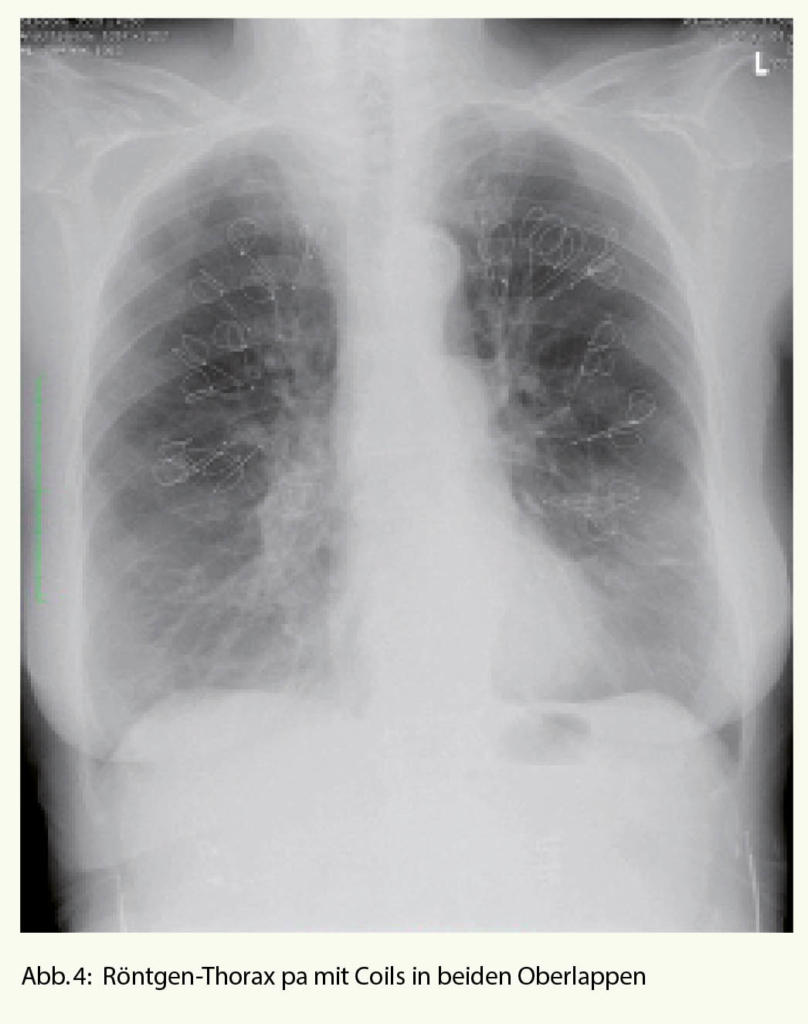
Bei den Coils handelt es sich um Drähte aus Nitinol, welche in gestrecktem Zustand über das flexible Bronchoskop in die Atemwege eingelegt werden und dort nach der Implantation ihre Spiralform wieder annehmen. Neben dem volumenvermindernden Effekt kommt es zu einer zusätzlichen Traktion an den Atemwegen (Zunahme des elastic recoil), welche durch die Coils offen gehalten werden. Insbesondere unter Belastung scheint sich diese Wirkung zu entfalten (Abnahme der dynamischen Überblähung). Es werden bis zu 12 Coils in einem Lungenlappen subsegmental implantiert. Das Vorgehen wird dann idealerweise auf der kontralateralen Seite nach 1 Monat wiederholt (Abb. 4).
Dieses Verfahren kann sowohl bei vorhandener Kollateralventilation wie auch beim homogenen Emphysemtyp angewandt werden, ist aber irreversibel. Die Nebenwirkungen sind ähnlicher Art wie bei der Ventileinlage, wobei die Pneumothoraxrate deutlich geringer ist mit etwa 6%. In den ersten 30 Tagen kann es zu Thoraxschmerzen und Hämoptysen führen, welche aber im weiteren Verlauf meist spontan verschwinden. Auch dieses Verfahren kann sowohl in Narkose wie auch beim lediglich sedierten Patienten erfolgen und bedarf einer mehrtägigen Hospitalisation. Eine Meta-Analyse von 5 Studien mit total 125 Patienten zeigte nach 6 Monaten eine signifikante Verbesserung im 6-Minuten-Gehtest von 44 Metern und einen Anstieg des FEV1 um 80ml. Eindrücklicher war die klinische Verbesserung mit einer Abnahme im SGRQ-score von 9.5 Punkten. Auch nach 12 Monaten waren diese Resultate noch signifikant vorhanden (12).
Zusammenfassend darf man festhalten, dass es mit den beschriebenen endoskopischen Lungenvolumenreduktionsverfahren nun auch eine minimal invasive Therapieoption zur Lungenvolumenreduktion gibt. Bei der Auswahl und Anwendung des Verfahrens ist eine enge Zusammenarbeit zwischen interventionellen Pneumologen, Thoraxchirurgen und Radiologen Voraussetzung für eine erfolgreiche Therapie.
LungenZentrum Hirslanden
Wittelikerstrasse 40
8032 Zürich
c.tuor@lungenzentrum.ch
Der Autor hat in Zusammenhang mit diesem Beitrag keine Interessenskonflikte deklariert.
- In der Schweiz beträgt die Prävalenz der COPD GOLD Stufe II oder höher 5.1%. Dies entspricht 200’000 bis 300’000 Patienten
- Symptomatische Patienten mit schwer eingeschränkter Lungenfunktion (FEV1 < 45%), deutlicher Überblähung (RV > 200%) und eingeschränkter Leistungsfähigkeit (6-Minuten-Gehleistung weniger als 450 Meter) sind potentielle Kandidaten für eine Lungenvolumenreduktion
- Die in der Schweiz angewandten Verfahren sind die chirurgische Lungenvolumenreduktion, die Induktion einer Lappenatelektase mittels Einlage von Ventilen und die Raffung des Lungengewebes mittels Coils idealerweise beidseits
- Voraussetzung für eine erfolgreiche Induktion einer Lappenatelektase mittels Ventileinlage ist das Fehlen einer Kollateralventilation zwischen den benachbarten Lungenlappen
- Die Einlage von Ventilen ist das einzige reversible Verfahren.
- Auch ein homogenes Lungenemphysem ist keine Kontraindikation für eine Lungenvolumenreduktion unabhängig der angewandten Methode
1. World Health Organisation: Burden of COPD. www.who.int/respiratory/copd/burden/en (letzter Besuch am 5. Januar 2018)
2. Murray CJ, Lopez AD: Measuring the global burden disease. N Engl J Med 2013: 369: 448-57.
3. Bridevaux PO, Probst-Hensch NM, Schindler C, et al.: Prevalence of airflow obstruction in smokers and never smokers in Switzerland. Eur Respir J 2010; 36: 1259-1269.
4. www.goldcopd.org
5. Brantigan OC: the surgical treatment of pulmonary emphysema. W V Medical J 1954; 5: 283-5.
6. Cooper JD, Patterson GA, Sundaresan RS, et al.: Results of 150 consecutive bilateral lung volume reduction procedures in patients with severe emphysema. J Thorac Cardiovasc Surg 1996; 112: 1319-29.
7. Fishman A, Martinez F, Naunheim K, et al.: A randomized trial comparing lung-volume-reduction surgery with medical therapy für severe emphysema. N Engl J Med 2003; 348: 2059-73.
8. Meyers BF, Yusen RD, Guthrie TJ, et al.: Results of lung volume reduction surgery in patients meeting a national emphysema treatment high-risk criterion. J Thorac Cardiovasc Surg 2004; 127: 829-835.
9. Klooster K, Ten Hacken NH, Hartmann JE, Kerstjens HA, et al.: Endobronchial valves for emphysema without interlobar collateral ventilation. N Engl J Med 2015;373: 2325-2335.
10. Klooster K, Hartmann JE, Ten Hacken NH, et al.: One-year Follow-Up after Endobronchial Valve Treatment in Patients with Emphysema without Collateral Ventilation in the STELVIO Trial. Respiration 2017;93:112-121.
11. Valipour A, Slebos DJ, Herth F, et al.: Endobronchial Valve Therapy in Patients with Hmogeneous Emphysema: results from the IMPACT Study. Am J Respir Crit Care Med 2016;194:1073-1082.
12. Slebos DJ, Hartman JE, Kloosters K, et al.: Bronchoscopic Coil Treatment for Patients with severe Emphysema: A Meta-Analysis.
der informierte @rzt
- Vol. 8
- Ausgabe 4
- April 2018