- CAR-T-Zell-Therapie: Update für den Allgemeininternisten

Mit einem Abriss über die Geschichte der Tumorimmunologie und -therapie eröffnete Prof. Dr. med. et Dr. phil. Sacha Zeerleder, Luzern, seinen hervorragenden Überblick über die CAR-T-Zelltherapie. Die Tumorimmunologie begann mit der Beobachtung von William Coley (1862-1936), der feststellte, dass es bei Sarkompatienten oftmals nach einer fieberhaften Erkrankung zu einer Rückbildung des Tumors kam. Coley entwickelte aufgrund dieser Beobachtung eine Bakterienmischung, das sogenannte Coley-Toxin, welches zu erfolgreichen Verläufen bei Tumorpatienten führte. Ungefähr zu Coleys Zeit wurde ein weiterer wichtiger Meilenstein von George Beatson gesetzt, der die Ablatio der Ovarien zur Heilung von inoperablem Brustkrebs einsetzte. Der Zusammenhang zwischen Sexualsteroidhormonen und Krebs ebnete den Weg für die Hormontherapie bei hormonempfindlichen Krebsarten wie Brust-, Ovarial-, Gebärmutter- und Prostatakrebs. Der erste prognostische Wert der Lymphozyteninfiltration war 1921, die TNM-Klassifizierung erfolgte 1932, das Konzept der «Immune Surveillance» 1957 und die Klonierung von CTLA-4 im Jahre 1987. Das erste Tumor-assoziierte Antigen (MAGE-1) wurde 1991 beschrieben und PD-1 1992 kloniert. Die Entdeckung der Anti-Tumoraktivität von CTLA-4 erfolgte 1996, die Anti-Tumoraktivität von anti-PD1/L1 2002. Der immunbasierte Test «Immunoscore» zur Quantifizierung des T-Zellinfiltrats erweist sich der TNM-Klassifizierung als überlegen (2006). Im Jahre 2016 wurde die immunbasierte Metastasenausbreitung beschrieben, im Jahre 2018 die immunbasierte Krebsevolution beim Menschen und im selben Jahr erfolgte die Immunoscore-Klassifizierung. 2018 wurde der Medizin-Nobelpreis für Immuntherapie verliehen und 2019 waren bereits 43 Checkpoint-Immuntherapien bei verschiedenen Krebsarten zugelassen.
Der Referent wandte sich nun der allogenen hämatopoetischen Knochenmarktransplantation zur Behandlung hämatologischer Krebserkrankungen zu. Dabei ist neben der erwünschten Graft vs. Leukemia-Reaktion, ein immunologisches wichtiges Phänomen, welches die Rückfallrate erniedrigt, auch die Graft vs. Host-Reaktion, die systemische zytotoxische Reaktion der transfundierten T-Zellen gegen den Wirtsorganismus, zu berücksichtigen.
Zelluläre Immuntherapie zur Heilung bösartiger Erkrankungen «der heilige Gral»
Welche Tumorantigene sind besonders geeignet? Avidität der Spender-T-Zellen gegen das Zielantigen? Expressionsmuster der Zielantigene (Expression in normalen Geweben)? Stabilität der Antigenexpression? Dabei ist eine wirksame Reaktion auf Tumore ohne Kollateralschaden erforderlich.
Adoptive T-Zelltherapie TIL, CAR und darüber hinaus
Die adoptive Zelltherapie (ACT) hat in den letzten Jahren mit der Zulassung von CAR-T-Zellen für die Behandlung von Patienten mit B-Zell-Malignomen einen Aufschwung erlebt. Um den Einsatz adoptiv übertragener T-Zellen für die Behandlung von Patienten mit soliden Tumoren und anderen hämatologischen Malignomen voranzutreiben, müssen jedoch zahlreiche Hürden in Bezug auf die Effektorzellen und die Mikroumgebung des Tumors überwunden und eine breitere ACT-Plattform genutzt werden, die nicht nur gentechnisch veränderte CAR-T-Zellen, sondern auch andere Formen der ACT einschliesslich der Therapie mit endogenen T-Zellen (ETC) und tumorinfiltrierenden Lymphozyten (TIL) umfasst. Die jüngsten Entdeckungen in Bezug auf die Immunresistenz und der Entwicklung von Technologien ermöglichen es, die Kraft tumorreaktiver T-Zellen für die adoptive Zelltherapie nutzbar zu machen. So titelte denn die New York Times am 9. Dez. 2012 «A breakthrough against leukemia using altered T cells. In girl’s last hope, altered immune cells beat leukemia». In der letzten Hoffnung eines Mädchens besiegen veränderte Immunzellen die Leukämie.
CAR-T-Zellen
CAR steht für «chimärer Antigenrezeptor». Die therapeutische Strategie basiert auf der genetischen Umprogrammierung von T-Zellen mit einem künstlichen Immunrezeptor, der sie gegen bestimmte Antigene (z.B. CD19, BCMA (B-cell maturation antigen)) auf malignen Zellen dirigiert und deren Zerstörung durch die Ausübung von T-Zellrezeptorfunktionen ermöglicht.
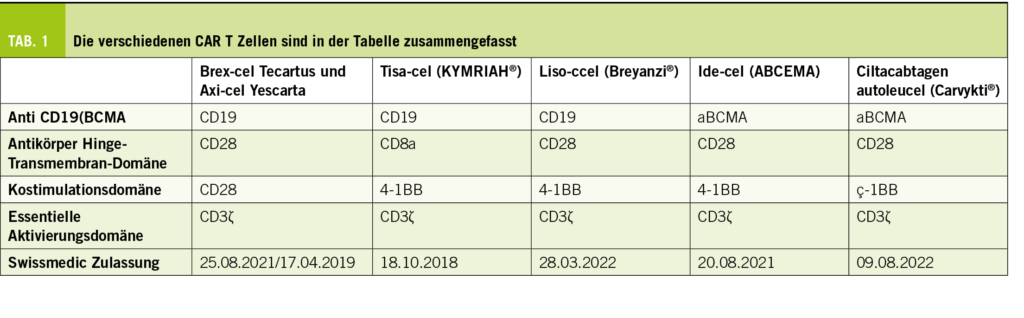
Es existiert eine ganze Reihe von verschiedenen CAR-T-Zellrezeptor-Therapien, die sich in ihrer Spezifität (anti-CD19 oder anti BCMA) unterscheiden, deren Hinge und Transmembranregion unterschiedlich ist (CD28 oder CD8a) und deren Co-Stimulationsdomänen sich unterscheiden (CD28, oder 4-1BB). Die Intensität der CAR-Signalisierung in T-Zellen wird nicht nur durch das Niveau der CAR-Expression, sondern auch durch die Scharnier-(hinge) Domäne beeinflusst. Die Scharnierdomäne reguliert die CAR-Sigalisierungsschwelle und die Transmembrandomäne die Menge der CAR-Signalisierung über die Kontrolle des CAR-Expressionsniveaus.
CAR-T-Zelltherapie: Prozess von der Ernte bis zur Infusion
Die einzelnen Schritte umfassen: die Lymphozytenapherese, die Lymphozyten-depletierende Chemotherapie und die Reinfusion («Transplantation»).
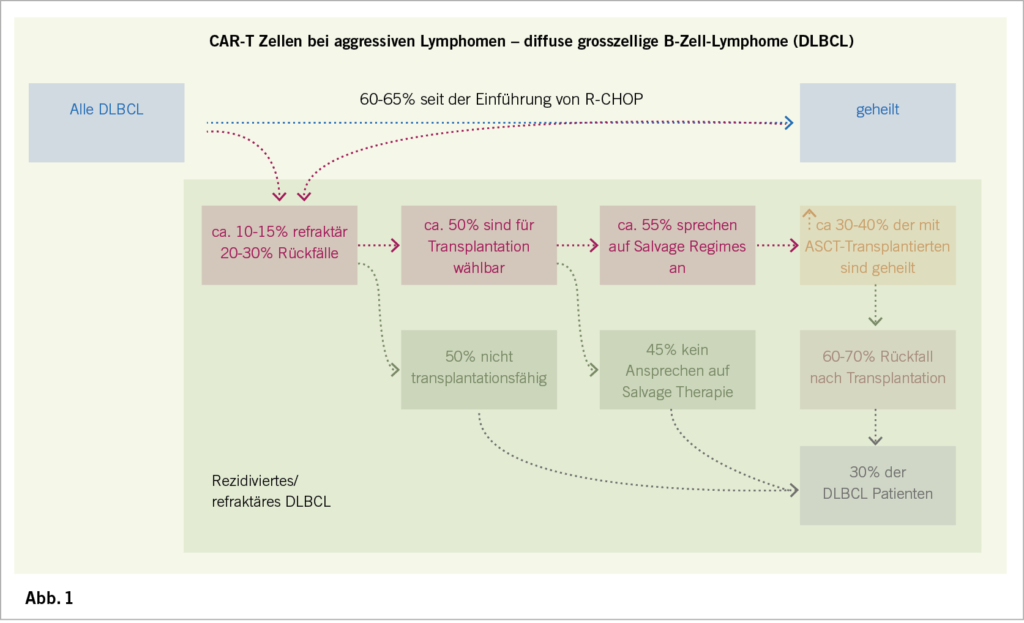
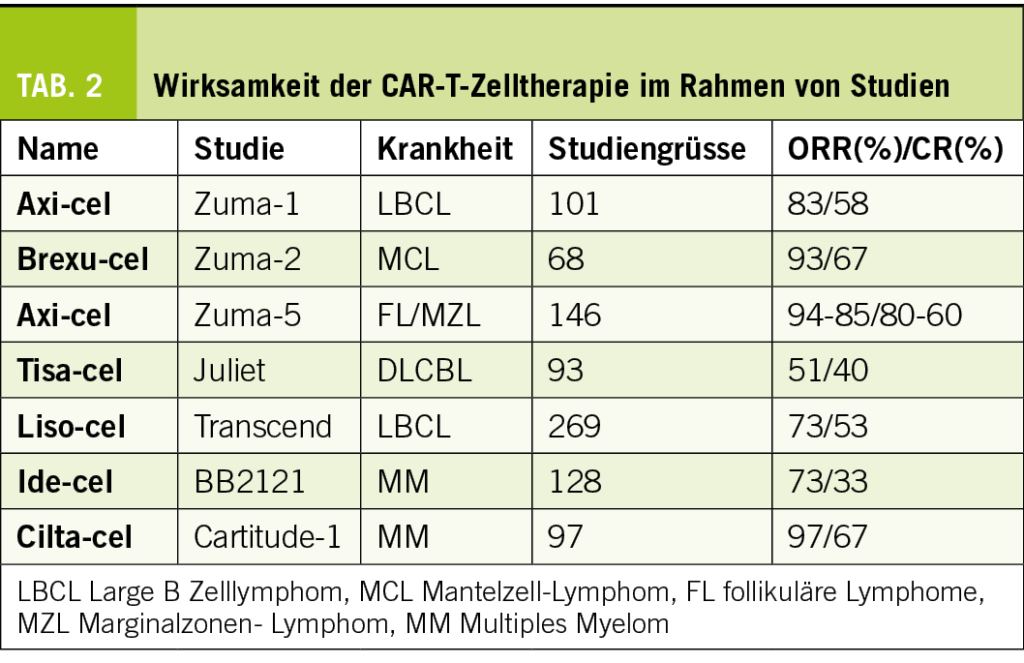
Die Reinigung, Selektion und Herstellung der CAR-T-Zellen (US/Europa) dauert 3-4 Wochen. In SCHOLAR-1, der grössten, gepoolten, retrospektiven Analyse auf Patientenebene zur Charakterisierung der Ansprechrate und des Überlebens bei Patienten mit refraktärem DLBCL lag die objektive Ansprechrate auf die nächste Therapielinie bei 26% (vollständige Ansprechrate 7%), und das mediane Gesamtüberleben betrug 6.3 Monate. Zwanzig Prozent der Patienten waren nach 2 Jahren noch am Leben. Die Ergebnisse waren in allen Studienkohorten gleich schlecht.
JULIET: Tisagenlecleucel induziert dauerhaftes Ansprechen. Bei Respondern war das 12-monatige Rückfall-freie Überleben 65%. 54% der Patienten (15/28), die eine PR erreicht hatten, wurden zu einer CR umgewandelt.
CAR-T-Zellen liessen sich bis zu 2 Jahren bei Patienten mit Ansprechen verfolgen.
ZUMA-1: Axi-cel induziert ein dauerhaftes Ansprechen bei DLBCL. Mediane Ansprechdauer (DOR) 11.1 Monate (4.2-51.3), mediane Dauer der CR 62.2 Monate (62.2-NE), mediane Dauer der PR 1.9 Monate ( 1.3-1.7). Das mediane OS betrug 25.8 Monate (12.8-NE).
CAR-T-Zelltherapie mit Ide-cel (bb2121) beim rezidivierenden/refraktären multiplen Myelom
Krankheitsprogression trotz immunmodulierender Therapie, Proteasom Inhibitoren und anti-CD38: PFS 3-4 Monate, medianes Gesamtüberleben 8-9 Monate. Phase 2 Studie OR 73%, CR 33%, Open Label Phase 3 Studie OR 71%, CR 39%.
Cita-cel bei rezidiviertem/refraktärem multiplem Myelom
OR 97%, CR 67%. Nach 27 Monaten PFS Rate 54.9% (44.0-64.6)
Die CAR-T Zell-Therapie wirkt sowohl beim aggressiven Lymphom als auch beim Multiplen Myelom.
Fazit
- Die CAR-T-Zelltheraoie ist effektiv beim aggressiven B-Zell-Lymphom und beim rezidivierenden/refraktären multiplen Myelom
- Sie ist ziemlich sicher
- Komplikationen sind
▻ Systemische inflammatorische Reaktion (Zytokinfreisetzungssyndrom, CRS)
▻ Immuneffektorzellen-assoziiertes neurotoxisches Syndrom (ICANS)
▻ Zytopenie post CAR-T (CAVE verlängerte hämatologische Toxizität
▻ Infektiöse Komplikationen
▻ Hypogammaglobulinämie - Logistischer Prozess (Gewinn/Produktion): Optimierung im Gange
- Supportive Behandlung durch gut trainiertes und erfahrenes Team
▻ Akute Komplikationen (CRS, ICANS): Inflammation blockieren (anti-IL6, anti-IL1, Steroide)
▻ Subakute Langzeitkomplikationen: Panzytopenie- und virale Prophylaxe, IVIG Infusionen, G-CSF - Offene Fragen:
▻ Rolle der allogenen HSCT (Konsolidierung nach CAR-T-Zell-Therapie?
▻ Substitut für autologe HSCT
▻ Wirksamkeit im Vergleich zu «T-cell engager/bispezifische Antikörper»
riesen@medinfo-verlag.ch