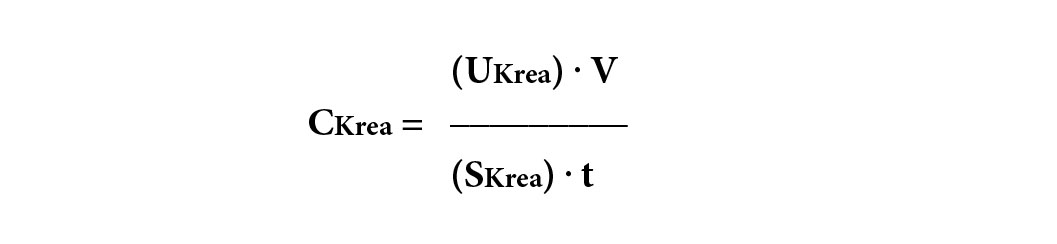- Chronische Niereninsuffizienz – Wissenswertes für den hausärztlichen Alltag
Eine chronische Nierenerkrankung (chronic kidney disease, CKD) definiert sich über die Chronizität (mindestens 3 Monate), einen strukturellen Schaden und/oder eine glomeruläre Filtrationsrate (GFR) < 60 ml/min./1.73 m2, d.h. eine CKD muss nicht automatisch mit einer verminderten Ausscheidungsfunktion assoziiert sein. Analog zur Definition basiert die heutige Stadieneinteilung der CKD auf einem funktionellen (estimated GFR = eGFR, Clearance) und einem strukturellen (Albuminurie) Parameter. Zur Bestimmung der eGFR sollen primär die auf Alter, Geschlecht und Serumkreatinin basierten Formeln CKD-EPI 2009 (bis 69 Jahre) und CKD-BIS-1 (ab 70 Jahren) verwendet werden. Kreatinin per se ist kein Nierenwert, sondern ein Abbauprodukt des Muskelstoffwechsels, so dass z.B. bei enorm geringer Muskelmasse (hohes Alter, Kachexie) die Kreatinin-basierte eGFR die Nierenfunktion überschätzt. In dieser Situation scheint die eGFR-Messung mittels der deutlich teureren Cystatin-C-Bestimmung präziser zu sein. Als Ursachen einer CKD stehen nebst einer Vielzahl weniger häufiger Ätiologien seit Jahren Diabetes mellitus und arterielle Hypertonie mit Abstand an vorderster Stelle. Jeder Patient mit CKD soll früher oder später nephrologisch beurteilt werden, sicher bei eGFR < 30 ml/Min./1.73 m2 (bei Einnierigkeit < 60 ml/min./1.73 m2), konstanter Albuminurie > 30 mg/mmol Kreatinin, persistierender nicht-urologischer (Mikro-)Hämaturie, therapierefraktärer arterieller Hypertonie und extensiv rezidivierender Nephrolithiasis. Bei allen Patienten mit CKD soll mindestens 1 x jährlich nebst der eGFR auch der Albumin/Kreatinin-Quotient in einem 2. Morgenurin vor dem Frühstück bestimmt werden.
Chronic kidney disease (CKD) is defined by chronicity (at least 3 months), structural damage, and/or GFR < 60 ml/min./1.73 m2, i.e., CKD need not automatically be associated with decreased excretory function. Analogous to the definition, the current staging of CKD is based on a functional (estimated GFR = eGFR, clearance) and a structural (albuminuria) parameter. Primarily, the age-, sex-, and serum creatinine-based formulas CKD-EPI 2009 (up to 69 years) and CKD-BIS-1 (70 years and older) should be used to determine eGFR. Creatinine per se is not a renal value, but a breakdown product of muscle metabolism, so that, for example, in the case of enormously low muscle mass (old age, cachexia), creatinine-based eGFR overestimates renal function. In this situation, eGFR measurement using the much more expensive cystatin C determination appears to be more accurate. For years, diabetes mellitus and arterial hypertension have been the leading causes of CKD, along with a variety of less common etiologies. Sooner or later, every patient with CKD should be evaluated nephrologically, certainly in the case of eGFR < 30 ml/min./1.73 m2 (in the case of singleness < 60 ml/min./1.73 m2), constant albuminuria > 30 mg/mmol creatinine, persistent non-urological (micro-) hematuria, refractory arterial hypertension and extensive recurrent nephrolithiasis. In all patients with CKD, the albumin/creatinine quotient should be determined at least once a year in addition to the eGFR in a 2nd morning urine before breakfast.
Key Words: chronic kidney disease, CKD
Definition der chronischen Nierenerkrankung
Die heute gebräuchliche Definition und Stadieneinteilung wurde von der KDIGO (Kidney Diseases – Improving Global Outcomes) 2002 vorgeschlagen (1), 2012 ergänzt (2) und 2020 nochmals breit diskutiert (3). Dabei ist der Begriff «chronische Nierenerkrankung» (englisch «chronic kidney disease; CKD») im Vergleich zu «chronischer Niereninsuffizienz» angebrachter, da er nicht automatisch eine eingeschränkte Nierenausscheidungsfunktion (Clearance), sondern auch strukturelle/funktionelle Nierenveränderungen ohne eingeschränkte Funktion beinhaltet. Zudem sollte der für PatientInnen angstmachende Begriff «terminale» Niereninsuffizienz vermieden werden (3).
Die Definition einer chronischen Nierenerkrankung (2) ist wie folgt:
Während mindestens 3 Monaten
(arbiträre Definition der Chronizität)
1. Nierenschaden mit oder ohne Funktionseinschränkung (GFR), manifestiert durch
►strukturelle Veränderungen (bioptisch gesichert)
►Marker des Nierenschadens (Proteinurie/Albuminurie,
Hämaturie, sonografische Veränderungen wie Narben nach Pyelonephritis etc.)
und/oder
2. GFR < 60 ml/min./1.73 m2, mit oder ohne Nachweis eines strukturellen Nierenschadens
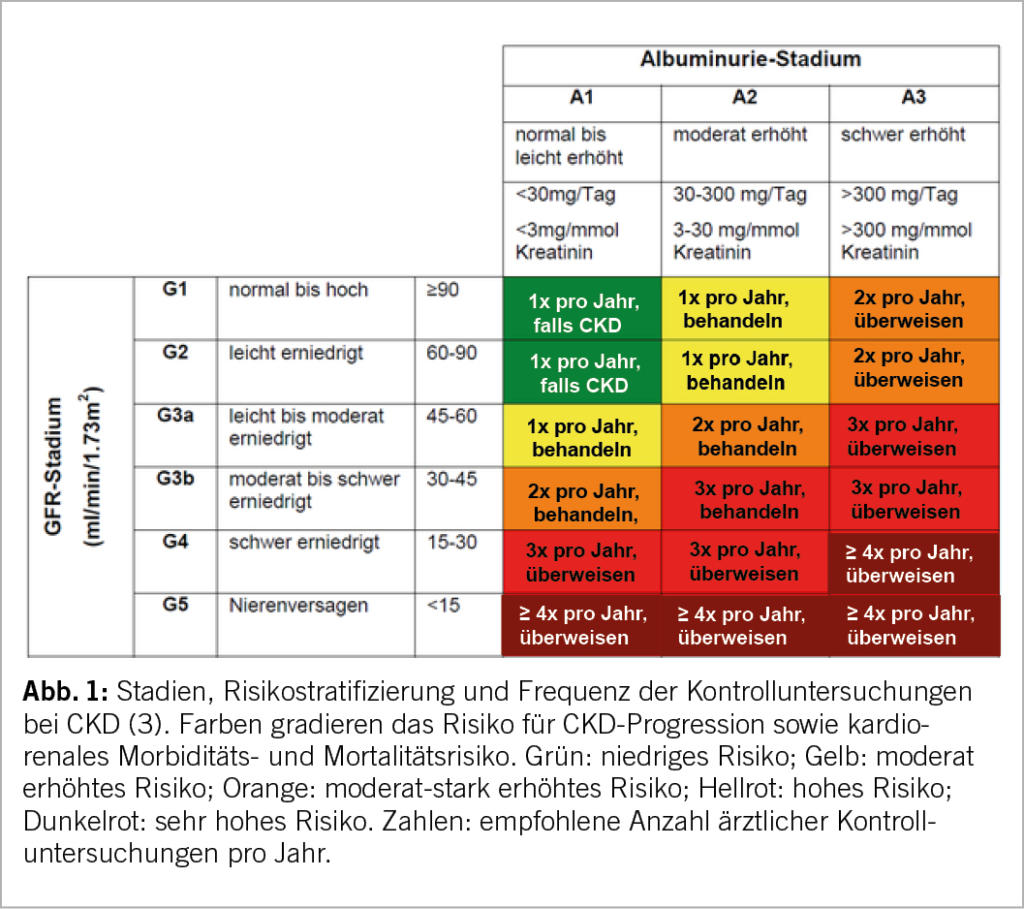
Stadien der chronischen Nierenerkrankung (KDIGO)
Unbehandelte chronische Nierenerkrankungen können schneller zur Nierenersatztherapie (Dialyse, Transplantation) führen und sind je nach Stadium mit einem zunehmend höheren Risiko für Gesamtmortalität, kardiovaskuläre Ereignisse und Hospitalisationen assoziiert (4). Die heute gebräuchliche Stadieneinteilung ist in Abbildung 1 dargestellt (3). Sie kombiniert den Grad der Funktionseinschränkung (eGFR, Clearance) mit der Albuminurie als Marker der strukturellen Nierenschädigung. Die vermehrte Albuminurie hat sich in zahlreichen Studien als entscheidender Progressionsfaktor einer chronischen Nephropathie erwiesen (5, 6)
Ursachen der chronischen Niereninsuffizienz
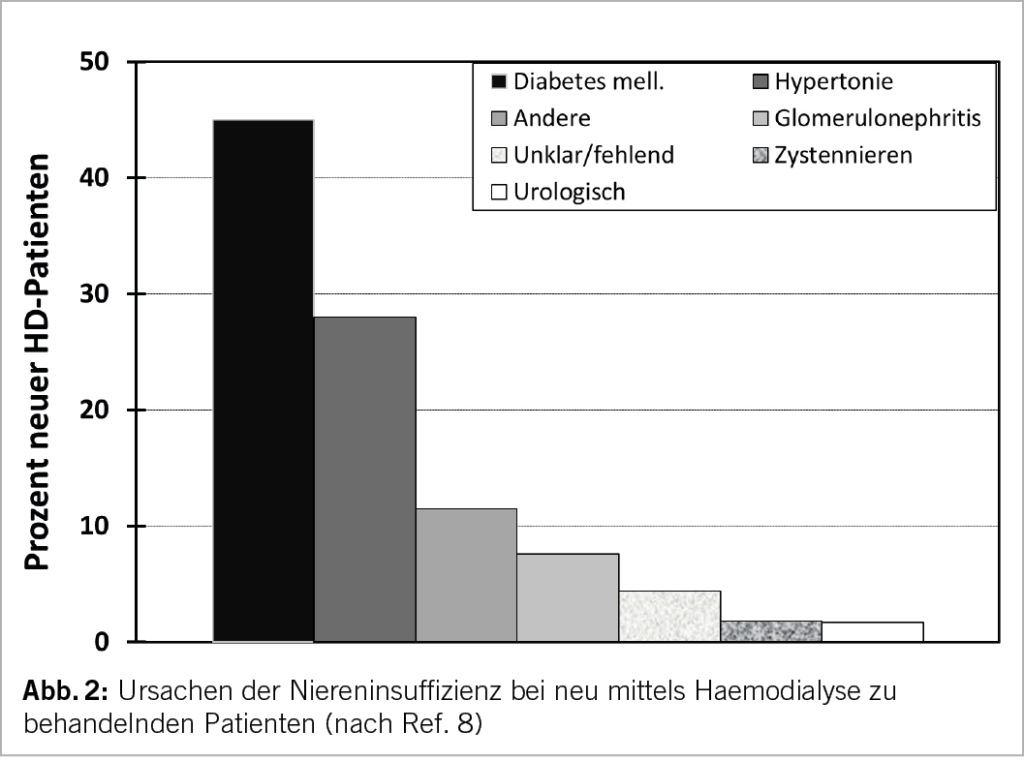
Seit Jahren sind Diabetes mellitus und schlecht kontrollierte arterielle Hypertonie die führenden Ursachen der chronischen Niereninsuffizienz (7). Bereits im jährlichen Bericht des US Renal Data Systems 2004 standen diese 2 Ursachen bei neu mittels Hämodialyse zu behandelnden Patienten an vorderster Stelle (8), wie in Abbildung 2 illustriert. Dies ist bis heute unverändert (9).
Weitere Ursachen (nach 7) sind Nierenarterienstenosen (renovaskuläre Nierenkrankheit), Anamnese von schwerem/prolongiertem akutem Nierenversagen, ausgeprägte Adipositas, schwere Herzinsuffizienz, Leberversagen, Autoimmunkrankheiten, rezidivierende komplizierte Harnwegsinfekte, verminderte Nierenzellmasse (Einnierigkeit nach Operation oder wegen Agenesie), Glomerulopathien, hereditäre Nierenkrankheiten, Malignome (v.a. Multiples Myelom), St. n. Chemo-/Radiotherapien, obstruktive Uropathie, Viruskrankheiten wie Hepatitis B/C und HIV sowie nephrotoxische Medikamente (z.B. Lithium, überdosiertes Vancomycin).
Indikationen für ein nephrologisches Konsilium
Diese sind in Tabelle 1 zusammengefasst. Wichtig ist die Familienanamnese bezüglich hereditärer Nephropathien, falls sonographisch grosse Zysten in Nieren und Leber vorhanden sind (adulte polyzystische Nierenkrankheit) oder Schwerhörigkeit mit Proteinurie kombiniert ist (Alport-Syndrom). Eine chronische hypoproliferative Anämie (ungenügend stimulierte Retikulozyten!) ist bei fehlendem Mangel von Eisen, Vitamin B12 und Folsäure meist Ausdruck einer chronischen Nierenerkrankung. Persistierende Urin-pH-Werte > 6 (einfacher Multistix) können Hinweis auf die häufige, meist inkomplette distale renal-tubuläre Acidose sein, welche Nephrolithiasis/Nephrokalzinose und Osteopenie/-porose begünstigt (10, 11).
Bestimmung der Nierenfunktionsparameter im klinischen Alltag
Serum-Kreatinin und Kreatinin-Clearance
Kreatinin stammt aus dem Metabolismus von Kreatin im Skelettmuskel und wird relativ konstant ins Blut abgegeben, was zu stabilen Serumkonzentrationen führt (12). Weil Kreatinin als kleines Molekül glomerulär frei filtriert wird, wurde es seit Jahrzehnten zur Bestimmung der Nierenfunktion mittels der klassischen Clearance-Formel verwendet:
wobei V das 24h-Urinvolumen, (UKrea) die Urinkonzentration von Kreatinin, (SKrea) die Konzentration von Kreatinin im Serum und t die Sammelzeit (24h = 1440 Minuten) bedeuten. Da 24-Stunden-Urinsammlungen im Praxisalltag nicht beliebt und gelegentlich nicht praktikabel sind, wurden Formeln zur Schätzung der GFR anhand von Alter, Geschlecht und Serum-Kreatinin entwickelt – estimated GFR = eGFR (13, 14). Bereits 2013 empfahlen die KDIGO-Richtlinien, nur die CKD-EPI-Formel 2009 und nicht mehr die ältere MDRD-Formel zu verwenden (15, 16). Eine neu entwickelte CKD-EPI-Formel 2021 schneidet klar schlechter ab als die CKD-EPI-Formel 2009, so dass man sich zumindest in Europa weiterhin auf die Verwendung der Formel von 2009 geeinigt hat (17).
Da in der Kohorte, in welcher die CKD-EPI-Formel entwickelt worden war, nur 13% der Probanden über 65 Jahre alt waren, entwickelten Schaeffner et al. (18) 2012 eine neue Kreatinin-basierte Formel (Berlin Initiative Study-1 = CKD-BIS1) für Patienten ab 70 Jahren mit hohem kardiovaskulärem Risiko. Im Vergleich zur CKD-EPI-Formel 2009 reklassifizierte die CKD-BIS1-Formel die eGFR-Klasse in rund 35%, davon die grosse Mehrheit (98%) in eine schlechtere GFR-Klasse mit demzufolge höherem kardiovaskulärem Risiko (19). Die CKD-BIS1-Formel wies auch eine signifikant bessere Zuverlässigkeit in der Voraussage harter kardiovaskulärer Endpunkte auf (18). Aus diesem Grund verwenden Labors bei Pa-tienten ab 70 Jahren zunehmend die CKD-BIS1-Formel. Sowohl die CKD-EPI- als auch die CKD-BIS1-Formel sind auf verschiedenen Internetseiten abrufbar.
Bei den eGFR-Formeln ist zu bedenken, dass Kreatinin als Abbauprodukt des Muskelstoffwechsels nicht nierenspezifisch ist und im Serum aus nicht-renalen Gründen erhöht sein kann. So ist es bei Patienten mit nicht altersdurchschnittlicher Muskelmasse ratsam, eher die «klassische» Kreatininclearance durchzuführen, wie folgende Fallbeispiele zeigen:
Fallbeispiel 1 – Unterschätzung der Nierenfunktion anhand des Serumkreatinins: ein 27-jähriger Mann wurde wegen Nierenfunktionsstörung zugewiesen. Er hatte sich zwecks «Muskelaufbau» wöchentlich Schwarzmarkt-Anabolika intramuskulär spritzen
lassen und 8 kg an Gewicht zugenommen. Anhand des Serum-Kreatinins von 139 μmol/l betrug die eGFR mittels CKD-EPI 59 ml/min./1.73 m2. Die zur Klärung durchgeführte 24-Stunden-Urinsammlung mit Kreatinin-Clearance ergab angesichts der hohen Kreatininausscheidung im Urin (Ausdruck der vermehrten Muskelmasse) einen normalen Wert von 95 ml/min./1.73 m2.
Fallbeispiel 2 – Überschätzung der Nierenfunktion anhand des Serum-Kreatinins: Eine 81-jährige Frau mit jahrelanger Hypertonie und Diabetes mellitus Typ 2 erkrankte an einem Kolonkarzinom und verlor 9 kg an Gewicht. Bei 1.49 m2 Körperoberfläche betrug anhand des Serum-Kreatinins von 79 μmol/l die eGFR 65 ml/min./1.73 m2. Die anschliessend durchgeführte «klassische» Kreatinin-Clearance ergab dann 39 ml/min./1.73m2
Solche Diskrepanzen müssen klinisch vermutet werden. Gerade bei alten Patienten mit verminderter Muskelmasse überschätzen die eGFR-Formeln die effektive GFR, was Implikationen für die Medikamentendosierung hat (20).
Urin-Kreatinin und Kreatinin-Clearance: wurde der Urin
richtig gesammelt? Im Steady State ist die über 24 h ausgeschiedene Menge Kreatinin einigermassen konstant. Somit kann über die Kreatininausscheidung – und nicht über das Harnvolumen – abgeschätzt werden, ob eine 24-Stunden-Urinsammlung vollständig erfolgte oder nicht. Dies geschieht mittels folgender Formeln (21):
Sollwert Männer : Urin-Kreatinin (mmol / kg KG / Tag) = (28.2 – (0.172 X Alter)) x 0.0088
Sollwert Frauen : Urin-Kreatinin (mmol / kg KG / Tag) = (21.9 – (0.115 x Alter)) x 0.0088
Cystatin-C
Cystatin-C ist ein kleinmolekulares Protein (13 kDa), das von kernhaltigen Zellen in konstanter Menge produziert, glomerulär frei filtriert und tubulär weder reabsorbiert noch ausgeschieden wird (22). Vor allem bei Untergewichtigen (siehe Fallbeispiel 2) wird die mit Cystatin-C berechnete eGFR weniger überschätzt als mit der Kreatinin-basierten eGFR, was Konsequenzen für die Stadieneinteilung der CKD mit entsprechender prognostischer Bedeutung hat (22). Die Cystatin-C-Bestimmung ist aber deutlich teurer als jene von Kreatinin, weshalb die eGFRCys nur dann angewendet werden sollte, wenn der Wert des Serumkreatinins ungenügend zuverlässig scheint. Dies ist der Fall bei extrem tiefem (Sarkopenie/Kachexie) oder hohem (morbide Adipositas) Körpergewicht oder bei extremen Ernährungsgewohnheiten (aussergewöhnlich proteinreich oder streng vegetarisch) (22).
Mikroalbuminurie
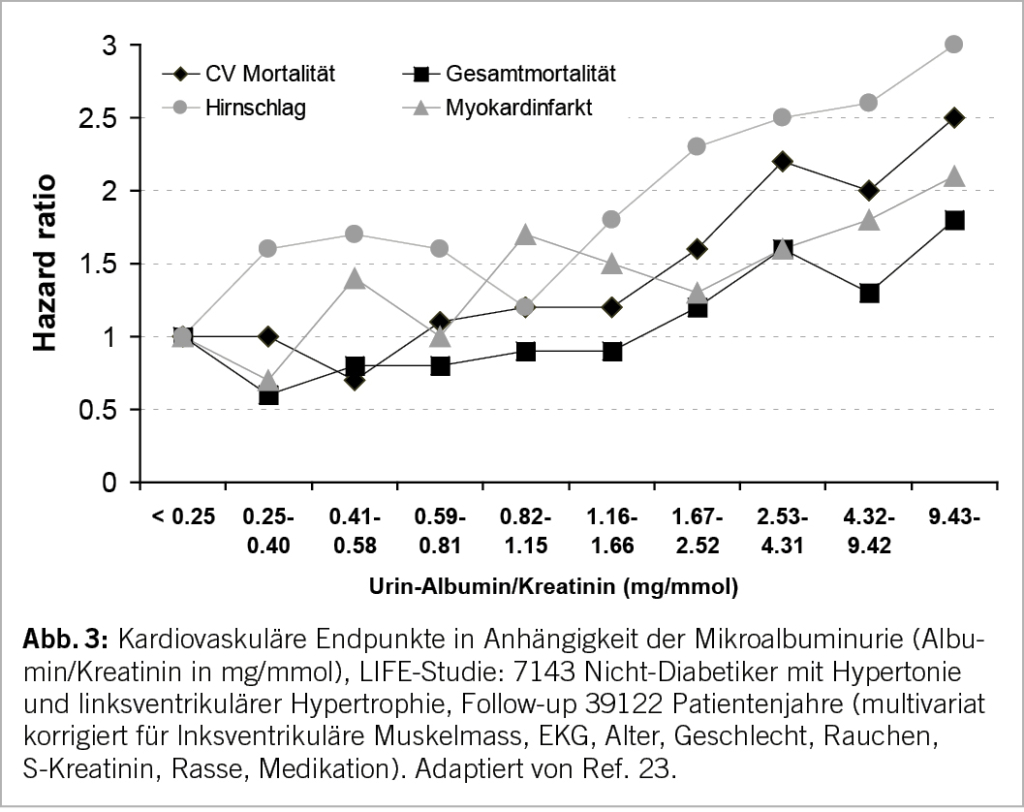
Wie in Abbildung 3 gezeigt, nehmen kardiovaskuläre Komplikationen und Gesamtmortalität mit steigender Albuminurie progredient zu (23). Das Gleiche wurde neulich in einer Meta-Analyse von 28 Kohortenstudien mit 693’816 Probanden für das Erreichen einer dialysepflichtigen Niereninsuffizienz gezeigt (6). Im klinischen Alltag sollte deshalb bei Patienten mit CKD mindestens 1 x jährlich nicht nur die eGFR, sondern auch der Albumin/Kreatinin-Quotient in einem 2. Morgenurin vor dem Frühstück bestimmt werden (24). Normal liegt dieser < 3 mg/mmol, die Mikroalbuminurie ist definiert als 3–30 mg/mmol, und eine stark erhöhte Albuminurie («Makroalbuminurie») als >30 mg/mmol Albumin/Kreatinin (2).
Erhaltung der Nierenfunktion bei CKD
Eingeschränkte Nierenfunktion bedeutet immer eine Reduktion der Anzahl noch funktionierender Nephronen. Bei 50% eingeschränkter Funktion muss somit die «Entgiftung» des Körperstoffwechsels mit der halben Nierenleistung bewerkstelligt werden. Dadurch unterliegen die noch intakten Nephronen einem erhöhten Workload, weshalb sie aber zur Erhaltung der Nierenfunktion möglichst geschont werden sollten. Dies geschieht durch Reduktion v.a. des intraglomerulären Drucks mit Verminderung von Albuminurie/Proteinurie – Nephroprotektion (5). Je geringer die Albuminurie, desto länger das Überleben noch intakter Nephronen. Klinisch wird der intraglomeruläre Druck entweder durch Dilatation der efferenten glomerulären Arteriole (ACE-Hemmer, Angiotensin II-Rezeptorantagonisten, Aldosteron-Antagonisten oder Lercandipin) oder – via tubulo-glomerulären Feedback – durch Konstriktion der afferenten glomerulären Arteriole (SGLT2-Hemmer, Reduktion der Zufuhr von Fleischeiweiss) erreicht (5).
Copyright bei Aerzteverlag medinfo AG
Innere Medizin & Nephrologie/Hypertonie
NierensteinZentrumZürich
Klinik Im Park
Bellariastrasse 38
8038 Zürich
bernhard.hess@hirslanden.ch
Der Autor hat keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
1. National Kidney Foundation. K/DOQI clinical practice guidelines for chronic kidney disease: evaluation, classification, and stratification. Am J Kidney Dis 2002; 39 (Suppl 1) : S1-S266.
2. Kidney Disease Improving Global Outcome (KDIGO) CKD Work Group. KDIGO 2012 clinical practice guideline for evaluation and management of chronic kidney disease. Kidney Int Suppl 2013: 3: 1-150.
3. Levey AS, Eckardt k-U, Dorman NM, Chrstiansen SL, Hoorn EJ, Ingelfinger JL et al. Nomenclature for kidney function and disease: report of a kidney disease: im- proving global outcomes (KDIGO) consensus conference. Kidney Int 2020; 97: 1117-1129.
4. Go AS, Chertow GM, Fan D, McCulloch CE, Hsu C-Y. Chronic kidney disease and the risks of death, cardiovascular events, and hospitalization. N Engl J Med 2004; 351:1296-1305.
5. Hess B. Nephroprotektion. info@herz+gefäss 2022; 5: 4-7.
6. Coresh J, Heerspink HJL, Sang Y et al. For the Chronic Kidney Disease Progno- sis Consortium and Chronic Kidney Disease Epidemiology Collaboration. Chan-ge in albuminuria and subsequent risk of end-stage kidney disease: an individual par- ticipant-level consortium meta-analysis of observational studies. Lancet Diabe-tes Endocrinol 2019; 7:115-127.
7. Fatehi P, Hsu Ch-Y. Chronic kidney disease (newly identified): Clinical presenta- tion and diagnostic approach in adults. UpToDate 2022 (online).
8. US Renal Data System 2004 Annual Data Report, Am J Kidney Dis 45, Suppl 1, S91, 2005.
9. 2018 USRDS Annual Data Report: Epidemiology of kidney disease in the United States. National Institutes of Health, National Institute of Diabetes and Digestive and Kidney Diseases, Bethesda, MD, Chapt. 1, 2018.
10. Sromicki J, Kacl G, Föhl M, Hess B. Prospective long-term evaluation of incomplete distal renal tubular acidosis in idiopathic calcium nephrolithiasis dia- gnosed by low-dose NH4Cl loading – gender prevalences and impact of alkali treatment. J Nephrol 2022, 35: 1619-1626.
11. Sromicki JJ, Hess B. Abnormal distal renal tubular acidification in patients with low bone mass – prevalence and impact of alkali treatment. Urolithiasis 2017, 45: 263-269.
12. Rose BD, Pathophysiology of renal disease, 2nd ed. 1987, chapt.1, McGraw-Hill, 1987.
13. Levey AS, Stevens LA, Schmid CH et al. A new equation to estimate glomerular filtration rate. Ann Intern Med 2009; 150: 604-612.
14. Polkinghorne KR. Controversies in chronic kidney disease staging. Clin Biochem Rev 2011; 32: 55-59.
15. Kidney disease improving global outcomes (KDIGO) CKD Work Group. KDIGO 2012 clinical practice guidelines for the evaluation and management of chronic kidney disease. Kidney Int Suppl 2013; 3: 1-150.
16. Matsushita K, Mahmoodi BK, Woodward M, Emberson JR, Jafar TH, et al. Com- parison of risk prediction using the CKD-EPI equation and the MDRD study equation for estimated glomerular filtration rate. JAMA 2012, 307: 1941-1951.
17. Gansevoort RT, Anders H-J, Cozzolino M et al. What should European nephrolo- gy do with the new CKD-EPI equation? Nephrol Dial Transplant 2023, 38: 1-6.
18. Schaeffner ES, Ebert N, Delalaye P et al. Two novel equations to estimate kidney function in persons aged 70 years or older. Ann Intern Med 2012, 157: 471-481.
19. Tarantini L, McAlister FA, Barbati G et al. Chronic kidney disease and prognosis in elderly patients with cardiovascular doisease. Comparison between CKD-EPI and Berline Initiative Study-I formulas. Eur J Prev Cardiol 2016, 23:1504-1513.
20. Frank M, Guarino-Gubler S, Burnier M, Maillard M, Keller F, Gabutti L. Estimation of glomerular filtration rate in hospitalised patients: are we overestimating renal function? Swiss Med Wkly 2012; 142: w13708.
21. Walser M. Creatinine excretion as a measure of protein nutrition in adults of var- ying age. J Parenter Enter Nutr 1987; 11: 73S-78S.
22. Bornet M-A, Beaud F, Bardy D., Boulat O, Kissling S. Bestimmung des Cystatin C zur Beurteilung der Nierenfunktion. Swiss Med Forum 2019, 19: 391-393.
23. Wachtell K, Ibsen H, Olsen MH et al. Albuminuria and cardiovascular risk in hy- pertensive patients with left ventricular hypertrophy: the LIFE study. Ann Intern Med 2003, 139: 901-906.
der informierte @rzt
- Vol. 13
- Ausgabe 7
- Juli 2023