- Chronischer Beckenschmerz am Beispiel vom Blasenschmerzsyndrom
Wichtig bei der modernen Betrachtung von Schmerzsyndromen des Beckens ist, dass der Schmerz als Krankheitsprozess gesamthaft ins Zentrum rückt. Dies bedeutet, dass die damit verbundenen funktionellen Organveränderungen sowie die negativen Auswirkungen auf die Kognition, das Verhalten, die Sexualität und die Emotionen in die Betrachtung einbezogen werden, und das Augenmerk nicht mehr in erster Linie einer konkreten peripheren Organpathologie gilt, welche häufig nur minimal nachweisbar ist. Eine monotherapeutische, oft repetitive Therapie mit peripherem Endorganansatz (z. B. Antibiotikatherapie mit dem Fokus bakterieller Infektbehandlung) ist dabei meist zum Scheitern verurteilt, weil wichtige Aspekte des chronischen Schmerzsyndroms vernachlässigt werden. Die Zukunft wird zeigen, welche multimodalen Behandlungsstrategien die besten Resultate bringen.
An important aspect of the modern approach to pelvic pain syndromes is that the pain as a disease process takes centre stage. This means that the associated functional organ changes as well as the negative effects on cognition, behaviour, sexuality and emotions are included in the consideration, and the focus is no longer primarily on a specific peripheral organ pathology, which is often only minimally detectable. A monotherapeutic, often repetitive therapy with a peripheral end organ approach (e.g. antibiotic therapy focussing on bacterial infection treatment) is usually doomed to failure because important aspects of the chronic pain syndrome are neglected. The future will show which multimodal treatment strategies produce the best results.
Key words: Pelvic pain syndrome, bladder pain syndrome, interstitial cystitis, chronic primary pain
Einleitung
In früheren Jahren fokussierte sich die Forschung im Bereich des chronischen Beckenschmerzes vorwiegend auf periphere Endorgan-Mechanismen wie entzündliche oder infektiöse Vorgänge. Jedoch machten Grundlagenforschung und klinische Erkenntnisse klar, dass sich viele krankheitsrelevante Vorgänge im zentralen Nervensystem abspielen. Heutzutage geht man davon aus, dass bei diesen Schmerzsyndromen ein peripherer Stimulus, z. B. eine Infektion oder ein Trauma, eine Reihe von Folgeerscheinungen auslöst. Diese verselbständigen sich im Rahmen einer Modulation des Zentralnervensystems letztlich unabhängig von der primären Ursache. Neben dem Schmerz äussert sich diese Modulation im Rahmen von verschiedenen anderen sensorischen, funktionellen (z. B. Miktion oder Defäkation), verhaltensmässigen oder psychologischen Phänomenen. Solche individuell ausgeprägten Phänomene bilden dann die Basis der Diagnose eines Schmerzsyndroms (1).
Es ist wichtig, dass bei vielen dieser Schmerzsyndrome keine periphere persistierende Pathologie mehr festzustellen ist, wie z. B. Entzündung/Infektion, welche durch das Krankheitssuffix «-itis» reflektiert ist. Somit ist eine Nomenklatur, welche sich allein auf das periphere Endorgan fokussiert, unpassend und irreführend, ja gefährlich, da daraus möglicherweise falsche therapeutische Konsequenzen gezogen werden. Aus diesem Grunde wird in der neuen Terminologie, u.a. in den Guidelines der European Association of Urology (1), der chronische Beckenschmerz in spezifisch-krankheitsassoziierten Beckenschmerz mit bekannter Ätiologie sowie in die Beckenschmerzsyndrome unterteilt. Die häufigsten Schmerzsyndrome im urologischen Bereich sind das Prostataschmerzsyndrom (Prostate Pain Syndrome = PPS, früher Chronische Prostatitis) und das Blasenschmerzsyndrom (Bladder Pain Syndrome = BPS, früher interstitielle Zystitis) sowie das skrotale Schmerzsyndrom. Von einem chronischen Schmerzsyndrom gemäss ICD-11-Klassifikation spricht man ab einer Dauer von drei Monaten (2). Diese neue ICD-11 Klassifikation nimmt zum ersten Mal chronischen Schmerz als eigenständige Erkrankung auf und unterteilt diesen in chronischen primären Schmerz und sekundären Schmerz. Chronisch primärer Schmerz entspricht einem Konzept, das auf der Einsicht beruht, dass chronische Schmerzzustände als eigenständige Erkrankung anerkannt werden sollen, selbst wenn das Verständnis für die zugrunde liegende Ätiologie und Pathophysiologie fehlt. Die Beckenschmerzsyndrome entsprechen zum grossen Teil der Definition des chronisch primären Schmerzes.
Die Hintergründe des chronischen Schmerzes
Mechanismen des chronischen Beckenschmerzes können verschiedene Prozesse beinhalten, welche weitgehend bekannt sind. Einerseits sind persistierende akute Schmerzmechanismen möglich, wie diejenigen, welche mit entzündlichen Veränderungen assoziiert sind, andererseits bestehen vor allem chronische Mechanismen, welche das Zentralnervensystem involvieren.
Bei der sogenannten peripheren Sensibilisierung geht man davon aus, dass unmyelinisierte viszerale Afferenzen (Typ C-Fasern), welche normalerweise nicht (50–90 Prozent) oder wenig aktiv sind, durch verschiedene Vorgänge eine reduzierte Aktivierungsschwelle oder eine gesteigerte Antwort aufweisen. Dies geschieht über eine Änderung in Botensubstanzen oder Modifikation von Rezeptoren. Als Beispiel sei hier die vermehrte Ausschüttung von Nerve Growth Factor (NGF), Adenosintriphosphat (ATP) oder Substanz P genannt, welche über ihre spezifischen Rezeptoren für eine vermehrte Aktivierung der viszeralen Afferenzen führen (3, 4). Durch zentralen Transport z. B. des Tyrosinkinase A (TrkA)-NGF wird unter Umständen auch die Genexpression verändert. Ein anderer peripherer Mechanismus ist die Veränderung von spannungsabhängigen Ionenkanälen (z. B. Tetrodotoxin-resistant Sodium Channel, NaV1.8), welche sich abhängig vom Membranpotential öffnen oder schliessen. Als weitere Möglichkeit kann es bei einem direkten Schaden an peripheren Nerven zu einer pathologischen afferenten Aktivität mit Ausbildung von neuropathischen Schmerzen und einer nachfolgenden zentralen Sensibilisierung kommen.
Bei der zentralen Sensibilisierung sind verschiedene Mechanismen vor allem auf spinaler Ebene involviert, insbesondere Änderungen in der Proteinaktivität, Proteintranskription oder auch strukturelle Änderungen in den neuronalen Verbindungen (5). Als Beispiel sei hier der Wegfall des Magnesiumblocks des N-metyl-Aspartat-Rezeptors (NMDA) genannt, welcher auf eine erhöhte Glutamatfreisetzung aufgrund repetitiver afferenter nozizeptiver Signale folgt. Dies führt über das Einströmen von Calcium-Ionen zu einer vermehrten Depolarisation des sekundären afferenten Neurons. Weiter zentral spielt die Modulation von spinalen Signalen eine wichtige Rolle, insbesondere das periaquäduktale Grau (PAG), welches unter dem Einfluss von höheren Zentren steht, die mit Kognition und Emotion assoziiert sind. Bei der deszendierenden Inhibition sind verschiedene Transmitter involviert, wie Opioide, 5-Hydroxytryptamin und Noradrenalin. Untersuchungen mit funktioneller Magnetresonanztomographie haben gezeigt, dass bei der wichtigen psychischen Modulation von viszeralen Schmerzen möglicherweise mehrere neuronale Bahnen involviert sind (6).
Wechselwirkung von Schmerz und Organfunktion – Phänotypisierung
Im Rahmen der meisten Schmerzsyndrome kommt es zur sekundären Ausbildung von Störungen der Organfunktion. Dabei sind diese häufig nicht nur Funktionsänderungen des (vermutlich) in die primäre Entstehung des Schmerzes involvierten Organs, sondern auch von anderen, häufig benachbarten Organen. So ist zum Beispiel das chronische PPS häufig mit Störungen der Blasenfunktion (z. B. überaktive Blase), der Sexualität (z. B. erektile Dysfunktion), der Defäkation (z. B. Obstipation) oder der Muskulatur (z. B. überaktiver Beckenboden) assoziiert. Diese Funktionsstörungen wiederum können dann die Schmerzsymptomatik negativ beeinflussen, respektive weiter verstärken. In ihrer Gesamtheit nehmen die Funktionsstörungen bei einzelnen Patienten sehr unterschiedliche Ausprägungen an. Es wurde im Rahmen von verschiedensten randomisierten Placebo-kontrollierten Studien gezeigt, dass einzelne Monotherapien häufig über das Gesamtkollektiv aller Patienten keinen signifikanten Effekt zeigten. Aus diesem Grunde wird versucht, entsprechend der Symptomatologie die Patienten in verschiedene Phänotypen einzuteilen und die Therapie entsprechend daran zu orientieren. Dies in der Hoffnung, dass einzelne Subtypen ein besseres Ansprechen auf eine phänotypen-fokussierte Therapie haben.
Aufgrund der Relevanz wird im Folgenden als Beispiel eines chronischen Beckenschmerzes das Blasenschmerzsyndrom diskutiert.
Das Blasenschmerzsyndrom
Hintergrund
Das chronische Blasenschmerzsyndrom ist charakterisiert als das Auftreten von anhaltenden oder wiederkehrenden Schmerzen, die in der Harnblasenregion wahrgenommen werden, begleitet von mindestens einem weiteren Symptom, wie z. B. einer Verschlechterung der Schmerzen durch Blasenfüllung und der Harnfrequenz am Tag und / oder in der Nacht (1). Es gibt keine nachgewiesene Infektion oder andere offensichtliche lokale Pathologie. Das Blasenschmerzsyndrom ist häufig mit negativen kognitiven, verhaltensbezogenen, sexuellen oder emotionalen Konsequenzen sowie mit Symptomen verbunden, die auf untere Harnwege und sexuelle Dysfunktion hinweisen. Synonyme für das Blasenschmerzsyndrom umfassen «interstitielle Zystitis» oder «schmerzhaftes Blasensyndrom» und sollten aktuell nicht mehr verwendet werden.
In der Literatur wird angegeben, dass ein chronisches Blasenschmerzsyndrom mit einer Prävalenz von 0,06 % bis 30 % (7–9) vorliegen kann. Es gibt eine weibliche Dominanz von etwa 10:1. Die relativen Anteile des klassischen Blasenschmerzsyndroms (Typ 3 mit sogenannten Hunner-Läsionen) und der Nicht-Läsionskrankheit sind unklar (1). Es gibt zunehmend Hinweise darauf, dass auch Kinder unter achtzehn Jahren betroffen sein können, obwohl die Prävalenzzahlen niedrig sind. Daher kann ein Blasenschmerzsyndrom nicht aufgrund des Alters ausgeschlossen werden (10).
Es wird angenommen, dass eine anfängliche nicht identifizierte Affektion der Blase, die zu Urothelschäden, neurogenen Entzündungen und Schmerzen führt, die Ursache für ein Blasenschmerzsyndrom ist. Bisher wurden keine Infektionen in Verbindung gebracht. Trotzdem ist eine Harnwegsinfektion im Kindes- und Jugendalter bei Patienten mit Blasenschmerzsyndrom im Erwachsenenalter signifikant häufiger. Zystoskopische und bioptische Befunde sowohl bei Blasenschmerzsyndrom mit als auch ohne Läsion zeigen Defekte in der Urothel-Glycosaminoglycan-Schicht (GAG), die submukosale Strukturen schädlichen Urinkomponenten aussetzen könnten (11–13) und eine daraus resultierende zytotoxische Wirkung haben.
Diagnose
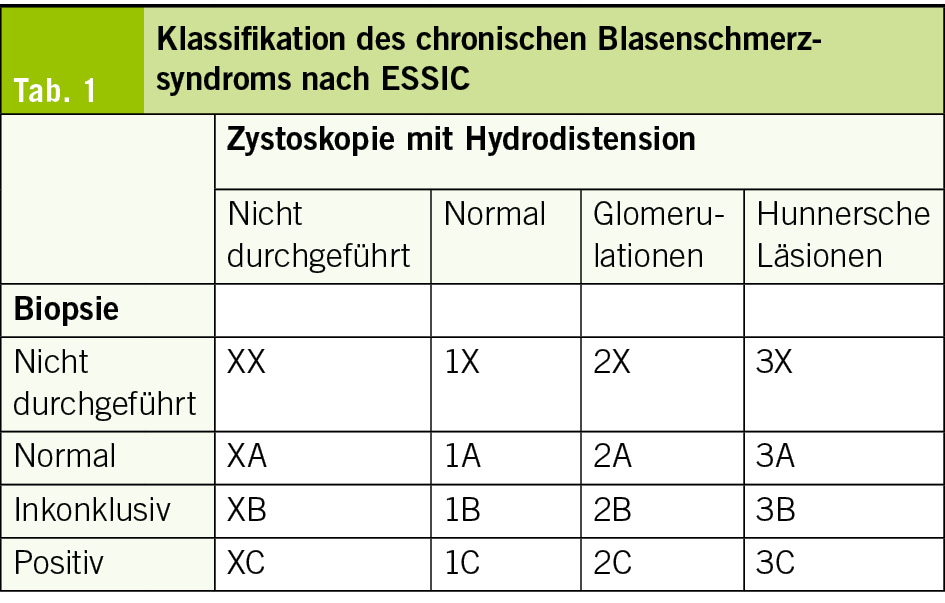
Das Blasenschmerzsyndrom sollte auf der Grundlage von Schmerzen, Druck oder Beschwerden diagnostiziert werden, die mit der Harnblase verbunden sind, begleitet von mindestens einem anderen Symptom, wie z. B. tagsüber und / oder nachts erhöhter Harnfrequenz. Zum Ausschluss anderer intravesikaler Pathologien und Klassifikation (nach ESSIC) ist eine Zystoskopie mit Hydrodistension und ggf. Biopsie indiziert (Tab. 1) (14).
Zystoskopisch zeigt das Blasenschmerzsyndrom Typ 3 gerötete Schleimhautbereiche, die häufig mit kleinen Gefässen verbunden sind, die in Richtung einer zentralen Narbe ausstrahlen und manchmal von einem kleinen Gerinnsel oder einer Fibrinablagerung bedeckt sind – die sogenannten Hunner-Läsionen (15) (Abb. 1). Die Narbe reisst mit zunehmender Blasendehnung und führt zu einem charakteristischen Bluten wie bei einem Wasserfall.
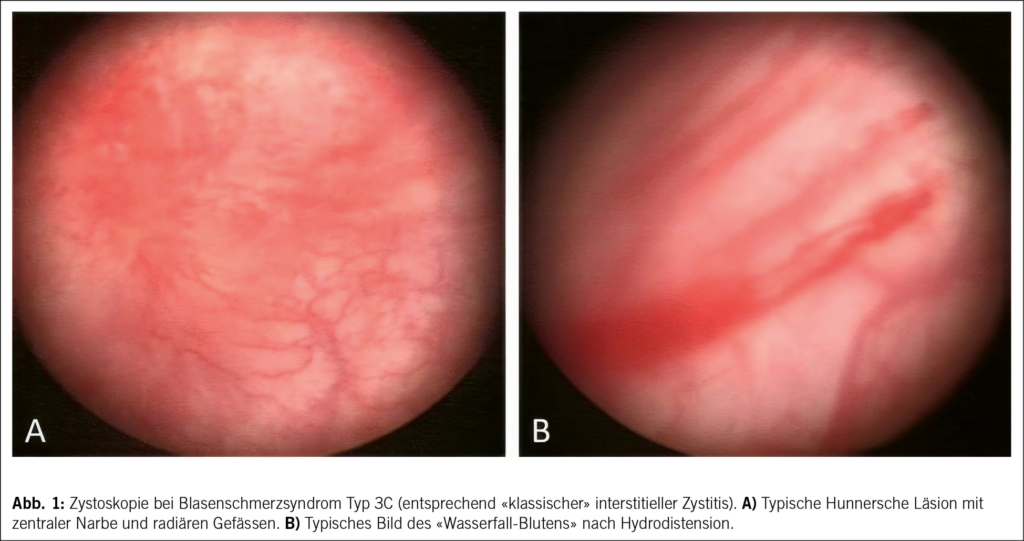
Im Kontrast dazu zeigt eine Nicht-Läsionskrankheit bei der initialen Zystoskopie eine normale Blasenschleimhaut. Die Entwicklung von Glomerulationen nach Hydrodistension wird als positives diagnostisches Zeichen angesehen. Zusätzliche Biopsien sind hilfreich bei der Sicherung der klinischen Diagnose sowie zur Unterscheidung der klassischen von den Nicht-Läsions-Krankheitstypen. Wichtige Differentialdiagnosen, die durch histologische Untersuchung ausgeschlossen werden sollen, sind Carcinoma in situ und tuberkulöse Blasenentzündung.
Therapie
Nebst den bei allen Beckenschmerztypen möglichen Therapieverfahren (Oral medikamentöse Therapien (Analgetika und Antidepressiva (Amitriptylin)), Physiotherapie und Verhaltensstrategien) spielen beim Blasenschmerzsyndrom auch Instillationen (z. B. Lokalanästhetika, Hyaluronsäure und Chondroitin-Sulphat, Heparin) eine Rolle. Die Hydrodistension der Blase mit Injektion von Botulinum Toxin Typ A kann gute Resultate beim chronischen Blasenschmerzsyndrom liefern (16). Als weiterer Eskalationsschritt steht die neuromodulative Therapie (siehe unten) zur Verfügung. Als Ultima Ratio kann die Zystektomie in ausgewählten Fällen in Betracht gezogen werden. Dieser Entscheid sollte jedoch, wenn immer möglich, nach Abwägungen sämtlicher Alternativen und im Rahmen eines multidisziplinären Boards gefällt werden.
Neuromodulation
Die Neuromodulation bei der Behandlung von Beckenschmerzen sollte von Spezialisten für Beckenschmerzmanagement in einem entsprechenden Zentrum angewendet werden. Diese Techniken werden als ergänzenden Teil eines umfassenderen Therapieplans verwendet und erfordern die kontinuierliche medizinische Anbindung. Es gibt verschiedene Möglichkeiten der Neuromodulation, welche folgend kurz erläutert werden.
Transkutane elektrische Nervenstimulation
Die transkutane elektrische Nervenstimulation (TENS) ist eine nicht-invasive Technik, die bei vielen Schmerzsyndromen eingesetzt wird. Die TENS stellt eine effektive, nicht-invasive Behandlungsoption für Patienten mit Beckenschmerzsyndrom dar, welche anhaltenden Nutzen bringen kann. Üblicherweise erfolgt die TENS-Instruktion tagesstationär, worauf ein Gerät zur Miete oder Kauf abgegeben wird und die Folgenutzung zu Hause geschieht.
Perkutane Tibialis-Nervenstimulation
Die perkutane Tibialis Nervenstimulation (PTNS) ist ebenfalls eine minimal-invasive Technik, die in einer ambulanten Umgebung durch entsprechend ausgebildete Therapeuten angewendet werden kann. Komplikationen sind selten und geringfügig und können zum Beispiel leichte Schmerzen an der Anwendungsstelle oder Hämatome beinhalten.
Sakrale Nervenstimulation
Die sakrale Nervenstimulation ist eine invasive Technik, die die Lokalanästhesie mit Sedierung oder Vollnarkose zur Implantation eines Geräts nach einer vorgängigen Teststimulation erfordert. Die meisten vorhandenen Studien zur sakralen Neuromodulation bei Beckenschmerzsyndrom berichteten über eine Verbesserung der Schmerzen. Diese Technik ist in ihrer Implantation und Anwendung komplex und sollte nur an entsprechenden Zentren angeboten werden. Da nicht alle Patienten einen Nutzen dieser Option haben, sollte vorgängig ausführlich die Notwendigkeit einer Teststimulationsphase besprochen werden und die Patienten aufgeklärt sein, dass, falls das Gerät bei ihnen keinen Nutzen bringt, dieses nach der Testphase wieder entfernt werden sollte.
Copyright Aerzteverlag medinfo AG
Klinik für Urologie
Kantonsspital St. Gallen
Rorschacher Strasse 95
9007 St. Gallen
Der Autor hat keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
- Chronische Beckenschmerzen und hier als Beispiel das Blasenschmerzsyndrom werden zunehmend als zentralnervöse Erkrankung verstanden, bei der initiale periphere Reize (z.B. Infektionen oder Traumata) eine Modulation des Zentralnervensystems auslösen, die sich unabhängig von der ursprünglichen Ursache fortsetzt.
- Traditionelle Bezeichnungen, die sich ausschließlich auf periphere Organe konzentrieren, können irreführend und therapeutisch schädlich sein. Die moderne Klassifikation unterscheidet zwischen spezifisch-krankheitsassoziierten Schmerzen und Beckenschmerzsyndromen ohne bekannte Ätiologie.
- Mechanismen des chronischen Schmerzes umfassen periphere Sensibilisierung, z.B. durch geänderte Rezeptoraktivitäten, sowie zentrale Sensibilisierung, insbesondere durch strukturelle und funktionelle Veränderungen im Zentralnervensystem.
- Die Behandlung von Beckenschmerzsyndromen erfordert einen multimodalen Ansatz, einschließlich medikamentöser Therapien, Physiotherapie und neuromodulativer Verfahren. Die Therapie sollte individuell angepasst und in spezialisierten Zentren durchgeführt werden.
1. Morschitzki H, Hartl T: Die Angst vor Krankheiten verstehen und über1. Engeler DS, Baranowski, A.P., Berghmans, B., Borovicka, J., Cottrell, A.M., Dinis-Oliveira, P., Elneil, S., Hughes, J., Messelink, E.J., de C Williams, A.C. EAU guidelines on chronic pelvic pain. Arnhem, The Netherlands: EAU Guidelines Office; 2020.
2. International classification of diseases 11th revision [Internet]. 2020. Available from: https://icd.who.int/en/.
3. Sun Y, Keay S, De Deyne PG, Chai TC. Augmented stretch activated adenosine triphosphate release from bladder uroepithelial cells in patients with interstitial cystitis. J Urol. 2001;166(5):1951-6.
4. Sculptoreanu A, Yoshimura N, de Groat WC. KW-7158 [(2S)-(+)-3,3,3-trifluoro-2-hydroxy-2-methyl-N-(5,5,10-trioxo-4,10-dihydrothieno[ 3,2-c][1]benzothiepin-9-yl)propanamide] enhances A-type K+ currents in neurons of the dorsal root ganglion of the adult rat. J Pharmacol Exp Ther. 2004;310(1):159-68.
5. McMahon SB, Jones NG. Plasticity of pain signaling: role of neurotrophic factors exemplified by acid-induced pain. J Neurobiol. 2004;61(1):72-87.
6. Fulbright RK, Troche CJ, Skudlarski P, Gore JC, Wexler BE. Functional MR imaging of regional brain activation associated with the affective experience of pain. AJR Am J Roentgenol. 2001;177(5):1205-10.
7. Bade JJ, Rijcken B, Mensink HJ. Interstitial cystitis in The Netherlands: prevalence, diagnostic criteria and therapeutic preferences. J Urol. 1995;154(6):2035-7; discussion 7-8.
8. Curhan GC, Speizer FE, Hunter DJ, Curhan SG, Stampfer MJ. Epidemiology of interstitial cystitis: a population based study. J Urol. 1999;161(2):549-52.
9. Parsons CL, Tatsis V. Prevalence of interstitial cystitis in young women. Urology. 2004;64(5):866-70.
10. Mattox TF. Interstitial cystitis in adolescents and children: a review. J Pediatr Adolesc Gynecol. 2004;17(1):7-11.
11. Johansson SL, Fall M. Clinical features and spectrum of light microscopic changes in interstitial cystitis. J Urol. 1990;143(6):1118-24.
12. Lokeshwar VB, Selzer MG, Cerwinka WH, Gomez MF, Kester RR, Bejany DE, et al. Urinary uronate and sulfated glycosaminoglycan levels: markers for interstitial cystitis severity. J Urol. 2005;174(1):344-9.
13. Parsons CL, Lilly JD, Stein P. Epithelial dysfunction in nonbacterial cystitis (interstitial cystitis). J Urol. 1991;145(4):732-5.
14. van de Merwe JP, Nordling J, Bouchelouche P, Bouchelouche K, Cervigni M, Daha LK, et al. Diagnostic criteria, classification, and nomenclature for painful bladder syndrome/interstitial cystitis: an ESSIC proposal. Eur Urol. 2008;53(1):60-7.
15. Fall M, Johansson SL, Aldenborg F. Chronic interstitial cystitis: a heterogeneous syndrome. J Urol. 1987;137(1):35-8.
16. Parsons BA, Goonewardene S, Dabestani S, Pacheco-Figueiredo L, Yuan Y, Zumstein V, et al. The Benefits and Harms of Botulinum Toxin-A in the Treatment of Chronic Pelvic Pain Syndromes: A Systematic Review by the European Association of Urology Chronic Pelvic Pain Panel. Eur Urol Focus. 2021.
der informierte @rzt
- Vol. 14
- Ausgabe 10
- Oktober 2024








