- COPD 2023
Die COPD gilt als Volkserkrankung. Die globale Prävalenz der COPD liegt bei 10,3% mit steigender Tendenz aufgrund der steigenden Anzahl rauchender Menschen in low and middle-income-countries (LMICs) und der zunehmenden Alterung in high income countries. Wie schon in den Vorjahren gab es 2023 von der Global Initiative for Chronic Obstructive Lung Disease (GOLD) ein Update zur erstmalig 2001 publizierten Empfehlung bezüglich Diagnose, Management und Prävention der COPD mit einigen essentiellen Neuerungen. (1)
COPD is considered a widespread disease and the global prevalence of COPD is 10.3% with an upward trend due to the increasing number of smokers in low and middle-income countries (LMICs) and the ageing population in high-income countries. As in previous years, in 2023 the Global Initiative for Chronic Obstructive Lung Disease (GOLD) issued an update to the recommendation first published in 2001 recommendation regarding the diagnosis, management and prevention of COPD with some essential innovations (1).
Key Words: COPD, Global Initiative for Chronic Obstructive Lung Disease (GOLD), prevention of COPD
Unter anderem wird die Definition der Erkrankung COPD angepasst, die berücksichtigt, dass neben dem Tabakrauch als Hauptursache der Erkrankung andere weitere pathogenetische Mechanismen zur klinischen Präsentation der COPD als sehr heterogene Erkrankung beitragen. Die angepasste Taxonomie umfasst folgende sogenannte Etiotypen der COPD:
► COPD-G (genetic): genetisch determinierte COPD, z.B. AA1AT Mangel
► COPD-D (developement): durch abnorme Lungenentwicklung verursacht, z.B. Frühgeburtlichkeit
► COPD-C (cigarette): durch Exposition zu Tabakrauch (Zigaretten, Passivrauchexposition, Vaping/E-Zigarette) verursacht
► COPD-P (pollution): durch Exposition gegenüber (Luft-) Schadstoffen verursacht
► COPD-I (infections): durch schwere/wiederholte (frühkindliche) Infekte verursacht
► COPD-A (asthma): in Verbindung mit Asthma in Kindheit stehend
► COPD-U (unknown): unbekannte Urache
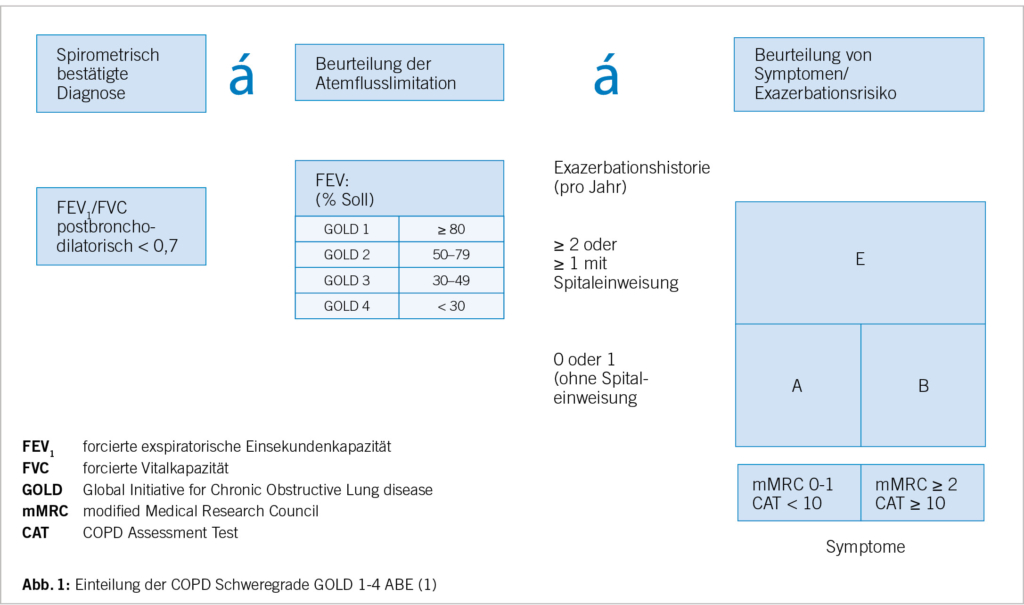
Die Diagnose der COPD sollte aufgrund der Anamnese, klinischen Symptomen, körperlicher Untersuchung und zudem spirometrischer Untersuchung gestellt werden. Bei der Spirometrie gilt weiterhin eine postbronchodilatatorische FEV1/FVC Ratio (Tiffeaneauwert) unter 70 % als Hinweis für eine obstruktive Ventilationsstörung. Es ist aber zu beachten, dass die Verwendung eines fixen FEV1/FVC Verhältnisses (kleiner 70%) zur Definition einer Obstruktion bei älteren Menschen zu einer Überdiagnose und bei jungen Erwachsenen zu einer Unterdiagnose einer obstruktiven Atemwegserkrankung bzw. der COPD führen kann, insbesondere bei leichten Erkrankungen (2).
Favorisiert wird daher die Verwendung eines Grenzwertes, der auf der unteren Grenze der Normalwerte für FEV1/FVC basiert (LLN: lower limit of normal). Darüber hinaus ist zu beachten, dass ein erniedrigter FEV1 Wert (FEV1 kleiner 80% des Referenzwertes nach Bronchodilatation) bei gleichzeitig noch normalem Tiffeaneauwert über 70 % mit respiratorischen Beschwerden verbunden ein Vorbote einer COPD sein kann (PRISm: Preserved ratio impaired spirometry). Diese Patientengruppe weist auch eine höhere Wahrscheinlichkeit für Komorbiditäten insbesondere kardiovaskuläre Erkrankungen und eine höhere
Mortalität jedweder Ursache auf (3). Die Einteilung der COPD-Patienten in die Schweregrade GOLD 1-4 erfolgt weiterhin bei eingeschränktem Tiffenauwert unter 0,7 bzw. 70 % nach bronchialem Dilatationstest abhängig von der Einschränkung der absoluten Einsekundenkapazität (GOLD 1: kleiner 80 % vom FEV1 Sollvolumen bis GOLD 4: kleiner 30 % vom FEV1 Sollvolumen).
Erwähnt werden sollte auch, dass eine nicht vollständige Reversibilität der Obstruktion im Bronchospasmolysetest (Spirometrie vor und 10 -15 min nach Gabe eines kurzwirksamen Betamimetikums mit positivem Befund bei Besserung der FEV1 um mehr als 200 ml und 10 % gegenüber Ausgangswert) auch bei Asthma und anderen Erkrankungen vorkommen kann. Zudem wird bei diagnostischen Unklarheiten die erweiterte lungenfunktionelle Diagnostik (hier v.a. Bodyplethysmographie und die Messung der Diffusionskapazität) und auch bildgebende Untersuchungen ((Herz-)ultraschall, Computertomographie, Pulsoxymetrie (auch bei Belastung, z.B. Sechsminutengehtest)) empfohlen. Gerade das CT Thorax sollte bei Patienten mit rezidivierenden Exacerbationen (u.a. Frage nach Bronchiektasien) bei einem FEV1 Wert unter 45% (u.a. Frage nach Hyperinflation/Emphysem), bei Symptomen die nicht im Verhältnis zum Schweregrad der Lungenfunktionseinschränkung bestehen (u.a. Frage nach Lungenfibrose) und bei Patienten, die die Kriterien für eine Lungenkrebsfrüherkennung erfüllen, erfolgen (4).
Betont wird von GOLD weiterhin die Bedeutung von Komorbiditäten wie v.a. kardiovaskulären Erkrankungen, Lungenkrebs, Osteoporose, gastrooesophagealer Reflux, Diabetes mellitus, Depression und Angststörungen sowie Sarkopenie, welche einen signifikanten Einfluss auf den Verlauf der COPD-Erkrankung und die Prognose haben. Dabei wird neben dem Rauchen auch eine chronische Inflammation im gesamten Organismus als Ursache für die Komorbiditäten vermutet (5).
Aufgrund der grossen Bedeutung von Exacerbationen für den Verlauf und die Prognose der COPD-Erkrankung werden die Schweregrade C und D neu zum Schweregrad E zusammengelegt, der, unabhängig von der Symptomschwere, durch mindestens zwei moderate Exazerbationen, beziehungsweise eine Exacerbation, die aber zur Hospitalisierung führt, charakterisiert ist (Abbildung 1).
Die Symptomatik sollte mittels CAT (COPD-Assessment-Test) oder mMRC (modified Medical Research Council)-Grades ermittelt werden und bestimmt die Einteilung in Gruppe A (wenig Symptome) oder B (starke Symptome), wenn nicht mehr als eine moderate Exacerbation (ohne Hospitalisierung) im Jahr stattgefunden hat (6, 7).
Ein wichtiger neuer Aspekt ist auch die angepasste Definition einer Exacerbation. Diese ist durch zunehmende Atemnot und/oder Husten mit Sputum innerhalb von weniger als 14 Tagen gekennzeichnet. Dies kann mit Tachypnoe und/oder Tachykardie einhergehen und ist oft mit gesteigerter lokaler und systemischer Inflammation verbunden, welche durch Atemwegsinfektionen, Luftverschmutzung oder andere Irritationen der Atemwege verursacht wird (8).
Wichtige Differentialdiagnosen bei einer COPD-Exacerbation sind Lungenembolie, kardiale Dekompensation, Myocardinfarkt, Pneumonie und Pneumothorax (9). Die Langzeitprognose einer COPD- Exazerbation mit Krankenhausaufenthalt ist mit Sterblichkeitsrate von ca. 50 % nach 3,6 Jahren schlecht. Zu den prognostischen Faktoren, die unabhängig voneinander mit einem schlechten Verlauf verbunden sind, gehören höheres Alter, niedrigerer BMI, Komorbiditäten (z. B. Herz-Kreislauf-Erkrankungen oder Lungenkrebs), frühere Krankenhausaufenthalte wegen COPD-Exazerbationen, klinischer Schweregrad der Exacerbation und Notwendigkeit einer langfristigen Sauerstofftherapie bei der Entlassung.
Auch wenn bis 80 % aller Exacerbationen ambulant behandelt werden können (medikamentös mit Bronchodilatoren, Steroidstosstherapie mit 40 mg Prednison für 5 Tage und Antibiotika bei Patienten mit den drei Kardinalsymptomen vermehrte Dyspnoe, vermehrte Sputummenge und Sputumpurulenz) (10, 11) schlägt GOLD folgende Indikationen für eine Spitaleinweisung bei Exacerbation vor:
► schwere Symptome wie akute Dyspnoezunahme in Ruhe, hohe Atemfrequenz, schlechte Sauerstoffsättigung, neu Verwirrtheit
► akute respiratorische Insuffizienz
► Neuauftreten von körperlichen Zeichen wie Zyanose oder peripheren Ödemen
► fehlendes Ansprechen auf die initiale medikamentöse Therapie der Exacerbation
► schwere Komorbiditäten wie Herzinsuffizienz oder neu aufgetretene Herzrhythmusstörungen
► insuffiziente häusliche Versorgung
Die meisten COPD-Patienten leiden noch mehrere Wochen lang an den Folgen der Exacerbation und kommen oft nie auf ihren ehemaligen klinischen Stand zurück. Eine frühzeitige klinische Nachkontrolle sollte innerhalb eines Monats nach der Entlassung erfolgen und führt zu weniger Rückfällen bzw. Re-Exacerbationen (1).
Die Therapie der stabilen COPD basiert auf der Symptomatik und Exacerbationshistorie mit Einteilung in die Risikogruppen A, B und E und gliedert sich in zwei Teile, einerseits die initiale Therapieempfehlung und andererseits die Follow-Up-Behandlung.
Die Basistherapie der COPD besteht grundsätzlich aus Bronchodilatoren, in Gruppe A empfiehlt GOLD einen kurz- oder langwirksamen Bronchodilatator mit Präferenz für ein langwirksames Präparat, hierbei mit gewisser Bevorzugung langwirksamer Anticholinergika. In den Gruppen B und E ist die duale Bronchodilatation (Kombination aus LABA (long acting beta agonists) und LAMA (long acting muscarinic agonists) die Therapie der Wahl. Die Kombination aus LABA und ICS (inhaled corticosteroid) wird bei der COPD-Therapie grundsätzlich nicht mehr empfohlen. Falls ICS indiziert sind (siehe Graphik ICS Therapie Kriterien) sollte eine Dreifachkombination aus LABA, LAMA und ICS erfolgen. Als Kriterium für ICS als zusätzliche Therapie in Gruppe E sollte die Zahl der eosinophilen Zellen im Differentialblutbild (grösser als 300 Eosinophile/µl) und die Exacerbationshistorie herangezogen werden. Eine Langzeitgabe von oralen/systemischen Steroiden ist kontraindiziert.
Bei der Followup Situation ist entscheidend, ob die Patienten mehr unter Symptomen leiden oder aber eher bei dem Patienten unter Therapie zwischenzeitlich Exacerbationen aufgetreten sind. Bei einer bereits laufenden Therapie mit LABA/LAMA Kombination wird dann eine Eskalation mit ICS empfohlen (LABA/LAMA/ICS Kombination = Tripletherapie), falls die Eosinophilenzahl im peripheren Blutbild bei mehr als 100 Zellen/µl liegt. Hier ist aber zu beachten, dass eine ggf. zum Zeitpunkt der Blutbildbestimmung durchgeführte systemische Steroidtherapie eine ansonsten vorliegende Eosinophilenzahl von über 100/µl verschleiern kann.
Im Vergleich zu einer LAMA/LABA Kombinationstherapie kann die Behandlung mit einer Tripletherapie bei symptomatischen Patienten, bei denen es unter Therapie zu Exacerbationen kommt, einen signifikanten Überlebensvorteil bringen (12).
Fixkombinierte Wirkstoffe (sog. fixe Triple-Therapie) bieten hinsichtlich des grösstmöglichen Nutzens und der Therapieadhärenz einen Vorteil. Grundsätzlich empfiehlt GOLD vor/bei jeder Therapieänderung eine Bewertung, Überprüfung und Berücksichtigung der Symptomatik und Exacerbationshistorie aber auch der Inhalationstechnik und Therapietreue sowie von nichtpharmakologischen Massnahmen wie Rauchentwöhnung oder auch ambulante/stationäre Rehabilitationsmassnahmen mit dem Ziel der Steigerung der körperlichen Aktivität.
Darüber hinaus wird allen COPD-Patienten die Influenza-, SARS- Cov-2-, Pneumokokken-, Pertussis- und Herpes Zoster-Impfung empfohlen.
Last but not least ist für die optimale Betreuung unserer COPD-Patienten die bestmögliche Kooperation von Hausärzten, Fachärzten, Physiotherapeuten, Ernährungsspezialisten, Rehabilitationsmedizinern und im Endstadium auch Palliativmedizinern essentiell und unabdingbar.
Copyright bei Aerzteverlag medinfo AG
LungenZentrum Hirslanden
Witellikerstrasse 40
8032 Zürich
a.piecyk@lungenzentrum.ch
Interessenskonflikt: Der Autor hat keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
1. The G lobal Initiative for Chronic Obstructive Lung Disease, 2023 GOLD REPOR
2. Guder C. et al.: Gold or lower limit of normal definition? A comparison with expert based diagnosis of chronic obstructive pulmonary disease in a porspective cohort study. Respir Res 2012 Feb 6;13(1):1
3. Stolz D. et. al.: Towards the elimination of chronic obstructive pulmonary disease: a Lancet Commission. Lancet 2022 Sep 17;400(10356):921-972.
4. Galban C et. al.: Computed tomography-based biomarker provides unique signature for diagnosis of COPD phenotypes and disease progression. Nat Med 2012 Nov;18(11):1711-5.
5. Fabbri L. M. et. al.: Complex chronic comorbidities of COPD. Eur Respir J 2008 Jan;31(1):204-12.
6. Fletcher CM: Standardised questionnaire on respiratory symptom: a statement prepared and approved by the MRC Committee on the Aetiology of Chronic Bronchitis (MRC breathlessness score). BMJ 196: 2: 1662.
7. Jones P.W. et al.: Development and first validation of the COPD Assessment Test. Eur Respir J 2009 Sep;34(3):648-54.
8. Celli R.B. et. al.: An Updated Definition and Severity Classification of Chronic Obstructive Pulmonary Disease Exacerbations: The Rome Proposal. Am J Respir Crit Care Med 2021 Dec 1;204(11):1251-1258.
9. Beghè B. et al.: Exacerbation of respiratory symptoms in COPD patients may not be exacerbations of COPD. Eur Respir J 2013 Apr;41(4):993-5.
10. Leuppi J.D. et. al.: Short-term vs Conventional Glucocorticoid Therapy in Acute Exacerbations of Chronic Obstructive Pulmonary DiseaseThe REDUCE Randomized Clinical Trial. JAMA. 2013;309(21):2223-2231.
11. Miravittles M. et. al.: Sputum colour and bacteria in chronic bronchitis exacerbations: a pooled analysis. Eur Respir J 2012 Jun;39(6):1354-60.
12. Martinez FJ, et al.: Reduced All-Cause Mortality in the ETHOS Trial of Budesonide/Glycopyrrolate/Formoterol for Chronic Obstructive Pulmonary Disease. A Randomized, Double-Blind, Multicenter, Parallel-Group Study. Am J Respir Crit Care Med 2021;203:553–564
der informierte @rzt
- Vol. 14
- Ausgabe 1
- Januar 2024