- Das kardiovaskuläre-renale-metabolische Syndrom (CKM)
Herz-Kreislauf-Erkrankungen sind weltweit die häufigste Todesursache. Unter den kardiovaskulären (cv) Risikofaktoren nimmt Diabetes mellitus Typ II (T2DM) aufgrund der steigenden Prävalenz eine besondere Stellung ein. Koronare Herzkrankheit (KHK), Herzinsuffizienz (HI) und chronische Niereninsuffizienz (CKD) sind deutlich erhöht. Der Begriff CKM bezeichnet ein komplexes Gesundheitsproblem, das auf den Wechselwirkungen zwischen Herzerkrankungen, Nierenerkrankungen, Diabetes und Adipositas beruht. Das Syndrom erhöht das Risiko für die Entwicklung und das Fortschreiten von Herz-Kreislauf-Erkrankungen und betrifft sowohl Risikopersonen als auch Personen mit bestehenden cv-Erkrankungen. Das Stadium zum Zeitpunkt der Diagnose kann Aufschluss über den Schweregrad der Erkrankung geben.
Cardiovascular disease (CVD) is the leading cause of death worldwide. Among the cardiovascular (CV) risk factors, diabetes mellitus type II (T2DM) occupies a special position due to its increasing prevalence. Coronary heart disease (CHD), heart failure (HF) and chronic kidney disease (CKD) are significantly increased. The term CKM describes a complex health problem resulting from the interaction between heart disease, kidney disease, diabetes and obesity. The syndrome increases the risk of developing and progressing cardiovascular disease and affects both those at risk and those with existing cardiovascular disease. The stage of the disease at the time of diagnosis may indicate the severity of the disease.
Key words: heart disease, kidney disease, diabetes and obesity, CKM-syndrome
Fallbeschreibung
Wir möchten einen 63-jährigen Hochrisiko-Patienten mit einer neuen moderaten Anstrengungsdyspnoe vorstellen. Er hat seit ca. 8 Jahren einen T2DM und eine CKD: G3aA3; Erstdiagnose vor 2 Jahren. Seit kurzem eine HI mit einer LV-EF von 53 % (HFpEF). Negative FA bez. koronarer Herzkrankheit, kein Nikotin. Die Details zum Fall vermittelt Abb. 1. Der Fall aus der Praxis soll auch die aktuellen Leitlinien zu den vorhandenen Krankheiten beleuchten. Der Patient hat mit drei kardiovaskulären Risikofaktoren und der Anstrengungsdyspnoe, nach den neuen ESC-Guidelines 2024 des CCS, ein moderates Risiko von 17 % für eine obstruktive KHK (1). In einer Koronar-CT-Untersuchung fand sich eine koronare diffuse 3-Gefässerkrankung mit zwei 50–60 % Stenosen am mittleren RIVA und an der proximalen CX. In einer Stressechokardiographie wurde eine koronare Ischämie ausgeschlossen. Die augenärztliche Kontrolle ergab eine leichte diabetische Retinopathie. Somit besteht wahrscheinlich eine diabetische Nephropathie. Der ABI betrug bei guten Fusspulsen bds 1.0 Die Transaminasen waren normal. Im erweiterten Echo nicht dilatierte, sklerosierte Aorta abdominalis, keine Lebersteatose, Nieren bds morphologisch normal.
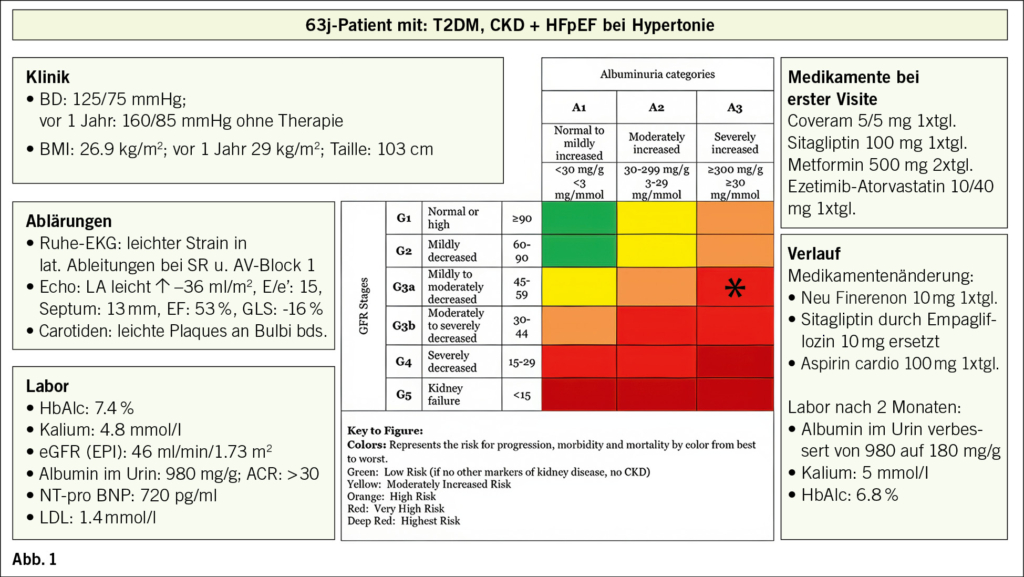
Kommentar
Das BD-Ziel von 120–129 mmHg systolisch haben wir mit obiger dualer Fixkombinatio (ACE-H./ Kalziumantagonist) erreicht. Dies ergibt eine bessere Progressionshemmung bei proteinurischen Nieren und eine geringere Mortalität (2). Die Triglyceride sind trotz des T2DM bei unserem Patienten normal, das Non-HDL ist <2,2mmol/l, das LDL misst unter obiger Kombinationstherapie 1,4mmol/l.
Bei Hypertonikern, kardiovaskulären- und diabetischen Patienten ist der regelmässige Ausschluss einer CKD mit einer eGFR (EPI) von <60ml/min/1.73m2 und/oder einer Mikro-/Albuminurie mit Hilfe der Urin-Albumin-Kreatinin-Ratio (UACR) im Spontanurin (A2-A3 >30mg/g Kreatinin) über >3 Monate entscheidend. In der Praxis wird ein Screening bei Risikopatienten viel zu selten durchgeführt. Eine CKD erhöht das cv Risiko resp. die cv Events und die Mortalität. Die UACR ist ein unabhängiger Prädiktor der cv Mortalität über das gesamte Spektrum der Nierenfunktion, dies unabhängig von anderen cv Risikofaktoren. Eine UACR ≥10mg/g ist mit einer erhöhten cv Mortalität assoziiert (30mg/g= HR 1,77), bei der eGFR ist dies <60ml/min/1.73m2 der Fall (2).
Das Risiko für eine HI bei einem T2DM, auch nach Kontrolle aller RF, beträgt nach verschiedenen Studien 25–45 %; davon haben ¾ eine HFpEF. Vier von 10 Patienten mit einem T2DM und vier von 10 mit einer HI haben eine CKD. 20 % aller Hypertoniker, 50 % aller T2DM-Patienten und 40 % aller Patienten mit einer kardiovaskulären Vorerkrankung haben eine Albuminurie. 80 % aller Diabetiker erleiden im Laufe ihres Lebens ein kardiovaskuläres Ereignis oder eine CKD (2,3). Da bei unserem Patienten eine Endorganschädigung vorliegt, ist er ein Hochrisiko-Patient. Er hat auf Grund der eingeschränkten eGFR und der Albuminurie eine 5x erhöhte 10-Jahres-Mortalität und nach den KDIGO 2024 Risikokalkulationen ein Risiko von 16,5 % in 5 Jahren ein terminales Nierenversagen zu erleiden – ckdpcrisk.org/kidneyfailurerisk (4, 5).
Wir haben neben den Lebensstilinterventionen mit einem regelmässigen körperlichen Training, einer gesunden Ernährung, einem Gewichtsmanagement und der Reduktion der kardiovaskulären Risikofaktoren drei neue wirksame medikamentöse Therapieoptionen, welche das kardiovaskuläre und renale Risiko deutlich senken. Zusätzlich kommt es zu einer Progressionshemmung der CKD. So wurde u.a. auch aufgrund der «ESC-Guidelines 2023: Diabetes und Herz», am ERA-Kongress 2024 anlässlich der Präsentation der FLOW-Studie, eine 6-Säulen-Therapie vorgestellt (5,6):
Die bisherigen 3 Säulen bestehen aus einem ACE-Hemmer/ARB, einem Statin/±Ezetimib und Metformin. RAAS-H. sind seit Jahren der Hauptpfeiler der Therapie, um das kardiovaskuläre und renale Outcome zu verbessern (2).
ACE-H./ARB: bei Diabetes; Hypertonie (>130/80mmHg); CKD mit Albuminurie >30mg/g (A2); BD-Selbstkontrolle, 24h-BD; cave: maskierte Hypertonie; wenn möglich max. zugelassene Dosis. Bei Hypertonie Fixkombinationen mit CCB/Diuretika, BD <130/80 mmHg bei Proteinurie; i.R. MRA.
Ein klarer cv Benefit ist bei den Statinen nachgewiesen. Metformin hat nach einer Metaanalyse von 40 Studien bei einem T2DM und einer koronaren Herzkrankheit günstige Auswirkungen mit einer Mortalitätssenkung von 33 % und eine Verminderung der cv Ereignisse um 17 % (7). Es gibt aber keine grossen Endpunktstudien.
Die neuen 3 Säulen sind: ein SGLT2-H., ein nicht steroidaler Mineralokortikoid-Rezeptor-Antagonist (ns-MRA) und ein GLP-1 RA (5,6). Das Ziel ist eine kardio-renale Protektion: Verringerung der kardiovaskulären Endorganschäden, der Mortalität und eine Verlangsamung der CKD-Progression.
Daher wurde die bisherige Therapie in unserem Fall auf Grund des T2DM, der HI und der eGFR von 46ml/min/1.73m2 und der Albuminurie neu angepasst: Anstelle eines DPP-4 Hemmers wurde dieser durch einen SGLT2-H. ersetzt.
Ein SGLT2-Hemmer wird als Antidiabetikum in den verschiedenen internationalen Guidelines, auf Grund seiner kardio- und renoprotektiven Wirkungen, bei obigen Erkrankungen primär eingesetzt (5,6,8). SGLT2-H. bei T2DM ± Atherosklerose; HI; CKD eGFR ≥20ml/min/1.73m2; Fortsetzung SGLT2-H. bis zur Dialyse; evtl. mit Metformin sofern eGFR ≥30ml/min/1.73m2 (Dosisanpassung).
Beispielsweise konnte in der DAPA-CKD Studie der renale Endpunkt innert 2,4 Jahren um 39 % gesenkt werden bei einer NNT von 19 (9). In der EMPA-Kidney Studie bei diabetischer (31 %) und nicht diabetischer CKD wurde der renale Endpunkt (Abfall eGFR, end stage renal disease, renaler od. cv Tod) um 28 % über 2 Jahre gesenkt, bei einer NNT von 28 (10). Je nach Ausgangs-eGFR kann eine Nierenersatztherapie mit einem SGLT2-H. um viele Jahre verzögert werden. So z.B. bei einer eGFR von 85ml/min/1.73m2 um 26.6 Jahre, bei einer eGFR von 20ml/min/1.73m2 um 5.4 Jahre (11). Nach den KDIGO Leitlinien 2024 wird bei einer CKD ein SGLT2-H. eingesetzt bei einer ACR ≥200mg/g und oder einer eGFR <45ml/min./1.73m2 (5). Auch bei nicht albuminurischen Patienten haben diese nach einer gepoolten Analyse von DECLARE-TIMI 58 und DAPA-CKD eine positive Wirkung (HR 0,54); je höher die Proteinurie, desto grösser ist der Benefit. Es kommt zu einer Halbierung des GFR-Verlustes (12). Patienten mit einem initialen GFR-Dip haben den grössten Benefit. In den ESC-Guidelines 2023 (6) wird der SGLT2-H. bereits bei einer eGFR <60ml/min/1.73m2 eingesetzt. Eine CKD ohne Albuminurie findet man vor allem bei einer HI. Bei einer HI wird ein SGLT2-H. unabhängig von der LVEF und dem HbA1c als Klasse IA-Indikation gewertet (6,13).
Finerenon, ein nicht steroidaler Mineralokortikoid-Receptor Agonist, hat heute einen sicheren Stellenwert bei einem T2DM mit CKD und einer persistierenden Albuminurie ≥300mg/g bei eGFR: >60 (A3) oder >30mg/g bei eGFR: 25–60 ml/min/1.73m2 (A2) trotz RAAS-H., eGFR: ≥25ml/min/1.73m2. Das Serumkalium darf bei Therapiebeginn nicht ≥4,8 mmol/l betragen; engmaschige Kontrollen sind wichtig. Stopp bei ≥5,5mmol/l. Die zusätzliche Gabe eines SGLT2-H. wirkt hier günstig.
Finerenon verhindert eine profibrotische und proinflammatorische Genexpression und zusätzlich Verminderung des oxidativen Stresses und Reduktion einer Vasokonstriktion. Klinisch kommt es zu einer Abnahme einer CKD-Progression, einer Abnahme einer Proteinurie, einer BD-Senkung und einem verbesserten cv Outcome.
Die Studien FIDELIO-DKD und FIGARO-DKD zeigen eine Risikoreduktion bezüglich CKD-Progression bei weniger kardiovaskulären Events (14, 15). In der FIDELITY-Studie, welche diese beiden zusammenfasst, wurde über 4 Jahre der renale Endpunkt um 23 %, das Risiko der cv Morbidität (HI-Hospitalisationen) und cv Mortalität um 14 % gesenkt (16). Es kommt zu einer Reduktion der Niereninsuffizienz, dies vor allem durch einen signifikanten Abfall der Albuminurie. Bei beiden war die Wirksamkeit über ein breites eGFR-Spektrum nachweisbar. Dabei war die Sicherheit gewährleistet, auch bei Personen mit einer tiefen eGFR. Finerenon ist zugelassen bei einer eGFR: >25ml/min/1.73.m2. Eine Hyperkaliamie wurde in der FIDELITY Studie in 1.7 % nachgewiesen.
Die aktuelle FINEARTS-HF Studie bei einer HI (HFmrEF, HFpEF) mit einer LVEF ≥40 % zeigte mit und ohne T2DM bei 6016 symptomatischen, hovhrisiko und gut behandelten älteren Patienten, teils mit CKM, mit Finerenon bis 40mg/p.d. positive kardiale Resultate mit einer Reduktion des primär zusammengesetzten Ergebnisses, cv Tod und Gesamtverschlechterung der HI, um 16 % bei diesen kardio-renalen-metabolischen Patienten. Dies unabhängig vom HbA1c (17). Dies ist als klinisch hochrelevant einzuschätzen, da es bisher neben der Gabe von SGLT2-Inhibitoren keine prognoseverbessernde Medikation für Betroffene mit einer HFpEF und einer evtl. CKD gibt. Interessant ist, dass auch bei mit SGLT2-Inhibitoren vorbehandelten Studienteilnehmenden eine ähnliche Risikoreduktion zu beobachten war wie bei den nicht vorbehandelten Patienten.
Das ereignisfreie Überleben konnte um 3.1 Jahre verlängert werden – je jünger ein Patient, desto besser (18). Nach einer HI-Verschlechterung sollte die Substanz möglichst rasch verordnet werden. Auch war der Gesundheitszustand deutlich besser. Gleichzeitig zeigte eine Subanalyse eine signifikante Reduktion eines neuen T2DM von 25 %, in Kombination (bei 14 %) mit einem SGLT2-H. um 27 % (19). Im Gegensatz zu den bisherigen MRAs hat die Substanz eine höhere Wirkkonzentration an Niere und Herz.
In der FINE-HEART Analyse wurden die 3 genannten Finerenon Studien gepoolt mit 18 991 Patienten (mittleres Alter 67 ±10 Jahre, 35 % Frauen). Es zeigte sich eine deutliche Senkung der Nierenendpunkte (HR 0.80) und der HI-Hospitalisation (HR 0.83). Der cv Tod wurde nicht signifikant gesenkt (20). Aktuell läuft bezüglich UACR-Verbesserung auch eine Studie bei Typ1-Diabetes (FINE-One).
GLP1-RA reduzieren die arteriosklerotischen Endpunkte und das Gewicht. Indikation: bei T2DM ± Atherosklerose, CKD bei zu hohen Bz-Werten, trotz SGLT2-H./Metformin (eGFR ≥ 30 ml/min/1.73m2);
GLP-1 RA eGFR >15ml/min/1.73m2, evtl. weitere Bz senkende Medikamente. Gewichtsreduktion bis 15 %, zusätzliche Senkung des cv Risikos und Senkung einer Albuminurie durch GLP-1 RA. Je höher das atherosklerotische Risiko und je adipöser ein Pa-tient, desto eher Gabe eines GLP1-RA (6).
Die im Sommer 2024 publizierte Flow Studie zeigte, dass Sema-glutid 1.0mg sc./Woche bei einer diabetischen CKD bei 3160 Pa-tienten mit einem RAAS-Hemmer den renalen Endpunkt hochsignifikant um 24 % gesenkt hat mit einer NNT von 20 in 3 Jahren (21). In einer am ERA-Kongress am 24.5.2024 vorgestellten Metaanalyse von 8 Studien inkl. FLOW mit GLP1-RA bei T2DM und CKD wurde bez. Nierenendpunkt eine Risikoreduktion von 18 % nachgewiesen.
Bei Herzkreislauferkrankungen mit Übergewicht resp. Adipositas ohne einen T2DM konnte mit Semaglutid 2,4mg sc./Woche die kardiovaskuläre Mortalität, die nichttödliche Myokardinfarkt- und die Schlaganfallrate gesenkt werden – (HR 0.80) (22). Der mittlere Gewichtsverlust betrug über 33 Monate 9.4 %. Bei einer HFpEF mit Adipositas ohne und mit T2DM zeigen sich unter Semaglutid 2.4 mg sc./Woche ebenfalls positive Resultate mit Verringerung der HI-Symptome und der körperlichen Einschränkung und Verbesserung der Bewegungsfunktion bei deutlichem Gewichtsverlust von im Mittel 13.3 % ohne T2DM resp. 9.8 % mit T2DM. Durch die Reduktion des Fettanteils kommt es u.a. zu einer Verbesserung der Entzündung (CRP-Abfall 42 resp. 43.5 %), des prothrombotischen und metabolischen Milieus. Auch die Hämodynamik wird günstig beeinflusst. GI-NW traten in 9.5 % auf (23,24).
Es gibt auch einen additiven Effekt bei der Kombination SGLT2- H. und GLP1-RA. In einer Kohortenstudie war die Kombination aus GLP1-Rezeptor-Agonist/SGLT-2-Inhibitor im Vergleich zu beiden Arzneimittelklassen allein mit einem geringeren Risiko für schwerwiegende kardiovaskuläre Ereignisse und schwerwiegende renale Ereignisse verbunden (25). Bei Patienten mit T2DM und zumindest mässig erhöhter Albuminurie hat eine Kombinationsbehandlung von SGLT2i, GLP-1 RA und ns-MRA das Potenzial relevante Verbesserungen beim kardio-vaskulären und renalen ereignisfreien Überleben und beim Gesamtüberleben zu erzielen: Mace Reduktion für schwere cv Ereignisse (HR 0.65), HI-Hospitalisationen (HR 0.45), Verlangsamung Fortschreiten CKD (HR 0.42) (26). Die besprochenen neuen Medikamente wirken positiv auf den Metabolismus, den Entzündungszustand, den oxidativen Stress, die Insulinresistenz und die vaskuläre Dysfunktion (27, 28). In Zukunft werden noch mehrere weitere Substanzen (u.a. Tirzepatid ein dualer Agonist an GIP- und GLP-1-Rezeptoren) oder Alternativen dazu kommen. Die soeben publizierte SUMMIT-Studie ergab, dass Tirzepatid das Risiko des primären Endpunkts – einer Kombination aus Tod durch kardiovaskuläre Ursachen oder einer sich verschlimmernden HI – im Vergleich zu Placebo um 38 % reduzierte. Der Effekt wurde durch eine Verringerung der Verschlechterung der HI (HR 0,54) angetrieben, die als solche definiert wurde, die einen Krankenhausaufenthalt oder eine dringende intravenöse medikamentöse Therapie erfordern. Tirzepatid hatte auch signifikante Auswirkungen auf den Gesundheitszustand, die Belastungstoleranz und auf systemische Entzündungen. Diese hoch aktuelle Studie zeigt den kardiovaskulären Nutzen von Tirzepatid bei Patienten mit HFpEF und Adipositas (29).
Durch diese drei neuen Substanzen (ein SGLT2-H., ein ns-MRA und ein GLP-1 RA) kann beim kardio-renalen-metabolischen Syndrom eine hocheffektive, evidenzbasierte, multidisziplinäre, personenzentrierte Therapie nach den neuen Guidelines durchgeführt werden; waren doch bisher 1/3 aller Todesfälle in den USA auf ein CKM-Syndrom zurückzuführen. Bei unserem Pa-tienten sind, trotz des hohen cv Risikos mit einem CKM-Syndrom Stadium 4, aktuell die Kriterien für einen GLP1-RA nicht gegeben – gut eingestellter T2DM und BMI < 27 kg/m2.
Copyright Aerzteverlag medinfo AG
Zweitabdruck aus info@herz+gefäss 05/2024
Zelglistrasse 17
8127 Forch
u.n.duerst@ggaweb.ch
Der Autor hat keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
- Das CKM-Syndrom wird als eine systemische Störung definiert, die durch patho-physiologische Wechselwirkungen zwischen metabolischen Risikofaktoren, chronischer Nierenerkrankung und dem Herz-Kreislauf-System gekennzeichnet ist.
- Die Kombination von SGLT2-H., GLP-1 RA und ns-MRA bietet signifikante Vorteile in Bezug auf kardiovaskuläre und Nierenereignis-freie Überlebenszeit sowie Gesamtüberlebenszeit bei Patienten mit T2DM und Albuminurie.
- Die Implementierung der «sechs Säulen» der Therapie für T2DM und CKD – RAAS-Blockade, Metformin, Statin und neu SGLT2-H., GLP-1 RA und ns-MRA – wird individuell empfohlen, um signifikante Vorteile für Patienten mit hohem kardiovaskulärem und renalem Risiko zu bieten.
1. Vrints Ch. Et al., 2024 ESC-Guidelines for the management of chronic coronary syndromes: Developed by the task force for the management of chronic coronary syndromes of the European Society of Cardiology (ESC) Endorsed by the European Association for Cardio-Thoracic Surgery (EACTS), European Heart Journal, Volume 45, Issue 36, 21 September 2024, Pages 3415–3537
2. Nephro Live 2024, 4.6. und Diabetes und Niere vom 4.7.2024, Streamed Up
3. Zhang R et al, Lifetime risk of cardiovascular-renal disease in type 2 diabetes: a population-based study in 473,399 individuals, BMC Med. 2022; 20(1) 63
4. Afkarian M. et al., Kidney disease and increased mortality risk in type 2 diabetes, J Am Soc Nephrol 2013; 24: 302-308
5. KDIGO, Kidney Int Suppl 2024; Clinical Practice Guideline for the evaluation and management of CKD, Kidney International 2024; 105, 4S, April 2024, 117-314
6. Marx N. et al., 2023 ESC-Guidelines for the management of cardiovascular disease in patients with diabetes, European Heart Journal (2023) 00, 1–98, https://doi.org/10.1093/eurheartj/ehad192
7. Han Y. et al., Effect of metformin on all-cause and cardiovascular mortality in patients with coronary artery diseases: a systematic review and an updated meta-analysis, Cardiovasc Diabetol 2019 Jul 30;18(1):96. doi: 10.1186/s12933-019-0900-7
8. American Diabetes Association, Diabetes care 2023;46(Suppl 1): S 191-S 202
9. Heerspink HJL. et al., Dapagliflozin in Patients with Chronic Kidney Disease, DAPA-CKD, N Engl J Med 2020 Oct 8 ;383(15):1436-1446
10. Herrington WG. et al., Empagliflozin in Patients with Chronic Kidney Disease, EMPA KIDNEY, N Engl J Med 2022; 388:117-127
11. Fernández-Fernandez B. et al., EMPA-KIDNEY: expanding the range of kidney protection by SGLT2 inhibitors, Clinical Kidney Journal, Volume 16, Issue 8, August 2023, Pages 1187–1198
12. Moura F. et al., ESC 2022, 26.-29.Aug., Barcelona Spain
13. Mc Donagh Th.A. et al., 2023 Focused Update of the 2021 ESC-Guidelines for the diagnosis and treatment of acute and chronic heart failure, European Heart Journal (2023) 00, 1–13, https://doi.org/10.1093/eurheartj/ehad195
14. Bakris GL. et al., Effect of Finerenone on Chronic Kidney Disease Outcomes in Type 2 Diabetes, FIDELIO DKD, N Engl J Med 2020 Dec 3;383(23):2219-2229
15. Pitt B. et al., Cardiovascular Events with Finerenone in Kidney Disease and Type 2 Diabetes, FIGARO DKD, N Engl J Med 2021;385 :2252-2263
16. Agarwal R et al., Cardiovascular and kidney outcomes with finerenone in patients with type 2 diabetes and chronic kidney disease: the FIDELITY pooled analysis, Eur Heart J 2022 Feb. 10;43(6):474-484
17. Finerenone in Heart Failure with Mildly Reduced or Preserved Ejection Fraction, FINEARTS-HF, N Engl J Med 2024 September 1, 2024, DOI: 10.1056/NEJMoa2407107
18. Vaduganathan M. et al., Estimated Long-Term Benefits of Finerenone in Heart Failure. A Prespecified Secondary Analysis of the FINEARTS-HF, Randomized Clinical Trial. JAMA Cardiol. doi:10.1001/jamacardio.2024.3782
19. Mc Murray, 60 th EASD Annual Meeting, LBA04, Presented Sept. 10,2024
20. Vaduganathan, M.et al., Finerenone in heart failure and chronic kidney disease with type 2 diabetes: FINE-HEART pooled analysis of cardiovascular, kidney and mortality outcomes Nat Med (2024). https://doi.org/10.1038/s41591-024-03264-4
21. Perkovic V. et al., Flow Study, Effects of Semaglutide on Chronic Kidney Disease in Patients with Type 2 Diabetes, N Engl J Med 2024;391:109-121
22. Lincoff AM et al. Semaglutide and Cardiovascular Outcomes in Obesity without Diabetes. SELECT Study, N Engl J Med. 2023 Nov 11. doi: 10.1056/NEJMoa2307563. Epub ahead of print. PMID: 37952131
23. Kosiborod MN. et al., Semaglutide in Patients with Heart Failure with Preserved Ejection Fraction and Obesity, STEP-HFpEF, N Engl J Med 2023;389:1069-1084
24. Kosiborod MN. et al., Semaglutide in Patients with Obesity-Related Heart Failure and Type 2 Diabetes, STEP-HFpEF DM, N Engl J Med 2024;390:1394-1407, DOI: 10.1056/NEJMoa2313917
25. Simms-Williams N. et al., Effect of combination treatment with glucagon-like peptide-1 receptor agonists and sodium-glucose cotransporter-2 inhibitors on incidence of cardiovascular and serious renal events: population based cohort study, BMJ 2024; 385: e078242 doi: 10.1136/bmj-2023-078242
26. Neuen BL. et al., Estimated Lifetime Cardiovascular, Kidney, and Mortality Benefits of Combination Treatment With SGLT2 Inhibitors, GLP-1 Receptor Agonists, and Nonsteroidal MRA Compared With Conventional Care in Patients With Type 2 Diabetes and Albuminuria, Circulation 2024;149 (6):450-462
27. Ndumele CE. et al. Cardiovascular-Kidney-Metabolic Health: A Presidential Advisory From the American Heart Association, Circulation 2023;148(20):1606-35
28. Marassi M. et al., The cardio-renal-metabolic connection: a review of the evidence Cardiovascular Diabetology volume 22, Article number: 195 (2023) https://cardiab.biomedcentral.com/articles/10.1186/s12933-023-01937-x#Fig1
News: der informierte @rzt
- Vol. 15
- Ausgabe 1
- Januar 2025








