- Einmal Vorhofflimmern, immer Vorhofflimmern

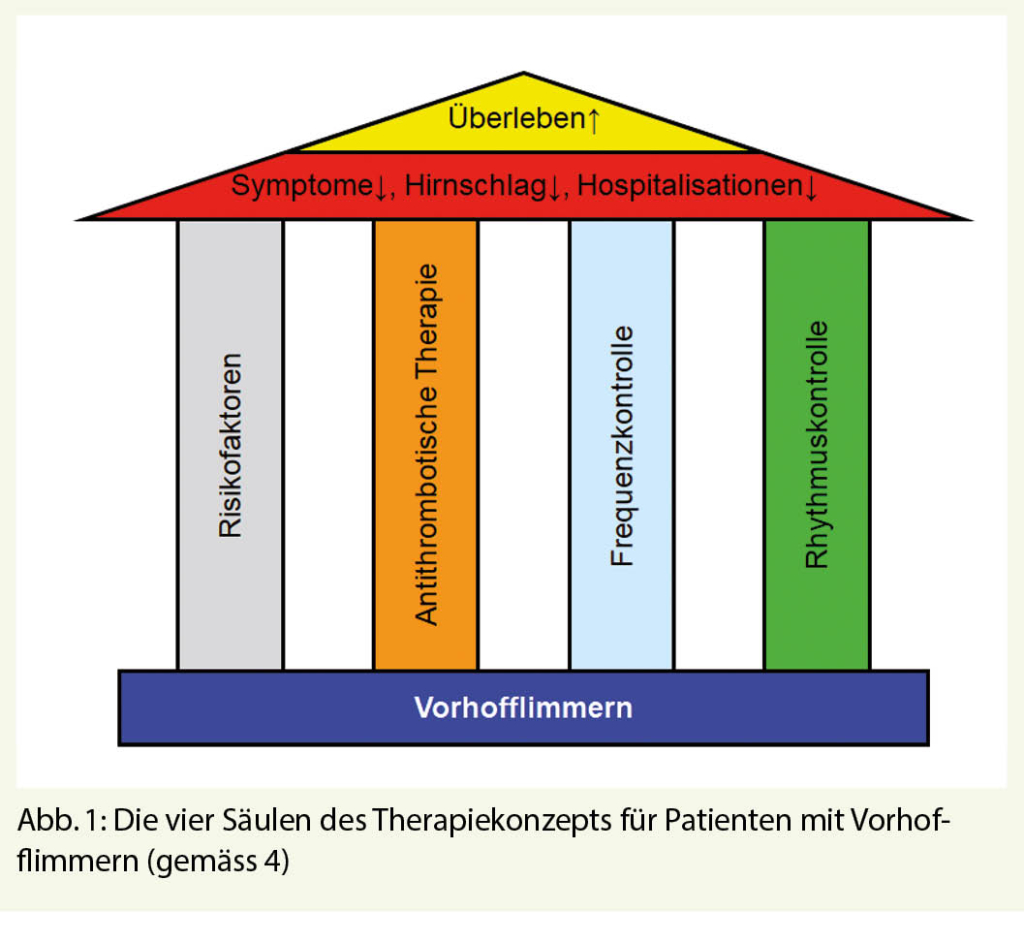
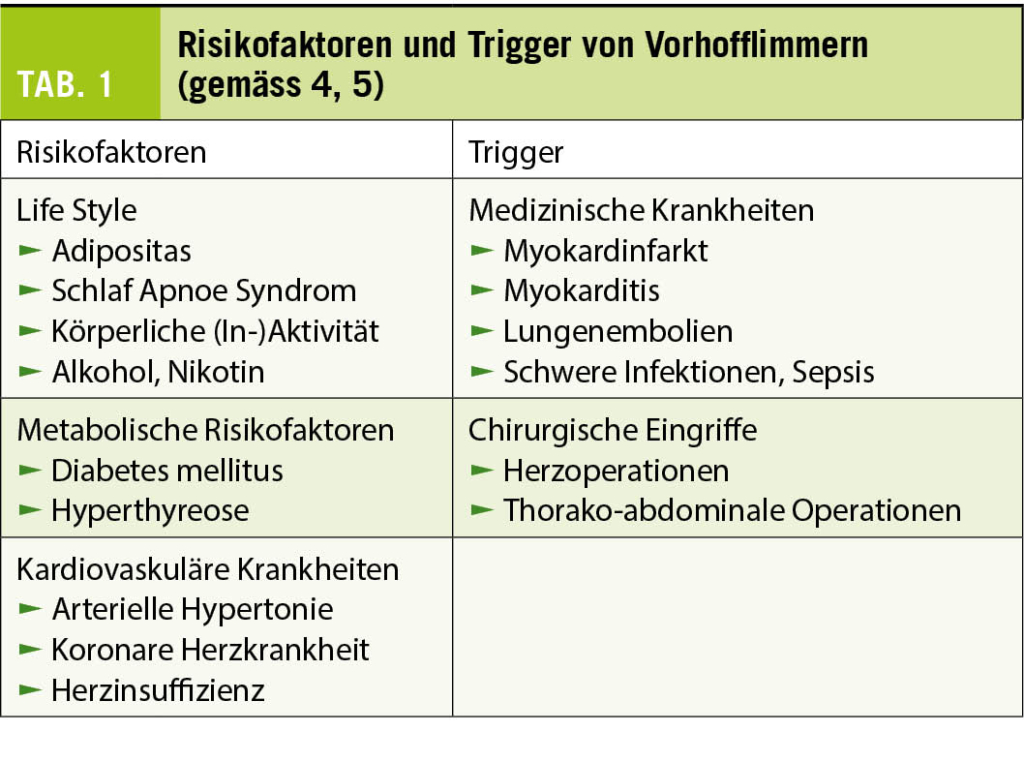
Vorhofflimmern ist die häufigste anhaltende Herzrhythmusstörung und mit einer erhöhten Mortalität und Morbidität assoziiert. Die Prävalenz dieser Rhythmusstörung nimmt im Alter stark zu. Die wichtigsten Risikofaktoren und Trigger für das Auftreten von Vorhofflimmern sind in Tabelle 1 zusammengefasst. Die Behandlung von Patienten mit Vorhofflimmern basiert auf vier Säulen (Abb. 1) (1 - 4). Die Massnahmen zur Reduktion der Risikofaktoren wie Adipositas und Bewegungsmangel haben nicht nur einen günstigen Einfluss auf das Auftreten und die Progression des Vorhofflimmerns (4), sondern auch auf viele andere kardiovaskuläre Krankheiten. Bei der Frequenz- und Rhythmuskontrolle handelt es sich primär um symptomatische Behandlungen, deren Timing und Intensität durch die Anfallshäufigkeit und Symptomatik des Vorhofflimmerns bestimmt wird. Nach einer ersten Episode eines symptomatischen Vorhofflimmerns kann man darum in ausgewählten Fällen mit dem Beginn der Behandlung bis zum Rezidiv zuwarten, ohne dass man dadurch die Prognose des Patienten beeinträchtigt (1).
Anders sieht es bei der Thromboembolieprophylaxe aus. Hier gibt es mit der Antikoagulation eine Therapie, die nicht nur die Morbidität, sondern auch die Mortalität verbessert und dies unabhängig davon, ob der Patient ein paroxysmales oder persistierendes Vorhofflimmern hat. So beträgt die relative Risikoreduktion für einen ischämischen Hirnschlag etwa 66% und für die Gesamtmortalität etwa 25%. Dies bei einem Risiko für relevante Blutungen unter der Behandlung von ca. 3% pro Jahr (1). Aus diesem Grund stellt sich schon bei der ersten EKG dokumentierten Episode eines Vorhofflimmerns die Frage: Profitiert dieser Patient von einer langfristigen Antikoagulation?
Indikation für die Antikoagulation bei Vorhofflimmern
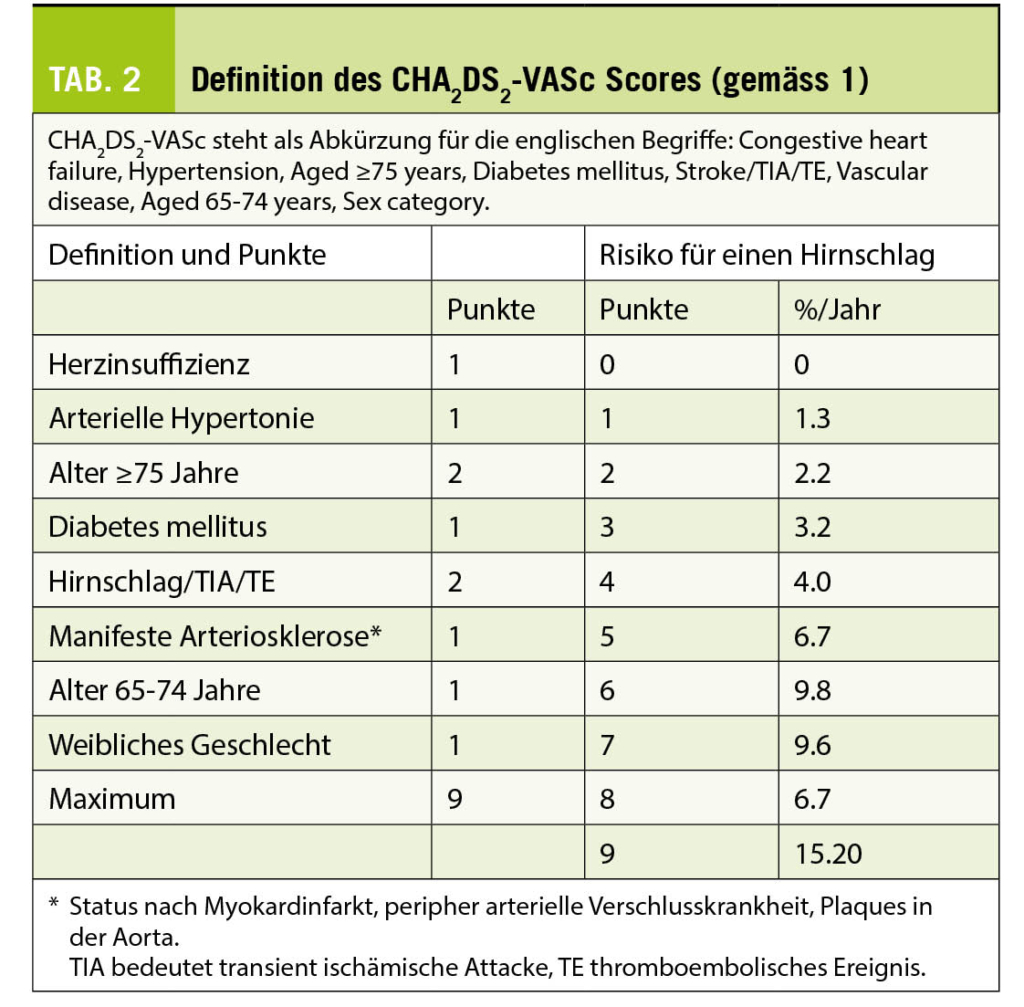
In den aktuellen Richtlinien findet man als Entscheidungshilfe für die Indikation zur Antikoagulation bei Patienten mit Vorhofflimmern den CHA2DS2-VASc Score (Tab. 2) (1). So wird für Männer mit ≥1 und für Frauen mit ≥2 Punkten der Einsatz einer oralen Antikoagulation empfohlen. Die klinische Präsentation des Vorhofflimmerns, Erstdiagnose, paroxysmales, persistierendes oder permanentes Vorhofflimmern, wird dagegen nicht für die Indikationsstellung berücksichtigt.
Anhand der drei eingangs beschriebenen Patientenbeispiele werden in den nächsten Abschnitten die Argumente für diese Empfehlungen diskutiert.
Patienten mit primärem Vorhofflimmern
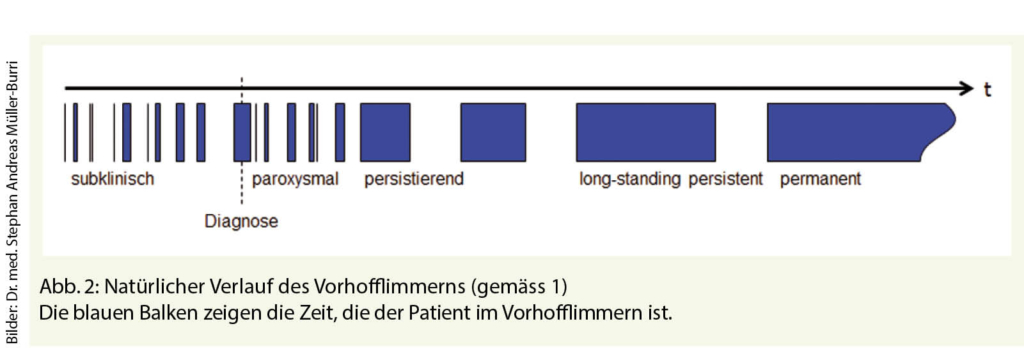
Wie beim Patienten A tritt das Vorhofflimmern in den meisten Fällen bei Patienten mit prädisponierenden Risikofaktoren, aber ohne erkennbaren Trigger auf. Gewisse Autoren sprechen von primärem Vorhofflimmern. Da es sich beim Alter und den anderen Risikofaktoren um irreversible oder chronische Gesundheitsprobleme handelt, zeigt auch das Vorhofflimmern einen chronisch progredienten Verlauf (Abb. 2) (1). Dementsprechend begann das Vorhofflimmern oft schon vor der ersten im EKG dokumentierte Episode und das Auftreten des nächsten Rezidivs ist nur eine Frage der Zeit. Basierend auf klinischen Daten (6), die bezüglich des thromboembolischen Risikos keinen Unterschied zwischen den verschiedenen Stadien des Vorhofflimmerns nachweisen konnten, empfehlen die Guidelines beim Patienten A zum Zeitpunkt der Diagnosestellung die Indikation für eine Antikoagulation zu beurteilen (1).
Patienten mit sekundärem Vorhofflimmern
Bei der Patientin B wurde das Vorhofflimmern erstmals im Rahmen einer akuten Infektion dokumentiert. Man spricht in diesem Fall von einem sekundärem Vorhofflimmern oder neu von Atrial Fibrillation Occuring Transiently with Stress (AFOTS)(7). Da die in Tabelle 1 aufgeführten Trigger oft reversibel oder nur passager vorhanden sind, stellt sich die Frage, ob das Vorhofflimmern im weiteren Verlauf wieder auftreten wird und darum, wie primäres Vorhofflimmern, langfristig behandelt werden muss?
Bis jetzt gibt es zu dieser Form des Vorhofflimmerns nur wenig klinische Daten und in den aktuellen Richtlinien findet diese im Alltag häufige Form des Vorhofflimmerns keine Erwähnung (1- 4, 8). Nur für Patienten mit Vorhofflimmern nach einer Herzoperation wird eine Antikoagulation unter Abwägung von Nutzen und Risiken empfohlen (1).
In der Framingham Population hatten von den Patienten mit sekundärem Vorhofflimmern 42% nach 5 Jahren ein Rezidiv der Rhythmusstörung. Im Vergleich dazu lag die Rezidivrate bei Patienten mit primärem Vorhofflimmern nur wenig höher bei 59% (9). Auch bei den Risikofaktoren unterscheiden sich Patienten mit sekundärem Vorhofflimmern kaum von Patienten mit primärem Vorhofflimmern (9 - 12). Das Auftreten von Vorhofflimmern im Rahmen einer akuten Erkrankung oder einer Operation ist in der Regel mit einer kurz- und langfristig erhöhten Morbidität und Mortalität assoziiert. Es gibt aber noch keine klinischen Daten aus Interventionsstudien, die zeigen, ob und wie man diese Risiken durch therapeutische Massnahmen günstig beeinflussen kann (7, 13). Im Alltag wird man sich darum bei diesen Patienten entweder für ein engmaschiges ambulantes EKG Monitoring zur Dokumentation eines Rezidivs des Vorhofflimmerns oder direkt für eine Antikoagulation gemäss CHA2DS2-VASc Score entscheiden.
Patienten nach erfolgreicher Katheterablation des Vorhofflimmerns
Die Katheterablation mit Isolation der Lungenvenen ist heute die effektivste Behandlung zur Rhythmuskontrolle bei Patienten mit Vorhofflimmern (1 - 4, 16). Je nach Patientenpopulation, Behandlungs- und Monitoringtechnik sind 1 Jahr nach einer solchen Behandlung 50-85% der Patienten frei von einem Rezidiv des Vorhofflimmerns (14, 15). Gleichzeitig bringt die Katheterablation eine Reduktion der Zeit im Vorhofflimmern, dem sogenannten Vorhofflimmerburden, um >90%. Im Langzeitverlauf sind nach 5 Jahren und wenn nötig mehreren Katheterablationen zwischen 63% und 82% der Patienten in einem stabilen Sinusrhythmus (17 - 21).
Aus Studien mit Antiarrhythmika weiss man, dass das Risiko für thromboembolische Ereignisse nicht durch die Behandlungsstrategie, Rhythmus- oder Frequenzkontrolle, beeinflusst wird (22). Die aktuellen Richtlinien (1, 16) empfehlen darum für den Patienten C nach Abheilen der durch die Ablationen im linken Vorhof entstandenen Endothelläsionen, d.h. nach ≥ 2 Monaten, nur anhand des CHA2DS2-VASc Score und unabhängig vom Erfolg der Katheterablation über die Fortsetzung der Antikoagulation zu entscheiden.
Es gibt allerdings Hinweise, dass Patienten nach einer erfolgreichen Katheterablation des Vorhofflimmerns ein geringeres Risiko für thromboembolische Ereignisse haben als unbehandelte Patienten. In einer Metaanalyse mit > 25 000 Patienten zeigte sich, dass die langfristige Antikoagulation im Vergleich zum Stoppen der Antikoagulation nach der Katheterablation nur mit einer Zunahme der Blutungskomplikationen, nicht aber mit einer Reduktion der thromboembolischen Ereignisse assoziiert war (23). Zurzeit laufen zwei randomisierte Studien, die untersuchen, unter welchen Umständen nach einer Katheterablation des Vorhofflimmerns die Antikoagulation gestoppt werden kann. Bis zur Publikation dieser Daten dürfte sich die Mehrheit der Elektrophysiologen weiter an den aktuellen Empfehlungen orientieren und die Antikoagulation bei einem CHA2DS2-VASc Score ≥ 2 für Männer und ≥3 für Frauen nur in Ausnahmefällen absetzen (1, 16).
Copyright bei Aerzteverlag medinfo AG
Klinik für Kardiologie, Stadtspital Triemli
Birmensdorferstrasse 497
8063 Zürich
andreas.mueller@triemli.zuerich.ch
Der Autor hat in Zusammenhang mit diesem Artikel keine Interessenskonflikte deklariert. Unabhängig davon haben der Autor und seine Institution für Aus- und Weiterbildung finanzielle Unterstützung von Biotronik, Boston Scientific, Medtronic, Abbott und Biosense Webster, Vortragshonorare von Biosense Webster, Medtronic, Abbott, AstraZeneca, Daiichi Sankyo, Biotronik und MicroPort erhalten sowie Consultant- und Proktoring-Honorare von Biosense Webster, Medtronic und Abbott.
- Vorhofflimmern ist eine chronisch progrediente Rhythmusstörung, deren Auftreten in Abhängigkeit von anderen Risikofaktoren (CHA2DS2-VASc Score) mit einem erhöhten Risiko für thromboembolische Ereignisse, insbesondere ischämische Hirninfarkte, assoziiert ist.
- Zurzeit ist die Antikoagulation die einzige therapeutische Massnahme, die dieses Risiko und damit auch das Überleben der Patienten positiv beeinflussen kann.
- Dagegen gibt es keine pharmakologische oder invasive Behandlung zur Stabilisierung des Sinusrhythmus (Rhythmuskontrolle), für die eine Reduktion des thromboembolischen Risikos nachgewiesen wurde, welche das Absetzen der Antikoagulation rechtfertigen würde.
- Der vereinfachende Merksatz aus dem Titel «Einmal Vorhofflimmern, immer Vorhofflimmern» hat darum in Bezug auf die Antikoagulation auch heute noch seine Berechtigung.
1. Kirchhof P, Benussi S, et al. 2016 ESC guidelines for the management of atrial fibrillation. EHJ 2016;37:2893-962.
2. Craig TJ, et al. 2014 AHA/ACC/HRS Guidelines for the management of patients with atrial fibrillation. JACC 2014;64:e1-76.
3. January CT, et al. 2019 AHA/ACC/HRS Focused Update of the 2014 AHA/ ACC/HRS Guideline for the Management of Patients With Atrial Fibrillation. Circulation 2019;140:e125-e151.
4. Chung MK, et al. Circulation 2020;141. DOI: 10.1161/CIR.0000000000000748.
5. Savelieva I and Camm J. Clin Cardiol 2008;31:55-62.
6. Friberg L. et al. EHJ 2010;31:967-75.
7. McIntyre WF, Healey J. JAFIB 2017;9:1475.
8. Ibanez B, et al. EHJ 2018;39:119-77.
9. Lubitz SA, et al. Circulation 2015;131:1648-55.
10. Kosmidou I, et al. JACC 2018;71:739-48.
11. Guenancia C, et al. Europace 2018;20:e179-88.
12. McIntyre WF, et al. EHJ: Acute Cardiovascular Care 2019;8:130-41.
13. Rath B, et al. Herzschr Elektrophys 2019;30:256-61.
14. Duytschaever M, et al. Heart Rhythm 2019, doi.org/10.1016/j.hrthm.2019.11.004.
15. Andrade JG, et al. Circulation 2019;140:1779-88.
16. Calkins H, et al. Europace 2018;20:e1-e160.
17. Ouyang F, et al. Circulation 2010;122:2368-77.
18. Weerasooriya R, et al. JACC 2011;57:160-6.
19. Scherr D, et al. Circ Arrhythm Electrophiol 2015;8:18-24.
20. Nielsen JC, et al. Heart 2017;103:368-76.
21. Saguner AM, et al. Europace 2018;20:58-64.
22. Wyse DG, et al. NEJM 2002;347:1825-33.
23. Proietti R, et al. J Cardiovasc Electrophysiol 2019;30:468-78.
der informierte @rzt
- Vol. 10
- Ausgabe 11
- November 2020