- Epilepsie bei älteren Menschen
Sowohl die Inzidenz als auch die Prävalenz der Epilepsie steigen nach 65 Jahren an. Angesichts der Alterung der Bevölkerung wird die Behandlung von Epilepsie bei älteren Menschen zu einer Herausforderung für die öffentliche Gesundheit. Bei der Behandlung dieser Patienten müssen die Ätiologie, die Komorbiditäten, die Risiken eines erneuten Anfalls oder der antikonvulsiven Behandlung sowie die pharmakodynamischen und pharmakokinetischen Veränderungen im Alter berücksichtigt werden.
Both the incidence and prevalence of epilepsy increase after the age of 65. In view of the ageing population, the management of epilepsy in the elderly is becoming a public health issue. The management of these patients implies taking into account the etiology, comorbidities, the risks inherent in a seizure recurrence or anticonvulsant treatment, as well as the pharmacodynamic and pharmacokinetic changes that occur in old age.
Key Words: epilepsy, elderly,public health, anticonvulsant treatment
Epilepsie ist die dritthäufigste neurologische Erkrankung im Alter von 65 Jahren, nach Schlaganfall und Demenz, die beide das Epilepsie-Risiko erhöhen (1). Dieser Trend wird sich angesichts der Alterung der Bevölkerung noch verstärken, da die Zahl der Personen >65 Jahre in den nächsten 15 Jahren um schätzungsweise 60% steigen wird (2). Die Behandlung von Epilepsie bei älteren Menschen erfordert aufgrund der verschiedenen Ätiologien, Komorbiditäten, des erhöhten Risikos von Nebenwirkungen der Behandlung, der Komedikation sowie der pharmakodynamischen und pharmakokinetischen Veränderungen besondere Überlegungen. Darüber hinaus sind ältere Menschen im Falle eines epileptischen Anfalls besonders verletzlich: Es besteht die Gefahr traumatischer Verletzungen, des Vertrauensverlusts und der Einschränkung der Selbstständigkeit. Trotz all dieser Faktoren wird Epilepsie bei älteren Menschen häufig verspätet diagnostiziert und die Patienten haben weniger leicht Zugang zu spezialisierten Zentren (3).
Epidemiologie
Wenn wir von epileptischen Anfällen bei älteren Menschen sprechen, sollten wir drei Szenarien klar definieren:
1) Provozierte (oder akut symptomatische) epileptische Anfälle, die in der Frühphase einer Hirnschädigung oder als Folge toxisch-metabolischer Störungen auftreten. Die Inzidenz steigt ab der dritten Dekade linear an und das Risiko wird auf 3,6% im Alter von 80 Jahren geschätzt (4). Nach einem ersten Anfall sollte eine breite biologische Untersuchung, eine Bildgebung des Gehirns und eine detaillierte Anamnese auf der Suche nach einem begünstigenden Faktor durchgeführt werden. Diese Art von Anfall führt nicht automatisch zu einer Epilepsiediagnose. Epilepsie ist nämlich definiert durch das Auftreten von ≥2 unprovozierten Anfällen im Abstand von 24 Stunden oder einem einzelnen Anfall mit einem geschätzten 10-Jahres-Rückfallrisiko von ≥60% (durch zusätzliche Untersuchungen wie EEG, Bildgebung) (5).
2) Epilepsie, die in jungen Jahren begonnen hat und bis ins hohe Alter andauert.
3) Epilepsie, die de novo im hohen Alter (>60 Jahre) auftritt. Die Inzidenz von Epilepsie ist in sehr jungen Jahren und im höheren Alter erhöht (allmählicher Anstieg ab 40-50 Jahren) und wird im Alter von 65 Jahren auf 90-150/100.000 geschätzt. Dieses bimodale Muster wurde sowohl in Industrie- als auch in Entwicklungsländern wiederholt nachgewiesen (3, 6). Angesichts der Alterung der Bevölkerung und der verbesserten Pflege mit längeren Überlebenszeiten für Epilepsiepatienten in jungen Jahren folgt die Prävalenz der Epilepsie demselben bimodalen Muster (5,4% bei älteren Menschen und bis zu 7,5% bei Patienten in Pflegeheimen) (7, 8). Die Inzidenz des Status epilepticus (SE), d. h. eines längeren Anfalls von mehr als 5 bis 10 Minuten, wird bei älteren Menschen auf 86/100’000 geschätzt, d.h. 5x höher als bei jüngeren Menschen (9). Darüber hinaus steigt die mit dem SE verbundene Mortalität mit zunehmendem Alter. Sie beträgt 38% bei > 60 Jahre (9, 10) und stellt einen der wichtigsten prognostischen Faktoren dar (11). Diese Daten untermauern die Tatsache, dass Epilepsie bei älteren Menschen nicht als harmlose Krankheit angesehen werden sollte.
Ätiologie und Risikofaktoren
Zerebrovaskuläre Erkrankungen sind für mehr als ein Drittel der Epilepsien bei älteren Menschen verantwortlich (12), wobei die Inzidenz von Epilepsie nach einem Schlaganfall bei 6,4-15% liegt (13). Neurodegenerative Erkrankungen und unbestimmte Ätiologien machen etwa ein Viertel der Fälle aus (6). Tumorätiologien sind für etwa 10% verantwortlich (14). Mehrere Studien berichten über eine Assoziation zwischen zerebrovaskulären Risikofaktoren und dem Auftreten von Epilepsie (15-18). In der ARIC-Kohorte (Atherosclerosis Risk in Communities) mit mehr als 10.000 Patienten, die über ein Jahrzehnt beobachtet wurden, wurde das Auftreten von Epilepsie mit Bluthochdruck, Diabetes und Schlaganfällen in Verbindung gebracht (18). Diese Beobachtung eröffnet die Möglichkeit eines ganzheitlichen Ansatzes, mit dem die Epileptogenese möglicherweise durch die Behandlung zerebrovaskulärer Risikofaktoren reduziert werden kann.
Diagnostische Herausforderung
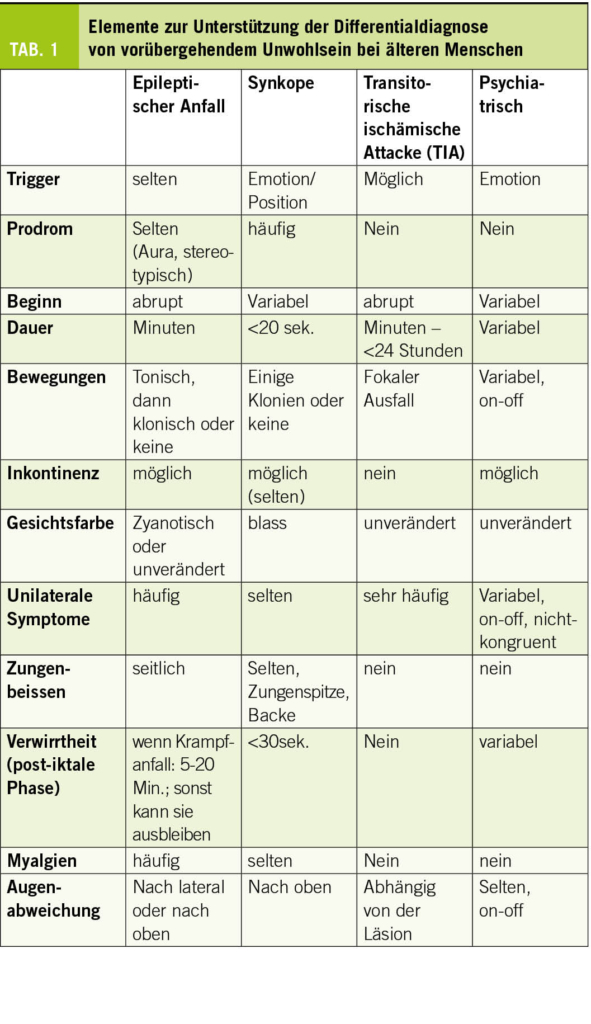
Epileptische Anfälle bei älteren Menschen sind überwiegend fokal und können aufgrund ihrer weniger “motorischen” Semiologie als bei jungen Menschen unbemerkt bleiben. Sie können sich nur in paroxysmalen Episoden äußern, in denen es zu einem Stillstand der Aktivität, Kontaktverlust, Sturz oder Verwirrung kommt (3). Bei 26% der älteren Patienten mit einer endgültigen Epilepsiediagnose wäre eine Epilepsie zunächst nicht in Betracht gezogen worden (19). Bis zu 70% der Anfälle bei der Alzheimer-Krankheit sollen rein mit Bewusstseinsstörungen auftreten (20). Darüber hinaus ist die Differenzialdiagnose sehr breit gefächert und umfasst Fluktuationen im Rahmen einer neurodegenerativen Erkrankung, Synkopen, TIAs oder toxisch-metabolische Störungen.
Die Anamnese beim Patienten und bei den Angehörigen ist von entscheidender Bedeutung. Dabei sollte aktiv nach dem stereotypen Charakter der Episoden, den Umständen des Auftretens und möglichen Begleiterscheinungen wie Automatismen gesucht werden (Tab. 1). Ältere Patienten neigen zu postkritischer Verwirrung oder Toddscher Lähmung, die über einen längeren Zeitraum (mehrere Stunden oder sogar Tage) andauern und zu einer Fehldiagnose von Demenz oder Schlaganfall führen können (21). Die Diagnose einer funktionellen Episode (PNES; Psychogenic Non epileptic Seizures) wird bei älteren Menschen oft wenig beachtet. In einer Kohorte von 94 Patienten im Alter von >60 Jahren, die unter EEG-Überwachung zur Charakterisierung von Episoden standen, zeigten 27 Patienten nicht-epileptische Episoden, hauptsächlich PNES (22). Häufig handelt es sich um Personen mit schwerer somatischer Komorbidität (23).
Das EEG kann natürlich bei der Diagnose helfen. Es ist jedoch zu betonen, dass eine interiktale Aufzeichnung weder eine perfekte Spezifität noch Sensitivität aufweist. Bei etwa einem Drittel der älteren Epilepsiepatienten werden im EEG interiktale Abnormalitäten (irritative Zone) festgestellt. Umgekehrt werden interiktale Anomalien, hauptsächlich im Schlaf, bei 2-6% der Patienten mit neurodegenerativen Erkrankungen berichtet, wobei es nicht notwendigerweise zu klinischen Episoden kommt, die mit Anfällen vereinbar sind (20). Die Anamnese und das klinische Urteil sollten daher Vorrang haben. Bei starkem klinischem Verdacht kann im Einzelfall eine Testbehandlung oder eine längere EEG-Aufzeichnung, die auch den Schlaf einschließt, diskutiert werden.
Behandlung
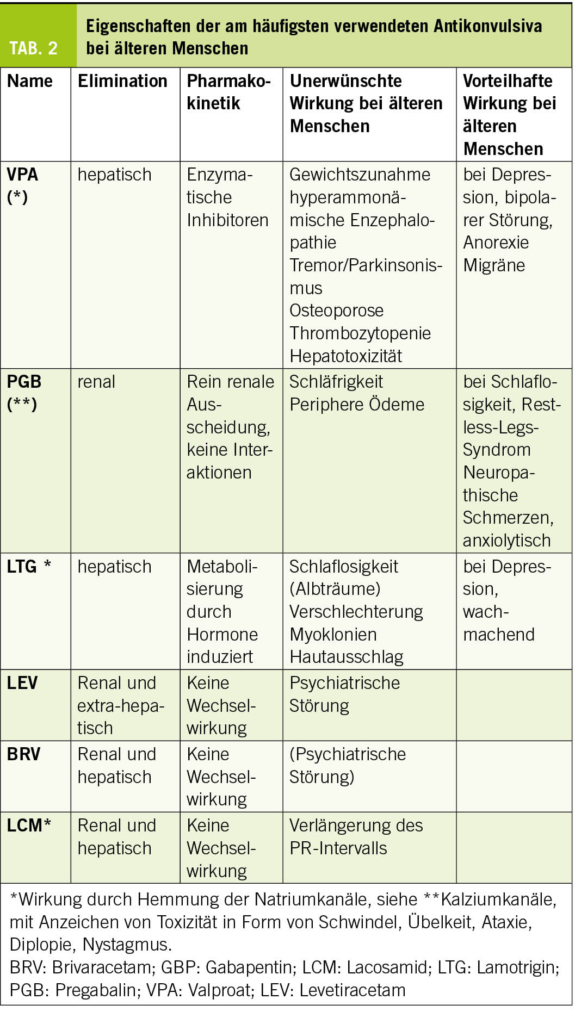
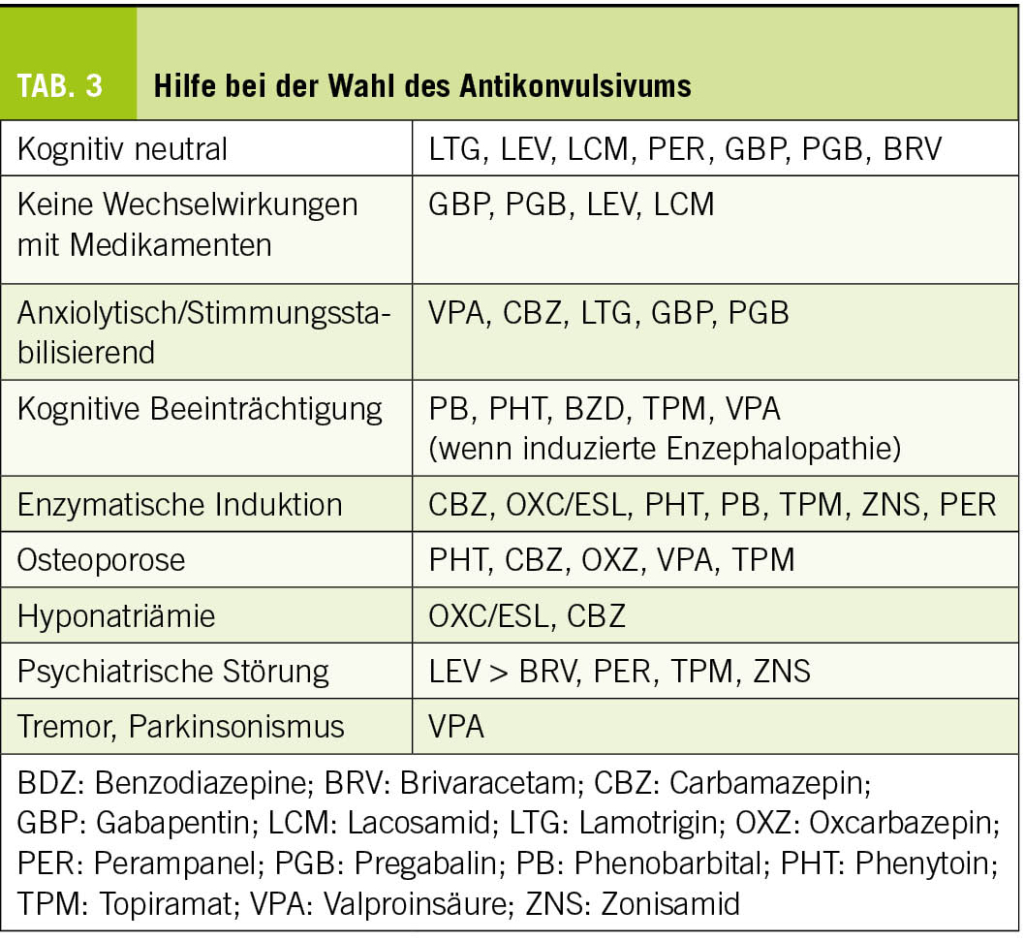
Obwohl die meisten älteren Menschen nach einem Jahr unter einer Monotherapie anfallsfrei sind (6), ist die Einführung einer Behandlung potenziell komplex und erfordert die Berücksichtigung altersbedingter pharmakodynamischer und pharmakokinetischer Veränderungen, Komedikationen und patientenspezifischer Komorbiditäten. Die Wahl der Medikation muss von Fall zu Fall unter Abwägung von Verträglichkeit und Wirksamkeit getroffen werden. Eine spezialisierte Beratung, zumindest in der Anfangsphase, ist daher empfehlenswert. Lamotrigin und Levetiracetam (24, 25) werden am häufigsten verwendet und sind zusammen mit Gabapentin/Pregabalin die Mittel der ersten Wahl bei älteren Menschen. Da Levetiracetam zu Verhaltensstörungen führen kann, sollten der Patient und seine Angehörigen darüber informiert und aktiv nach ihnen gesucht werden. Lamotrigin hat eine wachmachende und stimmungsstabilisierende Wirkung, die vorteilhaft sein kann. Diese Behandlung kann jedoch Myoklonien verstärken und ihr langsames, schrittweises Einleitungsschema angesichts des Risikos schwerer Hautreaktionen kann bei kognitiven Beeinträchtigungen schwierig zu befolgen sein. Generell sollten Enzyminduktoren aufgrund ihrer Auswirkungen auf den Knochenstoffwechsel und ihrer Wechselwirkungen mit anderen Medikamenten möglichst vermieden werden. In den Tabellen 2 und 3 sind die Eigenschaften der gängigsten Antikonvulsiva zusammengefasst. Bei der Einführung einer Behandlung sollte ein langsames Titrationsschema angewendet und eine niedrigere Dosis als bei jungen Menschen angestrebt werden.
Bidirektionale Beziehung zwischen Epilepsie und Demenz
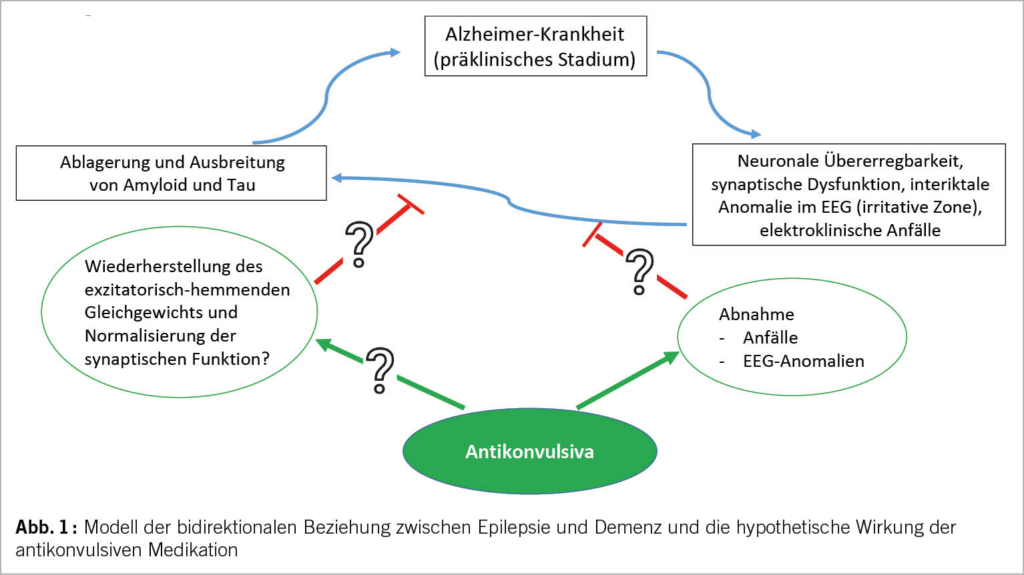
Nach einem ersten unprovozierten Anfall bei einem Patienten mit Alzheimer-Demenz wird das Risiko eines erneuten Anfalls auf 70% geschätzt (26), womit die diagnostischen Kriterien für eine Epilepsie erfüllt sind. Ein erhöhtes Risiko für epileptische Anfälle bei Demenz ist seit langem bekannt (27). Angesichts von Tierstudien, die beschrieben, dass die Akkumulation von β-Amyloid das Auftreten elektrischer Anfälle begünstigt und dass die Anfälle wiederum zu hippokampaler Dysfunktion und damit zu Gedächtnisstörungen beitragen (28), hat das Interesse an dieser bidirektionalen Beziehung in letzter Zeit zugenommen. In der Framingham-Kohorte wird von einem verdoppelten Demenzrisiko bei Patienten mit Epilepsie berichtet, und in ähnlicher Weise von einem erhöhten Epilepsie-Risiko bei Demenz (29). In ähnlicher Weise wurde in der ARIC-Kohorte ein 3x höheres Demenzrisiko bei Patienten mit Spätepilepsie (30) und ein 3x höheres Risiko für das Auftreten von Epilepsie bei Demenzpatienten (18) beobachtet. Die zugrunde liegende Pathophysiologie ist nach wie vor ungeklärt. Patienten mit Epilepsie, die in der Kindheit begonnen hatte, wiesen nach über 50 Jahren mehr kognitive Störungen und ein stärker verändertes Amyloid-PET auf als die Kontrollgruppe (31). In einer neueren Studie wurde kein Zusammenhang zwischen Antikonvulsiva und kognitiven Störungen festgestellt (32), sondern eher zwischen der Anfallshäufigkeit und dem kognitiven Verfall. Umgekehrt weisen mehr als 50% der Patienten mit Spätepilepsie zum Zeitpunkt der Diagnose ein MCI (mild cognitive impairment) auf (33, 34). Mehrere pathologisch-anatomische Studien an Patienten ohne Demenz, bei denen zur Behandlung von Epilepsie eine temporale Lobektomie durchgeführt wurde, beschreiben bei Patienten mit Epilepsie mehr Akkumulation von β-Amyloid oder Tau-Hyperphosphoryl als bei Kontrollpatienten (20, 35, 36). Schließlich werden interkritische EEG-Anomalien (irritative Zone) mit einer schlechten kognitiven Prognose bei der Alzheimer-Krankheit in Verbindung gebracht (29, 37). Es ist noch nicht geklärt, ob dies auf infraklinische Anfälle zurückzuführen ist, die die Kognition beeinträchtigen, ob diese EEG-Anomalien an sich schädlich sind oder ob sie auf eine schwerere zugrunde liegende Pathologie hindeuten. Dies hat dazu geführt, dass die Möglichkeiten einer prophylaktischen antikonvulsiven Behandlung untersucht wurden (Abb. 1). Tierstudien haben gezeigt, dass Levetiracetam durch die Verringerung der glutamatbedingten Exzitotoxizität und die Unterdrückung der hippokampalen neuronalen Hyperaktivität zu einer Wiederherstellung der synaptischen Funktion und einer Verringerung der β-Amyloidablagerungen führen kann. In einer neueren Studie wurden Alzheimer-Patienten randomisiert zwischen Placebo und sehr niedrig dosiertem Levetiracetam: Bei der kleinen Untergruppe mit irritativer Aktivität im EEG (9 Patienten!) verbesserten sich einige kognitive Funktionen nach Levetiracetam (38).
Schlussfolgerung
Epilepsie ist eine häufige Erkrankung bei älteren Menschen und kann zahllose körperliche, soziale und psychiatrische Folgen haben. Angesichts der bidirektionalen Beziehung zwischen Epilepsie und Demenz sollte ein rigoroses Screening nach klinischen Phänomenen durchgeführt werden, die auf epileptische Anfälle bei Demenzpatienten oder auf kognitive Beschwerden bei Epilepsiepatienten hindeuten. Die Diagnose und die Einleitung einer Behandlung erfordern die Hilfe eines Spezialisten.
Übersetzung aus «la gazette médicale» 02-2023
Copyright bei Aerzteverlag medinfo AG
MD, CHUV, NLG, BH07
Centre Hospitalier Universitaire Vaudois (CHUV)
und Universität Lausanne; Abteilung für klinische
Neurowissenschaften, Abteilung für Neurologie
Abteilung für Epileptologie
Rue du Bugnon 46
1011 Lausanne
Isabelle.beuchat@chuv.ch
MD, FAES, CHUV, NLG, BH07
Centre Hospitalier Universitaire Vaudois (CHUV)
und Universität Lausanne; Abteilung für klinische
Neurowissenschaften, Abteilung für Neurologie
Abteilung für Epileptologie
Rue du Bugnon 46
1011 Lausanne
Andrea.rossetti@chuv.ch
Die Autoren haben keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
◆ Epilepsie ist bei Menschen über 65 Jahren häufiger als in jeder
anderen Altersgruppe.
◆ Die Semiologie der epileptischen Anfälle ist anders, mit weniger
motorischen Manifestationen oder Generalisierung.
◆ Die antikonvulsive Therapie bei älteren Menschen muss angepasst werden, wobei Wirksamkeit und Verträglichkeit abgewogen und die spezifischen Komorbiditäten des jeweiligen Patienten berücksichtigt werden müssen.
◆ Es besteht eine bidirektionale Beziehung zwischen Epilepsie und Demenz; Demenz ist ein unabhängiger Risikofaktor für das Auftreten von Epilepsie und Epilepsie ein unabhängiger Risikofaktor für das
Auftreten von Demenz.
1. WHO. Epilepsy: a public health imperative. 2019 [online]. Available at: www.who.int/mental_health/neurology/epilepsy/report_2019/en/.
2. Available at: https://www.census.gov/content/dam/Census/%20library/publications/2016/demo/p95-16-1.pdf.
3. Stephen LJ, Brodie MJ. Epilepsy in elderly people. The Lancet 2000;355:1441-1446.
4. Annegers JF, Hauser WA, Lee JR, Rocca WA. Incidence of acute symptomatic seizures in Rochester, Minnesota, 1935-1984. Epilepsia 1995;36:327-333.
5. Fisher RS, Acevedo C, Arzimanoglou A, et al. ILAE official report: a practical clinical definition of epilepsy. Epilepsia 2014;55:475-482.
6. Sen A, Jette N, Husain M, Sander JW. Epilepsy in older people. The Lancet 2020;395:735-748.
7. Beghi E, Giussani G, Nichols E, et al. Global, regional, and national burden of epilepsy, 1990–2016: a systematic analysis for the Global Burden of Disease Study 2016. The Lancet Neurology 2019;18:357-375.
8. Birnbaum AK, Leppik IE, Svensden K, Eberly LE. Prevalence of epilepsy/seizures as a comorbidity of neurologic disorders in nursing homes. Neurology 2017;88:750-757.
9. DeLorenzo RJ, Hauser WA, Towne AR, et al. A prospective, population-based epidemiologic study of status epilepticus in Richmond, Virginia. Neurology 1996;46:1029-1035.
10. Sveinsson O, Andersson T, Carlsson S, Tomson T. The incidence of SUDEP: A nationwide population-based cohort study. Neurology 2017;89:170-177.
11. Sutter R, Kaplan PW, Ruegg S. Outcome predictors for status epilepticus–what really counts. Nat Rev Neurol 2013;9:525-534.
12. Liu S, Yu W, Lu Y. The causes of new-onset epilepsy and seizures in the elderly. Neuropsychiatr Dis Treat 2016;12:1425-1434.
13. Galovic M, Ferreira-Atuesta C, Abraira L, et al. Seizures and Epilepsy After Stroke: Epidemiology, Biomarkers and Management. Drugs Aging 2021;38:285-299.
14. Hernandez-Ronquillo L, Adams S, Ballendine S, Tellez-Zenteno JF. Epilepsy in an elderly population: Classification, etiology and drug resistance. Epilepsy Res 2018;140:90-94.
15. Leppik IE. Epilepsy in the elderly: scope of the problem. Int Rev Neurobiol 2007;81:1-14.
16. Ramsay RE, Pryor F. Epilepsy in the elderly. Neurology 2000;55:S9-14; discussion S54-18.
17. Choi H, Pack A, Elkind MS, Longstreth WT, Jr., Ton TG, Onchiri F. Predictors of incident epilepsy in older adults: The Cardiovascular Health Study. Neurology 2017;88:870-877.
18. Johnson EL, Krauss GL, Lee AK, et al. Association Between Midlife Risk Factors and Late-Onset Epilepsy: Results From the Atherosclerosis Risk in Communities Study. JAMA Neurol 2018;75:1375-1382.
19. Rowan AJ, Ramsay RE, Collins JF, et al. New onset geriatric epilepsy: a randomized study of gabapentin, lamotrigine, and carbamazepine. Neurology 2005;64:1868-1873.
20. Vossel KA, Tartaglia MC, Nygaard HB, Zeman AZ, Miller BL. Epileptic activity in Alzheimer’s disease: causes and clinical relevance. Lancet Neurol 2017;16:311-322.
21. Sheth RD, Drazkowski JF, Sirven JI, Gidal BE, Hermann BP. Protracted ictal confusion in elderly patients. Arch Neurol 2006;63:529-532.
22. McBride AE, Shih TT, Hirsch LJ. Video-EEG monitoring in the elderly: a review of 94 patients. Epilepsia 2002;43:165-169.
23. Duncan R, Oto M, Martin E, Pelosi A. Late onset psychogenic nonepileptic attacks. Neurology 2006;66:1644-1647.
24. Lattanzi S, Trinka E, Del Giovane C, Nardone R, Silvestrini M, Brigo F. Antiepileptic drug monotherapy for epilepsy in the elderly: A systematic review and network meta-analysis. Epilepsia 2019;60:2245-2254.
25. Lezaic N, Gore G, Josephson CB, Wiebe S, Jette N, Keezer MR. The medical treatment of epilepsy in the elderly: A systematic review and meta-analysis. Epilepsia 2019;60:1325-1340.
26. Voglein J, Ricard I, Noachtar S, et al. Seizures in Alzheimer’s disease are highly recurrent and associated with a poor disease course. J Neurol 2020;267:2941-2948.
27. Hesdorffer DC, Hauser WA, Annegers JF, Kokmen E, Rocca WA. Dementia and adult-onset unprovoked seizures. Neurology 1996;46:727-730.
28. Palop JJ, Chin J, Roberson ED, et al. Aberrant excitatory neuronal activity and compensatory remodeling of inhibitory hippocampal circuits in mouse models of Alzheimer’s disease. Neuron 2007;55:697-711.
29. Stefanidou M, Beiser AS, Himali JJ, et al. Bi-directional association between epilepsy and dementia: The Framingham Heart Study. Neurology 2020;95:e3241-e3247.
30. Johnson EL, Krauss GL, Kucharska-Newton A, et al. Dementia in late-onset epilepsy: The Atherosclerosis Risk in Communities study. Neurology 2020;95:e3248-e3256.
31. Joutsa J, Rinne JO, Hermann B, et al. Association Between Childhood-Onset Epilepsy and Amyloid Burden 5 Decades Later. JAMA Neurol 2017;74:583-590.
32. Foster E, Malpas CB, Ye K, et al. Antiepileptic drugs are not independently associated with cognitive dysfunction. Neurology 2020;94:e1051-e1061.
33. Witt JA, Werhahn KJ, Kramer G, Ruckes C, Trinka E, Helmstaedter C. Cognitive-behavioral screening in elderly patients with new-onset epilepsy before treatment. Acta Neurol Scand 2014;130:172-177.
34. Nardi Cesarini E, Babiloni C, Salvadori N, et al. Late-Onset Epilepsy With Unknown Etiology: A Pilot Study on Neuropsychological Profile, Cerebrospinal Fluid Biomarkers, and Quantitative EEG Characteristics. Front Neurol 2020;11:199.
35. Thom M, Liu JY, Thompson P, et al. Neurofibrillary tangle pathology and Braak staging in chronic epilepsy in relation to traumatic brain injury and hippocampal sclerosis: a post-mortem study. Brain 2011;134:2969-2981.
36. Tai XY, Koepp M, Duncan JS, et al. Hyperphosphorylated tau in patients with refractory epilepsy correlates with cognitive decline: a study of temporal lobe resections. Brain 2016;139:2441-2455.
37. Voglein J, Noachtar S, McDade E, et al. Seizures as an early symptom of autosomal dominant Alzheimer’s disease. Neurobiol Aging 2019;76:18-23.
38. Vossel K, Ranasinghe KG, Beagle AJ, et al. Effect of Levetiracetam on Cognition in Patients With Alzheimer Disease With and Without Epileptiform Activity:
A Randomized Clinical Trial. JAMA Neurol 2021;78:1345-1354.
der informierte @rzt
- Vol. 13
- Ausgabe 4
- April 2023