- Fallbeispiel aus der Praxis

Kardiovaskuläres Risiko und renales Risiko?
Der Hausarzt benötigt zur Beantwortung dieser Fragen Kenntnisse der neusten wichtigsten Studie (Selbststudium, Weiterbildungen). Was sind die Richtlinien zu Hypertonie, Lipiden und Diabetes? Was sind die Werte der Patientin, welche wichtigen Fragen sind zu stellen? Welche Medikamente oder Kombinationen werden von den Krankenkassen rückvergütet?
HbA1c als Kontrollwert ein wichtiges Therapieziel
Ein gutes HbA1c ist immer noch wichtig, um mikro- und makrovaskuläre Komplikationen zu vermeiden. < 7.0 % bei Patienten ohne Sulfonylharnstoffe und/oder Insulin, am besten <6.5 % (möglichst normal) ohne Gefahr für Hypoglykämie. <8.0 % bei älteren Patienten (> 80 Jahre) und/oder bei bereits manifesten Komorbiditäten (Niereninsuffizienz, Herzinsuffizienz, kardiovaskulären Erkrankungen) und Insulintherapie.
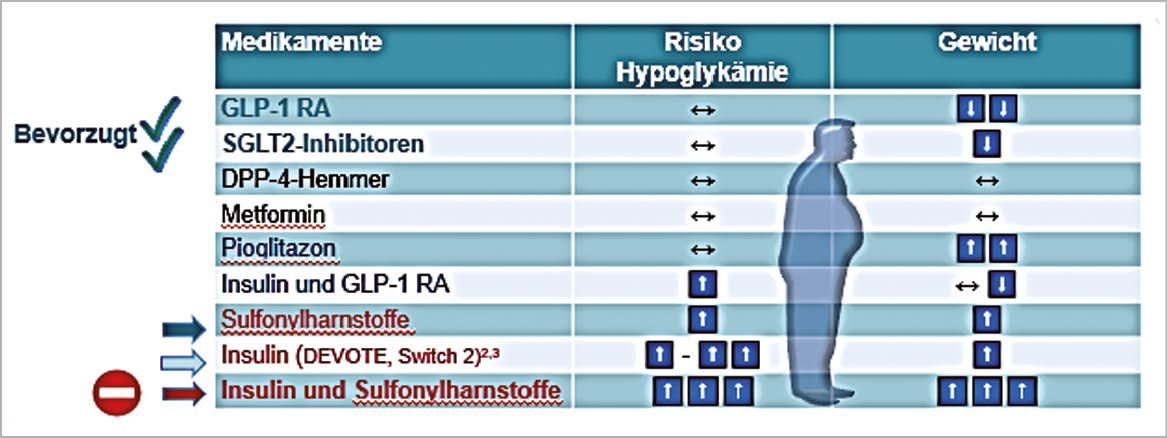
Therapie des T2DM: Bedenken der Patienten in Bezug auf Hypoglykämien und Gewichtszunahme
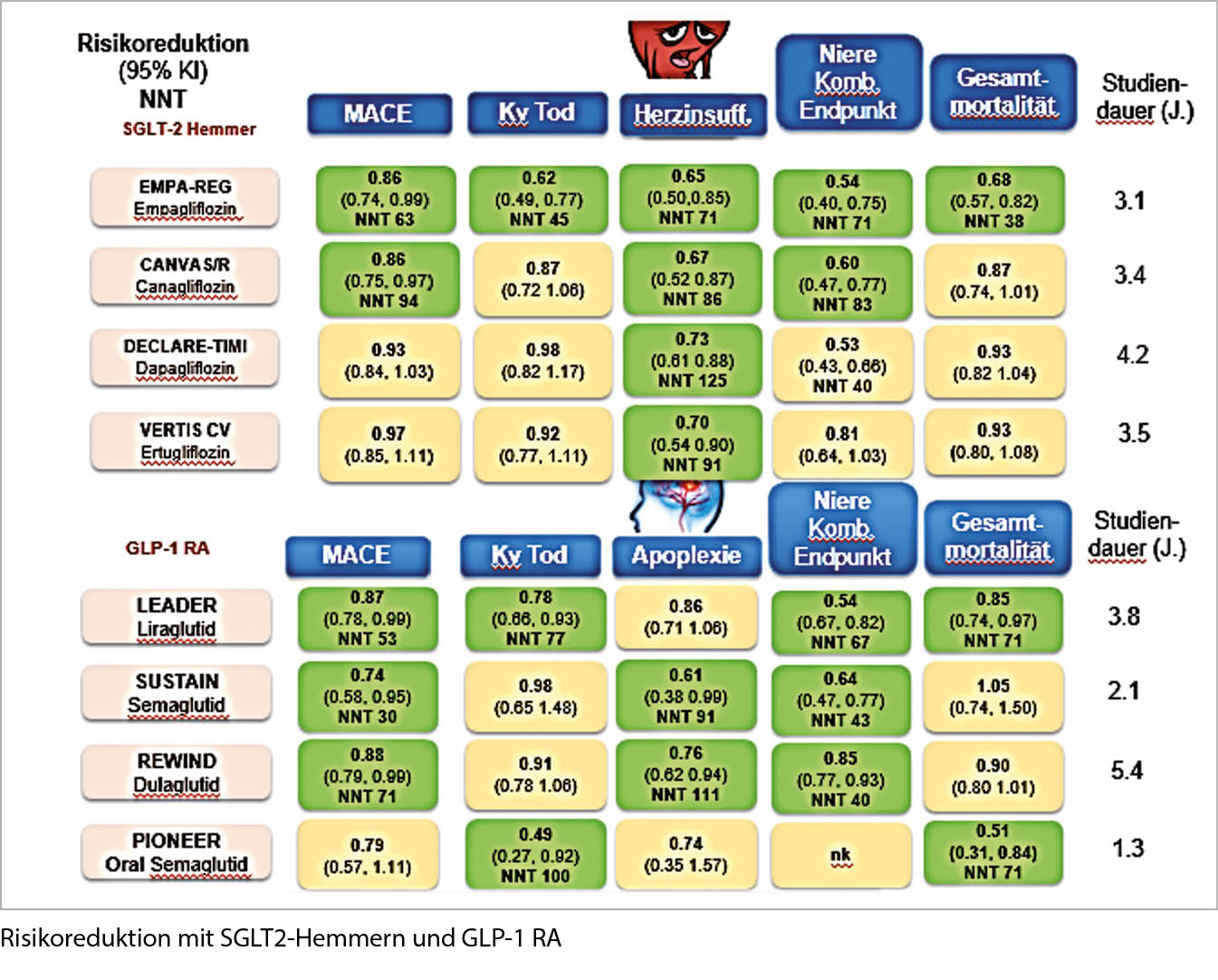
Prävention einer Nierenschädigung und Auftreten von Herzinfarkt und Schlaganfall bei T2DM durch GLP-1-RA und SGLT2-Hemmer. Die GLP-1-RA erhöhen die Insulinausschüttung und vermindern die Glukagonausschüttung, bewirken eine Appetit-Hemmung und führen zum Gewichtsverlust. Nebenwirkungen sind Übelkeit und Erbrechen. Die SGLT2-Hemmer reduzieren die Glukoserückresorption in der Niere und erhöhen dadurch die Glukoseausschüttung (-70g/Tag). Nebenwirkungen der SGLT2-Hemmer sind Infektionen des Genitaltrakts, 300-500ml grösseres Herzvolumen und Ketoazidose (Insulinmangel).
Situation in der Schweiz 2021
1. Insulinmangel? Besteht bei ca. 25 % aller Patienten. Wichtigste Frage, sollte immer gestellt werden!
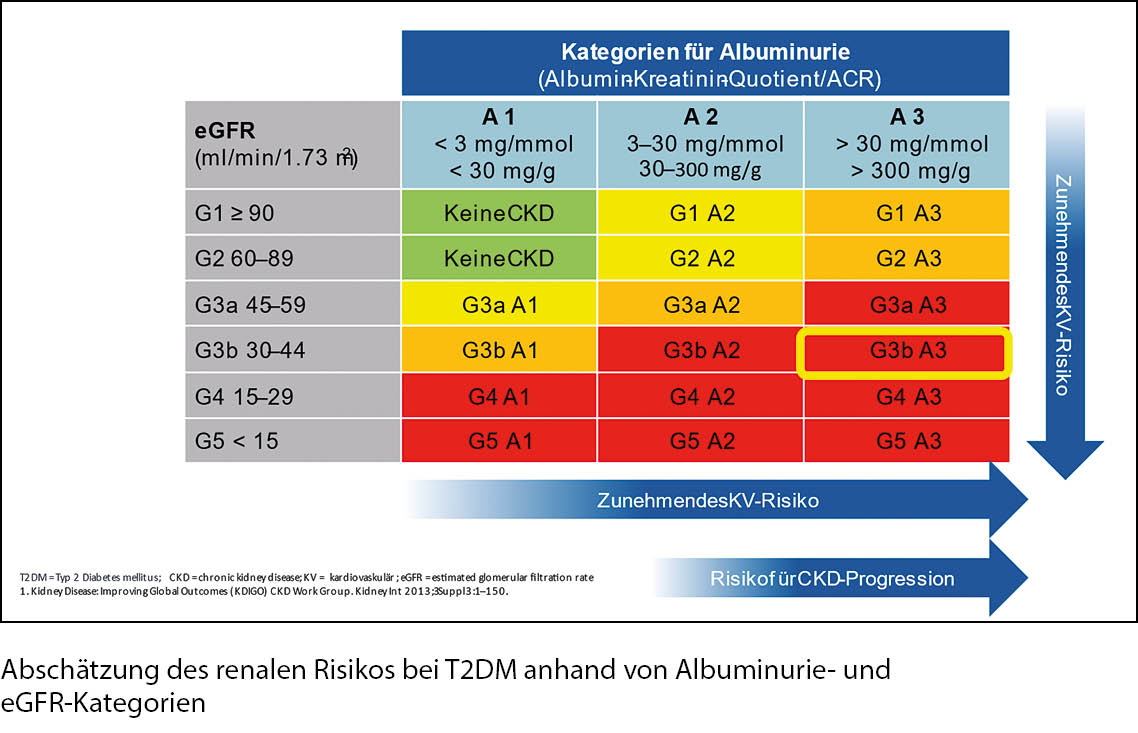
2. eGFR < 60ml/min: ca. 25 % aller Patienten. Nephroprotektion durch SGLT2-Hemmer, GLP-1-RA
3. Symptomatische kardiovaskuläre Erkrankung 25-32 %, asymptomatisch ca. 25 %.
4. Herzinsuffizienz ca. 10 % aller Patienten, bei ca. 25 % asymptomatisch, Diagnose in der Praxis schwierig, SGLT2-Hemmer. (HFrEF ¼, HFpEF ¾).
Welche initiale Therapie bei Diabetes? Metformin + SGLT2-Hemmer oder Metformin + GLP-1-RA?
Bezüglich MACE haben beide Kombinationen die gleichen Vorteile, die Nephroprotektion ist bei den SGLT2-Hemmern etwas ausgeprägter, im Hinblick auf Schlaganfall gibt es nur bei den GLP-1-RA einen Vorteil, bei Herzinsuffizienz nur bei den SGLT2-Hemmern. Der Gewichtsverlust ist bei den GLP-1-RA ausgeprägter als bei den SGLT2-Hemmern, eine orale Therapie existiert nur für die GLP-1-RA.
Alle Vorteile sprechen für eine Kombination GLP-1-RA + SGLT2-Hemmer.
Stellenwert der DPP-4-Hemmer: Die Zusammenfassung der primären Endpunkte der Studien mit DPP-4-Hemmern ergibt keinen Effekt auf MACE.
Warum werden DPP-4-Hemmer trotzdem so häufig eingesetzt?
DPP-4 Hemmer senken HbA1c zuverlässig. Sie senken damit auch mikro- und makrovaskuläre Komplikationen (über einen längeren Zeitraum). DPP-4-Hemmer haben keine Nebenwirkungen und können einfach verschrieben werden. Sie verursachen keine Hypoglykämien und keine Gewichtszunahme. Sie sind eine Alternative (2. Wahl) für GLP-1-RA (BMI <28). Sie sollten langsam durch GLP-1-RA ersetzt werden (auch oral).
Essentielle Empfehlungen für Allgemeininternisten (SGED/SSED 2020)
Die Motivation für Veränderungen der Lebensgewohnheiten ist sehr wichtig. Die Behandlung soll multifaktoriell erfolgen. Als Erstlinientherapie wird Metformin + GLP-1-RA oder Metformin + SGLT2-Hemmer empfohlen, als zweite Linie + SGLT2-Hemmer (bei Erstlinie Metformin + GLP-1-
RA) bzw. + GLP-1-RA. Als dritte Linie in beiden Fällen + Basalinsulin oder Sulfonylharnstoffe (Gliclazid). Darauf Basal-Bolus Insulin oder Mischinsulin. Weiterfahren mit Metformin, SGLT2-Inhibitoren, GLP-1-RA. Stopp Sulfonylharnstoffe und DPP-4-Hemmer (bei Patienten mit tiefem bis mässigem kardiovaskulärem Risiko oder ohne Risikofaktoren können DPP-4-Hemmer oder Sulfonylharnstoffe (Gliclazid bevorzugt) angewendet werden).
Es sollen aber auch die weiteren Risikofaktoren, Hypertonie und Lipide behandelt werden. Im Vergleich mit Hypertonie und Diabetes findet LDL-Cholesterin viel weniger Beachtung (Zielerreichung 72 %, 81 % und 20 %). Eine LDL-Cholesterinsenkung über den Zeitraum von 50 Jahren (Mendel’sche Randomisierungsstudien) reduziert das relative Risiko für ein kardiovaskuläres Ereignis um ca. 50 – 55 % pro mmol/l LDL-Cholesterin.
Die Behandlung einer Dyslipidämie umfasst eine Ernährungsumstellung (weniger Kohlenhydrate und Alkohol), mehr Bewegung und falls notwendig den Einsatz eines Statins. Die Ernährungsumstellung und die Alkoholeinschränkung reduziert vor allem die Triglyzeride. Die Richtlinien der ESC empfehlen bei moderatem Risiko einen LDL-C Zielwert <2.6 mmol/l (I/A)), bei hohem Risiko < 1.8 mmol/l und mindestens 50 % LDL-Cholesterinsenkung (I/A). Bei sehr hohem Risiko <1.4 mmol/l und 50 % LDL-Cholesterinsenkung (I/B). Statine sind bevorzugte 1. Linientherapie (I/A), falls Ziel nicht erreicht, Zugabe von Ezetimibe (I/B) und bei sehr hohem Risiko bei max. Statindosis und Ezetimibe oder bei Statinunverträglichkeit die Zugabe eines PCSK9-Hemmers (I/A).
Die optimale Therapie bei unserer Patientin mit Typ-2-Diabetes mellitus umfasst einen ACE-Hemmer + Ca-Blocker (Coveram® 10/10 1-0-0), Statin + Ezetimibe (Rosuvastatin / Ezetimibe 20/10 1-0-0, Stopp DPP-4-Hemmer, Metformin + SGLT2-Inhibitor (Xigduo® XR 10/1000 1-0-0, Jardiance® Met 5/500 1-0-1, GLP-1-
RA (Ozempic® 1 mg/Woche).
Resultate nach 4 Monaten:
Blutdruck 137/76 mmHg 🙂
LDL-C 1.5 mmol/l 🙂
HbA1c 6.9 % 🙂
Gewichtsabnahme 6 kg 🙂
Copyright bei Aerzteverlag medinfo AG
UniversitätsSpital Zürich
Rämistrasse 100
8091 Zurich
Roger.Lehmann@usz.ch
Der Autor deklariert Teilnahme an Advisory Boards und Referentenhonorare von Novo Nordisk, Sanofi, MSD, Boehringer Ingelheim, Servier und Astra Zeneca.