- Hämochromatose, Diagnose und Behandlung
Die Hämochromatose ist eine rezessive genetische Erkrankung mit variabler Penetranz, welche zu einer erhöhten Eisenaufnahme aus dem Darm führt. Als Folge kommt es zu einer Eisenüberladung verschiedener Organe, hauptsächlich in der Leber. Zum Suchen einer Eisenüberladung ist die Messung des Ferritinspiegels und der Transferrinsättigung in nüchternem Zustand der erste diagnostische Schritt. Die genetischen Mutationen, die der Krankheit zugrunde liegen, sind vielfältig und je nach ethnischer Gruppe unterschiedlich häufig. Die Therapie durch Aderlässe ist sehr wirksam und sollte nicht durch das Abwarten des Ergebnisses der genetischen Analysen verzögert werden. Eine neue Klassifizierung der Krankheit trägt zur besseren Erfassung der genetischen Komplexität bei und erleichtert dem Grundversorger die Betreuung betroffener Patienten.
Haemochromatosis is a recessive genetic disease with variable penetrance, which leads to increased iron absorption from the intestine. This results in iron overload in various organs, mainly in the liver. The first diagnostic step in the search for iron overload is to measure the ferritin level and transferrin saturation in a fasting state. The genetic mutations underlying the disease are diverse and vary in frequency depending on the ethnic group. Treatment by phlebotomy is very effective and should not be delayed by waiting for the results of genetic analysis. A new classification of the disease contributes to a better understanding of the genetic complexity and makes it easier for primary care providers to care for affected patients.
Key words: Haemochromatosis , genetic disease, iron overload
Einleitung und Übersicht
Die Hämochromatose ist eine genetische Erkrankung, die zu einer Störung der Eisenhomöostase mit einer Eisenüberladung im Gewebe führt. Die Krankheit wird durch Mutationen in mindestens fünf Genen verursacht. Dazu gehören sowohl HFE- als auch nicht-HFE-Gene (1). Diese vererbbaren Mutationen beeinträchtigen die Funktion von Hepcidin. Als zentraler Regulator der Eisenhomöostase kontrolliert Hepcidin die Eisenaufnahme im Darm und die Eisenfreisetzung aus Makrophagen durch die Interaktion mit dem Eisen-Exporter Ferroportin (2–4).
Die Penetranz der Mutationen, insbesondere der häufigen HFE-Mutationen, ist sehr variabel und das Vorliegen einer Mutation führt nicht zwangsläufig zu einer Eisenüberladung. Deshalb basiert die Diagnose der Hämochromatose auf phänotypischen Merkmalen, die durch biochemische und radiologische Befunde unterstützt werden. Die genetischen Tests erlauben aber eine präzise molekulare Charakterisierung.
Diagnostik der Hämochromatose
Bei der Anamnese und der klinischen Untersuchung sollte nach hepatischen und extrahepatischen Manifestationen der Eisenüberladung gesucht werden. Zu diesen gehören Müdigkeit, Anzeichen einer Leberzirrhose, endokrinologische Komplikationen (Diabetes, Hypothyreose, Nebenniereninsuffizienz sowie sexuelle oder reproduktive Störungen), kardiologische Komplikationen (darunter Arrhythmien und Herzinsuffizienz), muskuloskelettale Beschwerden (Arthralgien oder Frakturen im Rahmen einer möglichen sekundären Osteoporose) sowie Hyperpigmentierung der Haut. Arthralgien werden einer Studie zufolge von etwa 85 % der Patienten angegeben, vor allem in den Sprunggelenken, Hüften, Händen (typischerweise im zweiten und dritten Metakarpophalangealgelenk) und Handgelenken (5). Die Hämochromatose-Arthropathie präsentiert sich klinisch ähnlich wie eine Arthrose, tritt jedoch bereits bei deutlich jüngeren Patienten auf und ist durch zahlreiche Osteophyten und einen raschen Knorpelverlust gekennzeichnet (5).
Die Eisenüberladung, Transferrinsättigung > 50 % und Ferritin > 300 µg/L bei Männern beziehungsweise > 45 % und > 200 µg/L bei Frauen, sollte primär durch die Messung der Transferrinsättigung gesucht werden, die die erste biochemische Manifestation der Erkrankung darstellt. Transferrin, ein Glykoprotein, ist für den Transport von Eisen in die extrazelluläre Umgebung verantwortlich. Der Wert der Transferrinsättigung unterliegt zirkadianen Schwankungen, daher sollte die Blutentnahme morgens erfolgen. Nüchternheit scheint die diagnostische Aussagekraft nicht zu verbessern (6). Des Weiteren ist zu beachten, dass Alkoholkonsum den Wert der Transferrinsättigung erhöhen kann (7). Ausserdem bleibt der Wert der Transferrinsättigung, selbst nach wirksamer Aderlass-Therapie, tendenziell hoch (1).
Ferritin ist der intrazelluläre Eisenspeicher. Eine Hyperferritinämie ist jedoch nicht spezifisch für die Hämochromatose, sondern kann auch bei systemischer Entzündungen, metabolischem Syndromen, akuter oder chronischer Hepatopathie (inklusiv viraler Hepatitis) und Alkoholkonsum auftreten (8, 9). Bei den oben beschriebenen Krankheiten kann die Hyperferritinämie gelegentlich auch auf eine Eisenüberladung hinweisen, dort gibt es aber keine Evidenz für den Nutzen einer Phlebotomie (10). Bei Hepatitis C und Alkoholkonsum kann eine erworbene Suppression des Hepcidins eine Rolle spielen (11).
Ein isoliert erhöhtes Ferritin korreliert in weniger als 10 % der Fälle mit einer tatsächlichen Eisenüberladung (12), weshalb alternative Ursachen einer Hyperferritinämie ausgeschlossen werden sollten, damit unnötige genetische Tests vermieden werden (13). Die Bestimmung von Hepcidin wird aufgrund variierender Werte je nach eingesetztem Assay und fehlendem internationalen Standard nicht empfohlen (14).
Vor der Diagnosestellung einer Hämochromatose sollte eine Anämie mit sekundärer Eisenüberladung ausgeschlossen werden, da diese Erkrankungen unterschiedliche Ursachen und dementsprechend andere Behandlungsansätze haben. Nicht-transfusionsabhängige Anämien führen aufgrund der ineffizienten Erythropoese zu einer erhöhten Produktion von Erythroferron in den Erythroblasten. Erythroferron führt dann zu Reduktion der Hepcidin Produktion in der Leber (15–17). Transfusionsabhängigen Anämien führen durch repetitive Erythrozyten-Transfusionen zu einer Eisenüberladung (18). Aderlässe sind bei diesen Anämien aufgrund der begleitenden Anämie nicht angezeigt.
Die Bestimmung der Eisenüberladung durch serologische Bestimmung des Eisenstatus ist oft nicht ausreichend spezifisch. Früher war die Leberbiopsie der Goldstandard. Heute wird jedoch die nicht-invasive Bestimmung des Lebereisengehalts mittels MRT bevorzugt, wobei es verschiedene Protokolle ohne internationalen Konsens gibt (10). Bei Patienten mit erhöhten Eisenindizes und Homozygotie für C282Y kann die Diagnose Hämochromatose gestellt werden, ohne dass eine MRT erforderlich ist. Eine Leber-MRT kann jedoch Aufschluss über den Schweregrad der Eisenüberladung geben. Bei Patienten mit anderen Mutationen oder zusätzlichen Risikofaktoren kann eine nicht-invasive Eisenmessung mittels MRT hilfreich sein, um die Notwendigkeit einer Behandlung besser einzuschätzen.
Genetische Varianten und neue Klassifikation
In der Vergangenheit wurde angenommen, dass die Hämochromatose hauptsächlich durch Mutationen im HFE-Gen (insbesondere die Variante C282Y) verursacht wird. Diese Mutation, die in der nordeuropäischen Bevölkerung weit verbreitet ist (19, 20), kommt jedoch in grossen Teilen der Welt, beispielsweise in afrikanischen, asiatischen und indischen Ländern, selten vor oder wurde bisher nicht nachgewiesen (1).
Die Heterogenität und Komplexität der genetischen Defekte, welche die Hämochromatose begünstigen, sowie die fortschreitende Erkennung dieser Defekte dank der Next-Generation-Sequencing (NGS)-Techniken, haben in den letzten Jahren zu einer neuen Klassifikation der Hämochromatose geführt. Diese Klassifikation wurde 2021 von einer Arbeitsgruppe der International Society for the Study of Iron in Biology and Medicine (BIOIRON Society) entwickelt. Diese zielt darauf ab, die genetische Komplexität besser zu berücksichtigen und die Diagnose und Behandlung von Patienten mit Eisenstoffwechselstörungen für Grundversorger zu vereinfachen und somit nicht zu verzögern. Die neue Klassifikation unterscheidet zwischen HFE-assoziierten und nicht-HFE-assoziierten Mutationen sowie di-genetischen oder nicht-molekular definierten Mutationen (Tab. 1).
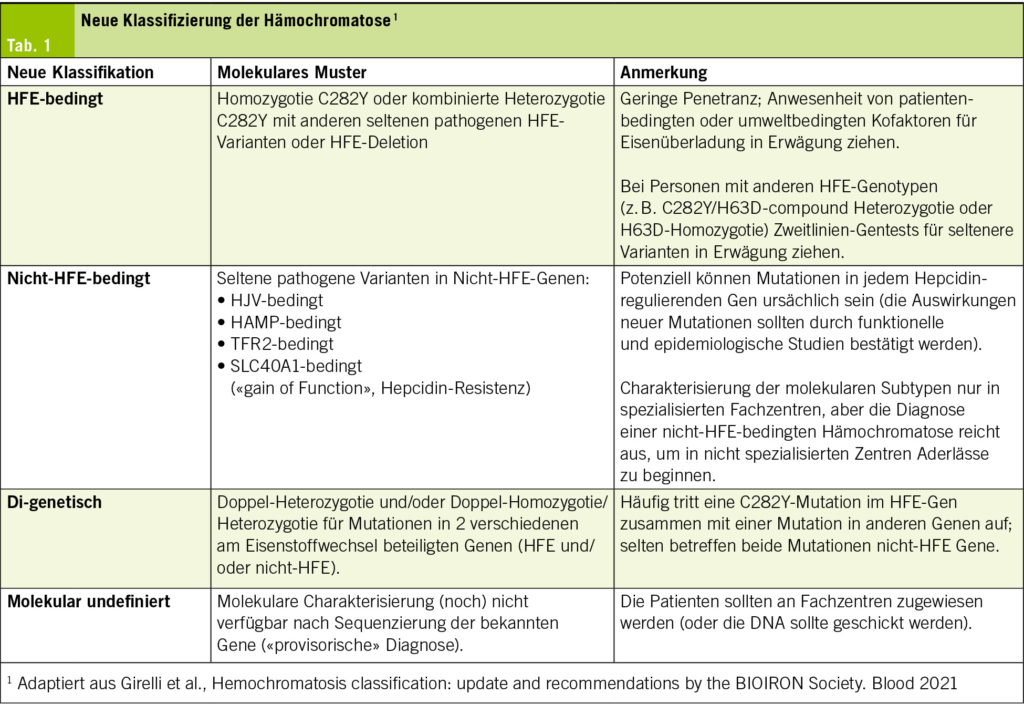
HFE-Mutationen
Bei den HFE-bezogenen Mutationen ist die homozygote C282Y Mutation am häufigsten. Diese tritt bei etwa 80 % der europäischen Patienten mit diagnostizierter Hämochromatose auf (21), wobei die Prävalenz von Nord- nach Südeuropa abnimmt. Die Penetranz der Krankheit ist selbst bei Patienten mit klassischer Homozygotie für C282Y sehr unterschiedlich und schwer zu prognostizieren. Das Auftreten einer klinisch relevanten Eisenüberladung wird von mehreren Umweltfaktoren-, Lebensstil- und wahrscheinlichen genetischen Kofaktoren beeinflusst. Daher wird die Hämochromatose nicht als monogenetische Krankheit angesehen (22). Die Penetranz der Erkrankung mit Eisenüberladung und Organschäden beträgt bei homozygoter C282Y-Mutation weniger als 50 % bei Männern und ist bei Frauen aufgrund der protektiven Wirkung der Menstruation noch tiefer. Die biochemische Penetranz (erhöhte Serumeisenmarker) ist jedoch höher (23, 24). Genetische Analysen sollten daher niemals vor einer phänotypischen Evaluation erfolgen, da sie allein nicht für die Diagnose der Hämochromatose ausreichen (10). Der Nachweis einer C282Y-Homozygotie zusammen mit erhöhten Serum-Eisenwerten (Ferritin- und Transferrin-Sättigung) sind jedoch ausreichend, um die Diagnose einer Hämochromatose zu stellen.
Die H63D-Mutation ist weit verbreitet und kann eine leichte Eisenüberladung begünstigen, aber weder die Homozygotie H63D noch die kombinierte Heterozygotie C282Y und H63D sind ausreichend für die Entwicklung einer Hämochromatose (25,26). Experten sind daher der Meinung, dass die Untersuchung der H63D-Variante im Diagnoseprozess der Hämochromatose nicht angezeigt ist (10). Im Falle einer relevanten Eisenüberladung mit Nachweis dieser Mutationen muss nach anderen begünstigenden Kofaktoren oder anderen selteneren genetischen nicht-HFE-Mutationen gesucht werden (25, 26).
Nicht-HFE-Mutationen
Zu den nicht-HFE-assoziierten Varianten gehören Mutationen in den Genen TFR2 (Transferrinrezeptor), SLC40A1 (Ferroportin), HAMP (Hepcidin) oder HJV (Hämojuvenil), wobei die beiden letzteren schweren Phänotypen mit früher kardialer und endokriner Beteiligung verursachen. Bei kaukasischen Patienten mit bestätigter Eisenüberladung ohne Nachweis einer HFE-Mutation, bei sehr jungen Patienten oder bei PatienteSchliesslich existieren di-genetische Formen mit Mutationen in zwei am Eisenstoffwechsel beteiligten Genen (sowohl HFE- als auch nicht-HFE-bezogen) und molekulargenetisch nicht definierten Formen. Bei Patienten mit Homozygotie für C282Y und einer schweren Form der Krankheit mit frühem Beginn sollte deshalb nach di-genetischen Mutationen gesucht werden. Bei Betroffenen, bei welchen klinisch eine Hämochromatose vorliegt, ohne dass Kofaktoren oder eine C282Y-Homozygotie nachgewiesen werden können – dies schliesst auch Patienten mit C282Y/H63D-Heterozygotie oder H63D-Homozygotie ein – muss die Diagnose einer molekular nicht definierten Hämochromatose in Betracht gezogen werden und eine Therapie eingeleitet werden (1). n nicht-kaukasischer Herkunft sollte nach Mutationen in diesen Genen gesucht werden (27).
Schliesslich existieren di-genetische Formen mit Mutationen in zwei am Eisenstoffwechsel beteiligten Genen (sowohl HFE- als auch nicht-HFE-bezogen) und molekulargenetisch nicht definierten Formen. Bei Patienten mit Homozygotie für C282Y und einer schweren Form der Krankheit mit frühem Beginn sollte deshalb nach di-genetischen Mutationen gesucht werden. Bei Betroffenen, bei welchen klinisch eine Hämochromatose vorliegt, ohne dass Kofaktoren oder eine C282Y-Homozygotie nachgewiesen werden können – dies schliesst auch Patienten mit C282Y/H63D-Heterozygotie oder H63D-Homozygotie ein – muss die Diagnose einer molekular nicht definierten Hämochromatose in Betracht gezogen werden und eine Therapie eingeleitet werden (1).
Ferroportin Mutationen
Mutationen im Ferroportin (SLC40A1) Gen sind explizit erwähnenswert, da diese sich sowohl klinisch als auch pathophysiologisch von der Hämochromatose unterscheiden (28, 29). Mutationen im SLC40A1 Gen können zu einem Funktionsverlust des membranständigen Eisentransporters führen (loss-of-function). Aufgrund Unfähigkeit des Exports von intrazellulärem Eisen führt dies hauptsächlich zu einer Eisenüberladung in der Milz und in viel geringerem Ausmass in der Leber. Der Grund liegt darin, dass hauptsächlich die Makrophagen der Milz am Abbau gealterter Erythrozyten beteiligt sind. So kommt es zu einer intrazellulären Eisenüberladung der Makrophagen in der Milz. Obwohl die Ferritinwerte bei dieser Erkrankung oft sehr hoch sind, findet sich meist eine normale oder sogar erniedrigte Transferrinsättigung und eine Therapie mit Aderlässen führt häufig zur Entwicklung einer Anämie (1). Die genetische Transmission dieser Mutationen ist, im Gegensatz zur Hämochromatose, autosomal dominant. Bei den wesentlich selteneren Mutationen mit erhöhter Aktivität des Ferroportin aufgrund einer Resistenz gegenüber der negativen Regulation durch Hepcidin (Hepcidin-Resistenz, gain-of-function) kommt es zu einer ungebremsten Absorption von Eisen im Duodenum trotz adäquat hochregulierten Hepcidin. Die Hepcidin-Resistenz führt schlussendlich zu einem klinischen Bild, welches mit jenem der HFE-assoziierten Hämochromatose identisch ist (30).
Sekundäre Organschädigungen
Ist die Diagnose einer Hämochromatose gestellt (Abb. 1), sollten sich alle Betroffenen einem nicht-invasiven Screening auf Leberfibrose mittels Leberelastographie oder des FIB-4-Serologiescores unterziehen. Allerdings existieren aktuell keine evidenzbasierten Empfehlungen für den Grenzwert zum Nachweis einer fortgeschrittenen Fibrose bei Patienten mit Hämochromatose. Die Grenzwerte könnten bei diesen Patienten niedriger sein als bei einer chronischen viralen Hepatitis, alkoholischen oder metabolischen Hepatopathie (31). Bei einem Ferritinwert von < 1000 µg/L ist das Risiko einer schweren Leberfibrose jedoch vernachlässigbar (32, 33). Das Risiko eines hepatozellulären Karzinoms bei Patienten mit Hämochromatose liegt bei 10–30 % und tritt fast ausschliesslich bei Patienten mit einer Zirrhose auf (34, 35). Bei Leberzirrhose ist daher ein halbjähriges Screening mittels Leberultraschall angezeigt (10). Die Messung von Alpha-Fetoprotein kann zusätzlich zu diesem Screening erfolgen (10).
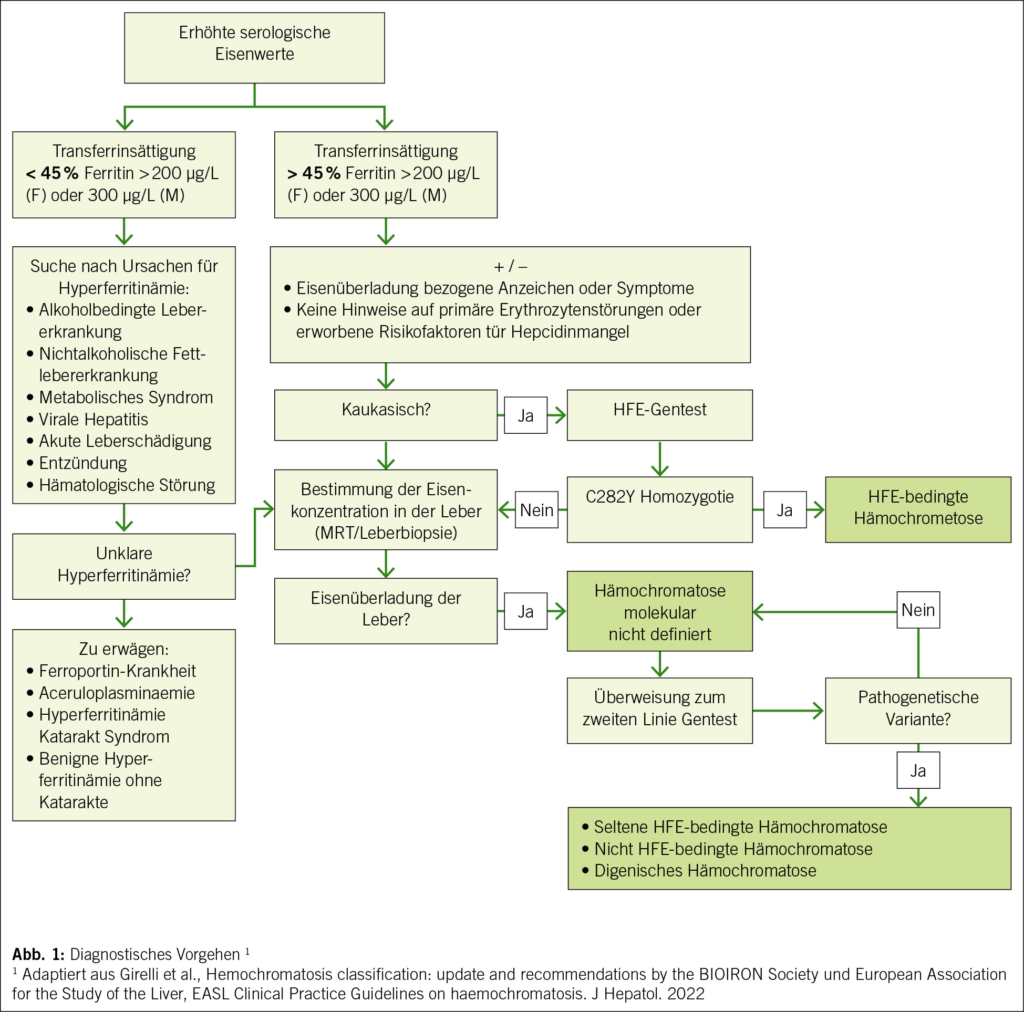
Bei Patienten mit schwerer Eisenüberladung, bei jungen Betroffenen und insbesondere bei Patienten mit Mutationen in den HJV- und HAMP-Genen ist auch eine kardiale Untersuchung mit EKG, Echokardiographie und kardialer MRT angezeigt. Bei klinischem Verdacht auf hormonelle Störungen sollten das Vorliegen von Diabetes, den Sexualhormonstatus sowie die Schilddrüsen-, Nebenschilddrüsen- und Nebennierenfunktion bestimmt werden.
Das Screening von Familienangehörigen beschränkt sich auf serologische Bestimmung des Eisenstatus mit Beginn im erwachsenen Alter. Ein genetisches Screening ist bei HFE-Mutationen aufgrund der variablen Penetranz nicht angebracht. Bei nicht-HFE-Mutationen oder molekular nicht definierten Mutationen sollte jedoch ein gezieltes genetisches bzw. phänotypisches Screening durchgeführt werden (10).
Die Behandlung der Hämochromatose
Die Behandlung der Hämochromatose besteht aus Aderlässen von etwa 400–500 ml, die in der Induktionsphase wöchentlich oder alle zwei Wochen durchgeführt werden, bis ein Ferritinwert von 50 µg/L erreicht ist (dies sollte nach zirka vier Aderlässen überprüft werden) (10). Es folgt eine Erhaltungsphase, in der das Ferritin zwischen 50–100 µg/L gehalten wird, mit Aderlässen (oder auch Blutspenden) alle ein bis vier Monate und Ferritinkontrollen alle sechs Monate. Der Hämoglobinwert ist vor jedem Aderlass zu überprüfen. Bei Werten unter 110 g/L sind die Aderlässe auszusetzen. Wichtig ist auch, die Folsäure und Vitamin B12 Spiegel bei diesen Patienten regelmässig zu überprüfen (10). Phlebotomien haben einen positiven Effekt auf die Müdigkeit, die Leberfibrose (auch in fortgeschrittenen Stadien) und das Überleben von Patienten mit Hämochromatose (36). Die Arthropathie zeigt ein deutlich geringeres Ansprechen und kann auch während der Erhaltungsphase auftreten (10).
Die Chelation mit oralem Deferasirox kann als Zweitlinientherapie bei Patienten mit schwierigem venösen Zugang, Nadelphobie, begleitender Anämie oder schwerer kardialer Eisenüberladung eingesetzt werden (10). Die Evidenz für diese Therapie ist jedoch begrenzt; sie ist bei fortgeschrittener Hepatopathie kontraindiziert und kann Nierenversagen und gastrointestinale Störungen als Nebenwirkungen verursachen (10). Eine relevante Entleerung der Eisenspeicher kann damit nicht erreicht werden, weshalb diese Therapie die Aderlässe in der Induktionsphase nicht ersetzen kann.
Bei der Diagnose Hämochromatose sollten alle Betroffenen, insbesondere solche mit begleitendem metabolischem Syndrom oder übermässigem Alkoholkonsum, eine angemessene Beratung zur dauerhaften Veränderung von Lebensstil und Essgewohnheiten erhalten, auch um unnötige Diäten auf eigene Initiative zu vermeiden. Es ist zu empfehlen, eisenhaltige Nahrungsergänzungsmittel abzusetzen, während über die Reduzierung des Verzehrs von Vitamin C und rotem Fleisch nur ein geringer Konsens besteht (10).
Copyright Aerzteverlag medinfo AG
Hämochromatose Sprechstunde
Klinik und Poliklinik für Innere Medizin
Universitätsspital Zürich
Rämistrasse 100
8091 Zürich
Hämochromatose Sprechstunde
Klinik und Poliklinik für Innere Medizin
Universitätsspital Zürich
Rämistrasse 100
8091 Zürich
Rare disease Sprechstunde
Klinik und Poliklinik für Innere Medizin
Universitätsspital Zürich
Rämistrasse 100
8091 Zürich
Die Autorenschaft hat keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
- Die Hämochromatose wird durch verschiedene HFE- und nicht-HFE-bedingte Mutationen verursacht. Ihre Prävalenz variiert je nach Ethnie und die Penetranz der Krankheit ist unterschiedlich.
- Die Diagnose basiert in erster Linie auf dem Nachweis einer Eisenüberladung. Die Bestimmung der Transferrinsättigung, des Ferritinspiegels und ein Blutbild sind die ersten diagnostischen Schritte.
- Die indirekte Bestimmung des Eisengehalts in der Leber mittels Magnetresonanztomographie ermöglicht es, die Leberbiopsie weitgehend zu ersetzen.
- Die Homozygotie H63D und die kombinierte Heterozygotie H63D und C282Y sind nicht diagnostisch für das Vorliegen einer Hämochromatose.
1. Girelli D, Busti F, Brissot P, Cabantchik I, Muckenthaler MU, Porto G. Hemochromatosis classification: update and recommendations by the BIOIRON Society. Blood 2021
2. Aschemeyer S, Qiao B, Stefanova D, et al. Structure-function analysis of ferroportin defines the binding site and an alternative mechanism of action of hepcidin. Blood. 2018;131(8):899-910.
3. Pan Y, Ren Z, Gao S, et al. Structural basis of ion transport and inhibition in ferroportin. Nat Commun. 2020;11(1): 5686.
4. Nemeth E, Tuttle MS, Powelson J, et al. Hepcidin regulates cellular iron efflux by binding to ferroportin and inducing its internalization. Science. 2004;306(5704): 2090-2093
5. Smith K, Fife-Schaw C, Dibb B, Griffiths W. Living with the impact of iron overload: report from a large survey of people with haemochromatosis. Haemocromatosis UK 2018. haemochromatosis.org.uk.
6. Adams PC, Reboussin DM, Press RD, Barton JC, Acton RT, Moses GC, et al. Biological variability of transferrin saturation and unsaturated iron- binding capacity. Am J Med 2007;120(999):e991–e997.
7. Ioannou GN, Weiss NS, Kowdley KV. Relationship between transferrin- iron saturation, alcohol consumption, and the incidence of cirrhosis and liver cancer. Clin Gastroenterol Hepatol 2007;5:624–629.
8. Knovich MA, Storey JA, Coffman LG, Torti SV, Torti FM. Ferritin for the clinician. Blood Rev. 2009;23(3):95-104.
9. Sandnes M, Ulvik RJ, Vorland M, Reikvam H. Hyperferritinemia-a clinical overview.
J Clin Med. 2021;10(9):2008.
10. European Association for the Study of the Liver. Electronic address eee, European Association for the Study of the L. EASL Clinical Practice Guidelines on haemochromatosis. J Hepatol. 2022;77:479–502
11. Girelli D, Nemeth E, Swinkels DW. Hepcidin in the diagnosis of iron disorders. Blood. 2016;127(23):2809-2813.
12. Cullis JO, Fitzsimons EJ, Griffiths WJ, Tsochatzis E, Thomas DW; British Society for Haematology. Investigation and management of a raised serum ferritin. Br J Haematol. 2018;181(3):331-340
13. Adams PC, Barton JC. A diagnostic approach to hyperferritinemia with a non- elevated transferrin saturation. J Hepatol. 2011;55(2):453-458.
14. Kroot JJ, van Herwaarden AE, Tjalsma H, Jansen RT, Hendriks JC, Swinkels DW. Second round robin for plasma hepcidin methods: first steps toward harmonization. Am J Hematol 2012;87:977–983.
15. Camaschella C, Nai A, Silvestri L. Iron metabolism and iron disorders revisited in the hepcidin era. Haematologica. 2020; 105(2):260-272.
16. Iolascon A, Andolfo I, Russo R. Congenital dyserythropoietic anemias. Blood. 2020; 136(11):1274-1283.
17. Santini V, Girelli D, Sanna A, et al. Hepcidin levels and their determinants in different types of myelodysplastic syndromes. PLoS One. 2011;6(8):e23109.
18. Pasricha SR, Frazer DM, Bowden DK, Anderson GJ. Transfusion suppresses erythropoiesis and increases hepcidin in adult patients with b-thalassemia major: a longitudinal study. Blood. 2013;122(1): 124-133.
19. Distante S, Robson KJ, Graham-Campbell J, Arnaiz-Villena A, Brissot P, Worwood M. The origin and spread of the HFE-C282Y haemochromatosis mutation. Hum Genet. 2004;115(4):269-279.
20. McCullough JM, Heath KM, Smith AM. Hemochromatosis: niche construction and the genetic domino effect in the European neolithic. Hum Biol. 2015;87(1): 39-58.
21. Porto G, Brissot P, Swinkels DW, Zoller H, Kamarainen O, Patton S, et al. EMQN best practice guidelines for the molecular genetic diagnosis of hereditary hemochromatosis (HH). Eur J Hum Genet 2016;24:479–495.
22. Pietrangelo A. Hereditary hemochromatosis: pathogenesis, diagnosis, and treatment. Gastroenterology. 2010;139(2):393-408, 408 e391-392
23. Allen KJ, Gurrin LC, Constantine CC, Osborne NJ, Delatycki MB, Nicoll AJ, et al. Iron-overload-related disease in HFE hereditary hemochromatosis. N Engl J Med 2008;358:221–230.
24. Waalen J, Beutler E. Iron-overload-related disease in HFE hereditary hemochromatosis. N Engl J Med 2008;358:2293–2294. author reply 2294-2295.
25. Steinberg KK, Cogswell ME, Chang JC, Caudill SP, McQuillan GM, Bowman BA, et al. Prevalence of C282Y and H63D mutations in the hemochromatosis (HFE) gene in the United States. JAMA 2001;285: 2216–2222.
26. Neghina AM, Anghel A. Hemochromatosis genotypes and risk of iron overload-a meta-analysis. Ann Epidemiol 2011;21:1–14.
27. Sandhu K, Flintoff K, Chatfield MD, et al. Phenotypic analysis of hemochromatosis subtypes reveals variations in severity of iron overload and clinical disease. Blood. 2018;132(1):101-110.
28. Pietrangelo A. The ferroportin disease. Blood Cells Mol Dis. 2004;32(1): 131-138.
29. Pietrangelo A. Ferroportin disease: pathogenesis, diagnosis and treatment. Haematologica. 2017;102(12): 1972-1984.
30. Vlasveld LT, Janssen R, Bardou-Jacquet E, et al. Twenty years of ferroportin disease: a review or an update of published clinical, biochemical, molecular, and functional features. Pharmaceuticals (Basel). 2019; 12(3):132.
31. Chin J, Powell LW, Ramm LE, Hartel GF, Olynyk JK, Ramm GA. Utility of serum biomarker indices for staging of hepatic fibrosis before and after venesection in patients with hemochromatosis caused by variants in HFE. Clin Gastroenterol Hepatol 2020.
32. Guyader D, Jacquelinet C, Moirand R, Turlin B, Mendler MH, Chaperon J, et al. Noninvasive prediction of fibrosis in C282Y homozygous hemochromatosis. Gastroenterology 1998;115:929–936.
33. Morrison ED, Brandhagen DJ, Phatak PD, Barton JC, Krawitt EL, El- Serag HB, et al. Serum ferritin level predicts advanced hepatic fibrosis among U.S. patients with phenotypic hemochromatosis. Ann Intern Med 2003;138:627–633.
34. Tarao K, Nozaki A, Ikeda T, Sato A, Komatsu H, Komatsu T, et al. Real impact of liver cirrhosis on the development of hepatocellular carcinoma in various liver diseases-meta-analytic assessment. Cancer Med 2019;8:1054–1065.
35. Morcos M, Dubois S, Bralet MP, Belghiti J, Degott C, Terris B. Primary liver carcinoma in genetic hemochromatosis reveals a broad histologic spectrum. Am J Clin Pathol 2001;116:738–743.
36. Bomford A, Williams R. Long term results of venesection therapy in idiopathic haemochromatosis. Q J Med 1976;45:611–623.
der informierte @rzt
- Vol. 14
- Ausgabe 10
- Oktober 2024










