- Hypomagnesiämie für den Praktiker
Eine Hypomagnesiämie ist bei ambulanten und stationären Patienten häufig anzutreffen. Bei bestimmten Risikopatienten führt sie zu erheblichen zerebralen, kardiovaskulären und biologischen Beeinträchtigungen. Durch eine ausführliche Anamnese, die durch einfache Laboruntersuchungen ergänzt wird, kann in den meisten Fällen eine Diagnose gestellt werden. In diesem Artikel wird ein Ansatz zur praktischen Vorgehensweise bei der Diagnose und Behandlung von Magnesiummangel vorgeschlagen.
Hypomagnesemia is common in ambulatory and hospitalized patients. In some at-risk patients, it leads to significant cerebral, cardiovascular and biological damage. A detailed history, together with simple laboratory tests, allows a diagnosis to be made in most cases. The aim of this article is to propose a practical approach to the diagnosis and management of magnesium deficiency.
Key Words: Hypomagnesemia, TRPM6 and TRPM7 transporters
Magnesium (Mg) ist nach Kalium (K) das zweithäufigste intrazelluläre Kation. Mg spielt eine zentrale Rolle bei zahlreichen intrazellulären und extrazellulären Signalwegen. Es ist an Enzymreaktionen, der Nervenleitung, der neuromuskulären Erregbarkeit und der Immunantwort beteiligt (1). Eine Hypomagnesiämie ist sehr häufig. Sie findet sich bei etwa 14% der Allgemeinbevölkerung und bis zu 8% der Krankenhauspatienten (2, 3).
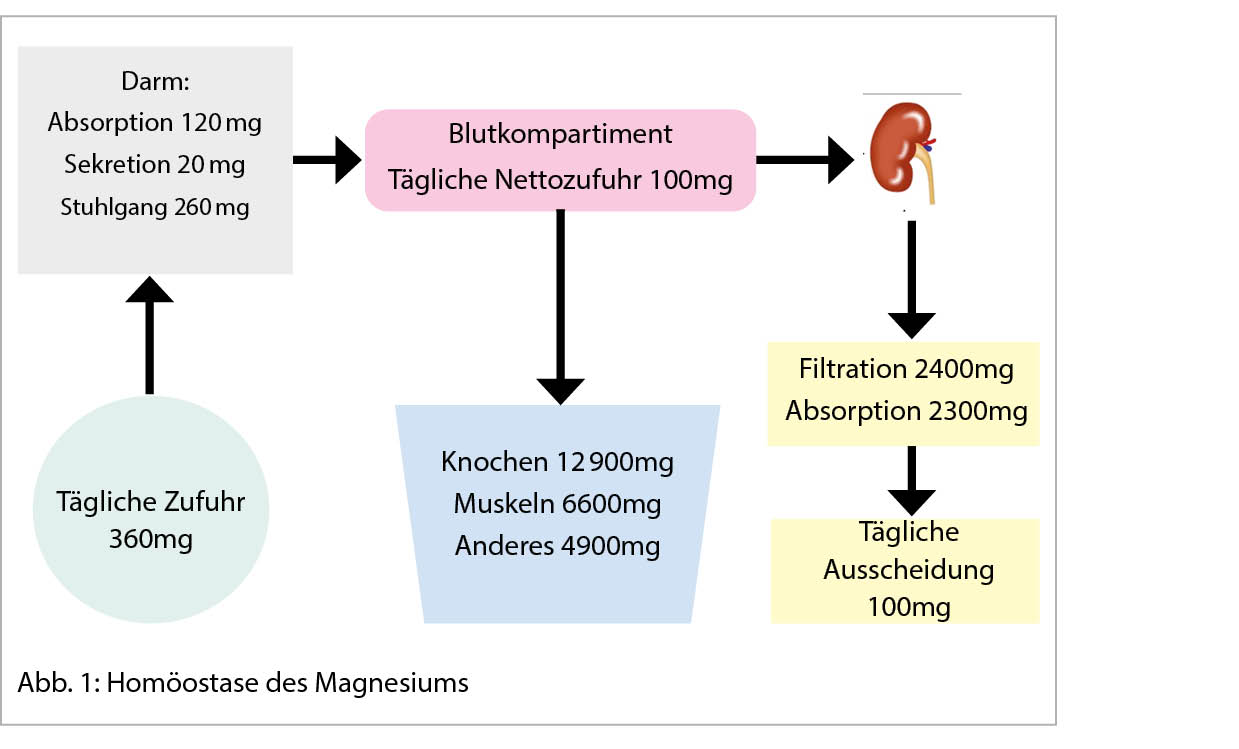
Magnesium-Homöostase (Abb. 1)
Der Körper enthält etwa 25g Magnesium, das überwiegend in intrazellulärer Form. Die Speicherung erfolgt zu 50-60% im Knochengewebe, zu 25-30% in Muskelzellen, zu 20-25 % in anderen Geweben und zu 1% im extrazellulären Umfeld (4). Das Serummagnesium macht 0,3% des Gesamt-Mg aus, wobei ein winziger Teil des freien Mg an den Zellaktivitäten teilnimmt. Es existiert in drei Formen: Frei und ionisiert als aktive Form (55% bis 70%), als an Proteine gebundene Form (30 %) und ein kleiner Teil (5 % bis 15 %) als Komplex an Phosphat, Bicarbonat, Citrat oder Sulfat gebunden (5). Die Plasmakonzentration von Mg liegt zwischen 0,7 und 1,1 mmol/l (4). Ein Erwachsener nimmt täglich zwischen 360mg und 420mg Mg zu sich. Die Absorption von ca. 120mg Mg erfolgt hauptsächlich im distalen Dünndarm, entweder passiv durch die parazelluläre Passage oder aktiv durch die transzelluläre Passage über bestimmte Transporter wie TRPM6 und TRPM7 (4). Die Regulierung von Mg erfolgt auf renaler Ebene mit einer Magnesurie zwischen 4 und 5 mmol/24h. Jeden Tag filtert die Niere bis zu 2,4 g Mg aus dem Blut. mit einer Ausscheidung von 5% im Urin und einer Rückresorption durch die Nephrone von 95% der verbleibenden Mg-Menge. Auf der Ebene des proximalen Tubulus contortus werden 15 bis 20% des Mg rückresorbiert. Der Grossteil der Absorption, 65-75%, findet im aszendenten Ast der Henle-Schleife statt. Hier wird der parazelluläre Transport durch den transepithelialen, elektrischen Gradienten begünstigt. Die interzellulären Verbindungen, die aus den Proteinen der Claudin-Familie bestehen (16 und 19), spielen eine entscheidende Rolle beim Mg-Transfer. Auf dem Niveau des distalen Tubulus contortus ist die finale Ausscheidungsfraktion von Magnesium (FeMg) definiert. Die Rückresorption von 5% bis 10% des gesamten Mg erfolgt auf aktivem transzellulärem Weg (Transporter TRPM6) am apikalen Zellpol.
Der Transportmechanismus über die basolaterale Seite der Zelle scheint unklar zu sein. Er hängt von Cyclin M2 und einer Na-K-ATPase-Pumpe ab, die sensibel auf die Mg-Konzentration ist (4, 5).
Symptome und Komplikationen
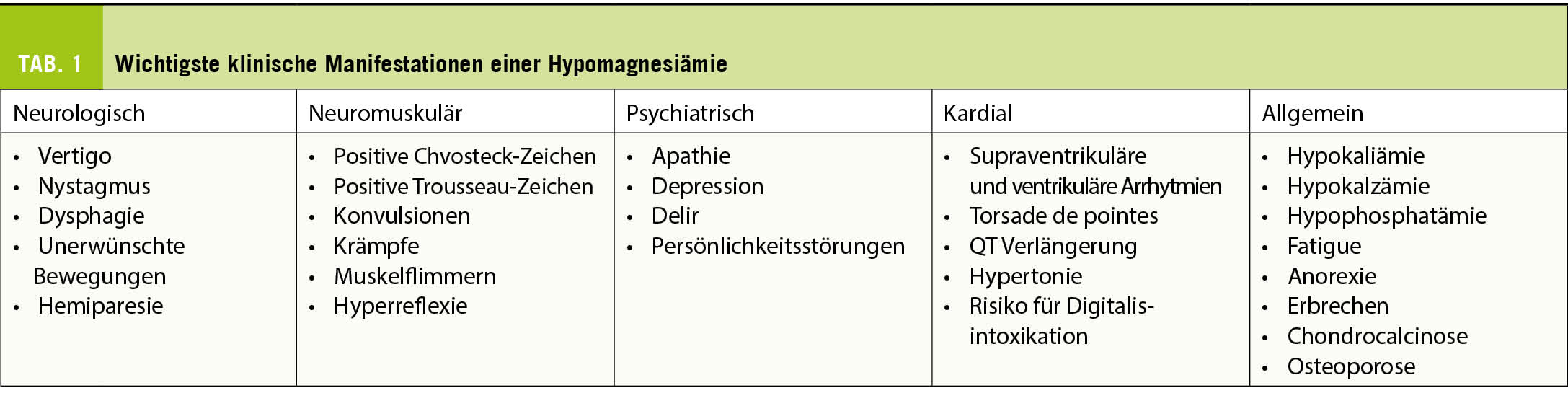
Die Symptome einer Hypomagnesiämie sind aspezifisch und vielfältig (Tab. 1). Bei einer mässigen Hypomagnesiämie können beim Patient Müdigkeit, Reizbarkeit, Unruhe oder Depressionen auftreten. Bei schwerer Hypomagnesiämie kann es zu Herzrhythmusstörungen kommen, zu Krampfanfällen oder Persönlichkeitsstörungen.
Die Komplikationen sind vor allem biologischer Art, mit einer Hypokalzämie infolge der Hemmung der Parathormonsekretion und einer Hypokaliämie, die auf eine Kaliumsupplementation nicht anspricht. Eine Chondrokalzinose kann sich durch Akkumulation von anorganischem Pyrophosphat entwickeln (6).
Ätiologie
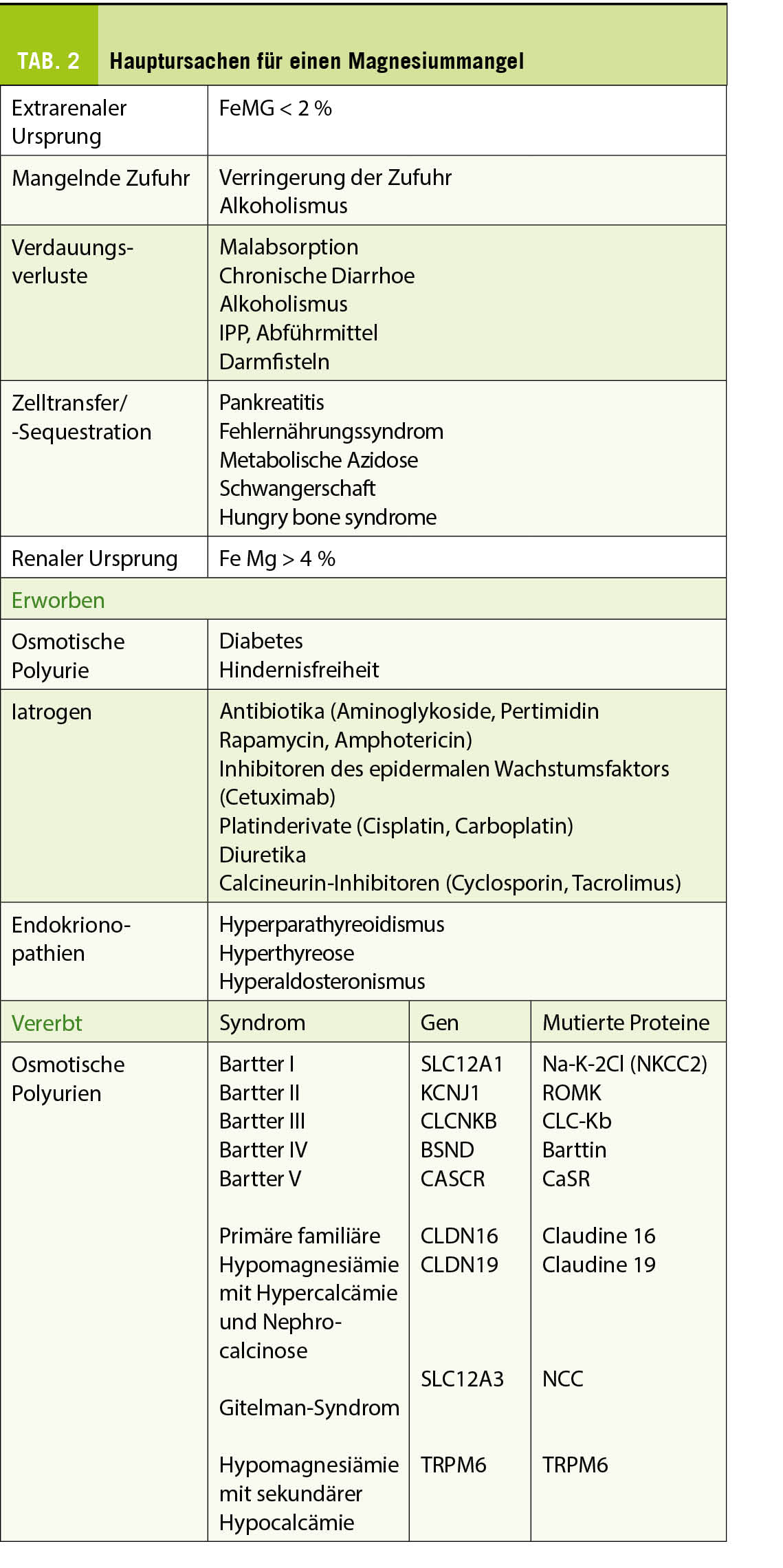
Bei einer Hypomagnesiämie unterscheidet man in der Regel renale und extrarenale Ursachen. Die wichtigsten Ätiologien sind in Tabelle 2 aufgelistet.
Verringerung der Zufuhr: Die notwendige tägliche Mg-Zufuhr beträgt 360mg für die Frau und 420mg für den Mann. Laut dem Schweizerischen Ernährungsbericht 2021 erreicht die Mehrheit der Bevölkerung über 18 Jahren die empfohlenen Tagesdosen nicht. Bei Personen über 65 Jahren liegt die Zufuhr bei etwa 15% unter dem Referenzmittelwert (7). Die moderne Ernährung mit einem geringeren Verzehr von Ölsaaten und Vollkorngetreide trägt zu einer geringeren Zufuhr bei (8). Alkoholkonsum trägt zu einem Mg-Mangel durch Unterernährung bei.
Verluste im Verdauungstrakt: Erkrankungen, die eine Malabsorption oder erhöhte Verdauungsverluste induzieren, führen zu einem Magnesiummangel.
Iatrogene Ursachen: In einer 2019 veröffentlichten Metaanalyse mit 16 Beobachtungsstudien, an denen 130’000 ambulante und stationäre Patienten teilnahmen, wurde eine Hypomagnesiämie bei 19,4% der Verbraucher von Protonenpumpenhemmern (PPI) gefunden, verglichen mit 13,5% der Personen ohne PPI. Ein Zusammenhang zwischen der PPI-Dosis und dem Auftreten von Hypomagnesiämie wurde ebenfalls nachgewiesen (9). Andere Medikamente, die zu einer Hypomagnesiämie führen können, sind Diuretika, Calcineurininhibitoren, Platinderivate, Antibiotika und Cetuximab (10).
Zellulärer Shift und Sequestrierung: Ein intrazellulärer Mg-Transfer kann bei einem Fehlernährungs-Syndrom auftreten. Bei einer metabolischen Azidose kann es zu einem intrazellulären Transfer kommen. Eine akute Pankreatitis verursacht eine Hypomagnesiämie durch Verseifung in den nekrotischen Fettgeweben. Andere, seltenere Pathologien existieren wie das «Hungry bone syndrome», das nach einer Parathyreoidektomie durch eine erhöhte zelluläre Mg-Aufnahme in den Knochen sichtbar wird. Bei Schwangerschaften wird eine transplazentare Mg-Passage beobachtet (11).
Renale Verluste: Hyperglykämie, akute Tubulusnekrosen und intensive Rehydrierung führen zu einer renalen Hyperfiltration von Mg. Die renale Rückresorption von Mg ist bei direkter Schädigung der Tubuli beeinträchtigt, wie beim Fanconi-Syndrom oder bei Arzneimitteltoxizitäten (12). Erblich bedingte Anomalien, die zu Mg-Verlusten führen, sind zahlreich. Die wichtigsten sind die familiäre Hypomagnesiämie mit Hyperkalziurie und Nephrokalzinose, das Bartter-Syndrom (V-Typen) und das Gitelman-Syndrom (13). Eine Mutation des Gens, das für das TRPM6-Protein kodiert, das im Dickdarm und im distalen Tubulus contortus vorkommt, führt bereits im frühen Kindesalter zu einer schweren Hypomagnesiämie (Hypomagnesiämie mit sekundärer Hypokalzämie) (14).
Bestimmung einer Hypomagnesiämie
Die Messung von Serum-Mg ist einfach und kostengünstig. Eine Hypomagnesiämie ist definiert durch einen Serum-Mg-Spiegel von weniger als 0,65mmol/l. Sie ist ab einem Mg-Wert von weniger als 0,5mmol/l schwerwiegend. Serum-Mg spiegelt nur 1% des gesamten Mg-Speichers wider. Da die intrazellulären Mg-Speicher bei der Schätzung des Serum-Mg nicht berücksichtigt werden, kann es zu einer Verminderung des Mg-Speichers kommen, trotz Vorliegen einer normalen Magnesämie. Die Magnesämie schwankt auch in Abhängigkeit von den Albuminvorräten (15).
Die Bestimmung des intraerythrozytären Mg könnte einen genaueren Wert für den Mg-Status sein. Der klinische Nutzen wurde jedoch nie bewiesen. Die Studien, die zu diesem Thema durchgeführt wurden, haben nur sehr wenige intrazelluläre Mg-Werte, nach einer langfristigen Substitution oder Depletion über einen längeren Zeitraum, ausgewertet. Ausserdem wird durch die Bestimmung des intraerythrozytären Mg der intramuskuläre Mg-Speicher nicht erfasst, was die Idee eines genaueren Instruments in Frage stellt (16).
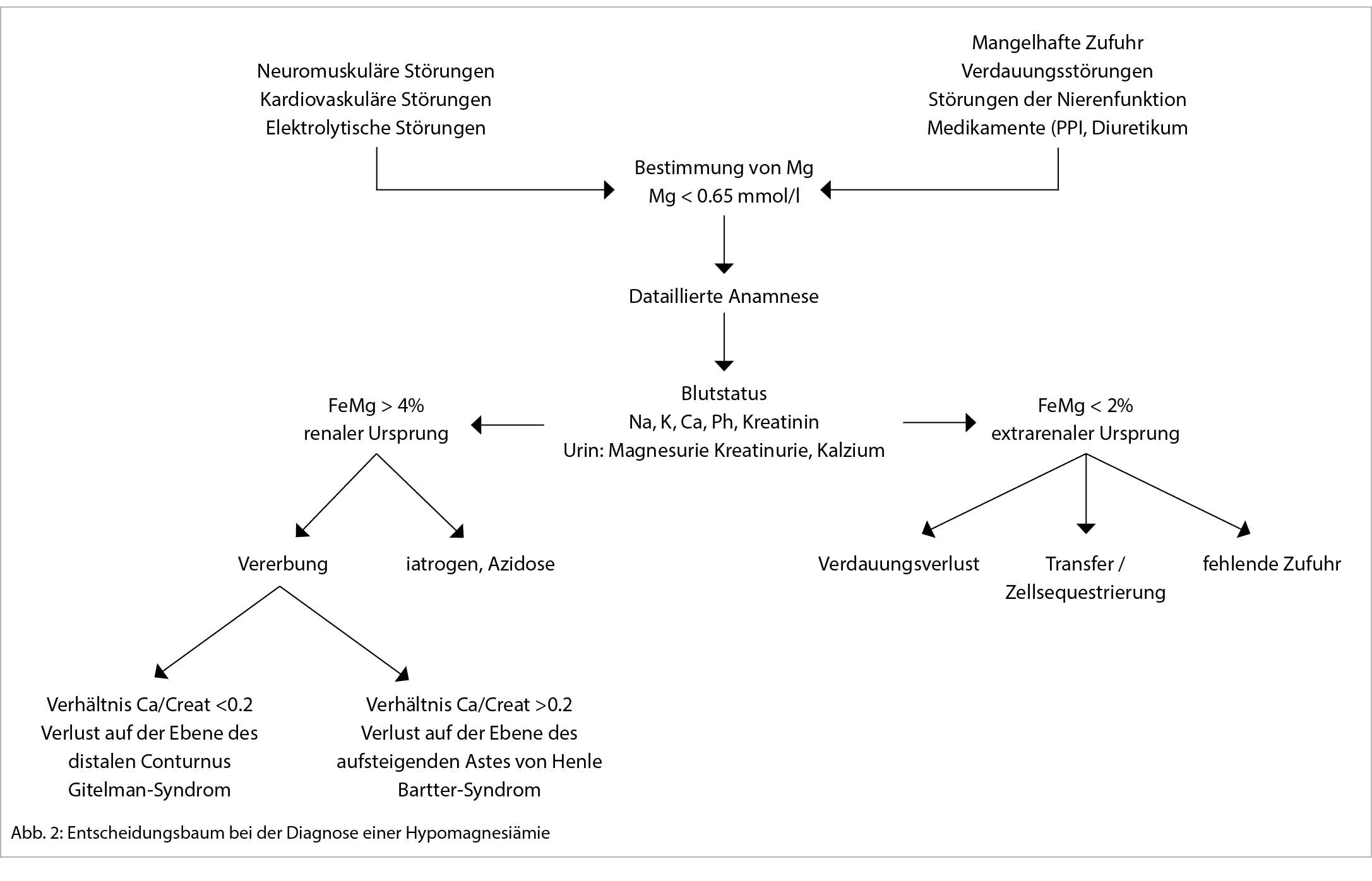
Im Zweifelsfall kann eine gleichzeitige Bestimmung von Mg im Urin und im Serum den Nierenverlust bestätigen oder ausschliessen. Die Analyse wird mit frischem Urin durchgeführt, indem die Ausscheidungsfraktion des Magnesiums nach folgenden Formel berechnet wird:
Formel für die Mg-Ausscheidungsfraktion
FeMg = Mg(U) x Cr (S) / (Mg (S) x 0.7 x Cr (U)) x 100
Aufgrund von seiner Konzentration in freier Form im Plasma (70%) wird die Mg-Konzentration mit 0,7 multipliziert.
FeMg: Fraktion der Ausscheidung von Magnesium.
U = Urin, Cr = Kreatinin, S = Serum
Laut einer Analyse von 74 Patienten mit Hypomagnesiämie durch Nierenverlust betrug die mediane Ausscheidungsfraktion von Mg 15% in einem Bereich zwischen 4-48 % (17). Die meisten Autoren definieren daher einen renalen Magnesiumverlust bei einem FeMg-Wert von mehr als 4% und einen extrarenalen Verlust bei einem FeMg von unter 2% mit einer Grauzone zwischen 2% und 4%. Eine 24-Stunden-Urinprobe ist ebenfalls möglich, wird aber selten verwendet. Eine Ausscheidung von mehr als 2mmol/24h weist auf einen Mg-Verlust in der renalen Mg-Ausscheidung hin.
Die genaueste Methode zur Beurteilung des Gesamt-Mg-Status ist ein Belastungstest, bei dem Mg infundiert wird und die Magnesiumkonzentration im 24-Stunden-Urin gemessen wird. Der vom Körper einbehaltene Mg-Spiegel steigt bei einer Depletion an (18). Diese Methode bleibt jedoch kostspielig, zeitaufwendig und der wissenschaftlichen Forschung vorbehalten.
Um besser zu erkennen, welcher Teil des Nierentubulus für den Mg-Verlust verantwortlich ist, kann das Calcium-Kreatinin-Verhältnis (mmol/mmol) erfragt werden. Dadurch kann z.B. zwischen dem Bartter-Syndrom (Verhältnis größer als 0,2) und dem Gitelman-Syndrom (Verhältnis kleiner als 0,2) unterschieden werden. (19) (Abb. 2).
Behandlung
Die Grundlage der Behandlung hängt vom Schweregrad der Symptome ab. Der erste Schritt besteht darin, die zugrunde liegenden Ursachen zu beheben. Bei sekundärem Hyperaldosteronismus wird durch die Zugabe eines Kaliumsparers die Rückresorption von Magnesium in den distalen Tubuli und des Sammelkanals begünstigt und das Risiko einer Torsade de pointes verringert (20).
Bei leichten bis mittelschweren Symptomen ist eine orale Substitution ausreichend. Es gibt verschiedene Präparate auf Mg-Basis mit einem Magnesiumgehalt, der zwischen 5% und 60% variieren kann, und einer Bioverfügbarkeit, die je nach Präparat zwischen 4% und 12% liegt (21). Im Handel sind organische Mg-Salze (Gluconat, Aspartat, Citrat, Carbonat), die besser verträglich und assimilierbar sind als die anorganischen Mg-Salze. (Sulfat, Chlorid) (21). Da es keine klaren Empfehlungen für eine orale Magnesiumsubstitution gibt, kann eine Behandlung mit 12-15 mmol/d in zwei- bis dreimal täglicher Dosierung vorgeschlagen werden (22).
Die klinischen Nebenwirkungen sind abdominelles Unbehagen mit Übelkeit und Erbrechen sowie Durchfall. Dies kann die Einnahme der oralen Medikation einschränken und eine intravenöse Substitution rechtfertigen. Die Indikationen für eine intravenöse Behandlung sind: Schwere symptomatische Hypomagnesiämie (Mg<0,5 mmol/l), anhaltende Diarrhöen, Unverträglichkeit einer oralen Behandlung oder Elektrolytstörungen, die gegen eine orale Substitution refraktär sind. Die am häufigsten verwendete Form ist Magnesiumsulfat (MgSO4). Eine Dosis von 1g MgSO4 enthält ca. 4mmol Mg, was zu einem Anstieg der Magnesämie um etwa 0,15mmol/l führt. Magnesiumsulfat gibt es in verschiedenen Konzentrationen von 10 %, 20 % oder 50 %, die mit 0,9 % NaCl oder 5 % Glukose verdünnt werden müssen (23).
In lebensbedrohlichen Notfällen (Torsade de Pointes, Präeklampsie) kann ein Bolus von 2g bis 4g, der mit NaCl oder G5 verdünnt werden muss, verabreicht werden, gefolgt von einer Erhaltungstherapie zwischen 1 bis 3g/h. In anderen Fällen Fällen, in denen eine intravenöse Substitution erforderlich ist, besteht ein Konsensus über die Verabreichung von 1g bis 2g MgSO4 als Bolus über 1 Stunde, gefolgt von einer Verabreichung von 4g bis 8g über 12-24 Stunden (24). Eine Überwachung je nach Schweregrad der Hypomagnesiämie erfolgt bis zur Normalisierung der Laborwerte.
Sollte man eine Hypomagnesiämie immer untersuchen und substituieren?
Seit einigen Jahren wird Mg für Energiekuren, bei Muskelkrämpfen und Stress eingesetzt. In der jungen und gesunden Bevölkerung wird sich die Niere anpassen und die Ausscheidung von Magnesium über den Urin verringern. Eine perorale Dosierung und Behandlung ist daher nicht sinnvoll. Bei Patienten, die an einer Krankheit leiden oder unter einer Behandlung stehen, die einen Mangel verursachen könnte, sollte die Bestimmung von Mg Teil der Untersuchung sein.
Eine ausführliche Anamnese in Verbindung mit einer einfachen biologischen Untersuchung ermöglicht es, die Ursache für einen Mg-Mangel zu finden. Patienten mit Hypomagnesiämie sollten vorsichtig supplementiert werden, um unerwünschte Nebenwirkungen, welche die Einhaltung der Therapie gefährden könnten, zu vermeiden.
Stellvertretende Klinikleiterin, Abteilung für Geriatrie
Freiburger Spital, Standort Riaz
Rue de l’Hôpital 9
1632 Riaz
karen.rizk@h-fr.ch
Klinischer Lehrbeauftragter
Naturwissenschaftliche und medizinische Fakultät, Universität Freiburg
Leitender Arzt – Abteilung für Geriatrie, HFR Riaz
andre.laszlo@h-fr.ch
FMH in Innerer Medizin, CAS in klinischer Forschung, MSc in EBHC,
Oxford, Standortleiter – Klinik für Innere Medizin, HFR Riaz
hoaphong.phamhuuthien@h-fr.ch
Die Autoren haben keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
◆ Der Verdacht auf Hypomagnesiämie sollte bei Patienten mit mangelnder Zufuhr, Verdauungs- und Nierenstörungen, einer Risikotherapie oder bei klinischen und biologischen Manifestationen erhoben werden.
◆ Eine ausführliche Anamnese in Verbindung mit einfachen Laboruntersuchungen ermöglicht es, die Ursache der Hypomagnesiämie zu finden. Im Zweifelsfall helfen Urintests, um zwischen einer renalen und einer extrarenalen Ursache zu unterscheiden.
◆ Die Mg-Substitution variiert je nach Schweregrad der Symptome. Vor jeder Substitution muss die zugrunde liegende Ätiologie korrigiert werden.
1. Huang CL, Kuo E. Mechanism of hypokalemia in magnesium deficiency. J Am Soc Nephrol. 2007 Oct;18(10):2649-52.
2. Schimatschek HF, Rempis R. Prevalence of hypomagnesemia in an unselected German population of 16,000 individuals. Magnes Res. 2001 Dec;14(4):283-90
3. Catalano A, Bellone F, Chilà D, Loddo S, Morabito N, Basile G, Benvenga S, Corica F. Rates of hypomagnesemia and hypermagnesemia in medical settings. Magnes Res. 2021 Feb 1;34(1):1-8
4. De Baaij JH, Hoenderop JG, Bindels RJ. Magnesium in man: implications for health and disease. Physiol Rev. 2015 Jan;95(1):1-46
5. Liamis G, Hoorn EJ, Florentin M, Milionis H. An overview of diagnosis and management of drug-induced hypomagnesemia. Pharmacol Res Perspect. 2021 Aug;9(4):e00829.
6. Fatemi S, Ryzen E, Flores J, Endres DB, Rude RK. Effect of experimental human magnesium depletion on parathyroid hormone secretion and 1,25-dihydroxyvitamin D metabolism. J Clin Endocrinol Metab. 1991 Nov;73(5):1067-72
7.Wäfler M, Zuberbuehler CA (2021) Les apports en micronutriments de la population suisse sont-ils satisfaisants ? Bulletin nutritionnel suisse: pages 115-134
8. Anses (2016) Actualisation des repères du PNNS : Élaboration des références nutritionnelles. Rapports d’ expertise collective. Édition scientifique
9. Srinutta, Thawin MDa; Chewcharat, Api MDa; Takkavatakarn, Kullaya MDa; Praditpornsilpa, Kearkiat MDa; Eiam-Ong, Somchai MDa; Jaber, Bertrand L. MD, MSb,c; Susantitaphong, Paweena MD, PhDa,d,∗ Proton pump inhibitors and hypomagnesemia, Medicine: November 2019 – Volume 98 – Issue 44 – p e1778
10. Türkmen Tugce, Schneider Taverna Christina, Krause Martin Hypomagnésémie induite par le cétuximab Forum Med Suisse. 2021;21(3940):686-688
11. Morton A. Hypomagnesaemia and pregnancy. Obstet Med. 2018;11(2):67-72. doi:10.1177/1753495X17744478
12. Pham PC, Pham PA, Pham SV, Pham PT, Pham PM, Pham PT. Hypomagnesemia: a clinical perspective. Int J Nephrol Renovasc Dis. 2014 Jun 9;7:219-30
13. Viering DHHM, de Baaij JHF, Walsh SB, Kleta R, Bockenhauer D. Genetic causes of hypomagnesemia, a clinical overview. Pediatr Nephrol. 2017 Jul;32(7):1123-1135. doi: 10.1007/s00467-016-3416-3. Epub 2016 May 27.
14. Schlingmann KP, Sassen MC, Weber S, Pechmann U, Kusch K, Pelken L, Lotan D, Syrrou M, Prebble JJ, Cole DE, Metzger DL, Rahman S, Tajima T, Shu SG,Waldegger S, Seyberth HW, Konrad M (2005) Novel TRPM6 mutations in 21 families with primary hypomagnesemia and secondary hypocalcemia. J Am Soc Nephrol 16:3061–3069
15. Kroll MH, Elin RJ. Relationships between magnesium and protein concentrations in serum. Clin Chem. 1985 Feb;31(2):244-6.
16.Workinger JL, Doyle RP, Bortz J. Challenges in the Diagnosis of Magnesium Status. Nutrients. 2018;10(9):1202. Published 2018 Sep 1.
17. Elisaf M, Panteli K, Theodorou J, Siamopoulos KC. Fractional excretion of magnesium in normal subjects and in patients with hypomagnesemia. Magnes Res. 1997 Dec;10(4):315-20.
18.Bielinski RW. Magnésium et activité physique [Magnesium and exercise]. Rev Med Suisse. 2006 Jul 26;2(74):1783-6.
19.Blanchard A, Bockenhauer D, Bolignano D, Calò LA, Cosyns E, Devuyst O, Ellison DH, Karet Frankl FE, Knoers NV, Konrad M, Lin SH, Vargas-Poussou R. Gitelman syndrome: consensus and guidance from a Kidney Disease: Improving Global Outcomes (KDIGO) Controversies Conference. Kidney Int. 2017 Jan;91(1):24-33
20.Gao X, Peng L, Adhikari CM, Lin J, Zuo Z. Spironolactone reduced arrhythmia and maintained magnesium homeostasis in patients with congestive heart failure. J Card Fail. 2007 Apr;13(3):170-7
21.Mohammad Tinawi. Disorders of Magnesium Metabolism: Hypomagnesemia and Hypermagnesemia. Archives of Clinical and Biomedical Research 4 (2020): 205-220.
22.Minetto D, Serratrice J, Stirnemann J. Le magnésium dans la pratique clinique quotidienne [Magnesium in daily practice]. Rev Med Suisse. 2016 Oct 19;12(535):1761-1765
23.Ayuk J, Gittoes NJ. How should hypomagnesaemia be investigated and treated? Clin Endocrinol (Oxf). 2011 Dec;75(6):743-6.
24.Hansen BA, Bruserud Ø. Hypomagnesemia in critically ill patients. J Intensive Care. 2018 Mar 27;6:21.
der informierte @rzt
- Vol. 12
- Ausgabe 8
- August 2022