- Impfen und Allergie – Mythen und Fakten
Schwere allergische Reaktionen auf Impfungen sind selten und schwierig vorherzusagen. Sie können durch die aktive Komponente oder durch Hilfsstoffe ausgelöst sein. Am häufigsten sind selbstlimitierende Lokalreaktionen, selten treten schwere Systemreaktionen vom Sofort- oder Spättyp auf. Aufgrund des wirksamen Schutzes und der hohen Bedeutung für die öffentliche Gesundheit sollten Impfungen auch Patienten mit einer Allergie in der Vorgeschichte wann immer möglich zugänglich sein. Hierfür sind eine sinnvolle Abklärung und Vorsichtsmassnahmen in der Verabreichung bei vorliegenden Allergien notwendig.
Serious allergic reactions to vaccines are rare and difficult to predict. They can be triggered by the active component or by excipients. Self-limiting local reactions are the most common, severe systemic reactions of the immediate or delayed type rarely occur. Due to the effective protection and the high importance for public health, vaccination should, whenever possible, also be accessible to patients with a history of allergy. This requires a reasonable diagnostic work-up and precautionary measures for administration in the context of existing allergies.
Key Words: allergy, egg allergy, vaccination, hypersensitivity reactions
In der Prävention von Infektionskrankheiten sind Impfungen hocheffizient und sicher. Die Zahl verdächtiger allergischer Reaktionen auf Impfungen ist viel höher als die Zahl bestätigter allergischer Reaktionen. Schwere allergische Reaktionen treten in ca. 1 Fall pro Million, Anaphylaxien in weniger als 1:100’000 Verabreichungen auf (1). Lokalreaktionen sind am häufigsten und werden von systemischen Reaktionen abgegrenzt (2).
Unterschieden wird zwischen Soforttypreaktionen, die innerhalb einer Stunde nach Verabreichung auftreten, und Spättypreaktionen, die innert Stunden bis Tagen auftreten. Soforttypreaktionen sind typischerweise IgE vermittelt, nebst nicht IgE vermittelten sogenannt anaphylaktoiden Reaktionen (direkte Aktivierung von Mastzellen, Basophilen oder Komplement). Spättypreaktionen sind meist nicht IgE vermittelt und können verschiedenen immunologischen Reaktionstypen nach Coombs und Gell zugeordnet werden. Die schwerste Form der IgE vermittelten Reaktion ist eine Anaphylaxie, die typischerweise innerhalb 30 Minuten und selten erst nach Stunden, dann meist weniger schwer, auftritt. Vaso-vagale und psychogene Reaktionen können eine Anaphylaxie imitieren. Schwere Sofort- und Spättypreaktionen können eine Kontraindikation für zukünftige Impfungen darstellen.
Komponenten der Impfung, die eine Allergie auslösen können
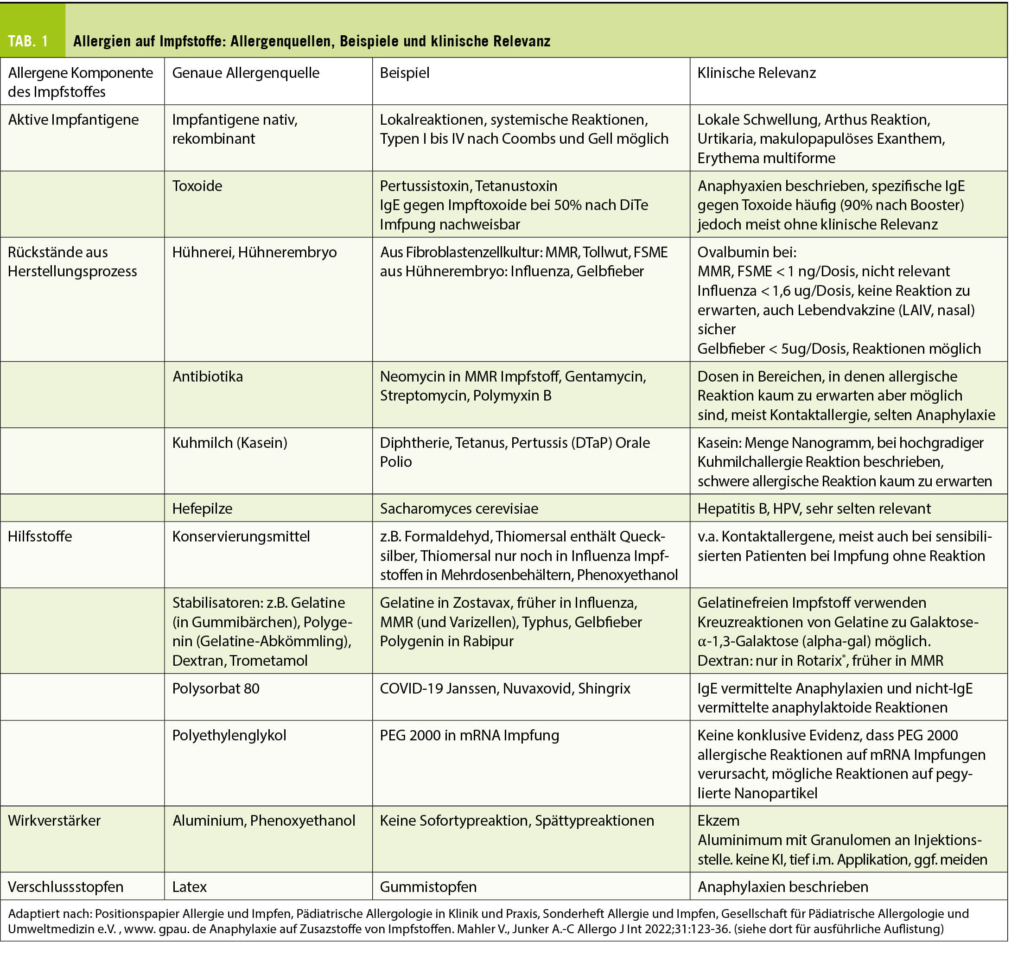
Impfstoffe beinhalten eine aktive Komponente, das mikrobielle Antigen (ganze Organismen, Teile davon oder inaktivierte Toxine), welches selten eine Hypersensitivitätsreaktion auslöst, sowie Zusatzstoffe, auf die die Mehrheit der Reaktionen zurückgeführt werden kann. Typische Beispiele sind Rückstände aus dem Herstellungsprozess wie Eiprotein und Antibiotika, Hilfsstoffe wie Gelatine, Polysorbat, das Konservierungsmittel Thiomersal und Wirkungsverstärker wie Aluminium. Eine Übersicht über Allergenquellen, Beispiele und klinische Relevanz gibt Tabelle 1.
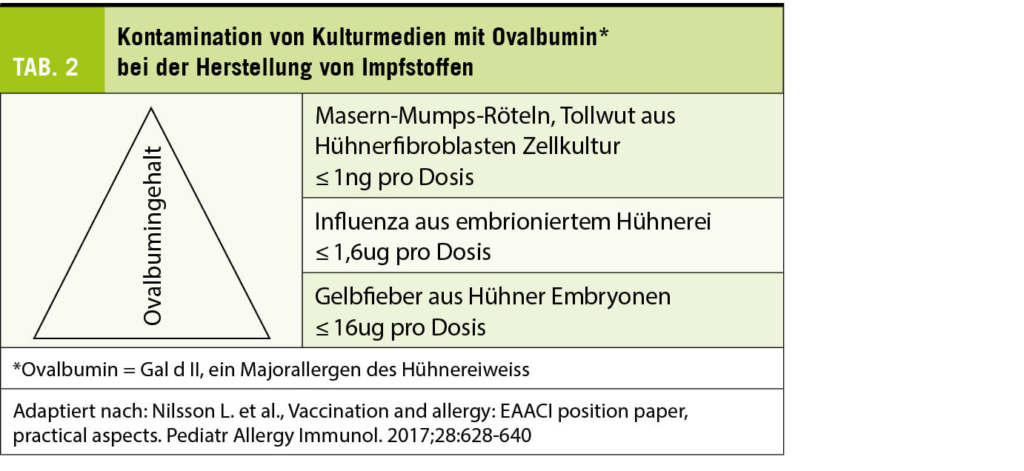
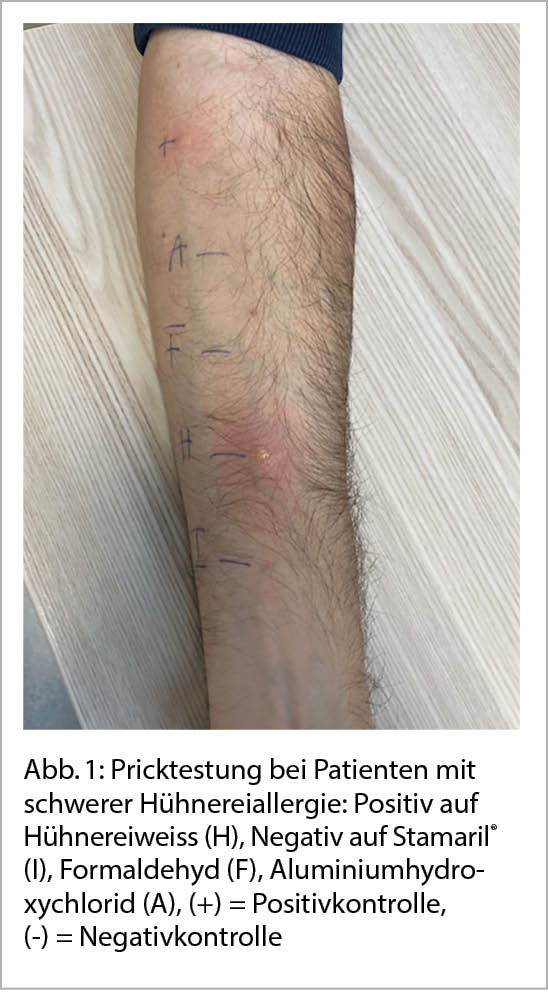
Bezüglich einer Allergie auf Hühnerei gilt, dass Impfstoffe heutzutage meist nur einen sehr geringen Gehalt an Ovalbumin (Gal d2, das im Eiklar mengenmässig dominierende Majorallergen) aufweisen, so dass die Problematik der Impfung von Hühnereiallergikern mehr den Mythen zuzuordnen ist. Influenza-Impfungen mit tiefem Ovalbumin-Gehalt von <1,2 ug/mL (2) (zum Vergleich: eine Eiportion enthält ca. 130 ug Ovalbumin) können bei Hühnereiweissallergikern sicher verabreicht werden (Tab. 2). Einzige Kontraindikation ist eine bekannte lebensbedrohende Anaphylaxie nach Hühnerei-Genuss. Der Gelbfieber Impfstoff enthält mehrere Mikrogramm Ovalbumin, so dass ein Hauttest vor Verabreichung sinnvoll ist. Abbildung 1 dokumentiert die Pricktestung bei einem Patienten mit bekannter schwerer Hühnereiallergie mit positiver Reaktion auf Hühnerei und negativer Reaktion auf den Gelbfieberimpfstoff Stamaril®. Der Impfstoff wurde aufgrund der Testresultate in drei Fraktionen problemlos verabreicht.
Diagnostik bei Patienten mit vermuteter Allergie auf Impfung
Bei der Festlegung der Diagnostik und etwaiger präventiver Massnahmen ist zu berücksichtigen, ob eine frühere Reaktion auf die Impfung stattgefunden hat oder ob eine vorbekannte Allergie auf einen Inhaltsstoff vorliegt. Bei Impfungen, die in Serie gegeben werden, kann die Bestimmung eines Impftiters hilfreich sein, um die Notwendigkeit einer erneuten Impfung abzuschätzen.
Die Diagnostik bei Soforttypreaktionen umfasst Hauttestungen mit dem Impfstoff und Zusatzstoffen. Die diagnostische Sensitivität von Prick- und Intrakutantests mit Impfstoffen ist bei anaphylaxieartigen Reaktionen sehr hoch. Der Impfstoff kann im Pricktest unverdünnt untersucht werden. Intrakutantestungen lösen gehäuft irritative Reaktionen aus, sie werden deshalb oft in der Konzentration 1% in NaCl 0,9% getestet. Intrakutantestungen lassen jedoch aufgrund der inhärenten immunaktivierenden Wirkung Spättypreaktionen erwarten, weshalb oft darauf verzichtet wird. Zusatzstoffe wie Hühnereiweiss, Formaldehyd, Aluminiumhydroxychlorid und je nach Fragestellung auch Gelatine, Saccharomyces Cerevisiae und Latex können mittels Prick und Intrakutantestung untersucht werden. Dazu können spezifische IgE z.B. gegen Ovalbumin, Gelatine, Latex und Saccharomyces Cerevisiae bestimmt werden (1).
Massnahmen bei Verabreichung bei Patienten mit vermuteter Allergie auf Impfung
Bei erneuter Verabreichung einer Impfung mit Anamnese einer stattgehabten Reaktion bei früherer Impfung muss nebst den Testresultaten immer der Schweregrad der Indexreaktion berücksichtigt werden. So bedingt das verzögerte Auftreten einer Urtikaria nach einer früheren Impfung weniger Vorsichtsmassnahmen als die Anamnese einer Anaphylaxie mit systemischen Symptomen. Bei negativer Hauttestung kann die Impfung normal verabreicht werden, wobei vorsichtshalber eine Überwachungszeit von mindestens 30 Minuten erfolgt. Bei positiver Hauttestung und Notwendigkeit erneuter Verabreichung erlaubt eine fraktionierte Verabreichung in den meisten Fällen eine erneute Impfung. Ein typisches Verabreichungsschema in 5 Schritten ist in Tabelle 3 illustriert (3). Im Alltag kommt je nach Bewertung der Vorgeschichte und Testbefunde ein vereinfachtes Schema, z.B. mit einer zweistufigen Verabreichung, häufiger zum Einsatz (Tab. 3).
Allergische Reaktionen auf COVID-19-Impfungen
Vier COVID-19 Impfstoffe sind aktuell in der Schweiz zugelassen: messenger RNA BNT162b2 von Pfizer (Comirnaty®), messenger RNA-1273 von Moderna (Spikevax®), der Vektor Impfstoff Ad26.COV2.S von Janssen und Nuvaxovid®/NVX-CoV2373 von Novavax, ein Protein-basierter Impfstoff. Alle gelten als wirksam und sicher. Anaphylaxien sind mit mRNA basierten Impfungen möglicherweise häufiger als mit anderen Impfstoffen. In einer Metaanalyse zu mRNA-Impfungen lag die Inzidenz einer Anaphylaxie bei 7,91 Fällen pro Million Verabreichungen (4). Der Mechanismus, der den allergischen und anaphylaktischen Reaktionen zugrunde liegt, ist nicht geklärt. Das in den mRNA-Impfungen enthaltene Polyethylenglykol (PEG) ist selten Auslöser allergischer Reaktionen bei Anaphylaxien gegen Produkte und Medikamente, die PEG beinhalten. Die mRNA-Impfungen enthalten PEG 2000, welches ein niedrigeres Molekulargewicht hat als die üblich verwendeten PEG z.B. in Laxantien (typischerweise PEG 3350). Während eigentliche allergische Reaktionen sehr selten sind, sind Hautveränderungen wie das Auftreten einer chronischen Urtikaria für eine Woche bis Monate nach mRNA-Impfstoffen vor allem nach der Boosterimpfung gehäuft beobachtet worden (5). Die Vektor Vakzine enthält Polysorbat, welches strukturell ähnlich wie PEG ist und allergische Reaktionen auslösen kann. Es gibt jedoch keine Bestätigung, dass eine frühere allergische Reaktion auf PEG und Polysorbat das Risiko auf eine Reaktion auf die COVID-Vakzine tatsächlich erhöht. Eine Vorabklärung hinsichtlich einer Allergie auf Polyethylenglykol oder Polysorbat vor Verabreichung der COVID-19 Vakzine ist von fraglichem Nutzen und nicht routinemässig empfohlen (4). Zu berücksichtigen ist auch, dass eine orale Zufuhr von PEG eine andere immunologische Wirkung entfaltet als eine tief subkutane oder intramuskuläre Impfung mit kleinen Mengen PEG.
Dies kann erklären, weshalb auch Patienten mit Nachweis einer Sensibilisierung auf PEG im Hauttest oder Basophilen Aktivierungstest die Impfung trotzdem meist vertragen.
Bei Patienten mit allergischen Reaktionen nach COVID-Impfung ist eine Abklärung empfohlen. Die Hauttestung mit dem Impfstoff selber zeigt dabei eine gute Aussagekraft. Der Impfstoff wird mittels Prick getestet. Sollte zusätzliche eine Intrakutantestung erfolgen, muss die mRNA-Impfung nicht verdünnt werden (wie sonst bei Impfstoffen üblich), da sie als nicht irritativ gilt. Auch die in vitro -Testung mittels Basophilen-Aktivierungstest (BAT) auf Macrogole kann hilfreich sein. Präventionsmassnahmen bei erhöhtem Risiko umfassen die Prämedikation mit einem Antihistaminikum, Überwachung für 30 Minuten oder die fraktionierte Verabreichung.
An Spättypreaktionen wird oft eine verzögert auftretende Urtikaria beobachtet, die auf eine Immunreaktion mit Degranulation von Mastzellen zurückgeführt werden kann. Eine allergologische Abklärung ist hier nicht sinnvoll. Vor weiteren Gaben der Impfung ist eine Prämedikation mit einem Antihistaminikum empfohlen.
Häufig sind auch Lokalreaktionen vom Spättyp mit dolenten Rötungen und Schwellung. Künftige Impfungen können nach Lokalreaktion normal verabreicht werden, wobei eine Injektion in den anderen Arm vorzuziehen ist.
Spättypreaktionen (auch vereinzelt schwere beschrieben) können auf verschiedene immunologische Mechanismen zurückgeführt werden. Diskutiert wird je nach Manifestationsform ein molekulares Mimikry von humanen Proteinen mit dem Spike Protein (6), eine direkte Aktivierung von Toll-like Rezeptoren durch Lipidnanopartikel (6) oder die mRNA (7) und eine Interaktion des Spike Proteins mit dem ACE-Rezeptor bei vaskulären Phänomenen (6).
Copyright bei Aerzteverlag medinfo AG
Universitätsspital Zürich
Allergiestation, Dermatologische Klinik
Rämistrasse 100
8091 Zürich
Universitätsspital Zürich
Allergiestation, Dermatologische Klinik
Rämistrasse 100
8091 Zürich
Universitätsspital Zürich
Allergiestation, Dermatologische Klinik
Rämistrasse 100
8091 Zürich
www.dermatologie.unispital.ch
peter.schmid@usz.ch
Die Autoren haben keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
◆ Impfungen sind eine entscheidende Errungenschaft in der Pflege der öffentlichen Gesundheit. Allergische Reaktionen sind sowohl bei herkömmlichen Impfstoffen als auch bei mRNA-Impfungen selten. Bei korrekter Einschätzung etwaiger Reaktionen auf Impfungen, unter Zuhilfenahme der verfügbaren diagnostischen Mittel und Einsatz von Vorsichtsmassnahmen kann die Sicherheit der Patienten optimal gewährt werden.
1. Nilsson L et al. Vaccination and allergy: EAACI position paper, practical aspects. Pediatr Allergy Immunol. 2017 28(7):628-640.
2. Sarti L et al. Diagnosis and management of hypersensitivity reactions to vaccines. Expert Rev Clin Immunol. 2020;16(9):883-896.
3. Kelso JM et al., Adverse reactions to vaccines practice parameter 2012 update. J. Allergy Clin Immunol. 2012;130:25-43
4. Greenhawt M et al. The Risk of Allergic Reaction to SARS-CoV-2 Vaccines and Recommended Evaluation and Management: A Systematic Review, Meta-Analysis, GRADE Assessment, and International Consensus Approach. J Allergy Clin Immunol Pract. 2021;9(10):3546-3567.
5. Prasad S et al. Cutaneous reactions following booster dose administration of COVID-19 mRNA vaccine: A first look from the American Academy of Dermatology/International League of Dermatologic Societies registry. JAAD Int. 2022;8:49-51.
6. Trougakos IP et al. Adverse effects of COVID-19 mRNA vaccines: the spike
hypothesis. Trends Mol Med. 2022;28(7):542-554.
7. Teijaro JR, Farber DL. COVID-19 vaccines: modes of immune activation and future challenges. Nat Rev Immunol. 2021;21(4):195-197.
der informierte @rzt
- Vol. 13
- Ausgabe 2
- Februar 2023