- Impfstoffe gegen COVID-19
Bis März 2021 wurden weltweit zwölf Impfstoffe gegen COVID-19 zugelassen. Ihre Verwendung wird es ermöglichen, die Pandemie zu beenden. Neben den üblichen Formaten, die inaktivierte Viren (4 zugelassene Impfstoffe) und proteinbasierte Impfstoffe (2 zugelassene Impfstoffe) umfassen, wurden zwei neue Formate validiert: ein rekombinantes Adenovirus (4 zugelassene Impfstoffe) und mRNA (2 zugelassene Impfstoffe). Letzteres war am schnellsten (zugelassen 2020 in der EU, den USA und der Schweiz). Die Schweiz hat einen Protein-Impfstoff, einen Adenovirus-Impfstoff und drei mRNA-Impfstoffe reserviert. Ich beschreibe hier die verschiedenen Impfstoffformate gegen COVID-19, gehe auf die von der Schweiz reservierten Impfstoffe ein und zeige auf, warum die mRNA-Impfstoffe am vorteilhaftesten zu sein scheinen.
Seit der Bestätigung des Prinzips der Impfung durch Jenner (unter Verwendung des Pockenvirus der Kuh «vacca») sind abgeschwächte (z.B. Gelbfiebervirus) und inaktivierte (z.B. Grippevirus) Viren Bestandteil wirksamer Impfstoffe. Die Herstellung von diesen Impfstoffen erfordert tierische Zellen (oder Eier) und kann schwierig sein (besonders wenn das Virus lytisch ist) und die Viren können von den Zellkulturen nicht vollständig gereinigt werden, da sie sonst zerstört würden. Infolgedessen enthalten die auf ganzen Viren basierenden Impfstoffe Verunreinigungen aus der Produktion, die Probleme durch Induktion einer irrelevanten Immunität und Intoleranz/Allergien verursachen können. Subunit-Impfstoffe haben sich hingegen als sicher und wirksam erwiesen und lassen sich etwas einfacher herstellen, reinigen und lagern (z.B. Hepatitis-B-Antigen: HBsAg). Sie müssen jedoch mit Adjuvantien ergänzt werden. In jüngerer Zeit wurden Impfungen mit rekombinanten Viren erzeugt, gestützt auf robuste Produktions-, Sicherheits- und Wirksamkeitsstandards, die für modifizierte abgeschwächte Viren (z.B. Adenoviren) etabliert sind. Diese Art von Impfstoffen wurde erst im Sommer 2020 für den Schutz gegen Ebola zugelassen (A). Schliesslich entwickeln seit Ende der 1990er-Jahre Firmen (beginnend mit der von mir mitgegründeten Firma CureVac) Impfstoffe auf Basis synthetischer, in vitro transkribierter mRNA (IVT-mRNA) (1-6). Dieses Format wurde vernachlässigt, weil mRNA fälschlicherweise als ein fragiles Molekül galt. Das ist aber falsch. Wegen der Omnipräsenz von RNasen, Enzymen, die RNA umgehend abbauen, müssen die Forschung und Entwicklung mit mRNA unter speziellen «RNase-freien» Bedingungen erfolgen. Die mRNA-Moleküle selbst sind jedoch in Abwesenheit von RNasen physikalisch-chemisch sehr stabil. Sie können eingefroren, aufgetaut, lyophilisiert und resuspendiert werden, ohne dass sie ihre Funktionalität verlieren (1). Tatsächlich ist mRNA das einzige biologische Molekül, das bis zu 95 °C erhitzt werden kann, ohne seine Aktivität zu verlieren. Andere biologische Moleküle wie DNA oder Proteine und auch Viren verlieren ihre Funktionalität, wenn sie auf 95°C erhitzt werden. Somit ist die mRNA kontraintuitiv das stabilste biologische Molekül für die Herstellung von Impfstoffen. Die Liposome hingegen, die zur Herstellung von mRNA-Impfstoffen verwendet werden, sind unter Umständen nicht stabil, weshalb die aktuellen mRNA-Impfstoffe tiefgekühlt gelagert werden müssen. Die Europäische Union hat diese Eigenschaft anerkannt, indem sie CureVac 2014 einen Preis von 2 Millionen Euro für bei Raumtemperatur stabile Impfstoffe zugesprochen hat (B). Dennoch hielt sich das Vorurteil, dass mRNA instabil sei, in der wissenschaftlichen und medizinischen Gemeinschaft und beeinträchtigte die Entwicklung von mRNA-basierten Medikamenten in den letzten zwanzig Jahren. Die Coronavirus-Pandemie im Jahr 2020 sorgte für eine endgültige Wende mit diesem Vorurteil und ermöglichte es dem mRNA-Impfstoff, sein Potenzial (rasche und einfache Herstellung, Sicherheit und Wirksamkeit) zu zeigen, so dass er als erstes Impfstoffformat gegen COVID-19-
Infektionen zugelassen wurde, weniger als ein Jahr nach der Veröffentlichung der Virussequenz (7). Nach dieser bemerkenswert schnellen Leistung wurden auch einige Anti-SARS-CoV-2-Impfstoffe zugelassen, die auf rekombinanten attenuierten Adenoviren, auf inaktiviertem SARS-CoV-2 und SARS-CoV-2-Proteinen basieren, so dass die Welt nun über ein Panel von 12 prophylaktischen Waffen gegen die Pandemie verfügt (C).
Sind alle Impfstoffe in ihrem Sicherheits- und Wirksamkeits-profil ähnlich?
Was die Sicherheit anbelangt, so haben alle zugelassenen Impfstoffe die reglementarisch geforderten Kontrollprozesse bestanden und gelten somit als sicher (auch wenn, wie bei allen Impfstoffen zu erwarten, Nebenwirkungen wie häufige Müdigkeit und lokale Reaktionen und selten auch allergische Reaktionen auftreten). Was die Wirksamkeit betrifft, so schützen alle Impfstoffe gut gegen COVID-19 (mehr als 70% und bis zu über 95%). Obwohl alle aktuellen rekombinanten Impfstoffe das SARS-CoV-2-Spike-Protein als Target verwenden, verwenden einige das Wildtyp-Protein, während andere gezielt mutierte Versionen davon verwenden. Diese vom Wildtyp gewollt abweichenden Versionen zeichnen sich insbesondere durch zwei aufeinanderfolgende Proline aus, die Lysin 986 und Valin 987 ersetzen. Das dadurch definierte Protein «PP Spike» ist bereits von SARS-CoV- und MERS-CoV-Spike bekannt. Die Erfahrung mit diesen früheren Coronaviren hat gezeigt, dass das Spike-Protein an der Virusoberfläche in einer Präfusionskonformation vorliegt und nach Eintritt in die infizierte Zelle die Konformation ändert (8). Die Modifikation von Spike zu PP-Spike stabilisiert diese Präfusionskonformation. Daher können Impfstoffe, die PP-Spike anstelle von Wildtyp-Spike verwenden oder exprimieren, mehr schützende Antikörper induzieren.
Impfstoffe, die in der Schweiz verwendet werden respektive deren Verwendung geplant ist
Vier Impfstoffplattformen bieten derzeit zugelassene Impfstoffe gegen SARS-CoV-2:
1. Impfstoffe auf der Basis von IVT-mRNA, die hauptsächlich in Europa und den USA von BioNTech/Pfizer, CureVac und Moderna entwickelt wurden
2. Impfstoffe auf der Basis rekombinanter defizienter Adenoviren, die in verschiedenen Ländern und von Firmen wie AstraZeneca, Johnson&Johnson und CanSino optimiert und produziert wurden
3. Impfstoffe auf Proteinbasis, die hauptsächlich in den USA und Russland entwickelt wurden
4. Inaktivierte SARS-CoV-2-Viren, die vor allem in China und Indien entwickelt wurden
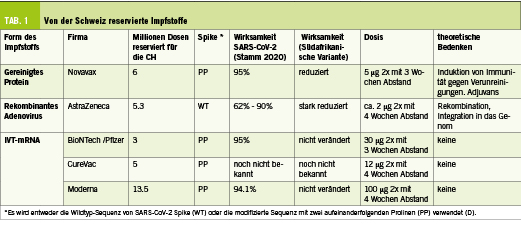
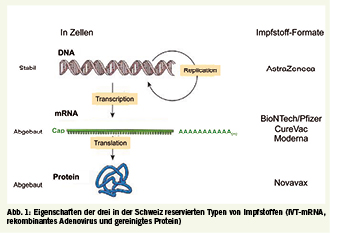
Über inaktivierte SARS-CoV-2-Viren liegen nur wenige Informationen vor, und die Schweiz hat diese Impfstoffe nicht reserviert. Daher werde ich im Folgenden die Eigenschaften der drei Typen von Impfungen (IVT-mRNA, rekombinantes Adenovirus und gereinigtes Protein, Abb. 1) vorstellen, für die die Schweiz Millionen von Dosen reserviert hat (Tab. 1).
Impfstoff auf Proteinbasis
Ein Sicherheitsvorteil von Proteinen ist, dass sie inert sind und nach der Verabreichung auf natürliche Weise abgebaut werden. Wenn sie jedoch in vitro in Zellen hergestellt worden sind, enthalten sie Verunreinigungen, die aus den Zellkulturen stammen. Dies muss besonders bei der Impfung von Allergikern beachtet werden, da eine allergische Reaktion auch auf geringe Verunreinigungen möglich ist. Darüber hinaus benötigen proteinbasierte Impfstoffe ein Adjuvans. Das Design und die Produktion eines Proteins für einen Impfstoff kann etwas umständlich sein, da jedes Protein anders ist (hydrophil, hydrophob, strukturiert, glykosyliert etc.). Daher kann es eine Herausforderung sein, die richtigen antigenen Eigenschaften des gereinigten Proteins im Impfstoff zu erhalten und zu bewahren. Sollte der Impfstoff zudem immunogene Verunreinigungen (einschliesslich fehlgefaltetem Antigen) enthalten, könnte er eine irrelevante Immunität induzieren. Der von der Schweiz reservierte Proteinimpfstoff von Novavax ist noch nicht zugelassen. Er enthält das rekombinante SARS-CoV-2-PP-Spike in voller Länge (auch in den Positionen 682 bis 685 mutiert, um Protease-Resistenz zu verleihen), der in Insektenzellen produziert und mit Matrix-M1, einem Adjuvans auf Saponinbasis, gemischt wird. Es wird bei 2 °C bis 8 °C gelagert. Die getesteten Dosen betrugen 5 und 25 Mikrogramm Protein pro Injektion, und es wurde festgestellt, dass sie in Phase I ähnlich hohe Titer neutralisierender Antikörper induzieren (9). Die Phase-III-Studie wurde mit zwei Injektionen von 5 μg Spike Protein + 50 μg Matrix-M1-Adjuvans im Abstand von 21 Tagen durchgeführt. Das Unternehmen berichtete im Januar 2021 über eine Wirksamkeit von 89,3% gegen COVID-19 (95,6% gegen den ursprünglichen COVID-19-Stamm und 85,6% gegen die britische Variante Stamm B.1.1.7). Damit erscheint der Novavax-Impfstoff als ein effizientes und sicheres Produkt von grossem Interesse. Ein weiterer Proteinimpfstoff (EpiVacCorona) ist verfügbar und wurde in Russland zugelassen. Es sind jedoch nur wenige Informationen verfügbar (E). Dennoch könnte er von Interesse sein, da er nicht von Zellen produziert, sondern chemisch synthetisiert wird. Die chemischen Peptidantigene, die dem SARS-CoV-2-Protein entsprechen, sind an ein Trägerprotein konjugiert und an Aluminiumhydroxid adsorbiert. Diese Art von chemisch synthetisierten Impfstoffen würde keine Verunreinigungen wie Proteine aus der produzierenden Zelle enthalten und daher möglicherweise ein geringeres Risiko für die Auslösung von Allergien oder irrelevanter Immunität darstellen.
Impfstoffe auf Adenovirus-Basis
Adenoviren sind unbehüllte Viren, die ungewöhnlich stabil sind gegenüber chemischen oder physikalischen Einwirkungen. Replikationsdefekte Adenoviren werden zur Herstellung rekombinanter Impfstoffe verwendet. Die in diesen Viren enthaltene rekombinante DNA wird aktiv in den Zellkern des Geimpften geschickt, wo sie in mRNAs übersetzt werden kann. Üblicherweise wird bei Impfstoff-Adenoviren das frühe Gen E1 deletiert, so dass sie zwar infizieren, sich aber nicht replizieren können. Ihre Produktion in vitro ist dank der Komplementierung in Zellen, die E1 exprimieren, möglich. Normale Säugetierzellen enthalten hingegen kein E1, womit eine Replikation im Geimpften vermieden wird. Der Impfstoff von AstraZeneca wird in HEK293-Zellen produziert, bei denen es sich um menschliche embryonale Nierenzellen handelt (die 1973 einem abgetriebenen weiblichen Fötus entnommen wurden), die durch Integration eines Teils des Adenovirus 5 transformiert wurden, der ebenfalls die Expression des E1-Proteins ermöglicht. Dank dieses Proteins kann HEK293 Viren produzieren, die für E1 defizient sind. Das Gen, das für das Antigen (hier SARS-CoV-2 Spike) kodiert, wird in diese replikationsdefizienten Viren eingeführt, wodurch sie zu rekombinanten replikationsdefizienten Impfviren werden. Die Herstellung von Adenoviren erfordert sehr grosse Zellkulturen und eine Optimierung des Prozesses. Theoretische Bedenken bestehen darin, dass das rekombinante defekte Adenovirus während der Produktion in vitro rekombiniert/evolutioniert (nicht alle aus der Zellkultur entnommenen Viren hätten die gleichen Sequenzen) oder in vivo nach der Injektion (z.B. bei einer Person, die mit einem gewöhnlichen Adenovirus infiziert ist), was zur Produktion neuer Adenoviren führen könnte. Eine weitere Sorge ist die Persistenz und Integration der chimären DNA in das menschliche Genom. Es ist bekannt, dass sich DNA-Viren schliesslich integrieren: bei Adenoviren in 1 von 1 Million Zellen in vivo bei Mäusen (10). Darüber hinaus ist nicht bekannt, wie sich die DNA-Sequenz des SARS-CoV-2-Spikes (die in der Natur nicht vorkommt, da Coronaviren RNA-Viren sind) in Zellen verhalten würde und ob sie Persistenz und Integrationsraten beeinflussen könnte. Die rekombinanten Adenoviren kombinieren mehrere Elemente von mehreren Viren, die sich in der Natur nicht begegnet wären, und das Langzeitergebnis in vivo solcher Chimären bleibt noch zu bestimmen.
Von den vier zugelassenen Impfstoffen auf Adenovirusbasis hat die Schweiz den von AstraZeneca reserviert. SwissMedic hat diesen Impfstoff namens ChAdOx1 nCoV-19 (AZD1222) jedoch noch nicht zugelassen. Es handelt sich um ein rekombinantes replikationsdefizientes Schimpansen-Adenovirus, in das ein Promotor aus dem Cytomegalovirus eingeführt wurde, gefolgt voneiner Gensequenz aus dem Gewebeplasminogenaktivator (der Leadersequenz), der cDNA, die für den Wildtyp-Spike in voller Länge kodiert, und am Ende von einer Polyadenylierungssequenz des bovinen Wachstumshormons (ich nenne diesen aus mehreren DNA Bauteilen zusammengesetzten Impfstoff «Frankimpffstein»). Der Impfstoff (5×1010 Partikel pro Injektion, d.h. ca. 1,5 Mikrogramm DNA) wird intramuskulär im Abstand von 4 bis 12 Wochen verabreicht. Es wurde berichtet, dass er einen unterschiedlich hohen Schutz bietet (abhängig von der Dosis und dem klinischen Studienzentrum), aber die Gesamtwirksamkeit liegt in der Regel über 70% (11). Obwohl es gegen die in Grossbritannien identifizierte Variante B.1.1.7 schützt. (F), scheint es nicht gut gegen die in Südafrika identifizierte Variante B.1.351 zu schützen (G). Mehrere Länder (Dänemark, Österreich, Estland, Lettland und Luxemburg) haben die Impfung mit ChAdOx1 nCoV-19 ausgesetzt, weil nach der Impfung Fälle von Thrombosen aufgetreten sind. Der Zusammenhang zwischen dem Impfstoff und diesen Problemen ist jedoch nicht erwiesen. Ein weiteres rekombinantes Adenovirus wurde als Impfstoff gegen SARS-CoV-2 zugelassen: Sputnik V (Gamaleya Research Institute). Es besteht aus zwei rekombinanten Adenoviren (Adenovirus Typ 26 und rekombinantes Adenovirus Typ 5, die nacheinander verabreicht werden), die beide das Gen für den Wildtyp-Spike in voller Länge tragen (rAd26-S und rAd5-S). Sputnik V wurde in Russland entwickelt. Der Impfstoff wird in einer Dosis von 1011 Partikeln intramuskulär im Abstand von 21 Tagen verabreicht und zeigte eine Wirksamkeit von 91,6% (12). Schliesslich wurde inzwischen der neu zugelassene rekombinante Adenovirus-Impfstoff Ad26.COV2.S von Johnson&Johnson unter sieben experimentellen rekombinanten Adenovirus-Impfstoffen vom Serotyp 26 (Ad26) auf Vektorbasis ausgewählt. Er unterscheidet sich insbesondere auch von dem Impfstoff von AstraZeneca, da er für einen Spike kodiert, der die beiden Proline besitzt, die die Präfusionskonformation stabilisieren. Eine einzige intramuskuläre Injektion von 5×1010 Partikeln bot selbst in Südafrika, wo die Variante B.1.351 weit verbreitet ist, einen 66-prozentigen Schutz gegen moderate und schwere COVID-19-Erkrankungen (13) (H).
Nicht-replizierende IVT-mRNA-Impfstoffe
Das Hauptmerkmal des nicht-replizierenden IVT-mRNA-Impfstoffs ist die Sicherheit. Dieses natürliche Molekül kann sich nämlich nicht replizieren, ist im Zytosol (und nicht im Zellkern) aktiv und wird durch im Gewebe reichlich vorhandene RNasen schnell und vollständig abgebaut. Somit besteht bei diesem Impfstoffformat im Gegensatz zu rekombinanten Adenoviren, aber ähnlich wie bei Proteinen, kein Risiko, zu persistieren, zu rekombinieren oder das menschliche Genom zu verändern (1-4). Da die mRNA leicht hochgereinigt werden kann (5), kodiert sie nur für ein einziges Antigen, was das Risiko einschränkt, eine Immunität gegen andere, irrelevante Antigene auszulösen, wie es bei Proteinen (Kontaminanten, fehlgefaltete Proteine) oder Adenoviren (Vektorproteine) der Fall ist. Die mRNA wird in Liposomen kondensiert, die in der Regel aus vier verschiedenen Lipiden bestehen und mit einer bereits 2018 zugelassenen liposomalen RNA-Formulierung verwandt sind: Das Medikament Onpattro basiert auf einer liposomalen Verabreichung von RNA (siRNA), jedoch nicht als Impfung, sondern zur Behandlung einer genetischen neurologischen Erkrankung (intravenöse Injektion von 30 mg pro Dosis alle 3 Wochen zur Behandlung der Polyneuropathie durch hereditäre Transthyretin-vermittelte Amyloidose). Obwohl das IVT-mRNA-Impfstoffformat erstmals 1993 offengelegt wurde (14), war es noch nicht hochwirksam, als ich 1998 mit der Evaluierung begann. Seine überragenden Sicherheitseigenschaften (wie oben erwähnt) ermutigten mich jedoch, es weiter zu optimieren. Eine weitere Eigenschaft des IVT-mRNA-Impfstoffs ist die Schnelligkeit und Einfachheit der Herstellung: Eine beliebige DNA-Sequenz, der ein adäquater Promotor (meist von den Bakteriophagen T7 oder SP6) vorangestellt ist, wird in vitro mit Hilfe der rekombinanten RNA-Polymerase (meist T7 oder SP6) effizient transkribiert (5). Aus einem Molekül DNA entstehen innerhalb weniger Stunden über 1000 Moleküle mRNA. Alle Produkte der Transkription (DNA, RNA-Polymerase, Nukleotide) sind bakteriellen oder chemischen Ursprungs. Somit ist der IVT-mRNA-Impfstoff vegan. Neben der Überwindung religiöser oder überzeugungsbedingter Vorbehalte reduziert diese Eigenschaft auch die Risiken von Allergien oder der Entwicklung einer irrelevanten Immunität gegen Kontaminanten aus Zellkulturen. Obwohl die Verwendung von IVT-mRNA in Impfstoffen relativ neu ist (1993 erstmals beschrieben, Mitte der 2000er Jahre bei Patienten und mir selbst injiziert [15, 16] und 2020 erstmals zugelassen), ist die Verwendung von mRNA zur Impfung uralt: Die Impfstoffe gegen Gelbfieber, Mumps, Masern und Röteln sind abgeschwächte RNA-Viren, die nach subkutaner Injektion funktionieren, indem sie ihre mRNA in die Wirtszellen abgeben, die Viruspartikel produzieren und eine Immunantwort auslösen. Diese alten Impfstoffe sind daher «natürliche» mRNA-Impfstoffe, während die neu zugelassenen Anti-SARS-CoV-2-Impfstoffe «synthetische» mRNA-Impfstoffe sind. Beide beruhen jedoch auf dem gleichen grundlegenden Mechanismus: der Produktion von viralen Proteinen durch menschliche Zellen mittels injizierter mRNA. Die Optimierung der IVT-mRNA-Moleküle und der liposomalen Formulierungen haben den IVT-mRNA-Impfstoff zu einem sehr potenten Format gemacht (17). Sie wird in klinischen Studien vor allem als Impfstoff gegen Malignome untersucht (18, 19). Anfang 2020 wurden für die Impfung gegen COVID-19 vier nicht-replizierende mRNA-Impfstoffe, die für den PP-Spike in voller Länge kodieren, getestet: zwei von BioNTech (BNT162a2, das mit unmodifizierten Nukleotiden hergestellt wird und BNT162b2, das PseudoUridin enthält), einer von CureVac (CvNCoV, das mit unmodifizierten Nukleotiden hergestellt wird) und einer von Moderna (der PseudoUridin enthält). Die Pseudouridin-Modifikation wurde 2005 publiziert, um die angeborene Immunstimulation durch RNA (Triggerung von Toll-Like-Rezeptoren) aufzuheben (20), was die Verwendung von IVT-mRNA zur nicht-immunogenen (nicht-vakzinierten) Proteinexpression ermöglicht. Allerdings wurde 2017 publiziert, dass überraschenderweise (und immer noch nicht erklärt) auch modifizierte mRNA in mRNA-Impfstoffen verwendet werden kann (21). Ob modifizierte (PseudoUridine) oder unmodifizierte mRNA für einen IVT-mRNA-Impfstoff am besten geeignet ist, ist noch nicht geklärt (BioNTech hat die Ergebnisse, die mit seinem nicht modifizierten mRNA-Impfstoff BNT162a2 erzielt wurden, noch nicht veröffentlicht). Obwohl die ersten Injektionen eines Anti-SARS-CoV-2-IVT-mRNA-Impfstoffs (und die weltweit erste Injektion eines experimentellen Anti-SARS-CoV-2-Impfstoffs in Menschen) an Freiwilligen von Moderna am 16. März 2020 durchgeführt wurden, erfolgte die erste Zulassung für den mRNA-Impfstoff von BioNTech (Comirnaty®) im Dezember 2020 (20. Dezember in der Schweiz). Diese beiden mRNA-Impfstoffe bieten einen Schutz von über 90% gegen COVID-19 (7, 22) und schützen auch vor den neuen Varianten (wobei die Neutralisierung dieser Variante geringere Verdünnungen von Seren erfordert als die zur Neutralisierung der anderen Varianten) (23). In Israel, das eine ähnliche Bevölkerungszahl hat wie die Schweiz, aber mehr als 50% der Menschen mit dem BioNTech/Pfizer-Impfstoff geimpft wurden, zeigt eine Studie an über 1 Million Personen (596.618 Geimpfte und 596.618 Nicht-Geimpfte) eine Wirksamkeit des Impfstoffs von 92% gegen eine Infektion, 94% gegen symptomatisches COVID-19, 87% gegen eine Hospitalisierung und 92% gegen eine schwere Erkrankung (7 Tage oder mehr nach der zweiten Dosis). Somit ist der BioNTech/Pfizer-Impfstoff nicht nur bei der Verhinderung der Krankheit, sondern auch der Übertragung hochwirksam (24). Das Auftreten von unerwünschten Wirkungen wird für den Impfstoff von Pfizer/BioNTech im Vergleich zum Moderna-Impfstoff als geringer angegeben (25). Der dritte von der Schweiz reservierte mRNA-Impfstoff, der von CureVac entwickelt wurde, zeigte in Phase I vielversprechende Ergebnisse (I) und wird nun in Phase III getestet. Die Ergebnisse werden im März 2021 erwartet. Sollte er zugelassen werden, wird die Schweiz noch vor dem Sommer über 20 Millionen IVT-mRNA-basierte Impfstoffdosen verfügen, die ausreichen werden, um die Bevölkerung vollständig sicher und effizient zu impfen.
Schlussfolgerungen
Die zugelassenen Impfstoffe gegen SARS-CoV-2 bieten alle einen effizienten Schutz gegen COVID19 und werden breit verabreicht, um die Pandemie zu beenden. Wie bei Impfstoffen, die durch eine starke Aktivierung des Immunsystems wirken, zu erwarten, sind häufige, meistens milde bis moderate Nebenwirkungen Müdigkeit, Kopfschmerzen und lokale Reaktionen. Drei Impfstoffformate wurden von der Schweiz reserviert (Abb. 1 und Tab. 1) und das einzige Format, das bei uns derzeit zugelassen ist, die Impfung mit IVT-mRNA, kombiniert die Sicherheitsaspekte der traditionellen proteinbasierten Impfstoffe (inert und schnell eliminiert) mit der Vielseitigkeit rekombinanter Viren (einfach zu entwerfen und schnell zu produzieren). Im Gegensatz zu rekombinanten Adenoviren besteht bei IVT-mRNA-basierten Impfstoffen jedoch nicht das Risiko, sich zu entwickeln, zu rekombinieren oder sich ins Genom zu integrieren; und im Gegensatz zu Proteinen ist das Risiko bei IVT-mRNA, eine Immunität gegen Kontaminanten zu induzieren, begrenzt. Die Sicherheits- und Flexibilitätsaspekte der IVT-mRNA-Impfstoffe haben sie zu den Gewinnern im Rennen um die Entwicklung von Impfstoffen gegen COVID-19 gemacht.
Diese Eigenschaften machen IVT-mRNA für die Entwicklung und Produktion von Impfstoffen besonders geeignet für eine allfällige Anpassung des Impfstoffs an neue Varianten von SARS-CoV-2, die der aktuellen impfstoffinduzierten Immunantwort widerstehen. Glücklicherweise ist dies aber bisher nicht der Fall, auch wenn die in Südafrika identifizierte Variante weniger gut als andere Varianten von mRNA-impfstoffinduzierten Antikörpern erkannt wird. Darüber hinaus erfordert die Produktion von einer Million Impfstoffdosen grosse Anlagen für übliche Impfstoffe (z.B. 6000 Liter für ein in Zellkultur hergestelltes Grippevirus), aber nur 6 Liter für die In-vitro-Transkription eines mRNA-Impfstoffs. Aus all diesen Gründen (Vielseitigkeit, Sicherheit, Einfachheit der Produktion) werden mRNA-Impfstoffe und mRNA-basierte Therapien intensiv entwickelt und versprechen, neue Medikamente gegen viele verschiedene Krankheiten zu schaffen.
Copyright bei Aerzteverlag medinfo AG
Universitätsspital Zürich, Dermatologie
Gloriastrasse 31
8091 Zürich
steve.pascolo@usz.ch
Der Autor hat deklariert, in Zusammenhang mit diesem Artikel keine Interessenskonflikte zu haben.
◆ Vier Prinzipien wurden verwendet, um 12 zugelassene Impfstoffe zu generieren: gereinigte Proteine und inaktivierte Viren sind «traditionelle Impfformen», während rekombinante Adenoviren und IVT-mRNA neue Impfformen sind.
◆ Die Schweiz hat 5 Impfstoffe reserviert, die auf 3 verschiedenen Prinzipien der Impfung basieren: Protein, Adenovirus und IVT-RNA
◆ Alle Anti-COVID-19-Impfstoffe sind mit häufigen, meist milden Nebenwirkungen verbunden, verleihen aber einen hohen Schutz gegen COVID-19 (meist über 70% und bis zu über 95%)
◆ Das IVT-mRNA-Format ist das schnellste (könnte auch genutzt werden, um schnell neue Impfstoffe gegen Varianten zu entwickeln) und theoretisch das sicherste.
◆ Die IVT-mRNA-Impfstoffe schützen gegen alle bisher identifizierten und getesteten Varianten von SARS-CoV-2.
◆ Die laufende Impfkampagne mit den zwei zugelassenen IVT-mRNA-Impfstoffen und eventuell mit einem dritten, der bald zugelassen werden könnte, sollte es ermöglichen, die Schweizer Bevölkerung vor dem Sommer 2021 sicher zu impfen.
1. Pascolo S. Messenger RNA-based vaccines. Expert Opin Biol Ther 2004; 4(8):1285-1294.
2. Pascolo S. Vaccination with messenger RNA. Methods Mol Med 2006; 127:23-40.
3. Pascolo S. Vaccination with messenger RNA (mRNA). Handb Exp Pharmacol 2008; (183):221-235.
4. Pascolo S. The messenger’s great message for vaccination. Expert Rev Vaccines 2015; 14(2):153-156.
5. Pascolo S. Messenger RNA: The Inexpensive Biopharmaceutical. Journal of Multidisciplinary Engineering Science and Technology (JMEST) 2017; 4(3):6937-6941.
6. Pascolo S. Synthetic Messenger RNA-Based Vaccines: from Scorn to Hype. Viruses 2021; 13(2).
7. Polack FP, Thomas SJ, Kitchin N, Absalon J, Gurtman A, Lockhart S, et al. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. N Engl J Med 2020.
8. Pallesen J, Wang N, Corbett KS, Wrapp D, Kirchdoerfer RN, Turner HL, et al. Immunogenicity and structures of a rationally designed prefusion MERS-CoV spike antigen. Proc Natl Acad Sci U S A 2017; 114(35):E7348-E7357.
9. Keech C, Albert G, Cho I, Robertson A, Reed P, Neal S, et al. Phase 1-2 Trial of a SARS-CoV-2 Recombinant Spike Protein Nanoparticle Vaccine. N Engl J Med 2020; 383(24):2320-2332.
10. Stephen SL, Montini E, Sivanandam VG, Al-Dhalimy M, Kestler HA, Finegold M, et al. Chromosomal integration of adenoviral vector DNA in vivo. J Virol 2010; 84(19):9987-9994.
11. Knoll MD, Wonodi C. Oxford-AstraZeneca COVID-19 vaccine efficacy. Lancet 2021; 397(10269):72-74.
12. Logunov DY, Dolzhikova IV, Shcheblyakov DV, Tukhvatulin AI, Zubkova OV, Dzharullaeva AS, et al. Safety and efficacy of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine: an interim analysis of a randomised controlled phase 3 trial in Russia. Lancet 2021; 397(10275):671-681.
13. Sadoff J, Le Gars M, Shukarev G, Heerwegh D, Truyers C, de Groot AM, et al. Interim Results of a Phase 1-2a Trial of Ad26.COV2.S Covid-19 Vaccine. N Engl J Med 2021.
14. Martinon F, Krishnan S, Lenzen G, Magne R, Gomard E, Guillet JG, et al. Induction of virus-specific cytotoxic T lymphocytes in vivo by liposome-entrapped mRNA. Eur J Immunol 1993; 23(7):1719-1722.
15. Probst J, Weide B, Scheel B, Pichler BJ, Hoerr I, Rammensee HG, et al. Spontaneous cellular uptake of exogenous messenger RNA in vivo is nucleic acid-specific, saturable and ion dependent. Gene Ther 2007; 14(15):1175-1180.
16. Weide B, Carralot JP, Reese A, Scheel B, Eigentler TK, Hoerr I, et al. Results of the first phase I/II clinical vaccination trial with direct injection of mRNA. J Immunother 2008; 31(2):180-188.
17. Pardi N, Hogan MJ, Porter FW, Weissman D. mRNA vaccines – a new era in vaccinology. Nat Rev Drug Discov 2018; 17(4):261-279.
18. Kranz LM, Diken M, Haas H, Kreiter S, Loquai C, Reuter KC, et al. Systemic RNA delivery to dendritic cells exploits antiviral defence for cancer immunotherapy. Nature 2016; 534(7607):396-401.
19. Sahin U, Derhovanessian E, Miller M, Kloke BP, Simon P, Lower M, et al. Personalized RNA mutanome vaccines mobilize poly-specific therapeutic immunity against cancer. Nature 2017; 547(7662):222-226.
20. Kariko K, Buckstein M, Ni H, Weissman D. Suppression of RNA recognition by Toll-like receptors: the impact of nucleoside modification and the evolutionary origin of RNA. Immunity 2005; 23(2):165-175.
21. Pardi N, Hogan MJ, Pelc RS, Muramatsu H, Andersen H, DeMaso CR, et al. Zika virus protection by a single low-dose nucleoside-modified mRNA vaccination. Nature 2017; 543(7644):248-251.
22. Baden LR, El Sahly HM, Essink B, Kotloff K, Frey S, Novak R, et al. Efficacy and Safety of the mRNA-1273 SARS-CoV-2 Vaccine. N Engl J Med 2020.
23. Wang Z, Schmidt F, Weisblum Y, Muecksch F, Barnes CO, Finkin S, et al. mRNA vaccine-elicited antibodies to SARS-CoV-2 and circulating variants. Nature 2021.
24. Dagan N, Barda N, Kepten E, Miron O, Perchik S, Katz MA, et al. BNT162b2 mRNA Covid-19 Vaccine in a Nationwide Mass Vaccination Setting. N Engl J Med 2021.
25. Meo SA, Bukhari IA, Akram J, Meo AS, Klonoff DC. COVID-19 vaccines: comparison of biological, pharmacological characteristics and adverse effects of Pfizer/BioNTech and Moderna Vaccines. Eur Rev Med Pharmacol Sci 2021; 25(3):1663-1669.
Links:
A. https://johnsonandjohnson.gcs-web.com/static-files/1c979f4f-cad3-4f8b-9a22-69aaac503570
B. https://ec.europa.eu/commission/presscorner/detail/en/IP_14_229
C. https://www.nytimes.com/interactive/2020/science/coronavirus-vaccine-tracker.html
D. https://www.bag.admin.ch/bag/en/home/krankheiten/ausbrueche-epidemien-pandemien/aktuelle-ausbrueche-epidemien/novel-cov/impfen.html
E. https://clinicaltrials.gov/ct2/show/NCT04527575
F. https://www.aekstmk.or.at/images/content/pdfs/covid19/Impf/Lancet%202021%20AZD1222%20efficacy%20against%20B1_1_7_%20variant.pdf
G. https://papers.ssrn.com/sol3/papers.cfm?abstract_id=3777268
H. https://www.fda.gov/media/146265/download
I. https://www.medrxiv.org/content/10.1101/2020.11.09.20228551v1
der informierte @rzt
- Vol. 11
- Ausgabe 3
- März 2021