- Individualisierte Abwägung des Blutungsrisikos unter DOACs bei Vorhofflimmern
Direkte orale Antikoagulantien (DOACs) werden zur Vorbeugung von Thromboembolien (TE) (z.B. kardioembolischem cerebrovaskulären Insult (CVI) bei Vorhofflimmern) sowie zur Therapie von TE gebraucht. Im Vergleich zu den Vitamin-K-Antagonisten (VKA) weisen sie als Medikamentenklasse weniger schwere Blutungen und insbesondere deutlich weniger intrazerebrale Blutungen bei gleich guter oder besserer antithrombotischer Wirkung auf. Kontraindikationen für DOACs bilden die Herzklappenprothesen, die valvuläre Mitralklappenstenose, intrakardiale Thromben, Sinusvenenthrombosen und das Phospholipidantikörpersyndrom, welche klassische VKA-Indikationen darstellen. Effektive DOAC-Antagonisten sind heute verfügbar, werden aber unter anderem wegen der kurzen Halbwertszeit relativ selten eingesetzt. Über die letzten Jahre sind gute Daten sowohl aus randomisierten Studien als auch von offenen Registern publiziert worden, die zur Vorbeugung von TE und DOAC-assoziierten Blutungen eine individualisierte Beratung unserer Patienten mit den diversesten Begleiterkrankungen und Charakteristika erlauben (Tumore, Nieren-, Lebererkrankungen, Thrombozytopenie, Co-Medikation, Compliance, frühere Blutungen, etc.). In der vorliegenden Übersicht sind die Fakten für eine individualisierte Arzt-Patienten-Diskussion in der Praxis und in der personalisierten, konkreten, optimalen Antikoagulantien-Therapie zusammengestellt.
Direct oral anticoagulants (DOACs) are applied in the prevention (e.g. cardioembolic stroke in atrial fibrillation) and treatment of systemic thromboembolic events (TE). Compared to vitamin-K-antagonists (VKA), these substances have been shown to be equal or better regarding their antithrombotic effects whilst causing less major bleeds (especially intracranial bleeds). DOACs should not be used in patients with prosthetic heart valves, mitral valve stenosis, intracardiac thrombi, cerebral venous sinus thrombosis or antiphospholipid syndrome. Effective specific antagonists are available, yet they are currently rather rarely used, also due to the short half life of DOACs. Over the past years promising data from randomized and registry studies on the prevention of DOAC-associated bleeding have been published. This information enables us to provide a personalized decision making for our patients in the view of their different characteristics comorbidities (e.g. cancer, renal and hepatic dysfunction, thrombocytopenia, co-medication, compliance, prior bleeds etc.) and personal preferences. This review provides a practical guide on the importance of an individualized shared decision making with oral anticoagulants.
Key Words: NOAC, Bleeding, Vorhofflimmern, risk assessment, practical management, atrial fibrillation, individualized therapy.
Fallbeispiel: Das Konsilium
Bei einer 70-jährigen Patientin wird im Rahmen einer präoperativen Untersuchung im EKG erstmalig ein wenig symptomatisches, normokardes Vorhofflimmern (VHF) festgestellt. Die Patientin soll aufgrund einer schweren Coxarthrose eine Hüft-Totalendoprothese (Hüft-TEP) erhalten. Zur Schmerzkontrolle nimmt sie seit einem Jahr ein rezeptfreies nicht-steroidales Antirheumatikum (NSAR, Ibuprofen 3x400mg), mittlerweile aufgrund progredienter Beschwerden zusätzlich Tramadol 3x50mg, ein. Anamnestisch sind eine arterielle Hypertonie (Candesartan 1x16mg und Amlodipin 1x10mg), eine hypertensiv-bedingte, chronische Niereninsuffizienz (Kreatinin 150μmol/l, Baseline eGFR 45ml/min) sowie eine aktuell recht stabile Immunthrombozytopenie (ITP, aktuell 75,000/μL, schwankend zwischen 50-250‘000/μL) bekannt. Auf Nachfrage berichtet sie von gelegentlichem orthostatischem Schwindel, weswegen sie vor 6 Monaten gestürzt sei, allerdings ohne Verletzungsfolgen. Ferner erlitt die Patientin vor zwei Jahren eine obere gastrointestinale (GI) Blutung, welche im Rahmen einer duodenalen Angiodysplasie (AD) interpretiert wurde. Seit der Laserkoagulation der AD ist die Patientin unter einer dauerhaften Therapie mit Protonenpumpenhemmern (PPI, Pantoprazol 1x40mg). Aufgrund des neu gefundenen VHF interpretieren Sie eine passagere Sprachstörung vor zwei Jahren retrospektiv mit hoher Wahrscheinlichkeit als transitorische ischämische Attacke (TIA). In der Echokardiografie bestätigen Sie bei der klinisch rüstigen Patientin eine leichte Linksherzinsuffizienz (EF 40%). Die Patientin hat aufgrund ihrer Vorgeschichte Vorbehalte gegenüber der Antikoagulation. Der Orthopäde möchte das perioperative, der Hausarzt das längerfristige Procedere festlegen, weshalb Sie konsiliarisch zur Beratung der Patientin beigezogen worden sind.
Individualisierte Nutzen-Risiko-Abwägung und Entscheidungsfindung mit der Patientin
Ist die Antikoagulation in diesem Fall indiziert und wie ist das Nutzen-Risiko-Verhältnis?
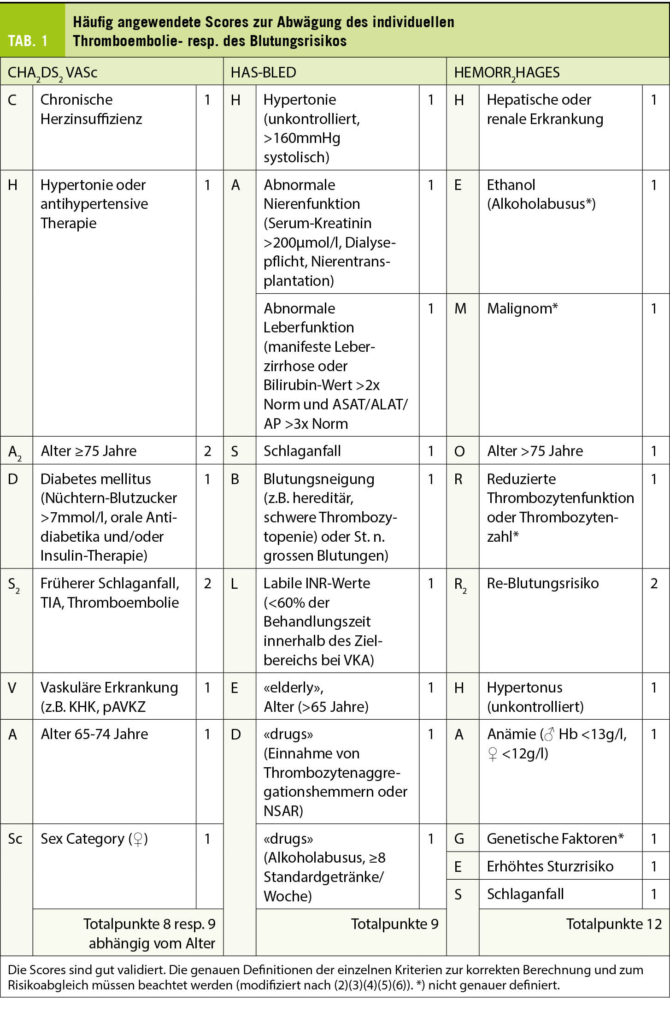
Zur Indikationsstellung einer oralen Antikoagulation nach Erstdiagnose eines primären VHF ist die individuelle Risikoabschätzung mittels Vortestwahrscheinlichkeit einer TE – beim VHF insbesondere CVI/TIA – ausschlaggebend. Zur Einschätzung eines TE-Risikos verwenden Sie den CHA2DS2-VASc-Score (1), welcher gegen den HAS-BLED-Score (2) zur Evaluation des Blutungsrisikos abgewogen wird (Tab. 1). Aufgrund der Vorgeschichte der Patientin ergibt sich ein CHA2DS2-VASc von 6 Punkten (Alter, Geschlecht, Herzinsuffizienz, Hypertonie und hochwahrscheinliche TIA). Dies entspricht einem jährlichen TE-Risiko (CVI, TIA, systemische TE) von 13.6% resp. einem CVI-Risiko von 9.7% (3), weshalb eine orale Antikoagulation zur Vorbeugung eines thromboembolischen Ereignisses gemäss den aktuellen Guidelines klar indiziert ist (4). Allerdings weist die Patientin auch einen HAS-BLED Score von 3 Punkten auf (Alter, Einnahme von NSAR, Status nach GI-Blutung). Sie geben im Blutungs-Score keine Punkte für die arterielle Hypertonie, da sie kontrolliert ist (aktueller Blutdruck bei <160mmHg systolisch) wie auch nicht für die chronische Niereninsuffizienz, da das Kreatinin bei <200μmol/L liegt. Die neu postulierte TIA werten Sie gemäss Definition des HAS-BLED ebenfalls nicht als CVI, so dass Sie für die Patientin ein Risiko für schwere Blutungen gemäss Lip et al. von 5.8% (5) resp. gemäss Pisters et al. von 3.7 pro 100-Patientenjahre (2) prognostizieren.
Die Patientin erkennt, dass anhand dieser Scores ihr TE- resp. CVI-Risiko das Blutungsrisiko deutlich übersteigt, aber sie hat aufgrund ihrer ITP bereits recherchiert und ist auf den HEMORR2HAGES-Score gestossen. Sie hat selbst einen Score von 4 Punkten berechnet (Niereninsuffizienz, Thrombozytopenie, Status nach Blutung), was ein Blutungsrisiko von 10.4% pro 100-Patientenjahre ergibt (6). Die Patientin möchte (zurecht!) wissen, warum die frühere Blutung, welche beim HEMORR2HAGES berücksichtigt wird, in dem von Ihnen angewandten HAS-BLED Score zusammen mit der Thrombopenie nicht gleichermassen berücksichtigt wird (Tab. 1). Sie befürchtet eine Blutung insbesondere aufgrund ihrer ITP. Sie argumentieren, dass die AD, welche die obere GI-Blutung verursacht hat, aufgrund der stattgehabten Intervention und einer kürzlichen Kontrolle mittels Re-Gastroskopie, nun kaum mehr ein Risiko darstelle. Zudem weisen Sie die Patientin darauf hin, dass ihr Blutungsrisiko – zumindest partiell – modifizierbar sei (Tab. 3) (4). Im Fall der Patientin ist es wichtig, die NSAR, durch andere nicht-ulcerogene oder plättchenhemmende Analgetika zu ersetzen und die PPI weiter einzunehmen (4, 7). In Studien wird eine Niereninsuffizienz im HAS-BLED Score als terminale Niereninsuffizienz oder ab einem Kreatinin 2,5mg/dl, d.h. >220μmol/l, was deutlich höher als das Kreatinin der Patientin ist (2). Weiter hat die Patientin genügend hämostatisch aktive Thrombozyten (retikulierte Thrombozyten bis zu 30%, total 50-250’000 Thrombozyten/μL) und hatte bisher klinisch keinerlei mukokutane oder andere relevante Blutungen, für welche die ITP verantwortlich gemacht würde. Sie weisen jedoch die Patientin daraufhin, dass man den behandelnden Hämatologen involviert, um – falls nötig – eine Behandlung der ITP mit Thrombozyten-stimulierenden Medikamenten zu initiieren (8). Damit reduzieren Sie die Blutungsgefahr auf einen Punkt (Thrombozytopenie), wobei hier die Kriterien resp. die Differenzierung der Thrombozytopenie/Thrombozytendysfunktion nicht scharf ist. Dies entspricht nun einer Blutungsrate von ca. 2.5% pro 100-Patientenjahre (6), so dass für die Patientin nun die Risiko-Analyse klar auf die Seite der Thromboembolie liegt.
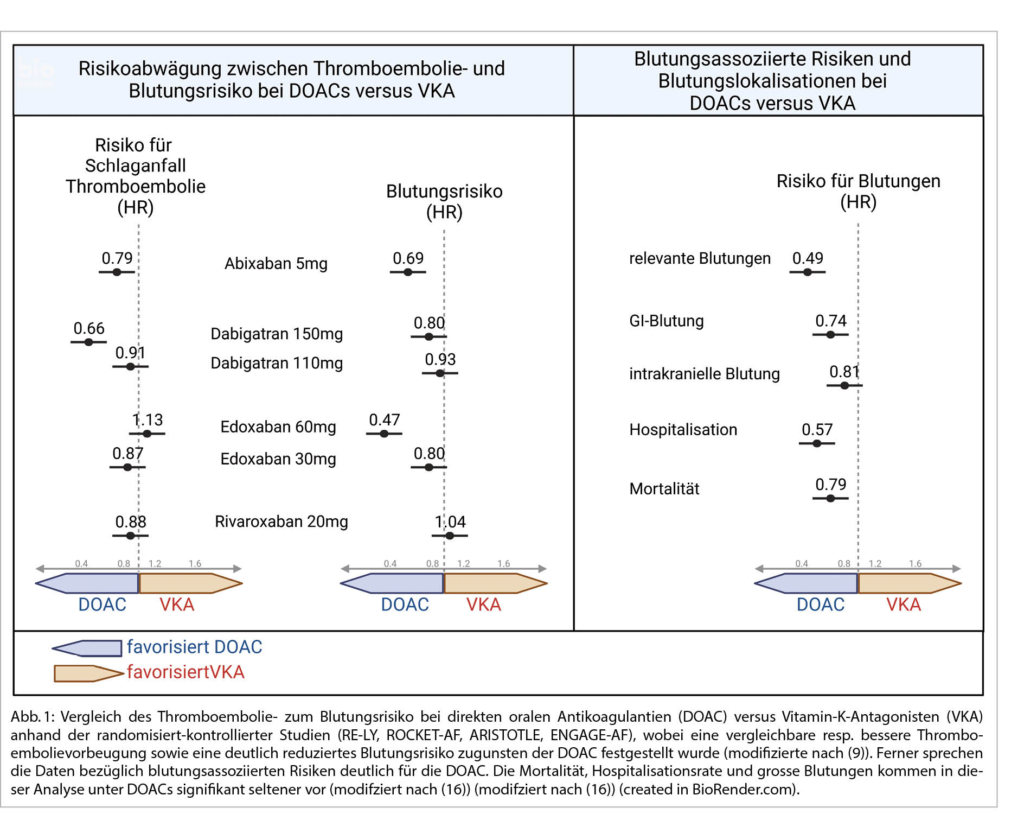
Die belesene Patientin weist Sie darauf hin, dass Ihre Daten/Argumente aus der Zeit der VKA stammten. Sie geben ihr auch hier Recht, zeigen ihr aber im Direktvergleich die geringere Blutungs- und gleiche bis bessere TE-Rate unter DOACs auf. Aus diesen Daten resultiert unter anderem auch die individualisierte Wahl des DOACs (Abb. 1) (9). In einer kürzlichen Meta-Analyse zeigte sich, dass von 1‘000 Patienten 17 eine relevante Blutung unter VKA erlitten haben und unter DOAC jedoch nur 11. Ebenfalls sank das Blutungsrisiko über die Zeit: Nach 10 Jahren Antikoagulation lag das Risiko einer tödlichen Blutung noch bei 2.4% (10).
Die Patientin möchte nun wissen, ob und wie ein Absetzen zu handhaben wäre, nachdem es trotzdemm zu einer Blutung käme. Längerfristig: Das Risiko der TE nach anhaltendem Absetzen der Antikoagulation erreicht 10% nach 1 Jahr und 36% nach 10 Jahren, wobei 4% dieser TE tödlich waren (11). Dementsprechend würde man ein Absetzen in dieser Konstellation nicht empfehlen. Interessant wäre hingegen die Möglichkeit der Dosisreduktion nach 6 Monaten, falls keine besondere TE-Risikokonstellation vorliegt (11). Sollte im Verlauf das Blutungsrisiko dem TE-Risiko deutlich überwiegen, könnte man bei der ansonsten rüstigen Patientin auch einen operativen Verschluss des linken Vorhofohrs erwägen (vgl. perioperatives und kurzfristiges Management unten) (13)(14).
Welches DOAC soll gewählt werden?
Nach der ausführlichen Anamnese und Untersuchung inkl. Würdigung der Laboranalysen (insbesondere Anämie, Thrombozytopenie, Nieren- und Leberfunktion), Co-Medikation, des Alters, allfällige Tumorleiden, vorgängigen Blutungen, sonstigen Gerinnungsstörungen, Abschätzung der Compliance, der Sturzgefahr und Diskussion der persönlichen Präferenzen zur Einnahmefrequenz (einmalig vs. zweimalige Einnahme/Tag) kann die Wahl des DOACs gemeinsam erfolgen.
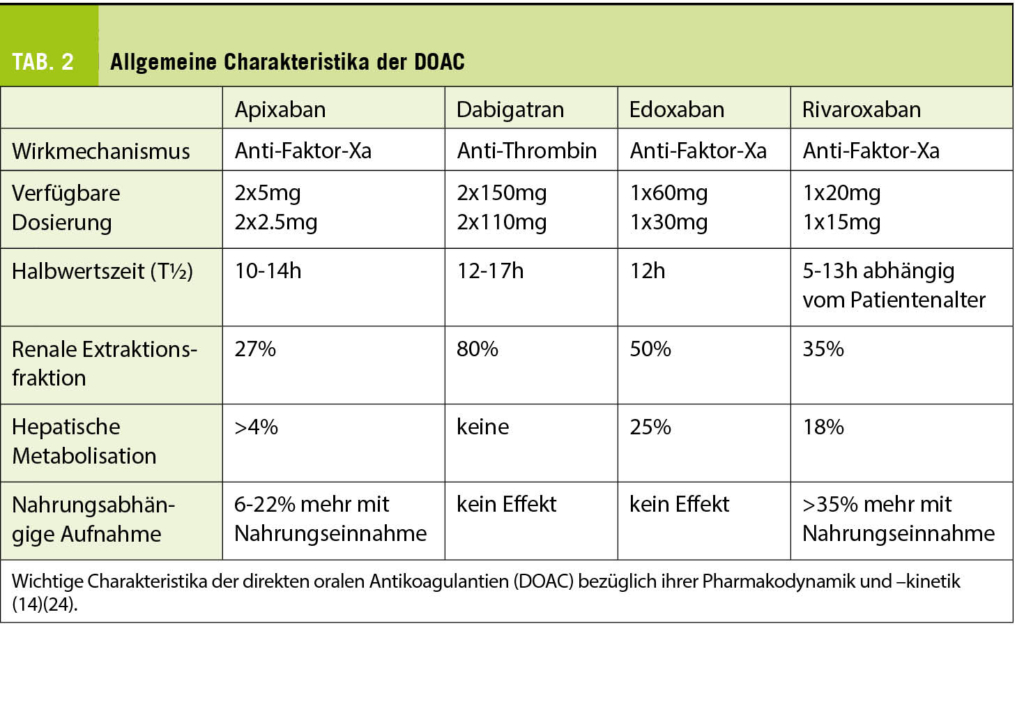
Bekannte internationale randomisiert-kontrollierte Studien haben gezeigt, dass DOACs zur Prävention von CVI/TE gleich gut oder besser und zur Prävention von Blutungen deutlich besser abschneiden als VKA (Abb. 1) (9). Gemäss den aktuellen Empfehlungen können bei Vorhofflimmern grundsätzlich alle DOACs zur Anwendung kommen, allerdings haben die einzelnen Präparate in Bezug auf ihre Applikation, Pharmakodynamik und –kinetik, die Effektivität und die Blutungsgefahr individuelle Vorteile (siehe unten, Tab. 2) (4)(13)(15).
DOACs und GI-Blutungen
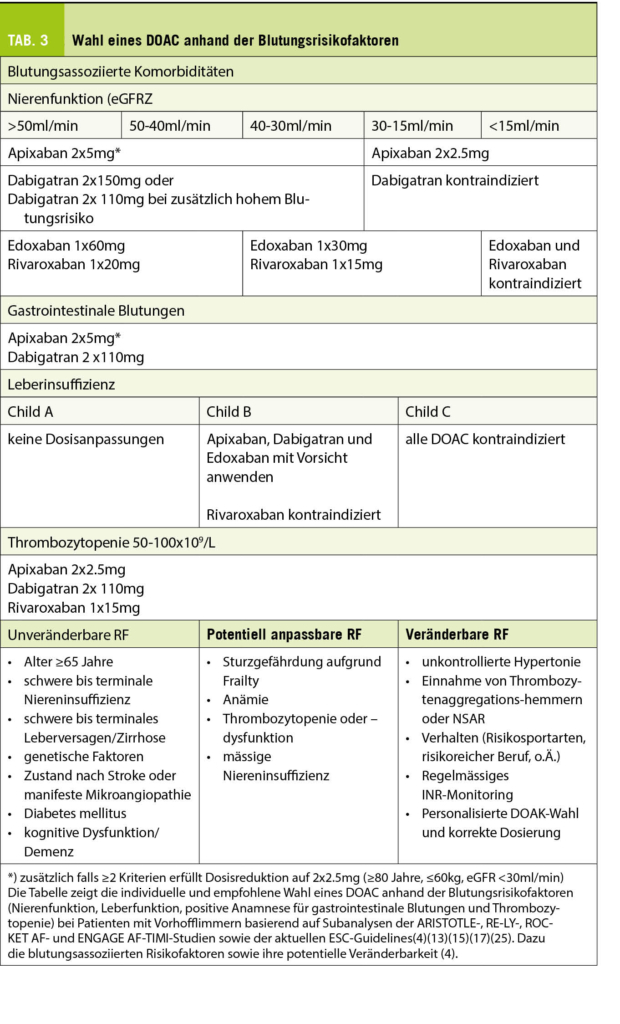
Grundsätzlich kann man der Patientin aufzeigen, dass mit der Einnahme eines DOAC anstelle des VKA ihr GI-Blutungsrisiko deutlich gesenkt werden kann (Hazard Ratio 0.74, Abb. 1) (9)(16). In einer kürzlich publizierten, grossen Registerstudie von Ingason et al. zur Untersuchung des gastrointestinalen Blutungsrisikos unter DOACs (Rivaroxaban, Apixaban und Dabigatran) wurde ein erhöhtes Risiko bei Patienten unter Rivaroxaban festgestellt (Cave: Kein Direktvergleich in Studien, indirekte Aussagen immer vorsichtig interpretieren). Das DOAC mit dem geringsten Risiko für GI-Blutungen schien Apixaban (Rivaroxaban 3.2% vs. Apixaban 2.5%-Risiko/Jahr (17). Diese Aussage ergibt sich auch aus Registerstudien, Versicherungsanalysen und aus grossen, randomisiert-kontrollierten DOAC-Studien. Hier zeigte sich nämlich das geringste GI-Blutungsrisiko für Apixaban bei voller Dosis und Dabigatran bei reduzierter Dosis (13). Daraus leitet sich Ihre Präferenz und Empfehlung für Ihre Patientin ab. Das GI-Blutungsrisiko kann wie erwähnt mit einer zusätzlichen Gabe von Protonenpumpeninhibitor (PPI) und mit modifizierter analgetischer Therapie gesenkt werden (Tab. 3) (4)(7).
DOACs und Niereninsuffizienz
Da nicht alle DOAC gleichermassen über die Niere eliminiert werden, müssen sie in ihrer Dosierung der Kreatinin-Clearance (eGFR) angepasst werden. Von allen DOAC wird Apixaban am wenigsten über die Niere ausgeschieden (ca. 27%), sodass es bei nierenkranken Patienten das bevorzugte DOAC ist (18). Es kann bis zu einer eGFR von bis 30ml/min zur Anwendung kommen und neuere Daten zeigen gar eine Anwendung bis 15ml/min resp. in Einzelfällen bei Dialysepatienten (13)(19). Bis zu einer eGFR von 30ml/min können ebenfalls Rivaroxaban, Dabigatran und Edoxaban in reduzierter Dosis verwendet werden (Tab. 3) (13).
DOACs und Leberinsuffizienz
Eine fortgeschrittene Leberfunktionsstörung führt zu einer Koagulopathie und zu einer Dysbalance von pro- und antikoagulatorischen sowie fibrinolytischen Faktoren, was in instabilen Gerinnungsparametern resultiert; DOACs sind daher bei schwerer Leberdysfunktion kontraindiziert (ab Stadium Child Pugh B). Mit entsprechender Vorsicht und Kontrolle können bis Child B Dabigatran, Edoxaban und Apixaban zur Anwendung kommen, allerdings ist eine Abwägung von Indikation, Nutzen und Risiken unerlässlich (Tab. 3) (13)(14).
DOACs und Sturzgefahr
Bei Patienten >75 Jahren, welche an Polymorbidität und einem damit einhergehenden «Frailty-Syndrom» leiden, sollte man die Sturzgefährdung beachten. Solche Patienten sind vermehrt gefährdet, eine intrakranielle Blutung (ICB) unter oraler Antikoagulation zu erleiden. Obwohl Studien zeigen, dass der Nutzen der Prävention einer TE und eines CVI der Gefahr einer ICB unter DOAC bei dieser Population überwiegt (15) und das Outcome nach ICB unter DOAC sowie VKA in etwa gleich ist, ist das Management von DOACs nach ICB ein Dilemma. In der Regel können 4-8 Wochen nach einer posttraumatischen ICB die DOACs nach eingehender Nutzen-Risiko-Abwägung wieder eingenommen werden. Allerdings muss bei unveränderbaren intrakraniellen Blutungsrisiken (z.B. cerebrale Amyloidose) das individuelle Blutungsrisiko (Compliance, Alkoholabusus, persistierende Sturzgefahr) und der Vorteil einer erneuten Einnahme von DOAC gut abgewogen werden (13). Da sehr viele von «Frailty» betroffenen polymorbiden Patienten auch untergewichtig sind und eine reduzierte Nierenfunktion aufweisen, werden Sie für diese Patienten die Abgabe von Apixaban in reduzierter Dosis ins Auge fassen (15).
DOACs und Tumorerkrankungen
Bei Patienten mit einem bekannten Tumorleiden können DOAC ebenfalls zum Einsatz kommen (niedermolekulares Heparin, LMWH und DOACs bevorzugt gegenüber VKA). Studien zum Vergleich mit LMWH sind verfügbar, wobei DOACs über alles non-inferior waren (20). Die individuellen Co-Faktoren des Patienten so wie auch das Blutungsrisiko des Tumors (z.B. erhöht bei gastrointestinalen oder urogenitalen Tumoren), gleichzeitige medikamentöse Therapien (Antikörpertherapien/Immunmodulatoren mit starker CYP3A4-Induktion oder –inhibition), vorhandene Begleiterkrankungen (z.B. Malnutrition, Ösophagitis/Gastritis durch Radio-/Chemotherapien, Zytopenien mit z.B. schwankenden Thrombozytenwerten, Niereninsuffizenz unterschiedlicher Dynamik, Dosisanpassungsbedarf, etc.) sind wiederum bei der Entscheidungsfindung zu beachten. Je nach Blutungsrisiko und passagerem Risiko werden Sie deshalb mind. vorübergehend mit LMWH mit angepasster Dosierung behandeln (21). Zusammenfassend sollte die DOAC-Wahl auf die Biologie des Tumors, die Begleittherapien, die individuellen Begleiterkrankungen und die Laborparameter abgestimmt und entsprechend die Dosis angepasst werden (nützliche Hinweise und Algorithmen in (15)(13)(21)(22)).
Soll ein präoperatives «Bridging» erfolgen?
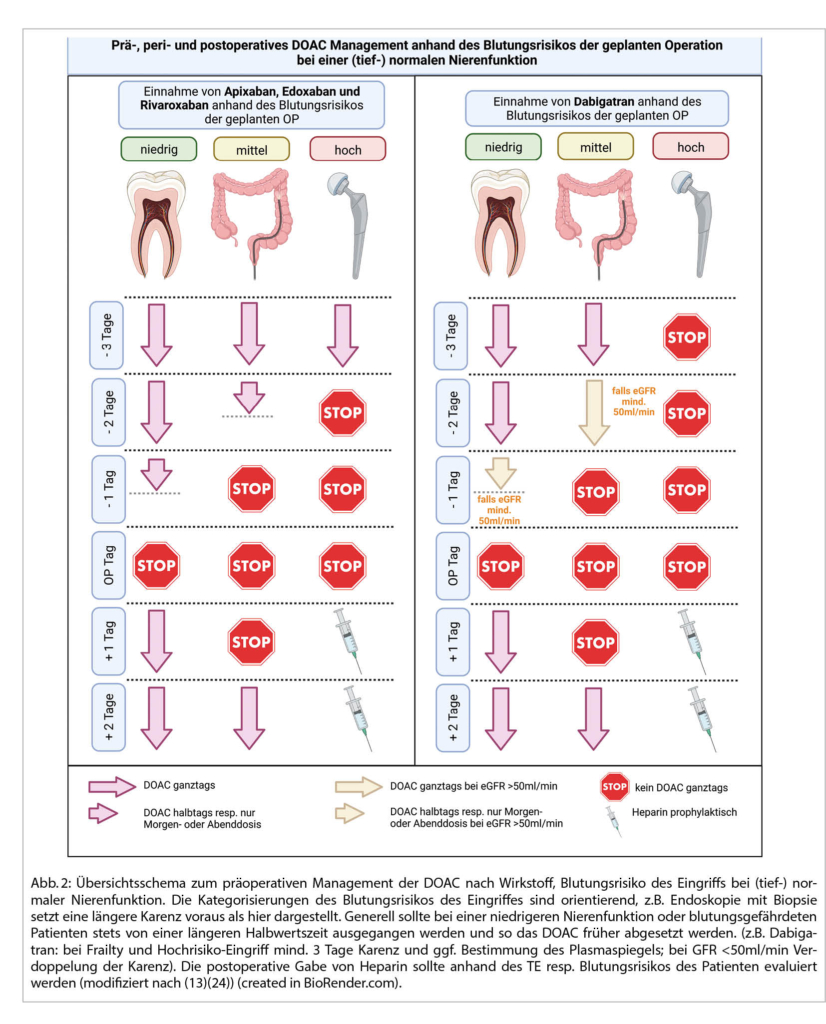
Bei elektiven Eingriffen haben randomisierte-kontrollierte Studien ergeben, dass das kurze präoperative Pausieren der oralen Antikoagulation dem «Bridgen» bzgl. Blutungsrisiko in aller Regel klar überlegen ist. Die Daten zeigen, dass perioperatives «Bridgen» mit dem Overlap von zwei Antikoagulantien das Gerinnungssystem entsprechend mehr belastet und das Blutungsrisiko deutlich erhöht wird. Bei einem geplanten Eingriff kann in Abhängigkeit vom Blutungsrisiko (tief: dentale, dermatologische, ophthalmologische, otologische Eingriffe; mässig: z.B. Endoskopie, hoch: z.B. orthopädischer oder neurochirurgischer Eingriff) und des TE-Risikos sowie der Nierenfunktion des Patienten meist ein gutes präoperatives Einnahmeschema erarbeitet werden (Abb. 2). Handelt es sich um eine notfallmässig indizierte Operation, erfolgt in der Regel die letzte Einnahme gleichentags der Indikationsstellung. Daher muss der Operateur evaluieren, ob die Notfalloperation innert Minuten, Stunden oder Tagen (Halbwertszeiten, Plasmakonzentrationen) stattfinden muss. In sehr dringenden Fällen empfiehlt sich die rasche Evaluation eines umfassenden Gerinnungslabors (inkl. PT, aPTT, spezifische anti-Xa Konzentrationen resp. Thrombinzeiten, sowie der spezifischen Plasmakonzentration im Falle von Dabigatran). Anhand dessen sollte die Evaluation einer spezifischen Antagonisierung des DOACs im interdisziplinären Team (zurückhaltend) stattfinden (13) (laufende Studien). Aktuell werden insbesondere bei lebensbedrohlichen, unkontrollierbaren Blutungen spezifische Antagonisten empfohlen: Dabigatran kann mit Idarucizumab, Rivaroxaban sowie Apixaban können mit Adnexanet alfa antagonisiert werden. Für Edoxaban ist die Datenlage noch nicht als ausreichend beurteilt, allerdings könnte in Zukunft auch Andexanet alfa zum Einsatz kommen. Bis dahin kann Prothrombinkomplex-Konzentrat angewandt werden (23).
Zusammenfassende Empfehlungen für Ihre Patientin
Zusammenfassend empfehlen Sie Ihrer Patientin bei einem deutlich erhöhten TE-Risiko die orale Antikoagulation. Aufgrund des erhöhten Blutungsrisikos schlagen Sie der Patientin eine Therapie mit DOACs vor. Die Reduktion des Blutungsrisikos diskutieren Sie eingehend: Sie raten Ihr zur Einnahme von PPI, die Sistierung der Therapie mit NSAR, einer erneuten Kontroll-Gastroskopie sowie engmaschige Kontrollen der Thrombozytenzahl, der Nierenfunktion sowie des Blutdrucks. Wegen des anamnestischen GI-Blutungsrisikos werden Sie eher eine Antikoagulation mit Apixaban oder Dabigatran in angepasster Dosis wählen, wobei letzterer Wirkstoff aufgrund der Niereninsuffizienz eher sekundär oder nur unter engmaschiger Kontrolle zu wählen ist. Ebenfalls diskutieren Sie mit der Patientin die zweimal tägliche Medikamenteneinnahme. Sollte dies seitens der Patientin oder Ihrerseits aus Gründen der Compliance nicht in Frage kommen, könnte Rivaroxaban oder auch Edoxaban in reduzierter Dosis angewendet werden. Sie empfehlen dann jedoch engmaschige Stuhl- und Hämoglobinkontrollen.
Aufgrund des deutlich erhöhten Blutungsrisikos der geplanten Operation wird man der Patientin empfehlen, das DOAC im Falle von Apixaban 48h und im Falle von Dabigatran 72h vor Schnitt abzusetzen. Der Operateur lässt zusätzlich bei vorhandener Niereninsuffizienz und Thrombozytopenie vor der Operation einen anti-Faktor-Xa-Spiegel bestimmen, der keine überhöhte Apixaban-Plasma-Konzentration im Sinne einer Kumulation zeigte. Am Abend des ersten und zweiten postoperativen Tages entscheidet sich der Operateur für eine prophylaktische Fragmin-Gabe von 5‘000E s.c. Am dritten postoperativen Tag konnte bei komplikationslosem postoperativem Verlauf und konstanter Thrombozytenzahl >70‘000/μl die Einnahme von 2×2.5mg Apixaban p.o. wiederaufgenommen werden.
Wie bereits vorgängig angemerkt, empfehlen Sie dieser Patientin engmaschige klinische (Blutungsstigmata) und laborchemische (Kreatinin und Blutbild) Kontrollen. Sie empfehlen, die Patientin im ersten Monat zur wöchentlichen, im zweiten Monat zu zwei-wöchentlichen ambulanten Visiten aufzubieten.
Copyright by Aerzteverlag medinfo AG
Department Innere Medizin
Kantonsspital Baden
5404 Baden
Leiter Gerinnungssprechstunde Kantonsspital Baden, 5404 Baden
Labor für Molekulare Kardiologie, Leiter Plättchenforschung,
Universität Zürich
Wagistrasse 12
8952 Schlieren
hansjuerg.beer@ksb.ch
Prof. J.H. Beer: Grant Support des Schweizerischen Nationalfonds (Gesuchsnummer 310030_144152), der Schweizerischen Herzstiftung, der Kardio Stiftung, Grant und Beratungs-Support an die Institution durch Bayer, Sanofi und Daitchii. T. Ziswiler deklariert keine Interessenskonflikte in Zusammenhang mit diesem Artikel.
◆ Bei der Indikationsstellung zur Antikoagulation müssen das
Thromboembolie- und Blutungsrisiko individualisiert gegeneinander abgewogen werden.
◆ Insbesondere bei speziell blutungsgefährdeten Patienten ist
eine gute Aufklärung bzgl. der assoziierten Risikofaktoren und regelmässige klinisch sowie laborchemische Kontrollen unter einer DOAC-Therapie unerlässlich.
◆ Potentiell und effektiv modifizierbare blutungsassoziierte Risikofaktoren müssen gründlich erfragt, untersucht und therapiert werden.
◆ Prä- und perioperatives Bridging soll nur in seltenen, speziellen
Ausnahmefällen (z.B. mechanische Herzklappenprothese und
Vorhofflimmern mit Stroke) angewandt werden, da eine passagere duale Antikoagulation zu einem deutlich erhöhten Blutungsrisiko führen kann.
1. Lip GYH, Nieuwlaat R, Pisters R, Lane DA, Crijns HJGM, Andresen D, et al. Refining clinical risk stratification for predicting stroke and thromboembolism in atrial fibrillation using a novel risk factor-based approach: The Euro Heart Survey on atrial fibrillation. Chest. 2010;137(2):263–72.
2. Pisters R, Lane DA, Nieuwlaat R, De Vos CB, Crijns HJGM, Lip GYH, et al. A novel user-friendly score (HAS-BLED) to assess 1-year risk of major bleeding in patients with atrial fibrillation: The euro heart survey. Chest. 2010;138(5):1093–100.
3. Friberg L, Rosenqvist M, Lip GYH. Evaluation of risk stratification schemes for ischaemic stroke and bleeding in 182 678 patients with atrial fibrillation: The Swedish Atrial Fibrillation cohort study. Eur Heart J. 2012;33(12):1500–10.
4. Hindricks G, Potpara T, Dagres N, Bax JJ, Boriani G, Dan GA, et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J. 2021;42(5):373–498.
5. Lip GYH, Frison L, Halperin JL, Lane DA. Comparative validation of a novel risk score for predicting bleeding risk in anticoagulated patients with atrial fibrillation: The HAS-BLED (hypertension, abnormal renal/liver function, stroke, bleeding history or predisposition, labile INR, elderly, drug. J Am Coll Cardiol. 2011;57(2):173–80.
6. Gage BF, Yan Y, Milligan PE, Waterman AD, Culverhouse R, Rich MW, et al. Clinical classification schemes for predicting hemorrhage: Results from the National Registry of Atrial Fibrillation (NRAF). Am Heart J. 2006;151(3):713–9.
7. Ray WA, Chung CP, Murray KT, Smalley WE, Daugherty JR, Dupont WD, et al. Association of Oral Anticoagulants and Proton Pump Inhibitor Cotherapy with Hospitalization for Upper Gastrointestinal Tract Bleeding. JAMA – J Am Med Assoc. 2018;320(21):2221–30.
8. Provan D, Arnold DM, Bussel JB, Chong BH, Cooper N, Gernsheimer T, et al. Updated international consensus report on the investigation and management of primary immune thrombocytopenia. Blood Adv. 2019;3(22):3780–817.
9. Lüscher TF, Davies A, Beer JH, Valgimigli M, Nienaber CA, Camm JA, et al. Towards personalized antithrombotic management with drugs and devices across the cardiovascular spectrum. Eur Heart J. 2021;00:1–24.
10. Khan F, Tritschler T, Kimpton M, Wells PS, Kearon C, Weitz JI, et al. Long-term risk for major bleeding during extended oral anticoagulant therapy for first unprovoked venous thromboembolism: A systematic review and meta-analysis. Ann Intern Med. 2021;174(10):1420–9.
11. Khan F, Rahman A, Carrier M, Kearon C, Weitz JI, Schulman S, et al. Long term risk of symptomatic recurrent venous thromboembolism after discontinuation of anticoagulant treatment for first unprovoked venous thromboembolism event: Systematic review and meta-analysis. BMJ. 2019;366:l4363..
12. Carlin S, Eikelboom JW. Direct oral anticoagulant dose selection: Challenging cases. J Thromb Haemost. 2021;19(11):2680–6.
13. Steffel J, Collins R, Antz M, Cornu P, Lien D, Haeusler KG, et al. 2021 European Heart Rhythm Association Practical Guide on the Use of Non-Vitamin K Antagonist Oral Anticoagulants in Patients with Atrial Fibrillation. Europace. 2021;23(10):1612-1676.
14. Zappulla P, Calvi V. Gastrointestinal Bleeding and Direct Oral Anticoagulants among Patients with Atrial Fibrillation: Risk, Prevention, Management, and Quality of Life. TH Open. 2021;05(02):e200–10.
15. Diener HC, Aisenberg J, Ansell J, Atar D, Breithardt G, Eikelboom J, et al. Choosing a particular oral anticoagulant and dose for stroke prevention in individual patients with non-valvular atrial fibrillation: Part 2. Eur Heart J. 2017;38(12):860–8.
16. Jackevicius CA, Lu L, Ghaznavi Z, Warner AL. Bleeding Risk of Direct Oral Anticoagulants in Patients with Heart Failure and Atrial Fibrillation. Circ Cardiovasc Qual Outcomes. 2021;(February):155–68.
17. Ingason AB, Hreinsson JP, Ágústsson S, Lund SH, et al. Rivaroxaban Is Associated With Higher Rates of Gastrointestinal Bleeding Than Other Direct Oral
Anticogulants: A Nationwide Propensity Score-Weighted Study. Ann Intern Med. 2021;174(11):1493-1502.
18. Hohnloser SH, Hijazi Z, Thomas L, Alexander JH, Amerena J, Hanna M, et al. Efficacy of apixaban when compared with warfarin in relation to renal function in patients with atrial fibrillation: Insights from the ARISTOTLE trial. Eur Heart J. 2012;33(22):2821–30.
19. Siontis KC, Zhang X, Eckard A, Bhave N, Schaubel DE, He K, et al. Outcomes associated with apixaban use in patients with end-stage kidney disease and atrial fibrillation in the United States. Circulation. 2018;138(15):1519–29.
20. Li A, Garcia DA, Lyman GH, Carrier M. Direct oral anticoagulant (DOAC) versus low-molecular-weight heparin (LMWH) for treatment of cancer associated thrombosis (CAT): A systematic review and meta-analysis. Thromb Res. 2019;173:158–63.
21. Pernod G, Joly M, Sonnet B. Direct oral anticoagulant (DOAC) versus low-molecular-weight heparin (LMWH) for the treatment of cancer-associated thrombosis (which agent for which patient). JMV-Journal Med Vasc. 2020;45(6):6S17–23.
22. Carrier M, Blais N, Crowther M, Kavan P, Gal G Le, Moodley O, et al. Treatment Algorithm in Cancer-Associated Thrombosis: Updated Canadian Expert Consensus. Curr Oncol. 2021;28(6):5434–51.
23. White K, Faruqi U, Cohen AAT, White K. New agents for DOAC reversal: a practical management review. Br J Cardiol. 2022;29(1):1.
24. Bonetti NR, Laube ES. NOAC: “NO Anticoagulation without Consideration. Cardiovasc Med. 2014;17(7–8):213–20.
25. Janion-Sadowska A, Papuga-Szela E, Lukaszuk R, Chrapek M, Undas A. Non–Vitamin K antagonist oral anticoagulants in patients with atrial fibrillation and thrombocytopenia. J Cardiovasc Pharmacol. 2018;72(3):153–60.
der informierte @rzt
- Vol. 12
- Ausgabe 7
- Juli 2022