- Infektiöse Endokarditis – Update 2024
Trotz grosser Fortschritte sowohl in Prävention, Diagnostik und Therapie in den letzten Jahren bleibt die infektiöse Endokarditis (IE) eine Erkrankung mit erheblicher Morbidität und Mortalität. Im Jahr 2023 wurden sowohl durch die Europäische Gesellschaft für Kardiologie (ESC) als auch durch die Internationale Fachgesellschaft für kardiovaskuläre Infektionen (ISCVID) überarbeitete Leitlinien zur IE publiziert. Darin wurden umfangreiche Neuerungen in den Bereichen Prävention, Diagnostik und Therapie implementiert. Präventive Massnahmen wurden klarer definiert und mit einer höheren Empfehlung versehen. In der Diagnostik werden neben der Echokardiographie der Einsatz weiterer Bildgebungsverfahren wie kardiale Computertomographie (CT) oder Positronenemissionstomographie (PET/CT) stärker gewichtet und in Bezug auf mikrobiologische Kriterien das Spektrum der typischen IE-Erreger erweitert. Bei der Therapie schliesslich gibt es relevante Neuerungen in Bezug auf Möglichkeiten einer ambulanten antibiotischen Therapie für bestimmte selektionierte Patienten. Die Indikationen für herzchirurgische Operationen wurden ebenfalls überarbeitet, wobei der Zeitpunkt der Operation klarer definiert wurde. Dieser Artikel gibt einen Überblick über die wichtigsten Änderungen.
Despite significant advancements in prevention, diagnosis, and therapy in recent years, infectious endocarditis (IE) remains a disease with considerable morbidity and mortality. In 2023, both the European Society of Cardiology (ESC) and the International Society for Cardiovascular Infectious Diseases (ISCVID) published revised guidelines on IE. Extensive innovations in the areas of prevention, diagnosis, and therapy were implemented. Preventive measures were more clearly defined and given stronger recommendations. In diagnosis, alongside echocardiography, the use of additional imaging modalities such as cardiac computed tomography (CT) or positron emission tomography (PET/CT) is given greater emphasis, and the spectrum of typical IE pathogens has been expanded concerning microbiological criteria. In therapy, there are significant innovations regarding the possibilities of outpatient antibiotic treatment for certain selected patients. The indications for cardiac surgical operations have also been revised, with the timing of surgery being more clearly defined. This article provides an overview of the most important changes.
Key words: Endocarditis/prevention, endocarditis/Diagnosis, endocarditis
Einleitung
Weltweit beträgt die geschätzte Inzidenz der IE 13.8 Fälle pro 100 000 Personen pro Jahr; 66 300 Patienten versterben an den Folgen einer IE (1). Trotz enormer Fortschritte in der Medizin haben sich sowohl die Inzidenz als auch die Mortalität (bei hospitalisierten Patienten mit IE zwischen 15 und 30 %) in den letzten 25 Jahren nicht wesentlich gebessert. Was sich jedoch verändert hat, ist die Ätiologie der IE. Waren früher häufiger Patienten mit rheumatischer Herzkrankheit als Risikofaktor betroffen und vergrünende Streptokokken die häufigsten Erreger einer IE, so sehen wir heute vermehrt Patienten mit kardiovaskulären Implantaten (Schrittmacher, künstliche Herzklappen (inkl. TAVI), Rekonstruktionen etc.), ältere Patienten mit mehr Komorbiditäten, mehr Immunsuppression, mehr altersbedingt degenerativen Klappenveränderungen und als auslösende bakterielle Erreger häufiger Staphylokokken, Enterokokken und weitere bisher eher seltene IE-Erreger, wie zum Beispiel Cutibakterien, Corynebakterien sowie gramnegative Bakterien, wie zum Beispiel Serratia marcescens. Vor diesem Hintergrund der epidemiologischen, klinischen und mikrobiologischen Veränderungen der IE wurden 2023 sowohl durch die European Society of Cardiology (ESC) (1) als auch die International Society of Cardiovascular Infections (ISCVID) (2) neue Guidelines zur Prävention, Diagnostik und Therapie der IE publiziert. In diesem Übersichtsartikel werden die für den Allgemeinpraktiker wichtigsten Aspekte der neuen IE-Guidelines beleuchtet und zusammengefasst.
Prävention
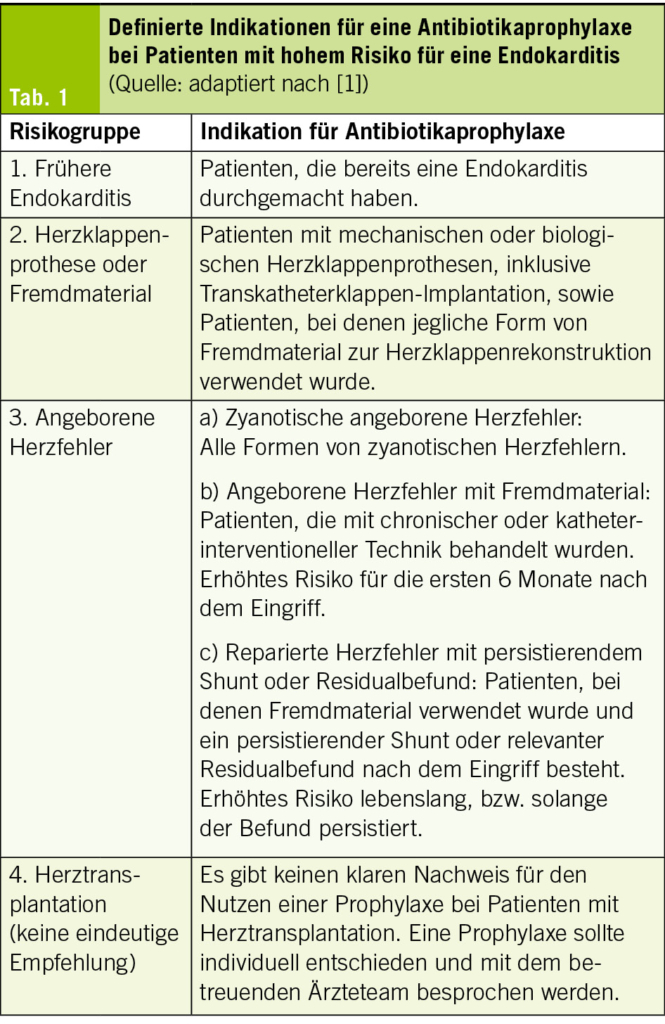
Patienten werden in Gruppen mit niedrigem, mittlerem und hohem Risiko einer IE eingeteilt. Unverändert bleibt die Empfehlung zur Prophylaxe mit Antibiotika für Patienten mit hohem IE-Risiko (Tab. 1), wurde aber von Evidenzklasse IIa auf Evidenzklasse I erhöht, innerhalb der Gruppe mit hohem Risiko für eine IE wurde ausserdem speziell eine früher durchgemachte IE stärker gewichtet (neu Evidenzklasse Ib für eine Antibiotikaprophylaxe bei diesen Patienten [zuvor Evidenzklasse II]). Die Gruppe mit Klappenprothesen (= hohes IE-Risiko) umfasst nun auch Patienten, bei denen für eine Klappenrekonstruktion Fremdmaterial eingesetzt wurde. Ebenso zählen Patienten dazu, bei denen mithilfe eines kathetergestützten Verfahrens eine Aorten- (TAVI) oder Pulmonalklappe implantiert wurde. Neu ist die Empfehlung zur Antibiotikaprophylaxe überdies bei Patienten mit Herzunterstützungssystemen (ventricular assist devices «VAD»). Erwogen werden kann eine Prophylaxe bei Patienten mit minimal-invasivem Eingriff an der Mitral- (MitraClip) oder Trikuspidalklappe (TriClip) (Evidenzklasse IIa), für Patienten nach Herztransplantation ist die Evidenzlage unklar und eine Prophylaxe sollte mit den behandelnden Ärzten individuell diskutiert werden. Für Patienten mit mittlerem (z. B. rheumatische Herzerkrankung, nicht-rheumatische degenerative Herzklappenerkrankungen, angeborene bikuspide Aortenklappe, intrakardiale Devices wie Pacemaker etc.) oder tiefem Risiko ist die Evidenzlage unklar und eine Antibiotikaprophylaxe wird nicht empfohlen.
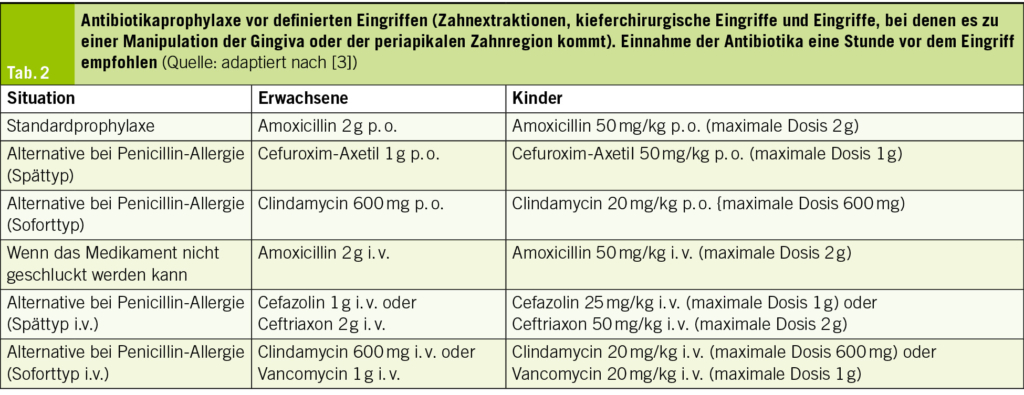
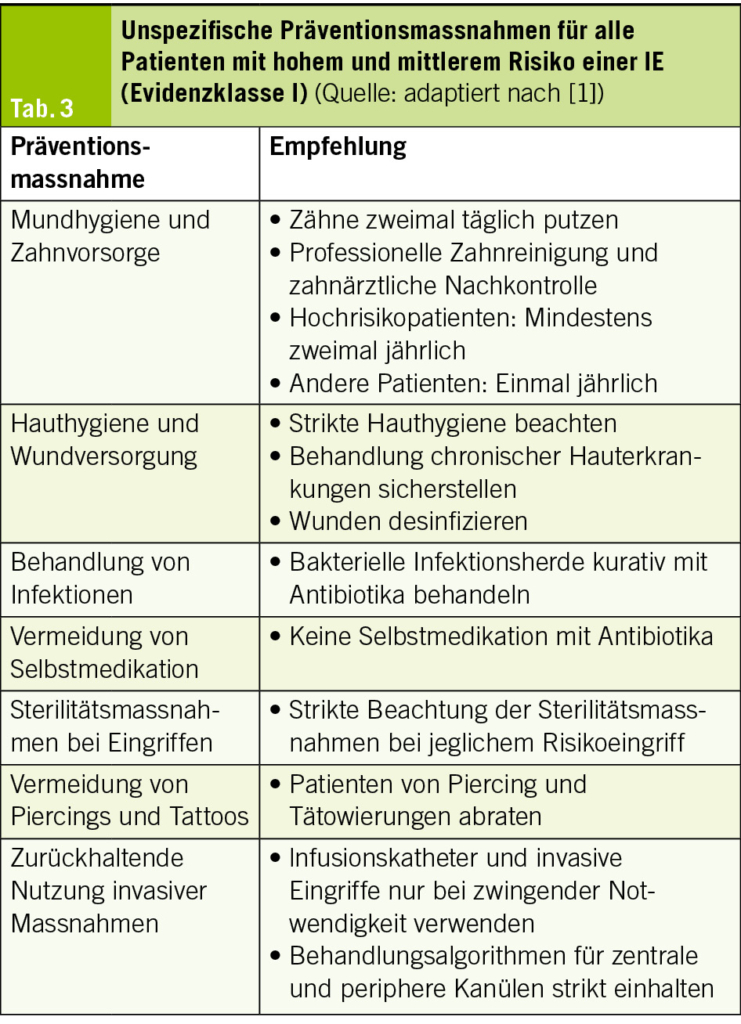
Die Gabe der Antibiotikaprophylaxe bei Patienten mit hohem Risiko wird in folgenden Situationen empfohlen: bei zahnmedizinischen Interventionen mit Blutungsfolge (Zahnextraktionen, kieferchirurgische Eingriffe, Eingriffen mit Manipulation an der Gingiva oder der periapikalen Zahnregion). Neu in den Guidelines ist auch die Empfehlung, dass eine Antibiotikaprophylaxe bei Patienten mit hohem Risiko auch im Rahmen invasiver diagnostischer oder therapeutischer Eingriffe am Respirationstrakt, Gastrointestinaltrakt, Urogenitaltrakt sowie an Haut, Weichteilen und muskuloskelettalem System erwogen werden kann (Evidenzklasse IIb), hiervon wurde in den vorhergehenden Leitlinien aus dem Jahr 2015 noch explizit abgeraten. Diese optionale Erweiterung der Indikation für eine Prophylaxe sei hier nur der Vollständigkeit halber erwähnt und es bleibt abzuwarten, wie sich die Schweizerische Expertengruppe «Infective Endocarditis Prevention» hierzu äussern wird (3). Allen Patienten mit hohem Risiko sollte ein Endokarditis-Ausweis (4) abgegeben werden. Das empfohlene prophylaktische Antibiotikaregime ist in Tab. 2 aufgelistet. Unspezifische Präventionsmassnahmen werden für alle Patienten mit mittlerem und hohem Risiko einer IE empfohlen (Evidenzklasse I), dazu gehören allgemeine Massnahmen, die in Tab. 3 zusammengefasst sind.
Neu ist weiter die Empfehlung, dass als präoperative antibiotische Prophylaxe vor kathetergestützter Implantation einer Klappe (z.B. TAVI) nicht wie sonst standardmässig Cefuroxim, sondern ein S. aureus- und Enterokokken-wirksames Antibiotikum verabreicht werden soll, nämlich Amoxicillin/Clavulansäure (Evidenzklasse IIa).
Patienten, die eine IE durch Streptococcus gallolyticus oder Enterokokken durchgemacht haben, sollen nach Abschluss der IE-Therapie im zeitnahen Intervall einer diagnostischen Koloskopie zugeführt werden, aufgrund einer Assoziation mit kolorektalen Neoplasien.
Diagnostik
Die IE bleibt aufgrund der vielfältigen klinischen Manifestation eine diagnostische Herausforderung. Je nach Prädilektion, Erreger und Komorbiditäten ist die klinische Präsentation unterschiedlich. Ein klinischer Verdacht sollte bei allen Patienten in Betracht gezogen werden, welche neu Fieber oder eine Sepsis mit unklarem Fokus haben. Fieber (77 %), neues Herzgeräusch (64 %), Herzinsuffizienz (27 %), septisch-embolische Komplikationen (25 %) und Rhythmusstörungen (11 %) sind die häufigsten Symptome vor Diagnosestellung einer IE (6). Klassische lehrbuchmässige Stigmata wie Janeway Läsionen, Osler Knoten, Roth Spots und Splinter Hämorrhagien sehen wir heutzutage selten. Dies hängt wahrscheinlich mit einem Shift von den früher häufiger (und eher protrahiert diagnostizierten) «Endocarditis lenta» Erregern (klassischerweise vergrünende Streptokokken) zu heute häufiger virulenteren Keimen (wie z. B. S. aureus u.a.) zusammen. Wichtig ist, dass man, gerade am Anfang der Versorgungskette in der Hausarztpraxis, an die Differentialdiagnose IE denkt, mehrere (idealerweise 3 x 2) Blutkulturen abnimmt und bei stabilem Allgemeinzustand des Patienten mit Antibiotika nach Möglichkeit noch zuwartet, um die entscheidende Erregerdiagnostik und Resistenzprüfung nicht zu verzögern.
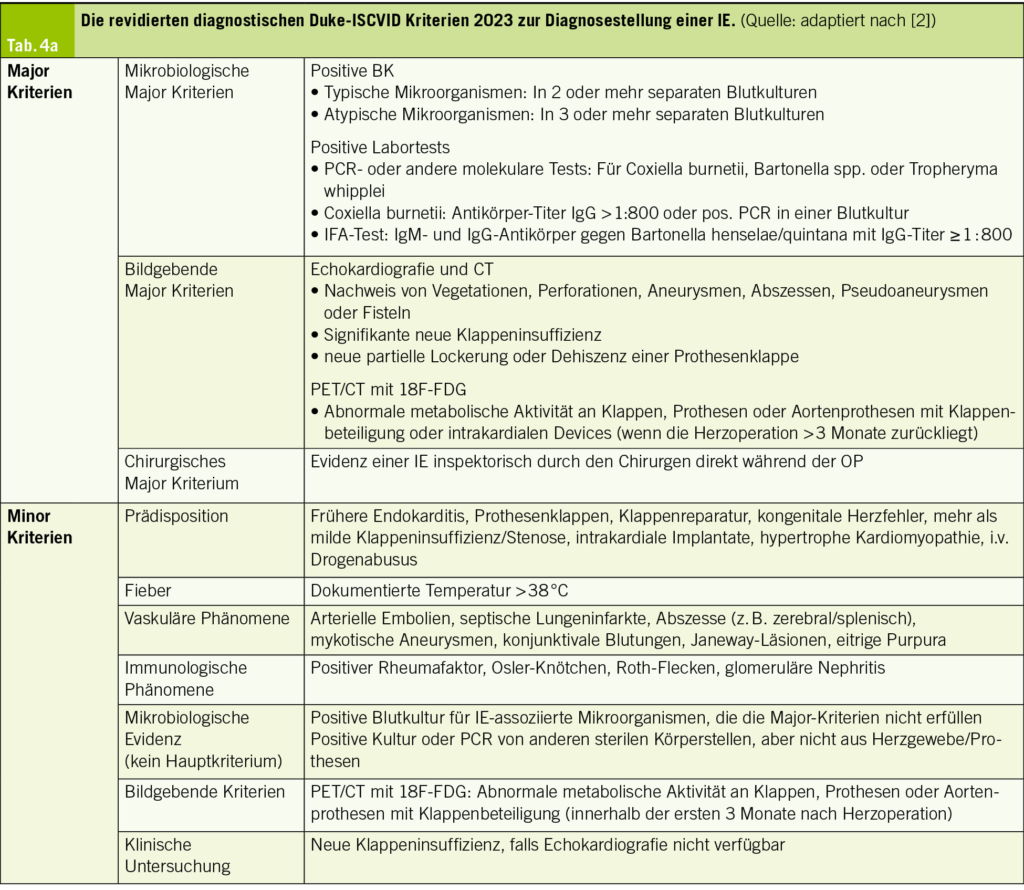
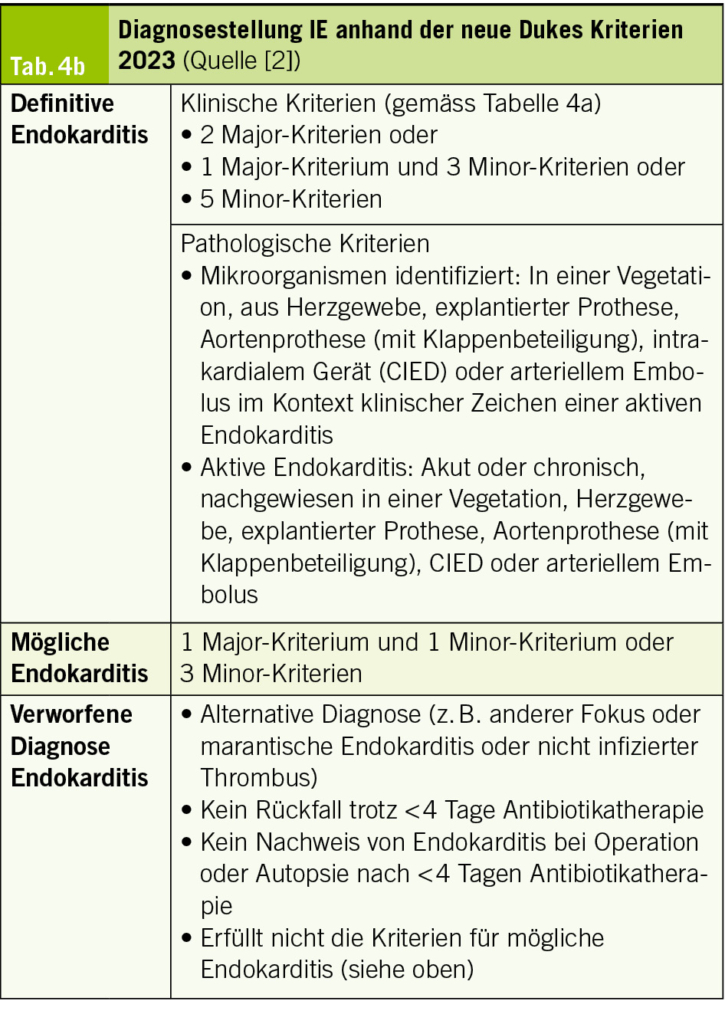
Die diagnostischen Dukes Kriterien zur IE wurden 2023 überarbeitet (Tab. 4). Die Echokardiographie bleibt weiterhin die zentrale Bildgebungsmodalität in der Diagnostik einer IE. Nachdem in den früheren Leitlinien CT und PET/CT als wertvolle diagnostische Ergänzungen erwähnt wurden, wird in den aktuellen Leitlinien die Bedeutung dieser Verfahren weiter hervorgehoben. Die CT hat neu eine Evidenzklasse IB zur ergänzenden Diagnostik bei Patienten mit vermuteter IE von Nativklappen. Ebenso haben PET/CT und CT bei vermuteter Prothesenklappen-IE eine IB-Empfehlung erhalten, wenn eine valvuläre Läsion detektiert und die Diagnose einer IE bestätigt
werden soll. Bei der Diagnosestellung einer Prothesenklappen-IE lässt sich die Sensitivität durch das PET/CT deutlich erhöhen (Sensitivität PET/CT für Prothesenklappenendokarditis 73–100 %, Spezifität 71–100 %) (5) Unabhängig davon, ob es sich um eine Nativ- oder Prothesenklappen-IE handelt, ist die CT gut geeignet zur Diagnose von paravalvulären oder periprothetischen Komplikationen, wenn die Ergebnisse der Echokardiographie uneindeutig sind.
Bei symptomatischen Patienten mit Nativ- oder Prothesenklappen-IE wird eine Bildgebung des Gehirns und des gesamten Körpers (CT, MRT, ev. PET/CT) empfohlen, um zerebrale oder periphere septische-embolische Läsionen zu erkennen oder diagnostische Nebenkriterien zu bestimmen (Evidenzklasse IB).
Mikrobiologisch wurde das Spektrum der IE typischen Erreger sowie auch die Technik des Erregernachweises erweitert. Neu werden bei allen Formen der IE auch Enterococcus faecalis und Staphylococcus lugdunensis, bei Prothesenklappen zusätzlich neben den Koagulase-negativen Staphylokokken auch Corynebakterien (Corynebacterium striatum, Corynebacterium jeikeium), Serratia marcescens, Pseudomonas aeruginosa, Cutibacterium acnes oder avidum, Candida sowie Mycobacterium chimaera zu den typischen IE-Erregern gezählt. Bei der Technik des Erregernachweises zählen neben der konventionellen Kultur neu auch molekulare Techniken (PCR, in-situ Hybridisierung, Next Generation Sequencing) als diagnostische Kriterien für eine IE. Ausserdem wurde als neues und drittes Major-Kriterium neben den beiden bisherigen zwei Major-Kriterien (Mikrobiologie und Bildgebung) ein chirurgisches Kriterium etabliert: Dieses ist erfüllt, wenn durch den Chirurgen direkt intraoperativ die Diagnose IE gestellt wird.
Es muss darauf hingewiesen werden, dass gewisse Unterschiede in der Formulierung und Gewichtung einzelner Kriterien bestehen, wenn man die europäischen (ESC) mit den internationalen (ISCVID) Guidelines vergleicht. Für beide Guidelines gilt, dass mit den neuen Kriterien die Sensitivität, eine definitive Diagnose einer IE zu stellen, steigt (Sensitivität für Prothesenklappen IE mit den ESC Dukes Kriterien von 2015: 65–97 %, Sensitivität mit den revidierten Duke-ISCVID Kriterien 2023: 78–97 %), diese Steigerung der Sensitivität geht aber einher mit einer gewissen Einbusse der Spezifität (5).
Tab. 4a und 4b zeigen die revidierten diagnostischen Duke-ISCVID Kriterien 2023 zur Diagnosestellung einer IE.
Therapie
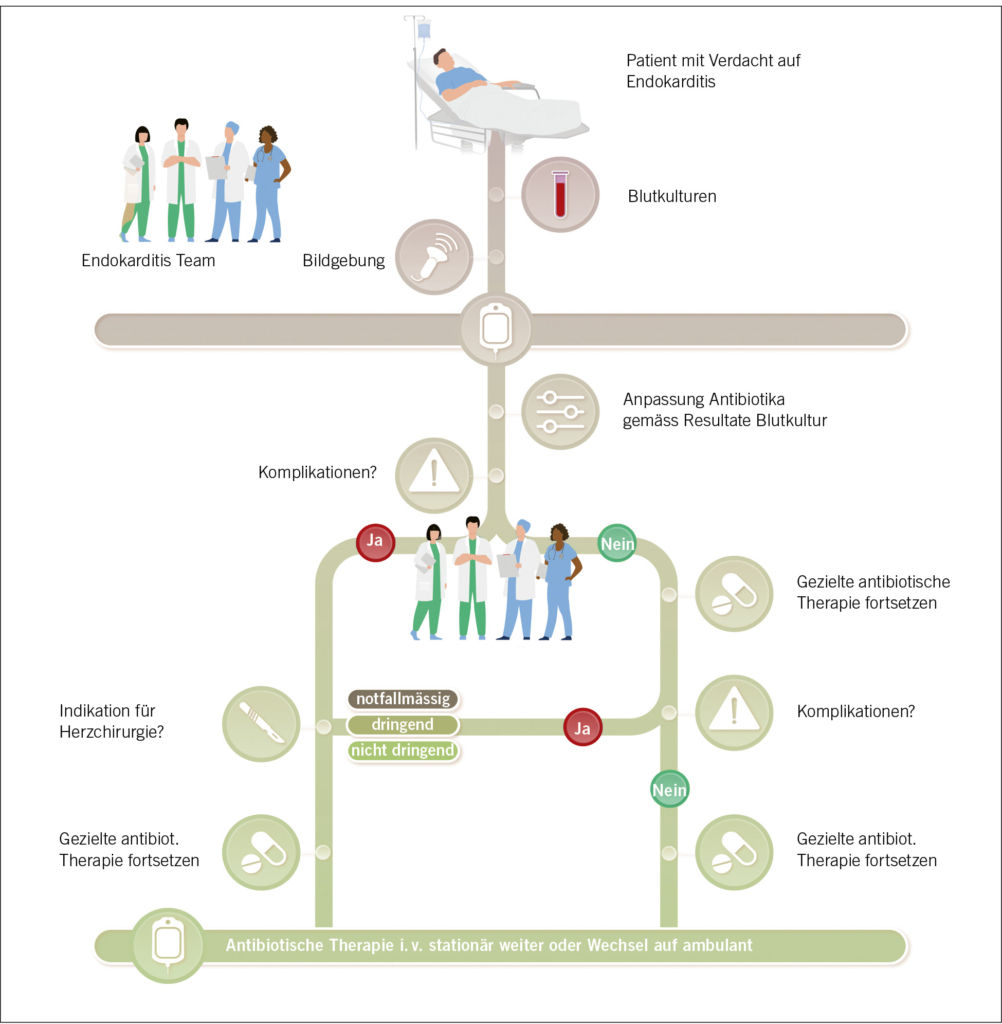
Heutzutage ist durch Daten belegt, dass ein interdiziplinärer Approach bei der Diagnostik und Therapie der IE das Outcome inklusive Mortalität verbessert. Man spricht auch vom «Endokarditis Team» und dieses setzt sich idealerweise zusammen aus Experten der Infektiologie/Mikrobiologie, Kardiologie, Herzchirurgie, ggf. Nuklearmedizin und Intensivmedizin (7) (Abb. 1).
Bei der Behandlung der IE ist die komplette Eradikation der Erreger das Ziel. Meist können Bakterien in den Biofilmen auf Klappe oder Fremdmaterial aufgrund der Erregerdichte in den Vegetationen ihre metabolische Aktivität drosseln und somit die Empfindlichkeit auf Antibiotika reduzieren. Dies erklärt die in der Regel notwendige lange Dauer der antibiotischen Therapie (meist 4–6 Wochen, in ausgewählten spezifischen Fällen ggf. verkürzbar auf 2 Wochen). Als empirische Therapie (bevor der Erreger und die Empfindlichkeit bestimmt sind) gilt nach wie vor Amoxicillin/Clavulansäure i.v. hochdosiert (+/– in Kombination mit einem Aminoglykosid) als Therapie der Wahl. Sobald Erreger und Empfindlichkeit bekannt sind, wird auf eine gezielte Antibiotikatherapie i.v. gewechselt. Auf die verschiedenen Antibiotikaregime bei den entsprechenden Erregern geht dieser Artikel im Detail nicht ein. Zur Konsultation empfehlen wir lokale Therapieempfehlungen wie z.B. das Vademecum Infektiologie des Stadtspitals Zürich (verfügbar online unter www.vademecum-
infektiologie.ch/ (9) oder als App im IOS oder Android Store gratis zum Download).
Eine wesentliche Neuerung der 2023 überarbeiteten Leitlinien ist die Möglichkeit einer ambulanten Fortführung der antibiotischen Therapie. In der Anfangsphase der Behandlung einer IE wird eine standardmässige i.v.-Behandlung über mindestens 7–10 Tage durchgeführt. Im Anschluss kann eine ambulante parenterale Antibiotikabehandlung oder auch eine abgestufte ambulante orale Antibiotikabehandlung zur Konsolidierung der antimikrobiellen Therapie erfolgen, vorausgesetzt, der Patient ist klinisch stabil und es liegen keine kritischen infektionsbedingten Komplikationen vor (8). Die ambulante Antibiotikatherapie wird in der Praxis aufgrund des klinischen Zustandes oder weiterer limitierender Komorbiditäten jedoch nur für wenige Patienten in Frage kommen.
Operative Versorgung
Etwa die Hälfte der Patienten mit einer IE benötigt eine Operation (10). Es gibt drei Hauptgründe, eine Operation durchzuführen: 1. progressive Herzinsuffizienz, 2. unkontrollierte Infektion und 3. Verhinderung septischer Embolien. Die Eingriffe werden in notfallmässig (innerhalb von 24 Stunden), dringlich (innerhalb von 3 bis 5 Tagen) und nicht dringlich (i.d.R. nach 1–2 Wochen antibiotische Therapie) unterteilt. Aorten- oder Mitralklappen-IE mit schwerer akuter Klappeninsuffizienz oder -stenose mit refraktärem Lungenödem oder kardiogenem Schock ist unverändert die Indikation zur notfallmässigen Operation. Die IB-Empfehlung für eine dringliche Operation bei lokal unkontrollierter Infektion wurde neben dem Vorliegen eines Abszesses, eines Pseudoaneurysmas, einer Fistel und einer grösser werdenden Vegetation neu um das Vorliegen einer Prothesendehiszenz sowie das Auftreten eines neuen atrioventrikulären Blocks erweitert. Eine dringliche Operation ist in Abhängigkeit vom klinischen Zustand des Patienten empfohlen, wenn die IE durch eine Pilzinfektion oder multiresistente Keime verursacht ist. Ebenso erwogen werden sollte eine dringliche Operation bei Patienten mit persistierend positiver Blutkultur nach 7 Tagen antimikrobieller Therapie, bei einer Prothesenendokarditis verursacht durch S. aureus oder ein gramnegatives Bakterium ausserhalb der HACEK-Gruppe (HACEK steht für Haemophilus, Aggregatibacter, Cardiobacterium, Eikenella und Kingella). Die Prävention septischer Embolien ist das dritte Hauptkriterium zur Operationsindikation. Eine dringliche Operation ist hier empfohlen bei Patienten mit Nativklappen IE der Aorten- oder Mitralklappe sowie bei Prothesenklappen IE mit grossen Vegetationen (≥ 10 mm) nach einem oder mehreren embolischen Ereignissen trotz adäquater Antibiotikatherapie. Aufgewertet zu einer IC-Empfehlung wurde, eine Herzoperation dringlich durchzuführen bei Aorten- oder Mitralklappen IE mit grossen Vegetationen (≥ 10 mm), wenn eine weitere Indikation zu einer Operation besteht. Neu ist die Empfehlung, dass eine dringliche Operation bei Aorten- oder Mitralklappen IE mit einer Vegetation ≥ 10 mm erwogen werden soll, wenn keine hochgradige Klappenstörung oder kein klinischer Nachweis von Embolien vorliegt und ein niedriges Operationsrisiko besteht (Evidenzklasse IIB). Neu ist auch die Empfehlung, Prothesenklappen IE, welche in den ersten 6 Monaten nach Implantation auftreten, grundsätzlich herzchirurgisch zu sanieren (Evidenzklasse IC).
Bei Patienten mit intrakranieller Blutung nach ischämischem Schlaganfall und IE sollte die herzchirurgische Behandlung der IE in der Regel zurückgestellt werden, es sei denn, es besteht eine hämodynamische Instabilität. In diesen Fällen muss im Endokarditis-Team unter Beizug der Kollegen der Neurologie interdisziplinär Nutzen und Risiko einer allfällig vorgezogenen Operation sorgfältig abgewogen werden.
Danksagung
Herrn Dr. Adrian Schibli danke ich herzlich für die kritische Durchsicht des Manuskripts und wertvolle Kommentare
Leitender Arzt Infektiologie
Leitung Med. Mikrobiologie
Stadtspital Zürich Triemli
Birmensdorferstrasse 497
8063 Zürich
Der Autor hat keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
- IE bleibt eine häufige Erkrankung mit hoher Morbidität und Mortalität
- Antibiotikaprophylaxe für Patienten mit hohem Risiko für IE ist vor zahnärztlichen Risikoeingriffen unbedingt empfohlen
- Bei klinischem Verdacht auf IE sollen 3×2 Blutkulturen
abgenommen werden, bevor mit einer Antibiotikatherapie begonnen wird. - Die Echokardiographie bleibt Bildgebung der ersten Wahl; neuere bildgebende Methoden wir CT und PET/CT gewinnen aber an Bedeutung
- Die Planung und Durchführung der IE Therapie erfolgt idealerweise im Endokarditis Team, zusätzlich zur Erreger- und resistenzgerechten antibiotischen Therapie empfiehlt sich eine frühe Rücksprache mit der Herzchirurgie
1. 2023 ESC Guidelines for the Management of endocarditis, European Heart Journal 2023 00, 1-95
2. The 2023 Duke-International Society for Cardiovascular Infectious Diseases Criteria for Infective Endocarditis, Fowler V et al, Clinical Infectious Diseases 2023;77(4):518-26
3. (3) Empfehlungen der Expertengruppe “Infective Endocarditis Prevention”, Swiss Medical Forum 2021;21(5-6):84-89
4. (4) Endokarditis Ausweis -> zu beziehen bei Schweizerische Herzstiftung: https://swissheart.ch/
5. Cuervo G et al, The clinial challenge of prosthetic valve endocarditis, Journal of the American College of Cardiology Vol 83, No 15, 2024:1418-1430
6. Habib G et al, Clinical presentation, aetiology and outcome of infective endocarditis. ESC-EORP EURO-ENDO registry; European Heart Journal 2019;40:3222-3232
7. Dayer M et al, recent insights into native valve infective endocarditis, Journal of the American College of Cardiology Vol 83, No 15, 2024:1431-1443
8. Iversen K et al, Partial Oral versus Intravenous Antibiotic Treatment of Endocarditis (POET trial), New England Journal of Medicine, 2019;380:415-424
9. Vademecum Infektiologie: www.vademecum-infektiologie.ch
10. Tornos P, Infective endocarditis in Europe: lessons from the Euro heart survey, Heart 2005 May;91(5):571-5.
der informierte @rzt
- Vol. 14
- Ausgabe 11
- November 2024