- Invasiver Brustkrebs bei Frauen im Alter von ≥ 80 Jahren
Brustkrebs ist die häufigste Krebserkrankung bei Frauen und nimmt mit zunehmendem Alter deutlich zu. Die Entwicklung der onkologischen Behandlungen hat zu einem Rückgang der Brustkrebssterblichkeit geführt. Dennoch ist die Betreuung der Patientinnen ≥80 Jahren wenig kodifiziert und beinhaltet keine klare Definition der Behandlungsziele sowie der potenziellen Auswirkungen auf die Funktionalität und Lebensqualität. Die auf den verfügbaren Daten basierenden Therapieempfehlungen sollten die Lebenserwartung der Patientin, ihre Ziele und die geriatrische Beurteilung einbeziehen. Dieser Artikel fasst die aktuelle Literatur und die Anpassungen zusammen, die bei Patientinnen ≥80 Jahre mit frühem oder metastasierendem Brustkrebs möglich sind.
Breast cancer is the most common cancer in women and increases considerably with age. Developments in oncological treatments have led to a reduction in breast cancer mortality. However, for patients ≥80 years, there are few treatment guidelines, that is why it is important to clearly define the objectives of the treatment as well as its potential effects on functionality and quality of life. Treatment recommendations based on available data must take into account the patient’s life expectancy, goals and geriatric assessment. This article summarizes the current literature and possible adaptations in patients ≥80 years with early or metastatic breast cancer.
Key words: oncogeriatrics, elderly patients and breast cancer, localised breast cancer, metastatic breast cancer
Das Medianalter bei der Diagnose von Brustkrebs liegt in der Schweiz bei 64 Jahren; 36 % der Patientinnen sind 70 Jahre und älter, 15 % 80 Jahre und älter. Die spezifische 5-Jahres-Überlebensrate steigt seit Jahren an und liegt bei 88 % (1) für alle Stadien. Im Jahr 2022 betrug die Lebenserwartung einer 80-jährigen Frau 10.4 Jahre (2). Diese sehr alten Patientinnen sind in den Studien nicht vertreten, die, von Ausnahmen abgesehen, Folgendes umfassen: Patientinnen in gutem Allgemeinzustand, ohne Organdysfunktion mit einen Leistungsstatus nach WHO 0 oder 1, d. h. normale Aktivität oder eingeschränkt für wichtige körperliche Aktivitäten, aber Patientin ambulant und in der Lage, leichte Arbeit zu verrichten. Es besteht also eine gewisse Unsicherheit über die Wirksamkeit und Toxizität von onkologischen Behandlungen bei dieser Bevölkerungsgruppe, die zudem eine hohe Prävalenz von Komorbiditäten und Polymedikation aufweist. Die Internationale Gesellschaft für geriatrische Onkologie (SIOG) hat Empfehlungen für die ältere Bevölkerung herausgegeben (3).
Geriatrisches Assessment
Die gute Praxis empfiehlt ein geriatrisches Assessment für alle älteren Krebspatienten ≥70 Jahre (3). In der Routine können anhand des G8-Screening-Scores Patientinnen identifiziert werden, die ein umfassenderes geriatrisches Assessment benötigen (4). Mehrere randomisierte Studien haben gezeigt, dass eine Anpassung der Behandlung die Toxizität von Behandlungen reduziert, die Anzahl der Behandlungen verringert und die Krankenhausaufenthalte und die Lebensqualität verbessert werden, während gleichzeitig das Überleben präserviert wird (5, 6). Eine Bewertung der Lebenserwartung mithilfe von Tools, in evidenzbasierten und in ePrognosis aufgelisteten Verfahren sollte durchgeführt werden.
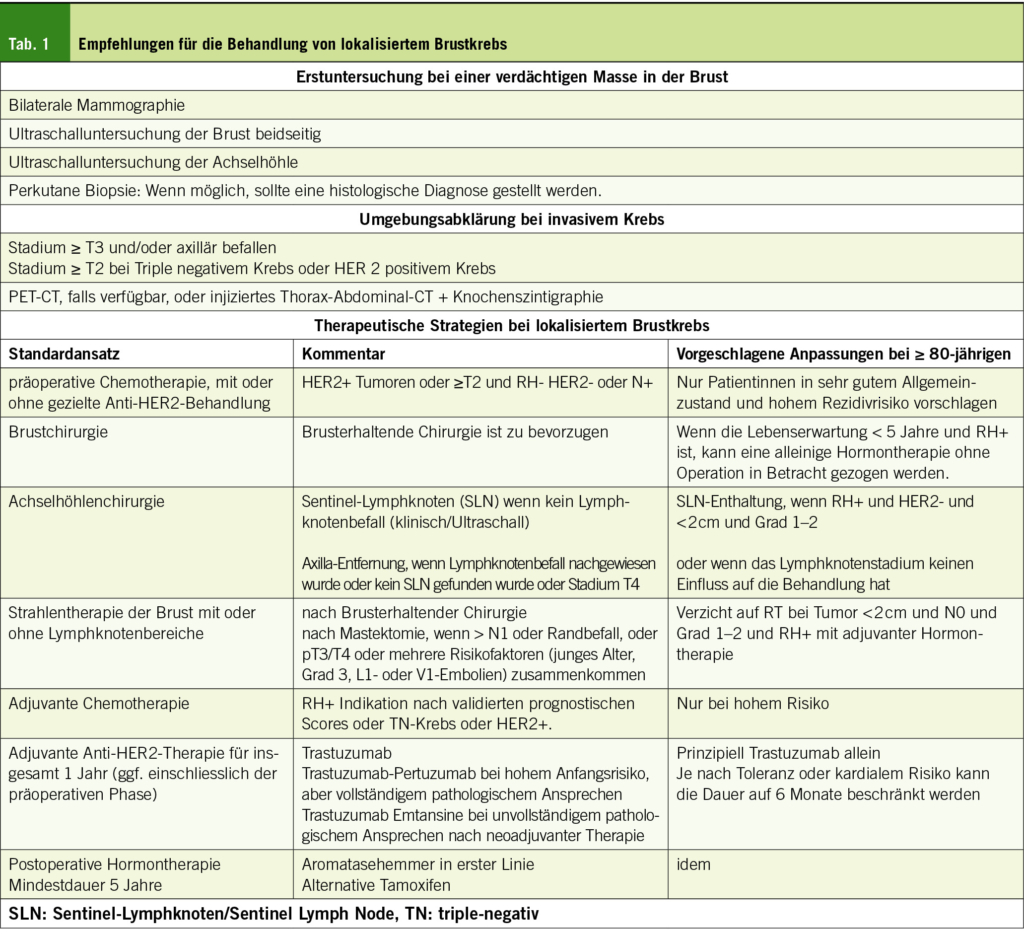
Lokalisierter Brustkrebs
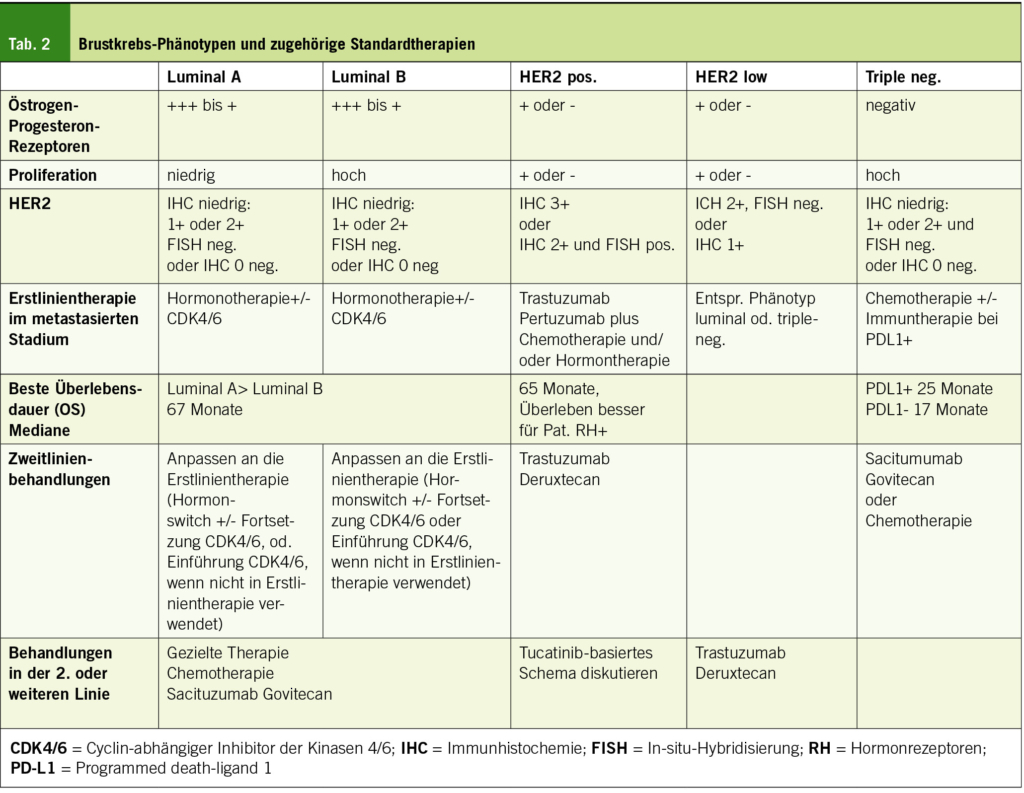
Wenn die Lebenserwartung <10 Jahre beträgt, ist das Mammographie-Screening sinnlos, da eine Reduzierung der Brustkrebssterblichkeit unwahrscheinlich ist (7). Die Standardbehandlung ist in der Tabelle 1 zusammengefasst. Die Wahl der Therapie hängt in erster Linie von der TNM-Klassifikation und dem histologischen Phänotyp ab (Tabelle 2). Etwa 90 % der Patientinnen im Alter von ≥80 Jahren weisen RH+ HER2– Tumoren auf (8).
Chirurgische Behandlung der Brust
Angesichts des fehlenden Unterschieds beim Gesamtüberleben (OS) im Vergleich zur Mastektomie, ist die brusterhaltende Chirurgie (engl. Breast Conserving Surgery = BCS) mit Strahlentherapie der Goldstandard geworden (9). Eine Hormontherapie ohne Operation sollte die Ausnahme bleiben, da sie eine schlechtere lokale Kontrolle beinhaltet, die manchmal einen chirurgischen Eingriff erforderlich macht (10), sowie die Tatsache, dass in einer neueren Studie ein schlechteres OS nach 5 Jahren bei Frauen im Alter von 80 Jahren und älter mit RH+ Krebs festgestellt wurde (11).
Axilläre chirurgische Behandlung
Die Phase-III-Studie NSABP-32, fand keinen Unterschied im Überleben oder der lokoregionären Kontrolle bei Patientinnen mit RH+ Brustkrebs ohne klinischen Befall der Axilla, die mit der Technik des Lymphknotenschnitts des Sentinel-Lymphknotens (engl. Sentinel Lymph Node = SLN) versus die axilläre Ausräumung behandelt wurden, was SLN zur Referenz für diese Patientinnen macht (12). Diese Praxis verringert die Komplikationen der klassischen Dissektion (Schmerzen, Taubheitsgefühl, Schwellung, etc. und eine Einschränkung der Armbewegung). Seit 2016 wird in einigen Leitlinien empfohlen, von einer routinemässigen Anwendung der SLN-Biopsie bei Frauen im Alter von ≥70 Jahren mit RH+, HER2– Krebs, < 2 cm, vom Grad 1 oder 2 abzusehen (13). Vor kurzem hat die SOUND-Studie (N=1405, 36 % > 65 Jahre) keinen Unterschied beim krankheitsfreien Überleben von Frauen ohne Fernerkrankungen mit < 2 cm, RH+, HER– Brustkrebs gezeigt (14).
Postoperative Strahlentherapie
Die postoperative Strahlentherapie (RT) reduziert das lokoregionale Rezidiv und senkt bei N+ Patientinnen die Mortalität durch Brustkrebs (15). Die Indikation bei älteren Patientinnen sollte nach einer Risikostratifizierung beurteilt werden (16). Zwei randomisierte Studien, haben gezeigt, dass die RT nach BCS das Gesamt- oder brustkrebsspezifische Überleben bei Patientinnen im Alter von ≥70 Jahren mit RH+ Brustkrebs, die eine Hormontherapie mit Tamoxifen (Tam) erhielten, nicht verbessert (17, 18). In diesen beiden Studien war die Rate des lokoregionalen Rezidivs ohne Strahlentherapie höher (10 % Tam vs. 2 % Tam+RT nach 10 Jahren (17) und 4.1 % Tam vs. 1.3 % Tam+RT nach 5 Jahren (18)). Allerdings zeigte die prospektive Kohortenstudie LUMINA (Alter Median 67.1 Jahre), dass Lokalrezidive nach 5 Jahren gering waren (2.3 %), obwohl bei postmenopausalen Frauen (8 % ≥75 und 3 % ≥80) mit Niedrigrisikokrebs (Luminal A, Grad 1 oder 2, T1N0), die mit BCS und Hormontherapie behandelt wurden, keine RT durchgeführt wurde (19). Die Strahlentherapie der gesamten Brust wird daher immer noch empfohlen nach BCS, aber bei Krebs mit niedrigem Risiko ist es bei Patientinnen mit begrenzter Lebenserwartung sinnvoll, auf eine Bestrahlung zu verzichten.
Neoadjuvante/adjuvante Chemotherapie
Präoperativ waren nur 6.3 % der 8949 eingeschlossenen Patientinnen in 8 randomisierten Studien 65 Jahre oder älter und keine über 80 Jahre alt (20). Die Erfahrung eines Referenzzentrums zeigt, dass höhere Toxizitäten zur Reduktion oder zum vorzeitigen Abbruch der Behandlung bei 78 % versus 57 % (p < 0.001) der 74 Patientinnen im Alter von 71 bis 76 Jahren führten (21). Die Indikation für eine solche Behandlung sollte nur bei hoch selektierten Patientinnen in Betracht gezogen werden, bei erhöhtem Rezidivrisiko, auf der Grundlage von Scores (22) oder bei RH-Karzinomen, bei denen die meisten Rückfälle innerhalb von 5 Jahren auftreten. Wie bei der neoadjuvanten Chemotherapie sind die Standardschemata, die in dieser Altersgruppe vorgeschlagen werden können, die folgenden: 4 Zyklen Docetaxel und Cyclophosphamid (TC), 4 Zyklen Doxorubicin – Cyclophosphamid, oder 6 Zyklen Cyclophosphamid, Methotrexat und Fluorouracil (CMF). Insbesondere wöchentliches Paclitaxel kann mit der Anti-HER2-Therapie kombiniert werden und auch bei schwächeren Patientinnen eingesetzt werden (22).
Anti- HER2-Behandlungen
Bei HER2+-Krebs sollte eine Anti-HER2-Therapie mit Trastuzumab unabhängig vom Alter eingeführt werden, obwohl ältere Patientinnen ≥60 Jahre in der HERA-Studie mit 16 % unterrepräsentiert waren (23), und eine erhöhte kardiale Toxizität aufwiesen, was die Notwendigkeit von Behandlungsunterbrechungen in fast 40 % der Fälle (24) bedeutete. Die SIOG empfiehlt eine adjuvante Chemotherapie (Docetaxel oder Paclitaxel wöchentlich) in Kombination mit 1 Jahr Trastuzumab. Angesichts des erhöhten Risikos für Toxizität, insbesondere im Verdauungstrakt, sollte die Kombination mit Pertuzumab nur gesunden Patientinnen vorbehalten sein (22). Eine Behandlung mit kürzerer Behandlungsdauer (6 Monate) kann für schwächere Patientinnen mit einem kardiologischen Risiko in Betracht gezogen werden (25, 26). Die Phase-III-Studie Short-HER zeigt ein vergleichbares krankheitsfreies Überleben und Gesamtüberleben mit 9 Wochen Trastuzumab versus 1 Jahr bei niedrigem Risiko (N0) und intermediärem Risiko (weniger als 4 befallene Lymphknoten) (27). Die Anwendung von Trastuzumab allein, ohne Chemotherapie, kann bei besonders anfälligen Patientinnen ebenfalls in Betracht gezogen werden (28).
Trastuzumab Emtansine (T-DM1) als adjuvante Therapie bei einer Erkrankung mit Resttumor reduziert das Risiko von Rückfällen und Tod nach neoadjuvanter Trastuzumab-basierter Behandlung im Vergleich zu Trastuzumab adjuvant. Toxizitäten wie Neuropathie und Pneumopathie stellen das Nutzen-Risiko-Verhältnis bei älteren Patientinnen in Frage (29).
Hormontherapie
Die Wirksamkeit der endokrinen Therapie ist altersunabhängig und die Wahl der Behandlung hängt vom geschätzten Rezidivrisiko, den Komorbiditäten der Patientin und den erwarteten Nebenwirkungen der endokrinen Therapie, darunter Osteoporose und Muskelschmerzen, der Skelettmuskulatur (Aromatasehemmer (AI)) oder dem Risiko von Thromboembolien und Endometriumkarzinom (Tam) (30) ab. Die IA sind dem Tam in Bezug auf das Risiko eines erneuten Auftretens des Brustkrebses und der Mortalität überlegen und sollten bevorzugt werden. Die Nicht-einhaltung der endokrinen Therapie in jedem Alter ein grosses Problem und scheint bei den 80-Jährigen und Älteren (n=100) mit 52 % gegenüber 24.2 % in der Gesamtbevölkerung (n=1192) zuzunehmen (31). In einer Studie mit 437 Patientinnen im Alter von ≥60 Jahren, weigerten sich die Patientinnen im Alter von ≥80 Jahren (n=79) häufiger, mit der Hormontherapie zu beginnen. (13 Prozent gegenüber 4.5 Prozent, P= 0.01) (32). Dieses Problem sollte angesprochen werden, bevor man sich bei einer lokalisierten Erkrankung gegen eine Operation entscheidet.
Behandlung von metastasierendem Krebs
Die Behandlung jeder Patientin mit metastasierendem Brustkrebs, unabhängig von ihrem Alter, ist nicht kurativ und zielt darauf ab, den Krebs zu kontrollieren und die Lebensqualität zu erhalten. Wir beschränken uns auf die ersten Behandlungslinien (Tabelle 2).
Je höher die RH-Expression, desto wahrscheinlicher ist es, dass der Krebs auf eine Hormonbehandlung anspricht, die dann die erste Wahl darstellt. Wenn eine Bedrohung der Organfunktion eine schnelle Tumorreaktion voraussetzt, kann eine Chemotherapie in Betracht gezogen werden. Die Inhibitoren der Cyclin-abhängigen Kinase 4/6 (CDK4/6) (Ribociclib, Abemaciclib, Palbociclib) in Kombination mit einem IA oder Fulvestrant (Antiöstrogen) verbessern die Ansprechrate und das progressionsfreie Überleben (PFS) (33). Ein besseres Gesamtüberleben wird in der 2. Linie erhalten. In der Erstlinie hat bislang nur Ribociclib plus Letrozol einen Vorteil beim OS auch bei den ≥75-Jährigen nachgewiesen (median 63.9 Monate vs. 51.4 Monate mit Letrozol plus Placebo) (34). Die Wirksamkeit von CDK4/6-Inhibitoren scheint altersunabhängig zu sein (198 Patientinnen ≥75 Jahre, d. h. 10.8 % der eingeschlossenen Population), zum Preis erhöhter Toxizitäten (88.8 % Grad 3–4 bei ≥75 Jahren versus 73.4 % bei <75 Jahren), was Dosisänderungen oder sogar den Abbruch der Behandlung erforderlich machte (33). Zum Zeitpunkt der Progression wird ein Wechsel der endokrinen Therapie (von IA zu Fulvestrant, von Fulvestrant zu IA) vorgeschlagen. Die Fortsetzung der Behandlung mit dem CDK4/6-Inhibitor wird weiterhin diskutiert (35), doch sollte diese begonnen werden, wenn sie nicht bereits vorher eingeführt wurde, in Anbetracht des erwarteten Nutzens für das OS (36). Bei Resistenz gegen eine Hormontherapie, können andere Therapien diskutiert werden (Chemo, zielgerichtete Therapien (37)).
HER2+-Krebs
Bei Patientinnen mit HER2+-Krebs wird die Anti-HER2-Therapie mit Trastuzumab in Kombination mit Pertuzumab und wöchentlichem Paclitaxel als Erstlinientherapie empfohlen (38). Für Patientinnen, die nicht für Taxane in Frage kommen oder die ein Schema wünschen, das weniger toxisch ist (wenig oder keine Alopezie oder Komplikationen im Verdauungstrakt, Infektionen und Neuropathie), können Vinorelbin oder Capecitabine Alternativen sein (22, 39, 40). Bei sehr fragilen Patientinnen kann Trastuzumab +/– Pertuzumab allein oder in Kombination mit einer Hormontherapie bei RH+ in Betracht gezogen werden (41, 42). Nach der Erstlinientherapie mit Trastuzumab ist der konjugierte Antikörper Trastuzumab-Deruxtecan (T-dxd) mit einem besseren OS im Vergleich zu T-DM1 (OS nach 24 Monaten 77.4 % vs. 69.9 %) assoziiert (43). Bei Patientinnen im Alter von ≥65 Jahren wurde eine Zunahme der Toxizitäten (Verdauung und Hämatologie) beobachtet, die in 25.4 % der Fälle zum Abbruch der Behandlung führten, verglichen mit 18.7 % bei den jüngeren Patientinnen. Das Risiko einer Lungenerkrankung ist auch höher (17.5 % gegenüber 11.8 %) (44). Die Anwendung dieser Behandlung muss daher bei älteren Patientinnen sehr vorsichtig sein. T-DM1 könnte bei Unverträglichkeit eingesetzt werden (45).
Triple-negative (TN) oder hormonresistente Krebserkrankungen
Eine Chemotherapie kann Patientinnen mit TN-metastasiertem Krebs oder bei RH+ Krebs, der gegen eine endokrine Therapie resistent ist oder deren Krankheit schnell fortschreitet oder die Funktion von Organen bedroht, vorgeschlagen werden. Eine Monochemotherapie ist vorzuziehen, wegen des höheren Risikos von Nebenwirkungen (22). Die Wahl basiert auf dem Nebenwirkungsprofil, Komorbiditäten und den Wünschen der Patientin. Die Hinzufügung eines Checkpoint-Inhibitors (CPI) zur Erstlinien-Chemotherapie verbessert bei PDL1-exprimierenden TN-Tumoren das OS um etwa 7 Monate (medianes Alter 55 Jahre, 23 % ≥65 Jahre (46); (medianes Alter 53 Jahre, 21 % > 65 Jahre (47)). Die Verwendung dieser neuen Therapien müssen bei älteren Patientinnen mit der grössten Vorsicht angewendet werden. Die schlechte Prognose von TN-Tumoren mit dem Einsatz von Chemo allein, wird auch verbessert in der 2. Linie durch den Antikörper Sacituzumab, gegen Trop2 konjugiert mit Govitecan (einem Topoisomerase-Inhibitor), mit einem medianen Überleben von 12.1 versus 6.7 Monaten (medianes Alter 54 Jahre, (29–82) (48)). Diese neuen Therapien sollten bei älteren Patientinnen mit grösster Vorsicht eingesetzt werden.
Schlussfolgerung
Brustkrebspatientinnen im Alter von ≥ 80 Jahren stellen einen wachsenden Anteil der Bevölkerung dar. Die therapeutischen Entscheidungen sollten auf der Lebenserwartung, den Vorteilen der potenziellen Behandlung, den Wünschen der Patientin und den potenziellen Nebenwirkungen der Behandlung beruhen. Eine enge Zusammenarbeit zwischen Onkologen und Geriatern ist von entscheidender Bedeutung, um ein Gleichgewicht zwischen den Zielen der onkologischen Behandlung und der Erhaltung der Lebensqualität der Patienten zu erreichen.
Copyright Aerzteverlag medinfo AG
Abteilung für Onkologie
Spital Wallis – CHVR
Av. Grand-Champsec 86
1951 Sitten
Abteilung für Onkologie
Spital Wallis – CHVR
Av. Grand-Champsec 86
1951 Sitten
Die Autor/-innen haben keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
- Ältere Frauen mit Brustkrebs stellen eine wachsende Population dar.
- Die Sterblichkeit durch Brustkrebs sinkt dank der Weiterentwicklung der onkologischen Behandlungsmethoden.
- Patientinnen ≥80 Jahre sind in klinischen Studien kaum vertreten, was die Entwicklung von Standards in dieser Population schwierig macht.
- Eine Anpassung der Behandlungen ist nach einer geriatrischen Beurteilung erforderlich, unter Berücksichtigung der Lebenserwartung, der Komorbiditäten und den Wünschen der Patientinnen.
1. https://www.bfs.admin.ch/bfs/fr/home/statistiques/sante/etatsante/maladies/cancer/specifiques.hml. Consulte le 12.11.2023
2. https://www.bfs.admin.ch/bfs/fr/home/statistiques/population/naissances-deces/esperance-vie.html. Consulte le 12.11.2023
3. Dale W, Klepin HD, Williams GR, et al. Practical assessment and management of vulnerabilities in older patients receiving systemic cancer therapy: ASCO guideline update. J Clin Oncol 2023; 41:4293-312
4. Soubeyran P, Bellera C, Goyard J, et al. Screening for vulnerability in older cancer patients: the ONCODAGE Prospective Multicenter Cohort Study. PLoS One 2014 Dec 11;9:e115060
5. management on the toxic effects of cancer treatment (GAP70+): a cluster-randomised study. Lancet 2021; 398:1894-1904.
6. Li D, Sun C-L, Kim H, et al. Geriatric assessment–driven intervention (GAIN) on chemotherapy-related toxic effects in older adults with cancer: A randomized clinical trial. JAMA Oncol 2021; 7:e214158
7. Badgwell BD, Giordano SH, Duan ZZ, et al. Mammography before diagnosis among women age 80 years and older with breast cancer. J Clin Oncol 2008; 26:2482–8.
8. Jenkins EO, Deal AM, Anders CK, et al. Age-specific changes in intrinsic breast cancer subtypes: A focus on older women. Oncologist 2014; 19:1076-83
9. Fisher B, Anderson S, Bryant J, et al. Twenty-year follow-up of a randomized trial comparing total mastectomy, lumpectomy, and lumpectomy plus irradiation for the treatment of invasive breast cancer. N Engl J Med. 2002; 347:1233-41.
10. Hind D, Wyld L, Reed MW. Surgery, with or without tamoxifen, vs tamoxifen alone for older women with operable breast cancer: cochrane review. Br J Cancer 2007; 96:1025-9.
11. De Boer AZ, de Glas NA, Marang-van de Mheen PJ, et al. Effect of omission of surgery on survival in patients aged 80years and older with early-stage hormone receptor-positive breast cancer. Br J Surg 2020; 107:1145–53
12. Krag DN, Anderson SJ, Julian TB, et al. Sentinel-lymph-node resection compared with conventional axillary-lymph-node dissection in clinically node-negative patients with breast cancer: overall survival findings from the NSABP B-32 randomised phase 3 trial. Lancet Oncol 2010; 11:927-33
13. Grossi S, Le J, Armani A. Omitting axillary staging in selected patients: Rationale of Choosing Wisely in breast cancer treatment. Surgery 2023; 174:413-5.
14. Gentilini OD, Botteri E, Sangalli C, et al. SOUND Trial Group. Sentinel lymph node biopsy vs no axillary surgery in patients with small breast cancer and negative results on ultrasonography of axillary lymph nodes: The SOUND randomized clinical trial. JAMA Oncol 2023; 9:1557-64.
15. McGale P, Taylor C, Correa C, et al. Effect of radiotherapy after mastectomy and axillary surgery on 10 years recurrence and 20 years breast cancer mortality: metaanalysis of individual patient data for 8135 women in 22 randomised trials. Lancet 2014; 383: 2127-35.
16. Stueber TN, Diessner J, Bartmann C, et al. Effect of adjuvant radiotherapy in elderly patients with breast cancer. PLoS One 2020; 15: e0229518.
17. Hughes Hughes KS, Schnaper LA, Bellon JR, et al. Lumpectomy plus tamoxifen with or without irradiation in women age 70 years or older with early breast cancer: long-term follow-up of CALGB 9343.J Clin Oncol 2013; 31: 2382-7.
18. Kunkler IH, Williams LJ, Jack WJ, et al; PRIME II investigators. Breast-conserving surgery with or without irradiation in women aged 65 years or older with early breast cancer (PRIME II): a randomised controlled trial. Lancet Oncol 2015; 16:266-73.
19. Whelan TJ, Smith S, Parpia S, et al; LUMINA study investigators. Omitting radiotherapy after breast-conserving surgery in luminal A breast cancer. N Engl J Med. 2023; 389:612-9.
20. Von Waldenfels G, Loibl S, Furlanetto J, et al. Outcome after neoadjuvant chemotherapy in elderly breast cancer patients – a pooled analysis of individual patient data from eight prospectively randomized controlled trials. Oncotarget 2018; 9: 15168-79
21. Williams AD, Dang CT, Sevilimedu V, et al. Neoadjuvant chemotherapy for breast cancer in the elderly: Are we accomplishing our treatment goals? Ann Surg Oncol 2022; 29:8002-11.
22. Biganzoli L, Battisti NML, Wildiers H, et al. Updated recommendations regarding the management of older patients with breast cancer: a joint paper from the European Society of Breast Cancer Specialists (EUSOMA) and the International Society of Geriatric Oncology (SIOG). Lancet Oncol 2021; 22:e327-e340.
23. Meron D, Piccart-Gebhart MJ, Gelber RD, et al. 11 years’ followup of trastuzumab after adjuvant chemotherapy in HER2-positive early breast cancer: final analysis of the HERceptin Adjuvant (HERA) trial. Lancet 2017; 389: 1195–205
24. Reeder-Hayes KE, Meyer AM, Hinton SP, et al. Comparative toxicity and effectiveness of trastuzumab-based chemotherapy regimens in older women with earlystage breast cancer. J Clin Oncol 2017; 35: 3298–305
25. Pivot X, Romieu G, Debled M, et al. 6 months versus 12 months of adjuvant trastuzumab for patients with HER2-positive early breast cancer (PHARE): a randomized phase 3 trial. Lancet Oncol 2013; 14:741-8.
26. Earl HM, Hiller L, Vallier AL, et al. 6 versus 12 months of adjuvant trastuzumab for HER2-positive early breast cancer (PERSEPHONE): 4-year disease-free survival results of a randomised phase 3 non-inferiority trial. Lancet 2019; 393:2599-2612.
27. Conte P, Bisagni G, Piacentini F, et al. Nine-week versus one-year trastuzumab for early human epidermal growth factor receptor 2-positive breast cancer: 10-year update of the ShortHER phase III randomized trial. J Clin Oncol. 2023; 41:4976-81.
28. Sawaki M, Taira N, Uemura Y, et al. Randomized controlled trial of trastuzumab with or without chemotherapy for HER2-positive early breast cancer in older patients. J Clin Oncol 2020; 38:3743–52.
29. Loibl S, Mano M, Untch M, et al. Phase III study of adjuvant ado-trastuzumab emtansine vs trastuzumab for residual invasive HER2-positive early breast cancer after neoadjuvant chemotherapy and HER2-targeted therapy: KATHERINE final IDFS and updated OS analysis. Presented at: 2023 San Antonio Breast Cancer Symposium; December 5-9, 2023; San Antonio, TX. Abstract GS03-12
30. Crystal JS, Rand J, Johnson J, et al. Adjuvant endocrine therapy is associated with improved overall survival in elderly hormone receptor-positive breast cancer patients. Breast Cancer Res Treat 2020;184:63–74.
31. Dragvoll I, Bofin AM, Soiland H, et al. Predictors of adherence and the role of primary non-adherence in antihormonal treatment of breast cancer. BMC Cancer 2022; 22:1247.
32. Guth U, Myrick ME, Kandler C, et al. The use of adjuvant endocrine breast cancer therapy in the oldest old. Breast 2013; 22:863-68.
33. Howie LJ, Singh H, Bloomquist E, et al. Outcomes of older women with hormone receptor-positive, human epidermal growth factor receptor-negative metastatic breast cancer treated with a CDK4/6 inhibitor and an aromatase inhibitor: an FDA pooled analysis. J Clin Oncol 2019; 37:3475-83.
34. Hart L, Im S, Tolaney SM, et al. Efficacy, safety, and quality of life with ribociclib + endocrine therapy in elderly patients with HR+/HER2– advanced breast cancer across the MONALEESA-2, -3, and -7 trials. Presented at the 2023 San Antonio Breast Cancer Symposium; December 5-9, 2023; San Antonio, TX; abstract PS02-01.
35. Kalinsky K, Accordino MK, Chiuzan C, et al. Randomized phase II trial of endocrine therapy with or without ribociclib after progression on cyclin-dependent kinase 4/6 inhibition in hormone receptor-positive, human epidermal growth factor receptor 2-negative metastatic breast cancer: MAINTAIN trial. J Clin Oncol 2023; 41:4004-13.
36. Sonke G, van Ommen-Nijhof, Wortelboer N, et al. Primary outcome of the phase 3 SONIA trial (BOOG 2017-03). J Clin Oncol 2023; 41: 17_suppl, LBA1000.
37. Andre F, Ciruelos EM, Juric D, et al. Alpelisib plus fulvestrant for PIK3CA-mutated, hormone receptor-positive, human epidermal growth factor receptor-2-negative advanced breast cancer: final overall survival results from SOLAR-1. Ann Oncol 2021; 32:208-17.
38. Miles D, Ciruelos E, Schneeweiss A, et al; PERUSE investigators. Final results from the PERUSE study of first-line pertuzumab plus trastuzumab plus a taxane for HER2-positive locally recurrent or metastatic breast cancer, with a multivariable approach to guide prognostication. Ann Oncol 2021; 32:1245-55.
39. Perez EA, Lopez-Vega JM, Petit T, et al. Safety and efficacy of vinorelbine in combination with pertuzumab and trastuzumab for first-line treatment of patients with HER2-positive locally advanced or metastatic breast cancer: VELVET Cohort 1 final results. Breast Cancer Res 2016; 18:126.
40. Andersson M, Lopez-Vega JM, Petit T, et al. Efficacy and safety of pertuzumab and trastuzumab administered in a single infusion bag, followed by vinorelbine: VELVET cohort 2 final results. Oncologist 2017; 22:1160-8.
41. Vogel CL, Cobleigh MA, Tripathy D, et al: Efficacy and safety of trastuzumab as a single agent in first-line treatmentof HER2-overexpressing metastatic breast cancer. J Clin Oncol 2002; 20:719-26
42. Huober J, Weder P, Ribi K, et al. Pertuzumab plus trastuzumab with or without chemotherapy followed by emtansine in ERBB2-positive metastatic breast cancer: A secondary analysis of a randomized clinical trial. JAMA Oncol 2023; 9:1381–89.
43. Hurvitz SA, Hegg R, Chung WP, et al. Trastuzumab deruxtecan versus trastuzumab emtansine in patients with HER2-positive metastatic breast cancer: updated results from DESTINY-Breast03, a randomised, open-label, phase 3 trial. Lancet 2023; 401:105-17.
44. Krop IE, Wildiers H, Hurvitz SA, et al. An age-specific pooled analysis of trastuzumab deruxtecan (T DXd) in patients (pts) with HER2-positive (HER2+) metastatic breast cancer (mBC) from DESTINY-Breast01, -02, and -03.J Clin Oncol 2023; 41:16_suppl, 1006
45. Krop IE, Kim SB, Gonzalez-Martin A, et al. Trastuzumab emtansine versus treatment of physician’s choice for pretreated HER2-positive advanced breast cancer (TH3RESA): a randomised, open-label, phase 3 trial. Lancet Oncol 2014; 15(7):689-69
46. Schmid P, Rugo HS, Adams S, et al; IMpassion130 Investigators. Atezolizumab plus nab-paclitaxel as first-line treatment for unresectable, locally advanced or metastatic triple-negative breast cancer (IMpassion130): updated efficacy results from a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol 2020; 21(1):44-59
47. Cortes J, Rugo HS, Cescon DW, et al; KEYNOTE-355 Investigators. Pembrolizumab plus chemotherapy in advanced triple-negative breast cancer. N Engl J Med 2022; 387:217-26.
48. Bardia A, Hurvitz SA, Tolaney SM, et al; ASCENT clinical trial Investigators. Sacituzumab govitecan in metastatic triple-negative breast cancer. N Engl J Med 2021; 384:1529-41.
der informierte @rzt
- Vol. 14
- Ausgabe 8
- August 2024