- Ischämiediagnostik bei chronischem Koronarsyndrom
Die koronare Herzerkrankung ist eine der häufigsten Ursachen für Mortalität und Morbidität weltweit. Für die Diagnose des chronischen Koronarsyndroms (CCS) werden von den aktuellen Guidelines abhängig von der Vortestwahrscheinlichkeit verschiedene Bildgebungsverfahren empfohlen, entweder mittels Beurteilung der koronaren Anatomie oder über einen funktionellen Stresstest, der myokardiale Ischämie nachweist. In diesem Artikel fassen wir die aktuellen Empfehlungen zusammen und beschreiben Limitationen und Stärken der einzelnen Bildgebungsverfahren.
Coronary artery disease is one of the leading causes of mortality and morbidity worldwide. For the diagnosis of chronic coronary syndrome (CCS), current guidelines recommend different imaging modalities depending on the pretest probability, either by assessment of coronary anatomy or via a functional stress test that detects myocardial ischemia. In this article, we summarize the current recommendations and describe limitations and strengths of each imaging modality.
Key Words: coronary artery disease, myocardial ischemia, chronic coronary syndrome, coronary event
Die koronare Herzkrankheit (KHK) ist eine der bedeutendsten Volkskrankheiten und die häufigste Todesursache weltweit (1). Arteriosklerotische Ablagerungen in den Koronarien führen zu einem Mismatch von myokardialem Sauerstoffbedarf und -versorgung und damit zu myokardialer Ischämie. Früh im Krankheitsverlauf kommt es zu einer endothelialen Dysfunktion, die eine zentrale Rolle in allen Phasen der Arteriosklerose spielt. Die KHK ist eine chronische Erkrankung, die unterschiedlich rasch progredient verläuft. Abhängig von Dauer und Schweregrad der durch die KHK induzierten Ischämie, manifestiert sie sich klinisch in unterschiedlichen Formen, grob zusammengefasst als akutes koronares Ereignis (ACS), meist ausgelöst durch ein akutes atherothrombotisches Event, oder als chronisches Koronarsyndrom (CCS).
Für die Diagnostik des CCS gibt es zwei verschiedene Ansätze: die anatomische Darstellung von Stenosen der epikardialen Gefässe (invasive Koronarangiographie oder CT-Angiographie) oder die Diagnose mittels eines funktioniellen nicht-invasiven Ischämietests. Viele Jahre lang war die invasive Koronarangiographie der Goldstandard für die Diagnosestellung der koronaren Herzkrankheit, bis immer mehr Studien zeigten, dass eine funktionelle Charakterisierung der Koronarzirkulation klinische und ökonomische Vorteile bietet (2, 3), sodass der nicht-invasiven Bildgebung in den aktuellen Guidelines ein höherer Stellenwert eingeräumt wurde (4).
Festlegen der Vortestwahrscheinlichkeit
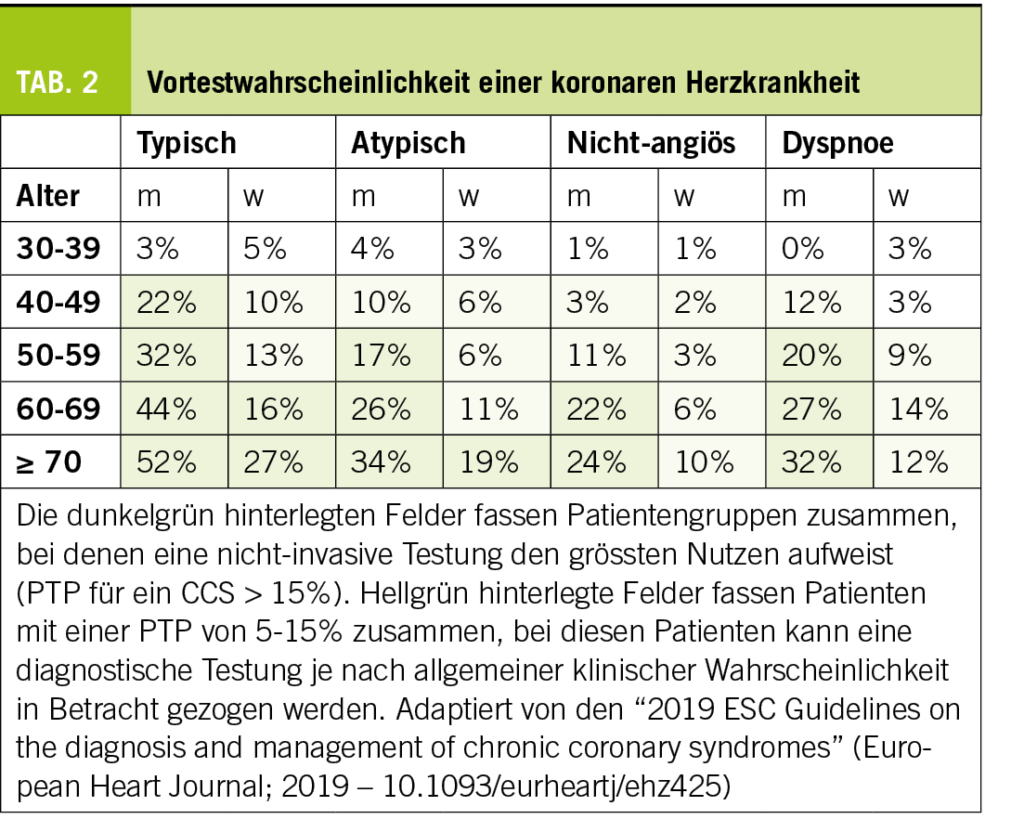
Aktuell empfehlen die ESC Guidelines einen stufenweisen Ansatz zur Diagnostik des CCS (4). Nach einer Basisevaluation, die eine Klassifizierung der Thoraxschmerzen (Tab. 1) einschliesst, wird die Vortestwahrscheinlichkeit (‘pre-test probability’, PTP) beurteilt. Bei einer mittleren PTP (15-85%) sind nicht-invasive diagnostische Tests am sinnvollsten. In den aktuellen Guidelines von 2019 wurde die Vortestwahrscheinlichkeit nach neueren Daten (5) nach unten korrigiert und Dyspnoe als Angina-äquivalent aufgenommen (Tab. 2) (4). Patienten mit einer PTP < 15% haben eine gute Prognose, sodass auf eine weitere routinemässige Diagnostik verzichtet werden kann (5). Liegen Faktoren vor, die die klinische Wahrscheinlichkeit für eine KHK erhöhen, wie EKG-Veränderungen oder kardiovaskuläre Risikofaktoren, kann auch bei Patienten mit tiefer PTP eine nicht-invasive Abklärung in Betracht gezogen werden.
Die Auswahl des richtigen Tests
Bei Patienten mit einer hohen Wahrscheinlichkeit für eine KHK, typischer Angina bei niedriger Belastungsintensität, Symptomen, die nicht auf eine medikamentöse Therapie ansprechen oder klinischen Hinweisen für eine hohe Ereignisrate sollte direkt eine Koronarangiographie durchgeführt werden (4).
Die nicht-invasive CCS-Diagnostik beinhaltet das Koronar-CT zur anatomischen Beurteilung der Koronarien sowie funktionelle Tests, die die myokardiale Ischämie nachweisen, welche bei körperlicher Belastung oder medikamentösem Stress hervorgerufen wird. Die Ergometrie hat aufgrund ihrer geringeren Sensitivität und Spezifität in der CCS-Diagnostik nur noch einen geringen Stellenwert.
Koronar-CT mit CT-Angiographie (CTA)
Mit dem Koronar-CT kann ohne Kontrastmittel und mit einer geringen Strahlendosis der Kalziumscore (CACS) und damit die Kalklast bestimmt werden (7), die ein verlässlicher Marker für koronare Atherosklerose und “arterielles Alter” ist (8). Sie liefert prognostische Informationen und dient als Risikomodifikator insbesondere bei asymptomatischen Patienten (9, 10).
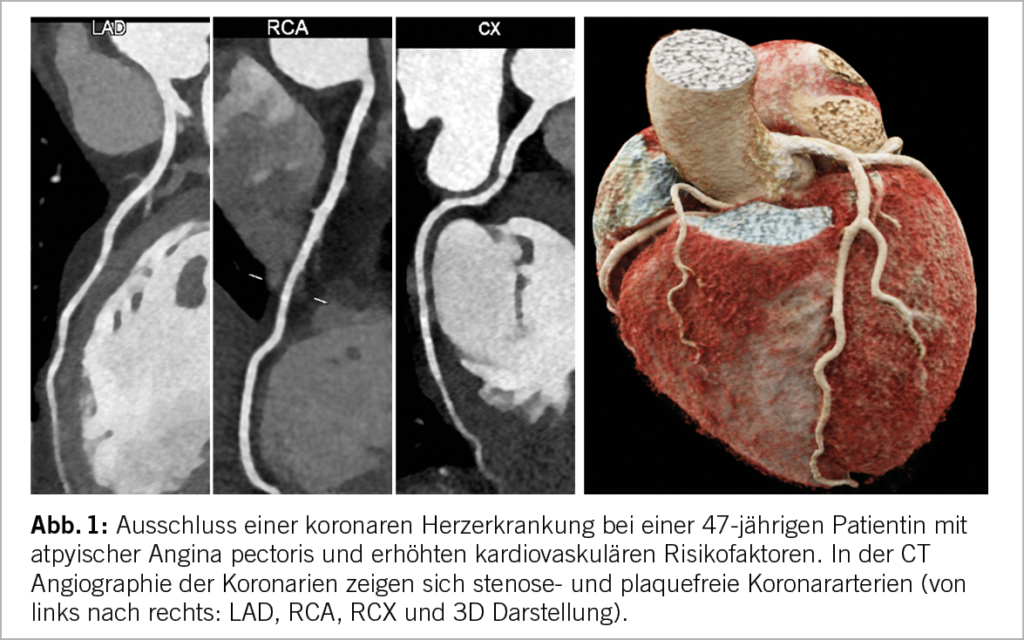
Die CT-Angiographie erlaubt mit der Gabe eines iodhaltigen Kontrastmittels die Darstellung der Koronaranatomie sowie möglicher Plaques (inkl. Charakterisierung der Plaques) und Stenosen (Abb. 1). Sie bietet eine hohe Genauigkeit für die Diagnostik und insbesondere den Ausschluss des CCS (11) und diagnostiziert im Gegensatz zu funktioneller Bildgebung auch subklinische arteriosklerotische Veränderungen der Gefässe. Da Stenosen mit einer Lumeneinengung von 50-90% nicht immer zu myokardialer Ischämie führen, wird eine nicht-invasive oder invasive funktionelle Beurteilung dieser empfohlen (4). Die CTA eignet sich bei Patienten ohne bekanntes CCS und einer PTP im unteren bis intermediären Bereich. Auch zur Abklärung der Durchgängigkeit von aortokoronaren Bypässen kann die CTA hilfreich sein (4, 12). Bei ausgedehnten Koronarverkalkungen besteht das Risiko, dass Stenosen überschätzt werden. Eine negative CTA hat einen hohen negativen prädiktiven Wert, die langfristige Prognose dieser Patienten ist exzellent (13).
Einschränkungen bestehen bei Patienten mit Allergien gegen iodhaltige Kontrastmittel und schwerer Niereninsuffizienz, wobei moderne Protokolle auch eine Beurteilung der Koronarien mit reduzierter Kontrastmittelgabe erlauben (14). Mit neueren CT-Geräten können auch Patienten mit höheren Herzfrequenzen (> 100/min) und Arrhythmien untersucht werden (15). Die Bestimmung der fraktionellen Flussreserve im CT (CT-FFR) wird zukünftig wahrscheinlich eine nicht-invasive Option für die Beurteilung der funktionellen Relevanz von Stenosen bieten (16).
Nicht-invasive funktionelle Tests
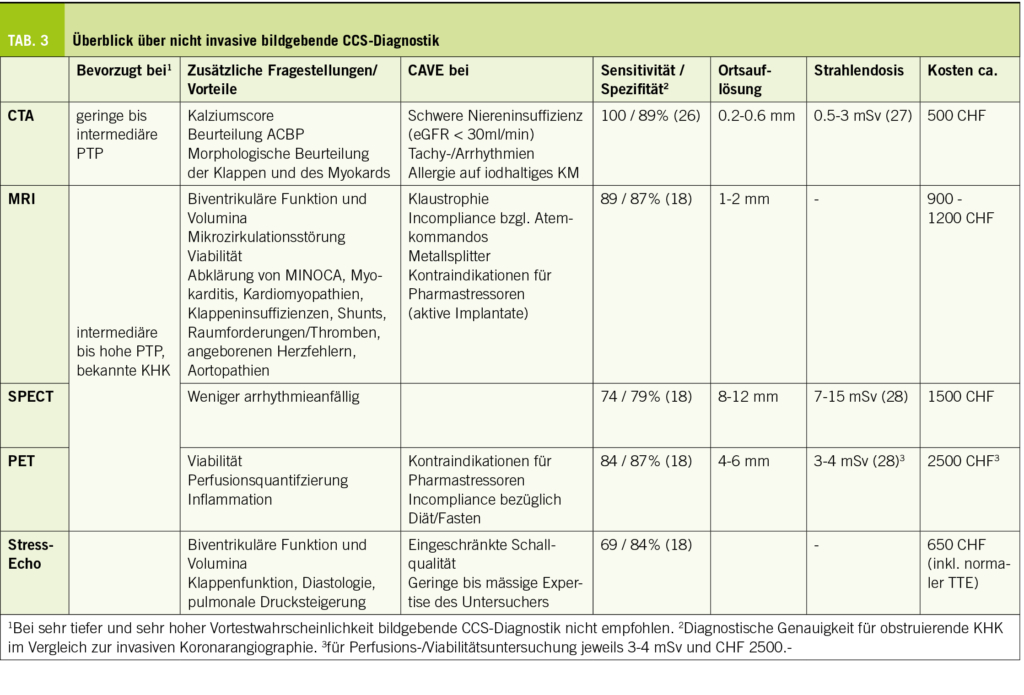
Nicht invasive funktionelle Untersuchungen zum Nachweis myokardialer Ischämie werden empfohlen bei Patienten mit intermediärer bis hoher PTP für ein CCS und umfassen die Herz MRI (kardiale Magnetresonanztomographie), SPECT (Single-Photon-Emissionscomputertomographie), PET (Positron Emission Tomography) und Stressechokardiographie. Bei einem Ischämieareal von ≥ 2/16 AHA-Segmenten im Herz MRI (oder Wandbewegungsstörungen in ≥ 3 Segmenten bei einem Dobutaminstress-MRI) und ≥ 10% des LV-Myokards im SPECT und PET geht man von einer prognostischen Relevanz aus (4).
Herz MRI
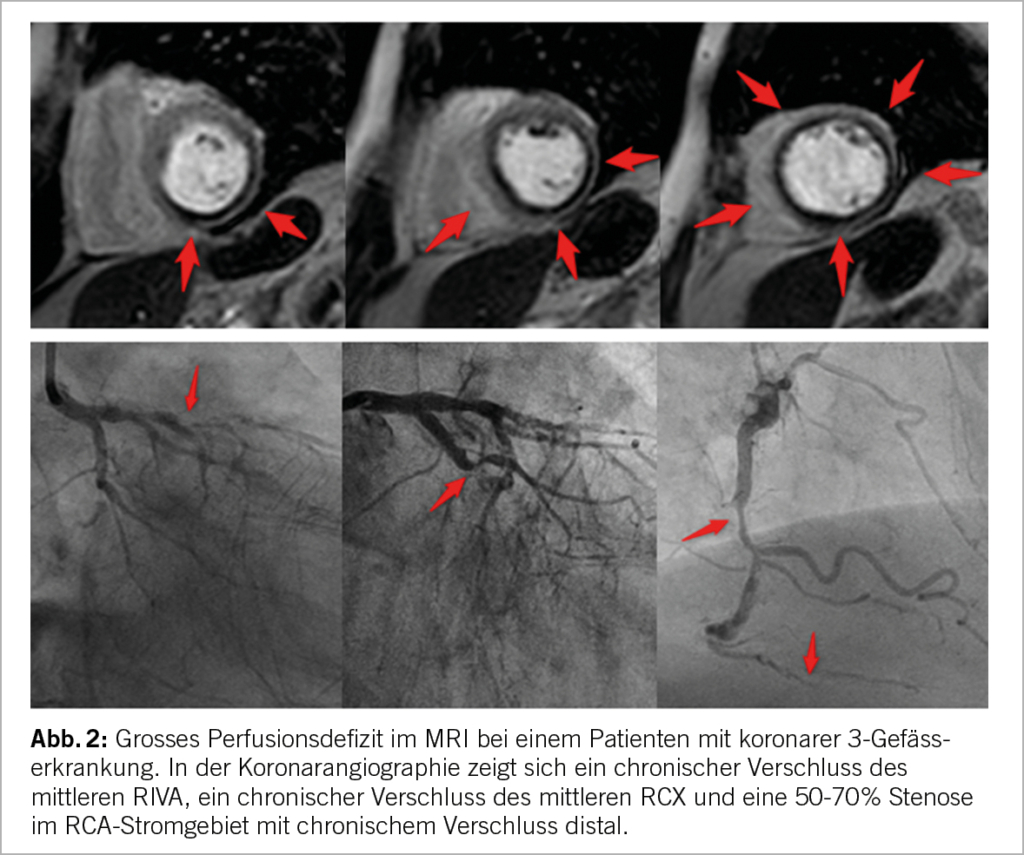
Mit dem Herz MRI können myokardiale Perfusionsdefizite (Abb. 2) unter pharmakologischer Belastung, meist nach Gabe des Vasodilatators Adenosin oder Regadenoson oder seltener unter direkter pharmakologischer Belastung mit Dobutamin (17), untersucht werden. Im Vergleich zur invasiven Koronarangiographie zeigt das Herz MRI für die Diagnose einer signifikant obstruierenden KHK eine hohe Sensitivität und Spezifität (18, 19) (Tab. 3). Das MRI liefert hierbei bessere prognostische Information als klinische Daten oder die Beurteilung der Wandbewegung. Patienten mit myokardialer Ischämie im Herz MRI haben ein höheres Risiko für kardiovaskuläre Ereignisse, wohingegen eine normale Perfusionsuntersuchung Patienten mit tiefem Risiko identifiziert (20). Technische Weiterentwicklungen mit Perfusionsquantifzierung und 3D-Perfusionsuntersuchungen, sowie frei geatmete Sequenzen werden die diagnostische Genauigkeit und Patientencomfort zukünftig weiter verbessern (19, 21, 22).
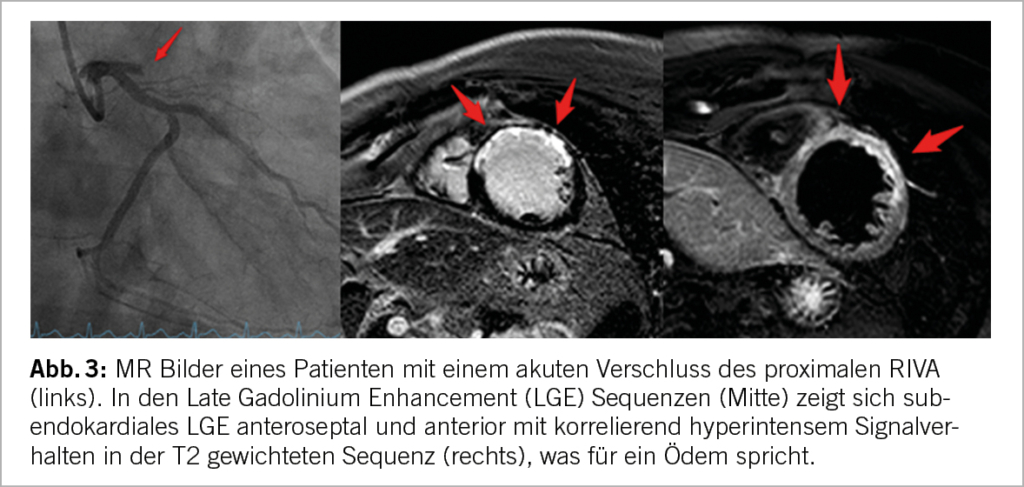
Unter den funktionellen Tests bietet das Herz MRI – neben der fehlenden Strahlenbelastung – einzigartige Vorteile. So können neben der myokardialen Perfusion auch die biventrikuläre Funktion, Klappenerkrankungen und Narben (Abb. 3) (23) in einer Untersuchung beurteilt werden. Das Herz MRI ist der Goldstandard für die volumetrische und funktionelle Beurteilung der Ventrikel. Weiterhin ist eine myokardiale Gewebecharakterisierung möglich und die akute myokardiale Schädigung (mit Ödem) (Abb. 3) kann von chronischen oder älteren Prozessen unterschieden werden.
Differentialdiagnosen, wie beispielsweise zugrundeliegende Kardiomyopathien, können ebenfalls abgeklärt werden. Bei Patienten mit Myokardinfarkt ohne obstruierende koronare Herzerkrankung (MINOCA) besteht im Rahmen des diagnostischen Work-Ups eine Klasse I Empfehlung für die Durchführung eines MRIs (24).
Limitationen bestehen bei Klaustrophobie, Kontraindikationen für die Pharmastressoren, Allergien auf gadoliniumhaltiges Kontrastmittel oder eine relevante Einschränkung der Nierenfunktion (eGFR < 30ml/min). Ausgeprägte Arrhythmien oder die Unfähigkeit des Patienten Atemkommandos zu befolgen können die Bildqualität einschränken. Aktive Implantate wie z.B. Herzschrittmacher können eine vorgängige Umprogrammierung und Überwachung nötig machen, stellen jedoch nur noch selten eine relevante Einschränkung dar (25).
Stress-Echokardiographie
Um verlässliche Resultate der Stress-Echokardiographie zu erhalten ist ein geübter Untersucher mit viel Erfahrung nötig. Vorteile sind die gute Verfügbarkeit, geringe Kosten und fehlende Strahlenbelastung, sowie neben der medikamentösen Belastung auch die Möglichkeit der physikalischen Stressuntersuchung. Ausserdem können neben der Pumpfunktion und Wandbewegung weitere Aspekte, wie die diastolische Funktion, Klappenfunktion und pulmonale Drucksteigerung unter Belastung untersucht werden. Limitationen bestehen bei eingeschränkter Schallqualität, Linksschenkelblock, Schrittmacherpacing und Rhythmusstörungen.
SPECT
Die SPECT untersucht die perfusionsabhängige, myokardiale Aufnahme eines radioaktiv markierten Tracers in Ruhe und während körperlicher oder pharmakologischer Belastung. Mit Hybrid-Geräten (SPECT-CT) kann kombiniert eine low-dose-CT für die Evaluation des Kalziumscores durchgeführt werden. Vorteil ist die Unabhängigkeit von Arrhythmien, Nachteile der SPECT sind die schlechtere räumliche Auflösung, die limitierte diagnostische Genauigkeit (18), sowie die Strahlenbelastung (Tab. 3).
PET
Bei der PET erfassen Detektoren die beim Zerfall eines injizierten, radioaktiven Tracers freigesetzten Photonen, was Rückschlüsse auf die Radionuklidkonzentration in einem Organ erlaubt. Für die Untersuchung der myokardialen Perfusion wird ebenfalls Ruhe mit medikamentösem Stress verglichen. Die PET erlaubt hierbei eine quantitative Messung des Subtratstoffwechsels und myokardialen Blutlusses, was die Diagnose balancierter Ischämien bei schwerer koronarer 3-Gefässerkrankung und Beurteilung einer mikrovaskulären Dysfunktion ermöglicht. Ausserdem ist wie auch im MRI eine Beurteilung der Viabilität möglich. Da hierfür jedoch ein anderer Tracer als für die Perfusionsuntersuchung nötig ist, ist dies mit einem grösseren Aufwand verbunden. Die PET hat eine bessere räumliche Auflösung und tiefere Strahlenbelastung im Vergleich zur SPECT. Nachteile sind die hohen Kosten, Verfügbarkeit und Länge der Untersuchung (bei kombinierter Fragestellung Ischämie/Viabilität).
Hybrid-Geräte können mittlerweile die Vorteile verschiedener Untersuchungstechniken kombinieren, sind jedoch mit grösserem Aufwand und Kosten verbunden und sollten speziellen Fragestellungen vorbehalten sein.
Zusammenfassung
Zusammenfassend bietet jede Untersuchungsart Vorteile und Limitationen. Je nach klinischem Bild, Vortestwahrscheinlichkeit sowie lokaler Verfügbarkeit und Expertise muss die geeignete Diagnostik individuell gewählt werden. Es ist zu erwarten, dass technische Weiterentwicklungen zukünftig zu einem noch grösseren Stellenwert der nicht invasiven CCS-Diagnostik führen werden.
Copyright bei Aerzteverlag medinfo AG
Insitut für Diagnostische und Interventionelle Radiologie
Universitätsspital Zürich
Klinik für Kardiologie, Universitäres Herzzentrum, Universitätsspital Zürich
Institut für Biomedizinische Bildgebung, Universität und ETH Zürich
Insitut für Diagnostische und Interventionelle Radiologie
Universitätsspital Zürich
Insitut für Diagnostische und Interventionelle Radiologie
Universitätsspital Zürich
Klinik für Kardiologie, Universitäres Herzzentrum, Universitätsspital Zürich
Institut für Biomedizinische Bildgebung, Universität und ETH Zürich
Der AutorInnen haben keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
1. Vos T, Lim SS, Abbafati C, Abbas KM, Abbasi M, Abbasifard M, et al. Global burden of 369 diseases and injuries in 204 countries and territories, 1990–2019: a systematic analysis for the Global Burden of Disease Study 2019. The Lancet. 2020 Oct 17;396(10258):1204–22.
2. Tonino PAL, De Bruyne B, Pijls NHJ, Siebert U, Ikeno F, van `t Veer M, et al. Fractional Flow Reserve versus Angiography for Guiding Percutaneous Coronary Intervention. N Engl J Med. 2009 Jan 15;360(3):213–24.
3. Nagel E, Greenwood JP, McCann GP, Bettencourt N, Shah AM, Hussain ST, et al. Magnetic Resonance Perfusion or Fractional Flow Reserve in Coronary Disease. N Engl J Med. 2019 Jun 20;380(25):2418–28.
4. Knuuti J. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes The Task Force for the diagnosis and management of chronic coronary syndromes of the European Society of Cardiology (ESC). Russ J Cardiol. 2020 Mar 11;25(2):119–80.
5. Foldyna B, Udelson JE, Karády J, Banerji D, Lu MT, Mayrhofer T, et al. Pretest probability for patients with suspected obstructive coronary artery disease: re-evaluating Diamond–Forrester for the contemporary era and clinical implications: insights from the PROMISE trial. Eur Heart J – Cardiovasc Imaging. 2019 May 1;20(5):574–81.
6. Götberg M, Christiansen EH, Gudmundsdottir IJ, Sandhall L, Danielewicz M, Jakobsen L, et al. Instantaneous Wave-free Ratio versus Fractional Flow Reserve to Guide PCI. N Engl J Med. 2017 May 11;376(19):1813–23.
7. Hecht HS, de Siqueira MEM, Cham M, Yip R, Narula J, Henschke C, et al. Low- vs. standard-dose coronary artery calcium scanning. Eur Heart J Cardiovasc Imaging. 2015 Apr;16(4):358–63.
8. McClelland RL, Nasir K, Budoff M, Blumenthal RS, Kronmal RA. Arterial age as a function of coronary artery calcium (from the Multi-Ethnic Study of Atherosclerosis [MESA]). Am J Cardiol. 2009 Jan 1;103(1):59–63.
9. Golub IS, Termeie OG, Kristo S, Schroeder LP, Lakshmanan S, Shafter AM, et al. Major Global Coronary Artery Calcium Guidelines. JACC Cardiovasc Imaging. 2023 Jan;16(1):98–117.
10. Eberhard M, Hinzpeter R, Schönenberger ALN, Euler A, Kuzo N, Reeve K, et al. Incremental Prognostic Value of Coronary Artery Calcium Score for Predicting All-Cause Mortality after Transcatheter Aortic Valve Replacement. Radiology. 2021 Oct;301(1):105–12.
11. Knuuti J, Ballo H, Juarez-Orozco LE, Saraste A, Kolh P, Rutjes AWS, et al. The performance of non-invasive tests to rule-in and rule-out significant coronary artery stenosis in patients with stable angina: a meta-analysis focused on post-test disease probability. Eur Heart J. 2018 Sep 14;39(35):3322–30.
12. Károlyi M, Eberhard M, Gloor T, Polacin M, Manka R, Savic V, et al. Routine early postoperative computed tomography angiography after coronary artery bypass surgery: clinical value and management implications. Eur J Cardio-Thorac Surg Off J Eur Assoc Cardio-Thorac Surg. 2022 Jan 24;61(2):459–66.
13. Finck T, Hardenberg J, Will A, Hendrich E, Haller B, Martinoff S, Hausleiter J, Hadamitzky M. 10-Year Follow-Up After Coronary Computed Tomography Angiography in Patients With Suspected Coronary Artery Disease. JACC Cardiovasc Imaging. 2019 Jul;12(7 Pt 2):1330-1338. doi: 10.1016/j.jcmg.2018.07.020. Epub 2018 Oct 17. PMID: 30343079.
14. Higashigaito K, Husarik DB, Barthelmes J, Plass AR, Manka R, Maisano F, et al. Computed tomography angiography of coronary artery bypass grafts: low contrast media volume protocols adapted to tube voltage. Invest Radiol. 2016;51(4):241–8.
15. Matveeva A, Schmitt RR, Edtinger K, Wagner M, Kerber S, Deneke T, et al. Coronary CT angiography in patients with atrial fibrillation: Standard-dose and low-dose imaging with a high-resolution whole-heart CT scanner. Eur Radiol. 2018 Aug 1;28(8):3432–40.
16. Eberhard M, Nadarevic T, Cousin A, von Spiczak J, Hinzpeter R, Euler A, et al. Machine learning-based CT fractional flow reserve assessment in acute chest pain: first experience. Cardiovasc Diagn Ther. 2020 Aug;10(4):820–30.
17. Manka R, Jahnke C, Gebker R, Schnackenburg B, Paetsch I. Head-to-head comparison of first-pass MR perfusion imaging during adenosine and high-dose dobutamine/atropine stress. Int J Cardiovasc Imaging. 2011 Oct 1;27(7):995–1002.
18. Takx RAP, Blomberg BA, El Aidi H, Habets J, de Jong PA, Nagel E, et al. Diagnostic accuracy of stress myocardial perfusion imaging compared to invasive coronary angiography with fractional flow reserve meta-analysis. Circ Cardiovasc Imaging. 2015 Jan;8(1):e002666.
19. Manka R, Wissmann L, Gebker R, Jogiya R, Motwani M, Frick M, et al. Multicenter Evaluation of Dynamic Three-Dimensional Magnetic Resonance Myocardial Perfusion Imaging for the Detection of Coronary Artery Disease Defined by Fractional Flow Reserve. Circ Cardiovasc Imaging. 2015 May;8(5):e003061.
20. Jahnke C, Nagel E, Gebker R, Kokocinski T, Kelle S, Manka R, et al. Prognostic Value of Cardiac Magnetic Resonance Stress Tests. Circulation. 2007 Apr 3;115(13):1769–76.
21. Kotecha T, Martinez-Naharro A, Boldrini M, Knight D, Hawkins P, Kalra S, et al. Automated Pixel-Wise Quantitative Myocardial Perfusion Mapping by CMR to Detect Obstructive Coronary Artery Disease and Coronary Microvascular Dysfunction: Validation Against Invasive Coronary Physiology. (1876-7591 (Electronic)).
22. Hoh T, Vishnevskiy V, Polacin M, Manka R, Fuetterer M, Kozerke S. Free-breathing motion-informed locally low-rank quantitative 3D myocardial perfusion imaging. Magn Reson Med. 2022 Oct;88(4):1575–91.
23. Goetti R, Kozerke S, Donati OF, Sürder D, Stolzmann P, Kaufmann PA, et al. Acute, Subacute, and Chronic Myocardial Infarction: Quantitative Comparison of 2D and 3D Late Gadolinium Enhancement MR Imaging. Radiology. 2011 Jun;259(3):704–11.
24. Collet JP, Thiele H, Barbato E, Barthélémy O, Bauersachs J, Bhatt DL, et al. 2020 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation: The Task Force for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation of the European Society of Cardiology (ESC). Eur Heart J. 2020;42(14):1289–367.
25. Glikson M, Nielsen JC, Kronborg MB, Michowitz Y, Auricchio A, Barbash IM, et al. 2021 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy. Eur Heart J. 2021 Sep 14;42(35):3427–520.
26. von Ballmoos MW, Haring B, Juillerat P, Alkadhi H. Meta-analysis: Diagnostic Performance of Low-Radiation-Dose Coronary Computed Tomography Angiography. Ann Intern Med. 2011 Mar 15;154(6):413–20.
27. Richards CE, Dorman S, John P, Davies A, Evans S, Ninan T, et al. Low-radiation and high image quality coronary computed tomography angiography in “real-world” unselected patients. World J Radiol. 2018 Oct 28;10(10):135–42.
28. Alam L, Omar AMS, Patel KK. Improved Performance of PET Myocardial Perfusion Imaging Compared to SPECT in the Evaluation of Suspected CAD. Curr Cardiol Rep. 2023 Apr;25(4):281–93.
der informierte @rzt
- Vol. 13
- Ausgabe 8
- August 2023