- Kontrolle der nicht schmerzhaften Symptome in der Palliativmedizin
Patienten mit fortgeschrittener Krebserkrankung weisen durchschnittlich 11 Symptome auf. Von diesen ist der Schmerz eines der häufigsten, aber bei weitem nicht das einzige, das mit Medikamenten oder nicht medikamentösen Ansätzen behandelt werden kann. Diese Übersicht bietet einen Überblick über das Management von sechs weiteren Symptomen, die am Lebensende häufig auftreten: Dyspnoe, Übelkeit/Erbrechen, Müdigkeit, Anorexie, Verwirrtheitszustand und Rasselgeräusche des Sterbenden.
Die Palliativmedizin hat als Hauptziel die Verbesserung der Lebensqualität von Menschen, die eine fortschreitende, unheilbare Krankheit haben. Eine Möglichkeit, diese Lebensqualität zu verbessern, ist die Kontrolle der vielfältigen Symptome, an welchen die Patienten leiden. Eine systematische Bewertung dieser Symptome mit Hilfe der Edmonton Symptom Assessment Scale (ESAS) kann neun von ihnen identifizieren und quantifizieren. Diese Selbsteinschätzungsskala wurde zwar ins Deutsche übersetzt, aber bisweilen noch nicht validiert, im Gegensatz zur französischen Version (1).
Dyspnoe
Dyspnoe, definiert als subjektives Empfinden von Atembeschwerden, ist eines der vom Patienten am häufigsten geäusserten Symptome. Sie wird oft von Sorgen und Angst zu ersticken begleitet und ist bei Menschen am Lebensende mit Prävalenzen von bis zu 75% beschrieben worden (2). Die effektivste Behandlung bleibt die Optimierung der Behandlung der zugrunde liegenden Krankheit. In dieser Hinsicht werden Behandlungen bei Herzinsuffizienz und chronisch obstruktiver Lungenerkrankung (COPD) so lange wie möglich aufrechterhalten, auch wenn das Lebensende sich nähert. In Bezug auf die symptomatische Behandlung hat sich Morphin als die wirksamste Substanz erwiesen (3). Die Wirkungsweise ist noch nicht vollständig geklärt, aber es wurden µ-Rezeptoren im Bronchialsystem gefunden. Es handelt sich also wahrscheinlich um einen Effekt, der mit dieser Medikamentenklasse zusammenhängt. Andere Wirkstoffe wie Oxycodon, sublinguales oder inhaliertes Fentanyl und Hydromorphon werden derzeit untersucht. Meistens handelt es sich dabei um kleine Studien, manchmal mit widersprüchlichen Ergebnissen. Eine aktuelle randomisierte kontrollierte Studie zeigte jedoch keinen Unterschied zwischen Oxycodon und Morphin bei chronischer Dyspnoe (4). Zusammenfassend eröffnen diese Informationen die Möglichkeit, bei persistierender Dyspnoe in der palliativen Situation auch andere Opiate einzusetzen. Die Angst vor Atemnot ist unbegründet, sofern die Substanz peroral verabreicht wird, die Dosis an die Situation angepasst ist und die Titration progressiv erfolgt (Kasten 1) (5).

Als Alternative kann dem Patienten angeboten werden, in Momenten der Dyspnoe einen Ventilator auf sein Gesicht zu richten. Diese Therapie ist erwiesenermassen genauso wirksam wie die Sauerstofftherapie (6). Bis heute hat jedoch keine Studie die Wirksamkeit von letzterer gegenüber einem Placebo bei fehlender Hypoxämie nachgewiesen (7).
In der stationären Umgebung werden die nicht invasive Beatmung (NIV) und die nasale High-Flow-Sauerstofftherapie (High Flow Nasal Cannula – HFNC) immer häufiger eingesetzt. Es hat sich gezeigt, dass die NIV einen Einfluss auf die Lebensqualität hat, aber keinen auf das Überleben und den natürlichen Krankheitsverlauf (8). Die Studien zur HFNC sind sogar noch ermutigender. Die HFNC vermindert nicht nur die Dyspnoe bei hypoxämischen Patienten (9), sondern kann die Symptome auch bei nicht hypoxämischen Patienten in Ruhe und bei Belastung positiv beeinflussen (10, 11). Im Gegensatz zur NIV ermöglicht diese Therapie dem Patienten einen verbalen Austausch mit seinem Umfeld und die Aufrechterhaltung der oralen Ernährung/Hydratation dadurch, dass der Sauerstoff nasal verabreicht wird (12). Diese Therapien gehören zusammen mit Morphin heute zum therapeutischen Arsenal der palliativen Behandlung der Dyspnoe.
Benzodiazepine werden bei chronischer Dyspnoe oft mit Opiaten kombiniert, auch wenn es dafür keine wissenschaftlichen Belege gibt (13). Allerdings ist wegen den kummulierten Nebenwirkungen zusammen mit den Opiaten Vorsicht geboten. Die Hauptindikation muss die Behandlung von Angstzuständen bleiben, die mit dem Gefühl der Dyspnoe einhergehen können. Es wird eine progressive Titration, beginnend mit kleinen Dosen, empfohlen.
Übelkeit und Erbrechen
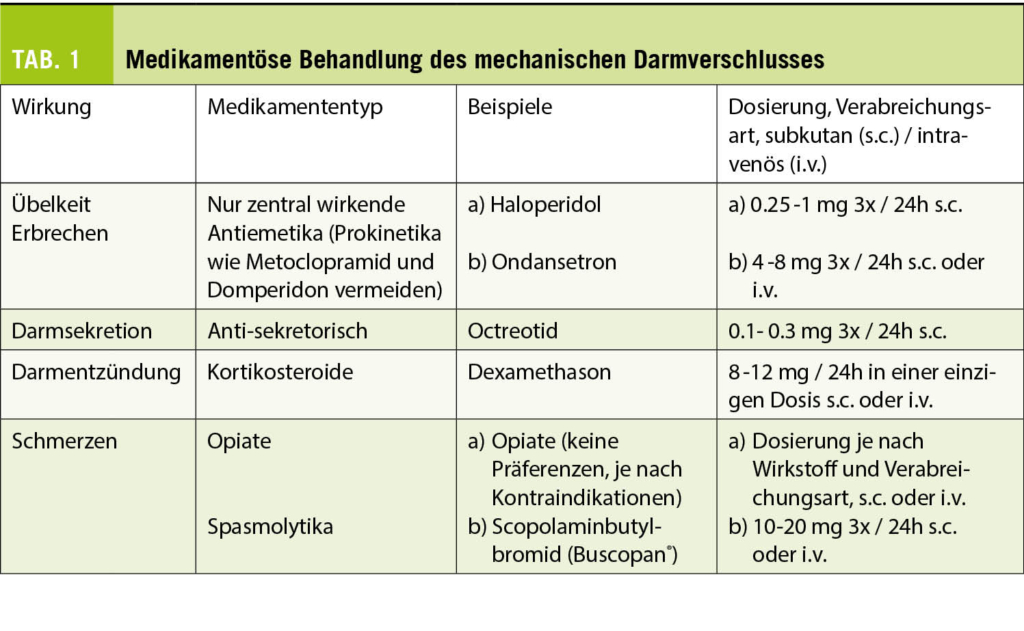
Übelkeit und Erbrechen (N/V) sind in der Palliativmedizin relativ häufig. Bei Krebs sind bis zu 70% der Patienten betroffen (14). Aber auch andere unheilbare Krankheiten wie Herz- oder Nierenversagen und COPD verursachen bei 50% der Patienten N/V (2). Einige spezifische Ursachen, wie z. B. Chemo- oder Strahlentherapie, Opiatbehandlung, gastrointestinale Erkrankungen, Stoffwechselstörungen oder intrazerebrale Erkrankungen (Metastasen, intrakranielle Hypertonie) sollten identifiziert und behandelt werden; meist wird bei diesen Patienten jedoch keine Ursache oder eine multifaktorielle Ursache gefunden (15). Metoclopramid ist das Mittel der ersten Wahl bei N/V ausgelöst durch Opioide und Stoffwechselstörungen. Das Ansprechen ist dosisabhängig und erfordert manchmal eine Titration auf bis zu 80mg/Tag (16). Bei N/V induziert durch Chemo- oder Strahlentherapie hat sich Ondansetron als sehr wirksam erwiesen (17). Die onkologischen Fachgesellschaften haben kürzlich den Einsatz von Olanzapin und Neurokinin-1-Rezeptor-Antagonisten zur Prävention von N/V infolge Chemo- und Strahlentherapie anerkannt (18). Es gibt nur wenige Fallserien in der Palliativmedizin mit Olanzapin, die aber alle einen günstigen Effekt bereits ab einer Dosis von 1,25 mg pro Tag zeigen (19). Wenn Haloperidol gegen Übelkeit nicht wirkt, wird manchmal Levomepromazin empfohlen. Dieses zeigte in einer kürzlich durchgeführten randomisierten kontrollierten Studie keinen Unterschied in der Wirksamkeit im Vergleich zu Haloperidol. Allerdings waren die Patienten unter Levomepromazin signifikant stärker sediert (20). Kortikosteroide sind bei intrakranieller Hypertension indiziert, können aber auch als Ergänzung zu anderen Antiemetika verordnet werden (21). Schliesslich ist Haloperidol bei unzureichender Kontrolle mit anderen Antiemetika und bei mechanischem Darmverschluss indiziert (22). Ein Ileus tritt bei 3-15% der Krebspatienten auf, vor allem bei Patienten mit Ovarial- (20-50 %) und Kolonkarzinomen (10-29%) (23). Abhängig von der Lage, dem Ursprung der Obstruktion, den Wünschen des Patienten und seinem Allgemeinzustand kann ein chirurgischer Eingriff in Betracht gezogen werden, einschliesslich Stenting oder Entlastungs-Gastrostomie. Meistens ist jedoch eine symptomatische Behandlung angezeigt (24). Eine Medikamentenkombination sollte auf folgende drei Achsen wirken: 1) Übelkeit; 2) Darmsekretion und -entzündung; 3) Schmerzen (25). Details zur medikamentösen Behandlung sind in Tabelle 1 ersichtlich.
Müdigkeit
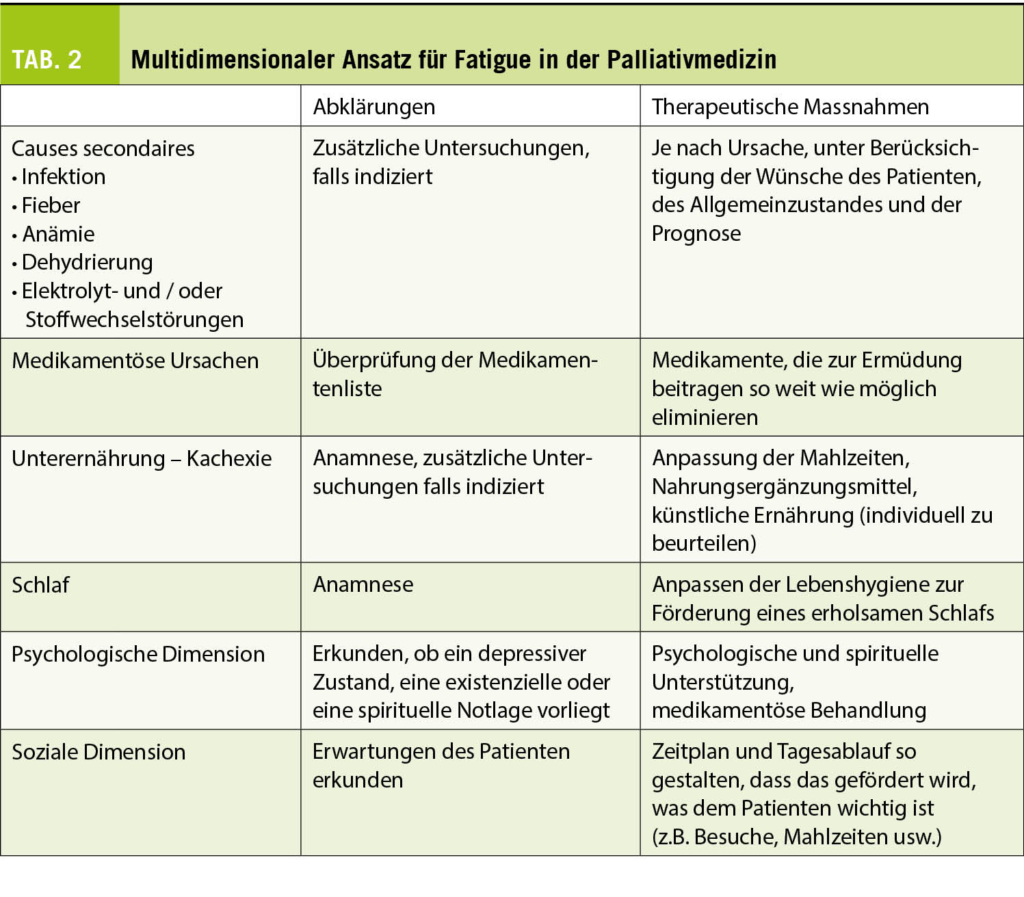
Müdigkeit kann als ein häufiges Symptom betrachtet werden, das wenig Aufmerksamkeit erhält. Dennoch kann es einen grossen Einfluss auf die Lebensqualität haben. Die Prävalenz liegt im Durchschnitt aller Erkrankungen bei etwa 60%, wobei Patienten unter Chemo- oder Strahlentherapie deutlich häufiger betroffen sind (26). Um Müdigkeit zu erkennen, schlägt die European Association of Palliative Care vor, die einfache Frage «Fühlen Sie sich ungewöhnlich müde oder schwach?» zu stellen, bevor die Ermüdung mit dem ESAS quantifiziert wird (26). Sekundäre Ursachen wie Infektionen, Stoffwechsel- und endokrine Störungen und Anämie, um nur einige zu nennen, sollten, soweit möglich und sinnvoll, abgeklärt und behandelt werden. Dies erfordert einen mehrdimensionalen Ansatz (Tab. 2). Medikamentöse Behandlungen sind eher enttäuschend und es ist vor allem körperliche Bewegung, die eine gewisse Wirksamkeit gezeigt hat (27). Es kann jedoch ein Versuch mit Kortikosteroiden (z.B. Dexamethason 4-8 mg täglich) für 5 Tage durchgeführt werden. Bei Erfolg kann die Behandlung bis zu zwei Wochen lang fortgesetzt werden; danach lässt die Wirkung nach. Andere Studien bei jungen Krebspatienten zeigen gute Ergebnisse mit Methylphenidat. Sein Nebenwirkungsprofil legt jedoch Vorsicht bei älteren Patienten nahe.
Anorexie
Die Anorexie ist definiert als Appetitlosigkeit oder eine reduzierte Nahrungsaufnahme. Sie kommt sehr häufig vor in der Terminalphase onkologischer Erkrankungen (85 %) (28)), aber auch bei Herz-, Nieren- oder Lungenversagen (50 %) (29)). Oft ist die reduzierte Nahrungsaufnahme eine der Hauptsorgen der Familie und eine Quelle der Angst. Die Behandlung erfolgt daher individuell nach einer gründlichen Erfassung, die nicht nur die Anamnese der Essgewohnheiten, das Vorhandensein von Faktoren, die eine Anorexie begünstigen (Kasten 2), sondern auch die Form, wie die Nahrung präsentiert wird und die Erwartungen des Patienten und seines Umfelds umfasst. Die Faktoren, die eine Anorexie begünstigen, sollten so weit wie möglich behandelt werden. In den frühen Stadien der Erkrankung kann eine künstliche Ernährung in Betracht gezogen werden. Im fortgeschrittenen Stadium (Lebenserwartung < 3 Monate) ist eine genussvolle Ernährung zu bevorzugen. Oft ist eine Anpassung der Portionen und deren Häufigkeit, der Textur, aber auch des Inhalts der Mahlzeiten notwendig. Die Hilfe einer Ernährungsberaterin kann von Vorteil sein. Orale Nahrungsergänzungsmittel sind manchmal angezeigt. Als appetitanregende Medikation kann eine Kur mit Kortikosteroiden (Prednison 0,5 mg/kg/Tag oder Dexamethason 0,1 mg/kg/Tag) vorgeschlagen werden, deren Wirksamkeit bereits nach 5 Tagen erkennbar ist, aber nach 2 Wochen nachlässt (30). Das Antidepressivum Mirtazapin zeigte in einer kleinen Pilotstudie bei Krebspatienten nach 7-wöchiger Behandlung eine Tendenz zur Appetitverbesserung. Umfassendere Studien sind noch nötig, um den Stellenwert dieses Wirkstoffs bei der Behandlung der Anorexie wirklich zu belegen (31). Andererseits vermochten weder Cannabis noch THC (Delta-9-Tetrahydrocannabinol) die Appetitlosigkeit in einer grossen multizentrischen Studie zu verbessern (32).
Verwirrtheitszustand
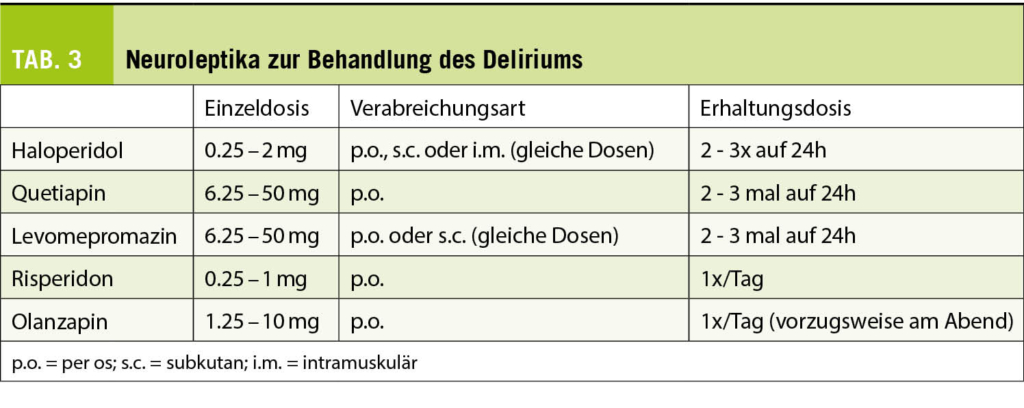
Ein solcher liegt bei 13-88% der Patienten vor, wobei die Inzidenz gegen Ende des Lebens zunimmt (33). Bei 30-50% wird der Verwirrtheitszustand durch reversible Ursachen (Infektion, Fäkalom/Verstopfung, Harnverhalt, Elektrolytstörungen, Medikamente) beschleunigt. Je nach Zustand und Prognose des Patienten können diese Ursachen gesucht und behandelt werden, während parallel dazu eine symptomatische Behandlung erfolgt. Eine aktuelle Studie, in der Haloperidol und Risperidon mit nicht pharmakologischen Massnahmen verglichen wurden, zeigte jedoch, dass letztere zur Entlastung der Patienten effektiver waren als Neuroleptika (34). Der aktuelle Trend in der Palliativmedizin geht dahin, auf den systematischen Einsatz von Neuroleptika zu verzichten. Sie sind (wahrscheinlich) immer noch in Fällen von schwerem hyperaktivem Verwirrtheitszustand indiziert, der der Person grosses Leid zufügt. Die Substanzen und Dosierungen sind in Tabelle 3 aufgeführt, wohlwissend, dass sich kein Molekül als einem anderen überlegen erwiesen hat.
Zusammenfassend lässt sich sagen, dass ein nicht pharmakologischer Ansatz eindeutig zu bevorzugen ist.
Rasselgeräusche des Sterbenden
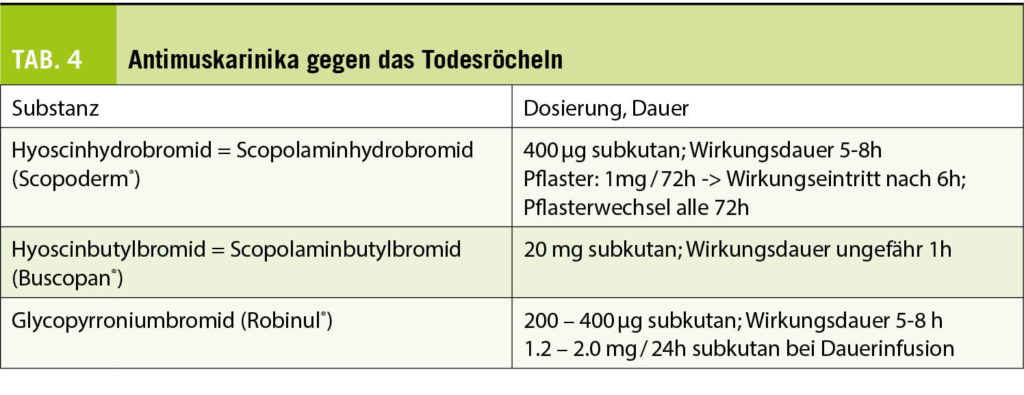
Eine starke bronchiale Obstruktion, auch als «Todesröcheln» bekannt, tritt in den letzten Lebenstagen oder sogar Stunden vor dem Tod auf. Bis zu 92% der Menschen sind davon betroffen. Bei Bewusstseinsstörungen ist der Schluckreflex beeinträchtigt, wodurch sich Sekrete in der Luftröhre und den Bronchien sammeln können. Die vorbeiströmende Luft erzeugt oszillierende Schwingungen, die als Rasselgeräusche wahrgenommen werden. Diese Stauung ist nicht zu verwechseln mit der alveolären Stauung aufgrund einer Lungeninfektion oder kardialen Dekompensation. Obwohl dieses Geräusch für Angehörige sehr störend sein kann, gibt es keinen Hinweis darauf, dass diese Rasselgeräusche dem Patienten Unbehagen bereiten. Eine medikamentöse Behandlung ist daher nicht unbedingt erforderlich (35). In erster Linie ist es wichtig, den Kontakt und die Kommunikation mit den Angehörigen zu suchen, um sie zu beruhigen. Ist jedoch eine Reduktion dieser Sekrete erwünscht, kann ein Versuch mit einer Behandlung mit Antimuskarinika unternommen werden, auch wenn die Wirkung dieser Substanzen gegenüber einem Placebo nie nachgewiesen wurde (36). In der Schweiz sind drei Substanzen verfügbar (Tab. 4). Eine weitere Möglichkeit ist die mechanische Absaugung, die sparsam eingesetzt werden sollte, da bei wiederholter Anwendung die Gefahr eines Traumas besteht.
Fazit
Um das Lebensende von Patienten angenehm zu gestalten, stehen den Ärzten mehrere Medikamente zur Verfügung, die eine Reihe von Symptomen kontrollieren. Aber auch Zuhören, Beziehungspflege und die Begleitung von Angehörigen haben ihren Platz in der Gesamtbetreuung eines Menschen mit einer fortschreitenden, unheilbaren Krankheit.
Bei diesem Artikel handelt es sich um einen Zweitabdruck, aktualisiert und übersetzt aus la «gazette médicale» 03_2021.
Copyright bei Aerzteverlag medinfo AG
Hôpitaux Universitaires de Genève, Hôpital de Bellerive
Service de médecine palliative
11 chemin de la Savonnière
1245 Collonge-Bellerive
petra.vayne-bossert@hcuge.ch
Die Autorin deklariert, dass keine Interessenskonflikte im Zusammenhang mit diesem Beitrag bestehen.
◆ Die regelmässige Bewertung der Symptome kann mit der ESAS-Skala leicht durchgeführt werden.
◆ Dyspnoe spricht gut auf kleine Dosen von Morphin an.
◆ Zur Behandlung von Übelkeit und Erbrechen in der Palliativmedizin stehen mehrere Medikamente zur Verfügung, darunter Metoclopramid, Ondansetron und Haloperidol.
◆ Müdigkeit ist ein schleichendes Symptom, das wenig Beachtung findet. Ein Versuch mit Kortikosteroiden kann eine gewisse Verbesserung bringen.
◆ Verwirrtheitszustände sind am Ende des Lebens sehr häufig. Ein nicht pharmakologischer Ansatz wird bevorzugt, aber manchmal sind kleine Dosen von Neuroleptika notwendig.
1. Pautex S, Vayne-Bossert P, Bernard M, Beauverd M, Cantin B, Mazzocato C, et al. Validation of the French Version of the Edmonton Symptom Assessment System. Journal of pain and symptom management. 2017;54(5):721-6 e1.
2. Solano JP, Gomes B, Higginson IJ. A comparison of symptom prevalence in far advanced cancer, AIDS, heart disease, chronic obstructive pulmonary disease and renal disease. Journal of pain and symptom management. 2006;31(1):58-69.
3. Abernethy AP, Currow DC, Frith P, Fazekas B. Prescribing palliative oxygen: a clinician survey of expected benefit and patterns of use. Palliative medicine. 2005;19(2):168-70.
4. Ferreira D, Louw S, McCloud Ph, Fazekas B, McDonald Ch, Agar M et al. Controlled-Release Oxycodone vs. Placebo in the Treatment of Chronic Breathlessness-A Multisite Randomized Placebo Controlled Trial. Journal of Pain and Symptom Management. 2020 Mar;59(3):581-589.
5. Pattinson KT. Opioids and the control of respiration. British journal of anaesthesia. 2008;100(6):747-58.
6. Abernethy AP, McDonald CF, Frith PA, Clark K, Herndon JE, 2nd, Marcello J, et al. Effect of palliative oxygen versus room air in relief of breathlessness in patients with refractory dyspnoea: a double-blind, randomised controlled trial. Lancet. 2010;376(9743):784-93.
7. Uronis HE, Currow DC, McCrory DC, Samsa GP, Abernethy AP. Oxygen for relief of dyspnoea in mildly- or non-hypoxaemic patients with cancer: a systematic review and meta-analysis. British journal of cancer. 2008;98(2):294-9.
8. Quill M, Quill T. Palliative use of noninvasive ventilation: navigating murky waters. Journal of Palliative Medicine. 2014 Jun;17(6):657-61.
9. Peters S, Holets S, Gay P. High-flow nasal cannula therapy in do-not-intubate patients with hypoxemic respiratory distress. Respiratory Care. 2013 Apr;58(4):597-600.
10. Hui D, Mahler D, Larsson L, Wu J, Thomas S, Harrison C et al. High Flow Nasal Cannula Therapy for Exertional Dyspnea in Cancer Patients: A Pilot Randomized Clinical Trial. The Oncologist. 2020 Dec 2. doi: 10.1002/onco.13624. Online ahead of print.
11. Hui D, Hernandez F, Urbauer D, Thomas S, Lu Z, Elsayem A, Bruera E. High-Flow Oxygen and High-Flow Air for Dyspnea in Hospitalized Patients with Cancer: A Pilot Crossover Randomized Clinical Trial. The Oncologist. 2021 May;26(5):e883-e892.
12. Koyauchi T, Hasegawa H, Kanata K, Kakutani T, Amano Y, Ozawa Y et al. Efficacy and Tolerability of High-Flow Nasal Cannula Oxygen Therapy for Hypoxemic Respiratory Failure in Patients with Interstitial Lung Disease with Do-Not-Intubate Orders: A Retrospective Single-Center Study. Respiration. 2018;96(4):323-329.
13. Simon ST, Higginson IJ, Booth S, Harding R, Weingartner V, Bausewein C. Benzodiazepines for the relief of breathlessness in advanced malignant and non-malignant diseases in adults. The Cochrane database of systematic reviews. 2016;10:CD007354.
14. Harris DG. Nausea and vomiting in advanced cancer. Br Med Bull. 2010;96:175-85.
15. Fainsinger R, Miller MJ, Bruera E, Hanson J, Maceachern J. Symptom control during the last week of life on a palliative care unit. Journal of palliative care. 1991;7(1):5-11.
16. Bruera E, Belzile M, Neumann C, Harsanyi Z, Babul N, Darke A. A double-blind, crossover study of controlled-release metoclopramide and placebo for the chronic nausea and dyspepsia of advanced cancer. Journal of pain and symptom management. 2000;19(6):427-35.
17. Billio A, Morello E, Clarke MJ. WITHDRAWN: Serotonin receptor antagonists for highly emetogenic chemotherapy in adults. The Cochrane database of systematic reviews. 2013(12):CD006272.
18. Sutherland A, Naessens K, Plugge E, Ware L, Head K, Burton M, Wee B. Olanzapine for the prevention and treatment of cancer-related nausea and vomiting in adults. Cochrane Database Systematic Review. 2018 Sep 21;9(9).
19. Passik SD, Lundberg J, Kirsh KL, et al. A pilot exploration of theantiemetic activity of olanzapine for the relief of nausea in patientswith advanced cancer and pain. Journal of Pain and Symptom Management. 2002;23:526–32.
20. Hardy JR, Skerman H, Philip J, Good P, Currow DC, Mitchell G, Yates P. Methotrimeprazine versus haloperidol in palliative care patients with cancer-related nausea: a randomised, double-blind controlled trial. BMJ Open. 2019 Sep 12;9(9).
21. Vayne-Bossert P, Haywood A, Good P, Khan S, Rickett K, Hardy JR. Corticosteroids for adult patients with advanced cancer who have nausea and vomiting (not related to chemotherapy, radiotherapy, or surgery). The Cochrane database of systematic reviews. 2017;7:CD012002.
22. Hardy JR, O’Shea A, White C, Gilshenan K, Welch L, Douglas C. The efficacy of haloperidol in the management of nausea and vomiting in patients with cancer. Journal of pain and symptom management. 2010;40(1):111-6.
23. Tuca A, Guell E, Martinez-Losada E, Codorniu N. Malignant bowel obstruction in advanced cancer patients: epidemiology, management, and factors influencing spontaneous resolution. Cancer Manag Res. 2012;4:159-69.
24. Romeo M, de Los LGM, Cuadra Urteaga JL, Vila L, Ahlal S, Indacochea A, et al. Outcome prognostic factors in inoperable malignant bowel obstruction. Supportive care in cancer : official journal of the Multinational Association of Supportive Care in Cancer. 2016;24(11):4577-86.
25. Walsh D, Davis M, Ripamonti C, Bruera E, Davies A, Molassiotis A. 2016 Updated MASCC/ESMO consensus recommendations: Management of nausea and vomiting in advanced cancer. Supportive care in cancer : official journal of the Multinational Association of Supportive Care in Cancer. 2017;25(1):333-40.
26. Radbruch L, Strasser F, Elsner F, Goncalves JF, Loge J, Kaasa S, et al. Fatigue in palliative care patients — an EAPC approach. Palliative medicine. 2008;22(1):13-32.
27. Cramp F, Byron-Daniel J. Exercise for the management of cancer-related fatigue in adults. The Cochrane database of systematic reviews. 2012;11:CD006145.
28. Laviano A, Meguid MM, Rossi-Fanelli F. Cancer anorexia: clinical implications, pathogenesis, and therapeutic strategies. The lancet oncology. 2003;4(11):686-94.
29. Collins PF, Elia M, Stratton RJ. Nutritional support and functional capacity in chronic obstructive pulmonary disease: a systematic review and meta-analysis. Respirology. 2013;18(4):616-29.
30. Tuca A, Jimenez-Fonseca P, Gascon P. Clinical evaluation and optimal management of cancer cachexia. Critical reviews in oncology/hematology. 2013;88(3):625-36.
31. Theobald D, Kirsh K, Holtsclaw E, Donaghy K, Passik S. An open-label, crossover trial of mirtazapine (15 and 30 mg) in cancer patients with pain and other distressing symptoms. Journal of Pain and Symptom Management. 2002 May;23(5):442-7.
32. Strasser F, Luftner D, Possinger K, Ernst G, Ruhstaller T, Meissner W et al. Comparison of orally administered cannabis extract and delta-9-tetrahydrocannabinol in treating patients with cancer-related anorexia-cachexia syndrome: a multicenter, phase III, randomized, double-blind, placebo-controlled clinical trial from the Cannabis-In-Cachexia-Study-Group. Journal of Clinical Oncology. 2006 Jul 20;24(21):3394-400.
33. Hosie A, Davidson PM, Agar M, Sanderson CR, Phillips J. Delirium prevalence, incidence, and implications for screening in specialist palliative care inpatient settings: a systematic review. Palliative medicine. 2013;27(6):486-98.
34. Agar MR, Lawlor PG, Quinn S, Draper B, Caplan GA, Rowett D, et al. Efficacy of Oral Risperidone, Haloperidol, or Placebo for Symptoms of Delirium Among Patients in Palliative Care: A Randomized Clinical Trial. JAMA internal medicine. 2017;177(1):34-42.
35. Campbell ML, Yarandi HN. Death rattle is not associated with patient respiratory distress: is pharmacologic treatment indicated? Journal of palliative medicine. 2013;16(10):1255-9.
36. Lokker ME, van Zuylen L, van der Rijt CC, van der Heide A. Prevalence, impact, and treatment of death rattle: a systematic review. Journal of pain and symptom management. 2014;47(1):105-22.
der informierte @rzt
- Vol. 11
- Ausgabe 6
- Juni 2021