- Kritische Punkte bei der Diagnostik des Eisenmangels
Eisen ist das vierthäufigste Element der Erdkruste, das in vielen Nahrungsmitteln ausreichend vorhanden ist. Dennoch ist Eisenmangel die häufigste Mangelerkrankung, an der weltweit zwei Milliarden Menschen leiden (1). Dabei ist Eisen für alle Zellen lebenswichtig. Dessen Mangel führt nicht nur zu einer Beeinträchtigung der Hämproduktion, sondern hat Auswirkung auf den gesamten Organismus und ist die pathophysiologische Grundlage vieler klinischer Symptome. Warum ist der Eisenmangel dennoch so häufig? In diesem ersten Teil des Artikels werden die kritischen Punkte der Diagnostik eines Eisenmangels dargestellt, ein späterer zweiter Teil wird der Substitution gewidmet sein.
Natürlich stehen dabei die altbekannten physiologischen Ursachen wie Wachstum, Regelblutung und Schwangerschaft im Vordergrund, die durch pathologische Prozesse mit chronischem Blutverlust und nicht zuletzt durch Diäten, Mangel- und Fehlernährung verstärkt werden. Angesichts der zahlreichen Faktoren, die zu einer negativen Eisenbilanz beitragen können, kann man den häufigen Eisenmangel in den Entwicklungsländern sicher verstehen. In den Industrieländern, wo genügend Nahrungsmittel, Medikamente und ein dichtes Netz medizinischer Versorgung zur Verfügung stehen, ist dessen hohe Prävalenz nicht wirklich zu verstehen und schon gar nicht zu rechtfertigen. Hier sollte es möglich sein, den Eisenstatus der Bevölkerung zuverlässig zu erfassen und bedarfsorientiert zu therapieren. Offensichtlich sind die diagnostischen und therapeutischen Massnahmen jedoch zumindest suboptimal und verbesserungswürdig.
Diagnostik
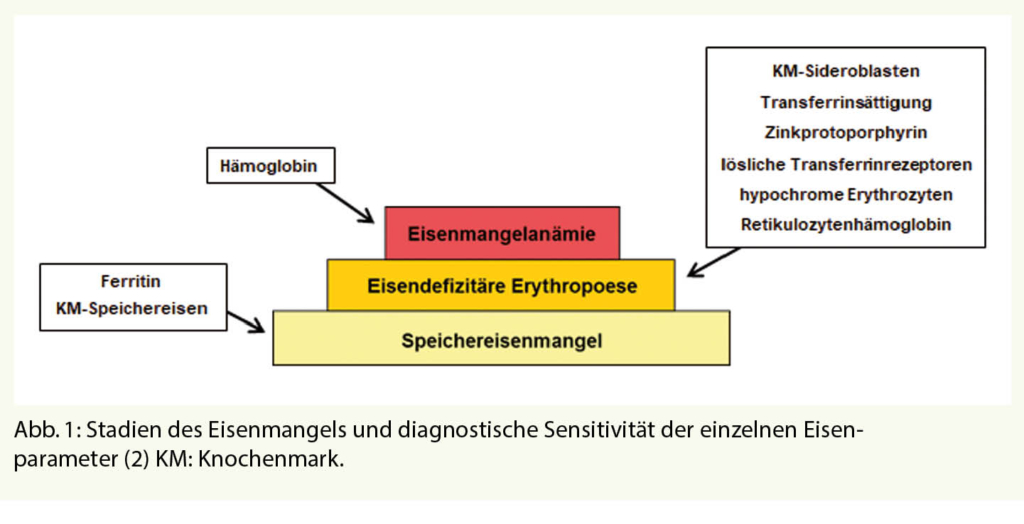
Die Grundlage einer optimalen bedarfsorientierten Therapie des Eisenmangels ist eine zuverlässige Beurteilung des Eisenstatus des Patienten. Dabei muss man sich zunächst klarmachen, dass der Eisenmangel ein dynamischer Prozess ist, der in unterschiedlicher klinischer Ausprägung vorliegen kann (Abb. 1). Eine negative Eisenbilanz führt zunächst zu einem Speichereisenmangel (Stadium I), der zumindest aus hämatologischer Sicht lediglich einen Schönheitsfehler ohne klinische Relevanz darstellt. Die Eisenspeicher sind zwar reduziert, die Erythropoese wird jedoch noch genügend mit Eisen versorgt. Klinisch relevant wird der Eisenmangel erst im Stadium der eisendefizitären Erythropoese (Stadium II), wenn die erythropoetischen Vorstufen im Knochenmark nicht mehr optimal mit Eisen versorgt werden. Bei Absinken des Hämoglobinwertes unter die Normgrenze liegt schliesslich ein Stadium III, die Eisenmangelanämie vor.
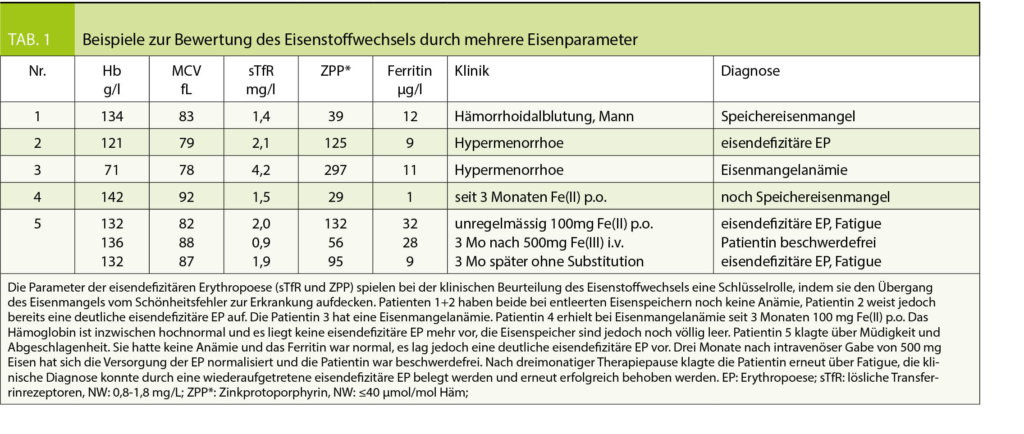
Bei der Interpretation der verschiedenen «Eisentests» ist es wichtig zu wissen, dass sie in Sachen Eisenmangel Unterschiedliches aussagen, indem sie verschiedene Stadien erfassen (Abb. 1). Ferritin ist ein Spiegel der Eisenspeicher, sagt jedoch überhaupt nichts über die Versorgung der Erythropoese aus. Dafür müssen andere Parameter eingesetzt werden. Dazu gehören das Zinkprotoporphyrin (ZPP), die löslichen Transferrinrezeptoren (sTfR), die hypochromen Erythrozyten (HYPO) und das Retikulozytenhämoglobin (CHr). Einen indirekten Hinweis auf eine eisendefizitäre Erythropoese liefert eine erniedrigte Transferrinsättigung von ≤ 15%. Die Hämoglobinbestimmung wird schliesslich benötigt, um den Hämoglobinabfall unter die untere WHO-Normgrenze (Frauen: 120 g/l, Männer: 130 g/l) zu beweisen und dadurch den höchsten Schweregrad des Eisenmangels, die Eisenmangelanämie zu diagnostizieren. Durch Bestimmung von mehreren Parametern die sich sinnvoll ergänzen ist es möglich, den Eisenstatus einer Person genau zu charakterisieren und die klinische Relevanz einzuschätzen (Tab. 1).
Welchen Test sollte man in der täglichen Routine als Screeningparameter des Eisenstoffwechsels verwenden? Die WHO empfiehlt diesbezüglich die Bestimmung von Ferritin im Serum. Das ist von der Theorie her sicher richtig, denn Ferritin ist der einzige Laborparameter, der die Eisenspeicher widerspiegelt und somit den Eisenmangel bereits im Anfangsstadium erfasst. Ein Serumferritin <15 µg/l gilt als beweisend für einen Speichereisenmangel, höhere Werte werden als normal angesehen solange sie die Obergrenze nicht überschreiten, die nach WHO für Frauen bei 150 µg/l und für Männer bei 200 µg/l liegt. Diese Normwerte basieren jedoch auf epidemiologischen Untersuchungen und spiegeln lediglich den durchschnittlichen Eisengehalt der Eisenspeicher der jeweiligen Bevölkerung wider, haben also nichts mit einem Idealwert zu tun. Wenn heutzutage die meisten Jugendlichen übergewichtig sind, ist es zwar normal, aber noch lange nicht gut. Angesichts der Tatsache, dass eine Schwangerschaft einen Netto-Mehrbedarf von etwa 500 mg Eisen bedeutet, wäre zumindest bei Frauen im gebärfähigen Alter ein Ferritinwert von mindestens 50 µg/l (50 µg Ferritin ≈ 500 mg Speichereisen) als Startkapital wünschenswert. Die Bedeutung von Ferritin als Screeningparameter des Eisenstoffwechsels wird in der täglichen Routine durch seine Eigenschaft als Akut-Phase-Protein stark eingeschränkt. Entzündliche Erkrankungen, Neoplasien, aber auch Lebererkrankungen bewirken eine Erhöhung des Ferritinspiegels im Serum, wodurch ein bestehender Eisenmangel häufig maskiert wird. So wurden zum Beispiel bei Patienten mit hämatologischen und soliden Neoplasien trotz vorliegender Eisenmangelanämie in 25% Ferritinwerte >100 µg/l, bei weiteren 25% sogar > 800 µg/l gemessen (3). Damit ist Ferritin eigentlich nur bei anderweitig gesunden Personen anwendbar.
Aus klinischer Sicht ist es auch nicht wirklich interessant, ob die Eisenspeicher des Patienten voll oder nur halbvoll sind. Der Kliniker möchte wissen, ob die vorliegende Anämie bzw. die aktuellen Beschwerden des Patienten durch einen Eisenmangel bedingt sind, oder nicht. In diesem Zusammenhang sind Laborparameter interessant, die die Eisenversorgung der Erythropoese überwachen und eine eisendefizitäre Erythropoese diagnostizieren können. Von diesen Parametern (Abb. 1) wird meist die Transferrinsättigung empfohlen, für Patienten mit renaler Anämie unter Behandlung mit Erythropoese-stimulierenden Substanzen (ESA) die hypochromen Erythrozyten (HYPO). Der aus unserer Sicht diagnostisch wertvollste Parameter der eisendefizitären Erythropoese ist die Bestimmung des intraerythrozytären Zinkprotoporphyrin (ZPP) (4). Das ZPP entsteht bei ungenügender Versorgung der erythropoetischen Vorstufen alternativ zu Häm, indem Zink statt Eisen in das Protoporphyrin IX eingebaut wird (5). Dabei werden zwangsläufig alle Störungen des Eisenstoffwechsels erfasst, nicht nur der echte Eisenmangel. Falsch erhöhte Werte werden dagegen nur bei der sehr seltenen kongenitalen erythropoetischen Porphyrie gemessen. Durch die Bestimmung des ZPP bekommt der Kliniker auf die Frage: «Hat die Anämie irgendetwas mit Eisen zu tun?» eine klare Antwort: ja, bzw. nein. Normale Werte schliessen eine Störung des Eisenstoffwechsels (bis auf einen reinen Speichereisenmangel) aus. Erhöhte Werte beweisen eine eisendefizitäre Erythropoese und erlauben durch deren Quantifizierung auch eine Einschätzung der klinischen Bedeutung (Tab. 1).
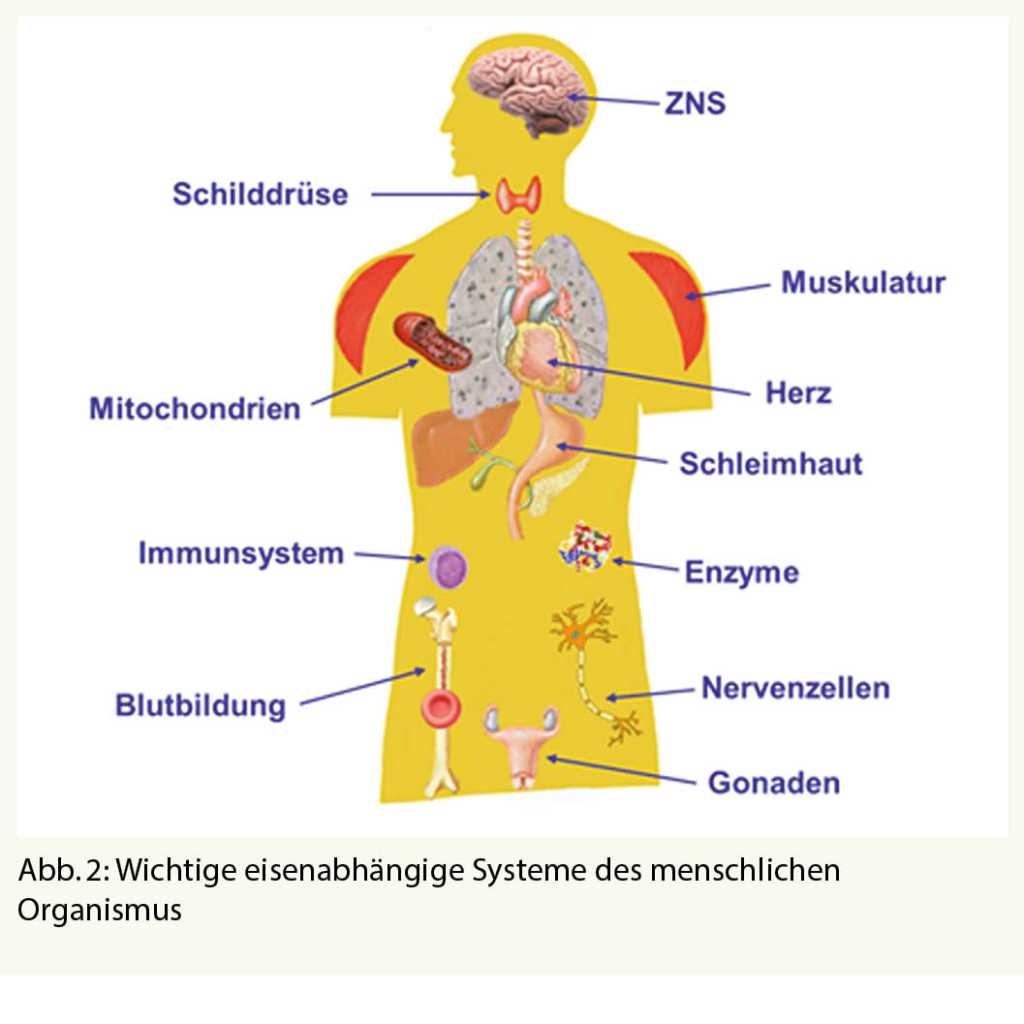
Natürlich ist diese Stadieneinteilung des Eisenmangels und Beurteilung des Eisenstatus sehr «erythropoeseorientiert». Das hängt einerseits damit zusammen, dass bei der Beurteilung des Eisenstoffwechsels die Knochenmarksuntersuchung historisch eine Schlüsselrolle gespielt hat. Es ist aber insbesondere auf die Tatsache zurückzuführen, dass es genug Parameter gibt, um die Eisenversorgung der Erythropoese, zumindest bei anderweitig gesunden Personen, zuverlässig beurteilen zu können. Im Unterschied dazu können wir die Versorgung der anderen eisenabhängigen Systeme des menschlichen Organismus (Abb. 2) nicht laborchemisch erfassen, sondern deren Minderversorgung bei entsprechenden klinischen Symptomen und deren Besserung auf Eisengabe nur vermuten. Aufgrund dieser klinischen Beobachtungen wurde in den letzten Jahren die Frage gestellt: Gibt es einen «Eisenmangel ohne Anämie?» Auf diese Frage gibt es eine eindeutige Antwort: natürlich, sogar zwei Stadien – den Speichereisenmangel und das Stadium der eisendefizitären Erythropoese. Dabei ist jedoch nicht klar, ob alle Zellen des menschlichen Organismus gleichzeitig in gleichem Ausmass vom Eisenmangel getroffen werden. Die hohe Transferrinrezeptordichte auf den roten Vorstufen weist darauf hin, dass die Erythropoese offensichtlich bevorzugt versorgt wird. Es gibt auch klinische Hinweise darauf, dass eisenmangelbedingte Symptome bereits zu einem Zeitpunkt auftreten können, zu dem die Erythropoese noch nicht eisendefizitär ist. Das beste Beispiel dafür ist das sogenannte Eisenmangelsyndrom (Iron-Deficiency-Syndrom, IDS), das bei niedrignormalen Eisenspeichern mit Ferritinwerten <50 µg/l überwiegend bei Frauen im Menstruationsalter auftritt, durch Erschöpfungszustände, Konzentrationsstörungen, depressive Verstimmung, Schlafstörungen und Kopfschmerzen charakterisiert ist und nach Eisengabe verschwindet. Auch die funktionelle Besserung einer Herzinsuffizienz, eines ADHS, oder eines Restless-Legs-Syndroms nach Eisengabe bei Patienten ohne Anämie deutet darauf hin, dass nicht alle Systeme des menschlichen Organismus hinsichtlich der Eisenversorgung einen so hohen Stellenwert haben wie die Erythropoese, die in der Mangelsituation möglicherweise zu Lasten anderer Organsysteme bevorzugt mit Eisen versorgt wird. Angesichts dieser Überlegungen ist es nicht ganz ausgeschlossen, dass der Ausschluss einer eisendefizitären Erythropoese (vorzugsweise durch ein normales ZPP) zwar eine Minderversorgung der erythropoetischen Vorstufen, nicht jedoch eine Minderversorgung anderer Systeme ausschliesst. Erhöhte ZPP-Werte sind jedoch unabhängig von der Hämoglobinkonzentration und vom Ferritinwert ein eindeutiger Indikator einer ungenügenden Eisenversorgung, was in vielen Fällen eine ursächliche Klärung zunächst unklarer klinischer Symptomatik erlaubt und therapeutische Massnahmen erleichtert (Tab. 1, Patient 5).
Copyright bei Aerzteverlag medinfo AG
Universitätsklinikum Mannheim
Medizinische Klinik III
Hämatologie und Internistische Onkologie
Theodor-Kutzer-Ufer 1-3
D-68167 Mannheim
jan.hastka@umm.de
Universitätsklinikum Mannheim
Medizinische Klinik III
Hämatologie und Internistische Onkologie
Theodor-Kutzer-Ufer 1-3
D-68167 Mannheim
Die Autoren haben Vorträge für die Firma Vifor Pharma gehalten.
- Es gibt mehrere Stadien des Eisenmangels, die bei der klinischen Beurteilung berücksichtigt werden müssen: Speichereisenmangel, eisendefizitäre Erythropoese und Eisenmangelanämie.
- Um sich ein genaues Bild über den Eisenstatus machen zu können, sollte neben dem «Speicher-Marker» Ferritin auch ein Parameter der eisendefizitären Erythropoese untersucht werden.
- Serumferritin <15 µg/l gilt als beweisend für einen Speichereisenmangel. Klinische Symptome des Eisenmangels können jedoch auch bei höheren Werten auftreten.
1. McLean E, Cogswell M, Egli I, Wojdyla D, de Benoist B. Worldwide prevalence of anaemia, WHO Vitamin and Mineral Nutrition Information System, 1993-2005. Public health nutrition. 2009 Apr;12(4):444-54.
2. Hastka J, Metzgeroth G, Gattermann N. Eisenmangel und Eisenmangelanämie. Leitlinien der DGHO. Onkopedia 2019.
3. Aapro M, Osterborg A, Gascon P, Ludwig H, Beguin Y. Prevalence and management of cancer-related anaemia, iron deficiency and the specific role of i.v. iron. Annals of oncology : official journal of the European Society for Medical Oncology / ESMO. 2012 Aug;23(8):1954-62.
4. Hastka J, Metzgeroth G. Rationale Anämieabklärung. J Lab Med. 2015;39(5):273-89.
5. Labbe RF, Vreman HJ, Stevenson DK. Zinc protoporphyrin: A metabolite with a mission. Clinical chemistry. 1999 Dec;45(12):2060-72.
6. Anker SD, Comin Colet J, Filippatos G, Willenheimer R, Dickstein K, Drexler H, et al. Ferric carboxymaltose in patients with heart failure and iron deficiency. The New England journal of medicine. 2009 Dec 17;361(25):2436-48.
7. McMurray JJ, Adamopoulos S, Anker SD, Auricchio A, Bohm M, Dickstein K, et al. ESC guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association (HFA) of the ESC. Eur J Heart Fail. 2012 Aug;14(8):803-69.
8. Ganzoni AM. [Iron deficiency and iron deficiency anemia]. ZFA Zeitschrift fur Allgemeinmedizin. 1977 Apr 20;53(11):613-7.
9. Toblli JE, Cao G, Oliveri L, Angerosa M. Comparison of oxidative stress and inflammation induced by different intravenous iron sucrose similar preparations in a rat model. Inflamm Allergy Drug Targets. 2012 Feb;11(1):66-78.
10. Auerbach M, Ballard H. Clinical use of intravenous iron: administration, efficacy, and safety. Hematology / the Education Program of the American Society of Hematology American Society of Hematology Education Program. 2010;2010:338-47.
11. Bailie GR, Mason NA, Valaoras TG. Safety and tolerability of intravenous ferric carboxymaltose in patients with iron deficiency anemia. Hemodialysis international International Symposium on Home Hemodialysis. 2010 Jan;14(1):47-54.
12. Chertow GM, Mason PD, Vaage-Nilsen O, Ahlmen J. Update on adverse drug events associated with parenteral iron. Nephrology, dialysis, transplantation : official publication of the European Dialysis and Transplant Association – European Renal Association. 2006 Feb;21(2):378-82.
13. Keating GM. Ferric carboxymaltose: a review of its use in iron deficiency. Drugs. 2015 Jan;75(1):101-27.
der informierte @rzt
- Vol. 10
- Ausgabe 9
- September 2020