- Medikamentöse Therapie der Adipositas
Adipositas ist weltweit zu einem relevanten Gesundheitsproblem geworden. Konservative Therapien, welche auf eine Verbesserung des Lebensstils abzielen, zeigen nur einen sehr begrenzten Erfolg. Die bariatrische Chirurgie ist deutlich effektiver, jedoch aufgrund ihrer Nebenwirkungen nur sehr adipösen Personen vorbehalten. Können Medikamente hier helfen? Dieser Artikel gibt eine Übersicht über den aktuellen Stand von Medikamenten zur Behandlung der Adipositas.
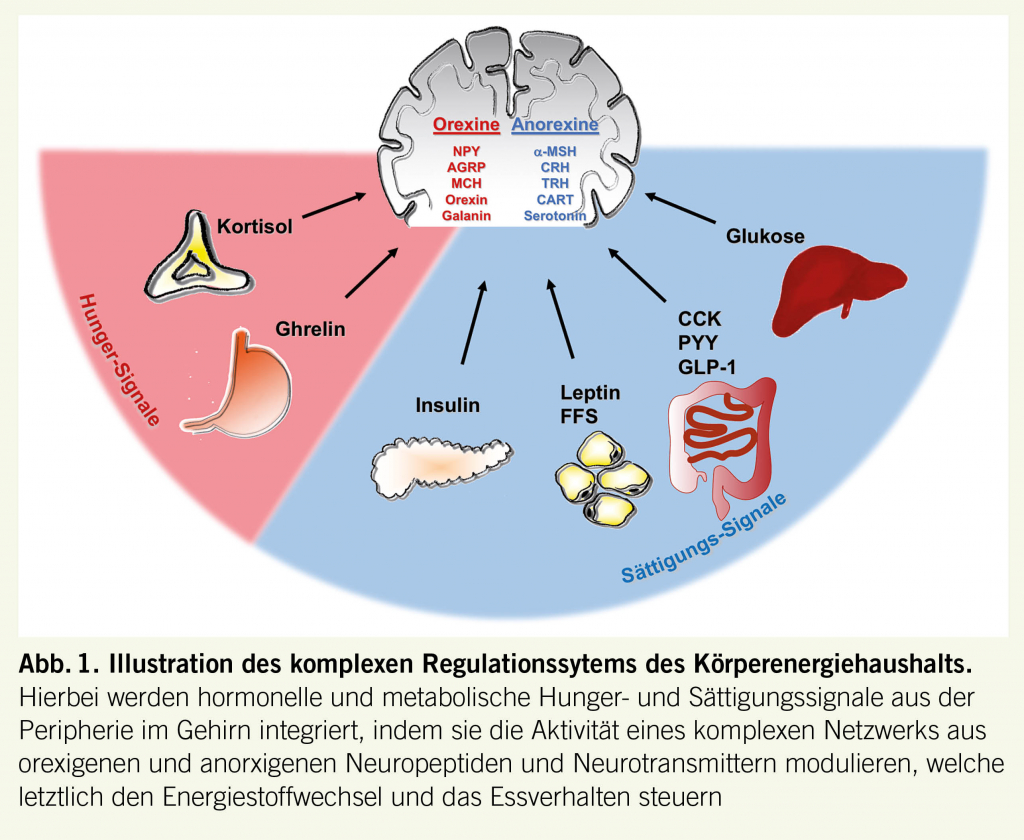
Adipositas entsteht durch eine über einen längeren Zeitraum anhaltende positive Energiebilanz, das heisst, der Köper nimmt mehr Energie auf als er verbraucht. Neben der körperlichen Aktivität ist dabei die Nahrungsaufnahme und somit das Essverhalten ein wesentlicher Faktor. Es gibt viele wissenschaftliche Belege dafür, dass der Körperenergiestatus und damit das Körpergewicht einer komplexen, neuroendokrinen Regulation unterliegen. Dabei geben viele periphere, hormonelle Signale wie z.B. das Adipokin Leptin aus dem Fettgewebe oder gastrointestinale Peptidhormone wie Ghrelin und Glucagon-like peptide-1 (GLP-1) Rückmeldung an das Gehirn über den aktuellen und längerfristigen Energiestatus. Angriffspunkte dieser Signale im Gehirn sind der Hirnstamm sowie der Hypothalamus, welche durch ein Netzwerk von spezifischen Neuronen über die Freisetzung von orexigenen und anorexigenen Neuropeptiden sowie Neurotransmittern die homöostatische Regulation bewerkstelligen und Gefühle von Hunger und Sättigung steuern (Abb. 1). Ebenfalls integriert werden hier metabolische Signale wie Glukose oder freie Fettsäuren (FFS). In den letzten Jahren hat man zudem herausgefunden, dass die genannten peripheren Signale auch die neuronale Aktivität mesolimbischer Hirnstrukturen, so genannte Belohnungszentren, modulieren und dadurch die hedonische Regulation des Essverhaltens stark beeinflussen. Interessant ist, dass bei adipösen Personen viele funktionelle Veränderungen auf verschiedenen Ebenen dieses komplexen Regulationssystems nachweisbar sind. Vor diesem Hintergrund wundert es nicht, dass fast alle, der neuen Medikamente gegen Adipositas direkt oder indirekt einen zentralnervösen Angriffspunkt haben und durch eine Beeinflussung des Regulationssystems Hunger und Appetit reduzieren.
Adipositas-Medikamente – eine Geschichte der Hoffnungen und Enttäuschungen
In den letzten 30 Jahren sind viele Medikamente zur Gewichtsreduktion nach positiven Zulassungsstudien auf den Markt gekommen, um dann einige Jahre später aufgrund von Nebenwirkungen wieder zurückgezogen zu werden. Beispiele hierfür sind die Amphetamine Fenfluramin and Dexfluramin, welche durch vermehrte Freisetzung von Serotonin leider nicht nur den Appetit reduzieren, sondern auch die Entstehung von Herzklappenerkrankungen und pulmonale Hypertonie begünstigen. Nach dieser negativen Erfahrung Ende der 90er Jahre wurde 1999 Sibutramin (Reductil®), ein Serotonin und Noradrenalin Wiederaufnahmehemmer, von der europäischen Zulassungsbehörde (EMA) zur Gewichtsreduktion zugelassen, um dann 2010 aufgrund einer erhöhten Inzidenz von kardiovaskulären Ereignissen wieder zurückgezogen zu werden. Weiter ging es mit dem Endocannabinoid Rezeptor Blocker Rimonabant (Acomplia®), welcher 2006 von der EMA zugelassen wurde. Bereits 2008 zeigte sich, dass die Substanz, welche die neuronale Aktivität von Belohnungszentren beeinflusst, zu vermehrten Depressionen und Suiziden führt und somit vom Markt genommen werden musste.
Für neue Medikamente hohe Hürden zu nehmen
Vor dem Hintergrund dieser negativen Erfahrungen wurden die Hürden für eine Zulassung von Medikamenten gegen Adipositas von den verantwortlichen Behörden deutlich erhöht (1). So müssen die Medikamente eine Wirksamkeit von einem Gewichtsverlust von mindestens 5% nach einem Jahr aufweisen und es müssen grosse kardiovaskuläre Sicherheitsstudien durchgeführt werden. Bei serotoninergen Substanzen werden zudem, zumindest in Subkollektiven, Echokardiographien zur Detektion von Herzklappenvitien und pulmonalvenösen Druckerhöhungen gefordert und es wird in allen Studien gezielt nach psychiatrischen Komplikationen gesucht.
Offensichtlich gibt es deutliche Unterschiede in der Einschätzung des Nutzen/Risiko Verhältnisses bei einzelnen Substanzen zwischen der nordamerikanischen (FDA) und der europäischen (EMA) Zulassungsbehörde (2). So ist beispielsweise der spezifische Serotonin 2c Rezeptor Agonist Lorcaserin (Belviq®) in den USA zur Gewichtsreduktion zugelassen, während der Zulassungsantrag bei der EMA aufgrund von geringen Bewilligungschancen seitens der Herstellerfirma in 2013 zurückgezogen wurde.
Eine ähnliche Situation findet sich bei einem Kombinationspräparat bestehend aus Phentermin und Topiramat (Osymia®), welches in den USA zugelassen ist. Phentermin erhöht die Ausschüttung der Neurotransmitter Dopamin und Noradrenalin, während Topiramat den zentralnervösen AMPA Rezeptor blockiert. Letztere Substanz ist in Europa und in der Schweiz als Monotherapeutikum, auch in deutlich höheren Dosen, zur Behandlung von Epilepsie und Migräne zugelassen. Anträge des Herstellers auf Zulassung des Kombinationspräparats Phentermin/Topiramat zur Gewichtsreduktion sind aufgrund von primär psychiatrischen Nebenwirkungen von der EMA bereits zweimal (2012 und 2013) abgelehnt worden.
Anders verhält es sich mit einem Kombinationspräparat aus Naltrexon und Bupropion. Unter dem Handelsnamen Mysimba® ist das Präparat 2015 von der EMA zur Gewichtsreduktion bei Adipositas (ab einem BMI von 30 kg/m2) zugelassen worden. In den USA wird es unter dem Namen Contrave® vertrieben. In der Schweiz ist das Präparat bislang nicht verfügbar und nicht von der Swissmedic zugelassen. In Deutschland ist es seit 2018 auf dem Markt. Bupropion wird in der Schweiz als Monopräparat zur Rauchentwöhnung (Handelsname Zyban®) und als Antidepressivum (Handelsname Wellbutrin®) eingesetzt. Das Kombinationspräparat enthält in einer Tablette 7.2 mg Naltrexon und 78 mg Bupropion (als Reinsubstanz) und wird zu Beginn der Behandlung in der Dosierung, je nach Verträglichkeit, langsam von einer bis auf 4 Tabletten pro Tag gesteigert. Naltrexon ist ein Opioid Rezeptor Antagonist, während Bupropion als Dopamin und Noradrenalin Wiederaufnahme-Hemmer wirkt. Die Kombination beider Substanzen vermindert den Appetit, indem es im Nucleus arcuatus des Hypothalamus Proopiomelanocortin (POMC)-Neuronen stimuliert, die dann das anorexigene alpha-Melanozytenstimulierende Hormon (α-MSH) freisetzen. In einer grossen randomisierten Plazebo-kontrollierten Studie, welche 1 742 übergewichtige und adipöse Patienten einschloss, wurde gegenüber der Plazebogruppe über ein Jahr ein zusätzlicher Gewichtsverlust von knapp 5% des Ausgangsgewichts beobachtet (3). Als häufigste Nebenwirkungen wurde Übelkeit von etwa 30% der Patienten berichtet. Man darf gespannt sein, ob das Präparat auch auf den Schweizer Markt kommen wird und ob es sich ggf. in der Praxis bewähren wird. Aufgrund der fehlenden Kostenerstattung seitens der Krankenkassen scheint es in Deutschland bislang noch wenig eingesetzt zu werden, so dass die klinischen Erfahrungen sehr begrenzt sind.
Orlistat – immer noch da
Die einzige Substanz, welche sich seit mehr als 20 Jahren auf dem Markt hält, ist Orlistat. Als Lipase-Hemmer ist es das Einzige der genannten Medikamente, welches nicht am Gehirn angreift, sondern im Darm die Fettdigestion und -absorption hemmt. Die dadurch oft entstehende, unangenehme Steatorrhoe und der meist eher moderate gewichtsreduzierende Effekt von durchschnittlich etwa 4% des Ausgangsgewichts (im Vergleich zu einer Plazebo-Behandlung mit gleichartiger diätetischer Therapie) mag erklären, warum das Medikament nur relativ selten eingesetzt wird (4). Erwähnenswert ist jedoch, dass es ab einen BMI von 35 kg/m2 sowie bei Patienten mit Typ 2 Diabetes ab einem BMI von 28 kg/m2 auf Antrag von den Krankenkassen in der Schweiz für einen Zeitraum von maximal 2 Jahren finanziert wird. Voraussetzung für die 2-jährige Kostenübernahme ist gemäss Spezialitätenliste BAG (SL) jedoch, dass der erzielte Gewichtsverlust nach 6 Monaten mindestens 10% beträgt oder bei Patienten mit Diabetes mindestens 5 kg oder eine HbA1c Senkung um 0.5% erzielt wurde (5). Das Medikament wird mittlerweile von vielen Generikaherstellern angeboten und ist auch bei regulärer Einnahme von 3 Tabletten pro Tag (jeweils vor den Hauptmahlzeiten) mit Tagestherapiekosten von 2.85 SFr. recht günstig.
Liraglutid – schon da, aber noch nicht ganz
Liraglutid ist ein Peptid, welches dem körpereigenen Darmhormon GLP-1 sehr ähnlich ist und über eine agonistische Wirkung an dessen Rezeptor wirkt. Aufgrund seines positiven Einflusses auf den Glukosestoffwechsel ist das Medikament unter dem Handelsnamen Victoza® bereits seit fast 10 Jahren in der Schweiz bis zu einer Dosis von 1.8 mg pro Tag als s.c. Injektion zur Behandlung des Typ 2 Diabetes zugelassen. Daneben reduziert Liraglutid dosis-
abhängig das Körpergewicht (6-7), was primär auf seine Appetit-reduzierende Wirkung zurückgeführt wird. Nicht ganz klar ist, ob diese Wirkung allein über einen Einfluss auf afferente Fasern des N. vagus vermittelt wird oder das Peptid auch über die Blut-Hirn-Schranke gelangt und direkt zentralnervöse GLP-1 Rezeptoren stimuliert (8-9). Unabhängig davon haben funktionelle MRI Untersuchungen gezeigt, dass Liraglutid nach peripherer Applikation die neuronale Verarbeitung von visuellen Nahrungsreizen im Gehirn beeinflusst (9-10).
Unter dem Handelsnahmen Saxenda® ist Liraglutid in der Schweiz seit Ende 2016 bis zu einer Dosis von 3 mg pro Tag zur Behandlung der Adipositas zugelassen. Klinische Studien hatten zuvor gezeigt, dass Liraglutid auch bei übergewichtigen Patienten ohne Diabetes das Körpergewicht senkt, ohne dabei Hypoglykämien zu induzieren. Konkret zeigte eine randomisierte Plazebo-kontrollierte Studie, welche 3 731 übergewichtige Personen ohne Diabetes einschloss, dass Liraglutid bei einer maximalen Tagesdosis von 3.0 mg über ein Jahr das Körpergewicht um etwa 5.4% des Ausgangsgewichts mehr reduziert als eine Plazebo-Behandlung (11). Wie üblich erhielten beide Studiengruppen während der Studie eine begleitende Lebensstil-Beratung. Eine anschliessende Subgruppenstudie, welche 2 254 übergewichtige Personen mit Prädiabetes einschloss, zeigte, dass auch noch nach 3-jähriger Behandlung mit Liraglutid ein Gewichtsverlust von 4.3% gegenüber Plazebo nachweissbar war (12). Zudem wurde die Inzidenz von Diabetes um etwa 79% über diesen Zeitraum reduziert.
Gastrointestinale Nebenwirkungen wie insbesondere Übelkeit treten sehr häufig unter Liraglutid auf (40% vs. 15% im Plazebo-Arm während ein Jahr Behandlung), sind jedoch meist Dosis-abhängig und nur von passagerer Natur. Daher titriert man üblicherweise die Dosis in 0.6 mg Schritten pro Woche langsam bis auf maximal 3 mg auf. Gallenblasensteine (0.8% vs. 0.4%) mit damit assoziierten Komplikationen (0.5% vs. 0%) und Pankreatitiden (0.2% vs. 0%) treten unter Liraglutid zwar selten aber dennoch vermehrt auf (11). Zur kardiovaskulären Sicherheit von Liraglutid kann, bezogen auf die 3 mg Dosis, bislang noch keine definitive Aussage gemacht werden. Die grosse LEADER Studie, in welcher 9 340 Typ 2 Diabetes Patienten mit 1.8 mg Liraglutid oder Plazebo behandelt wurden, zeigte jedoch eine Reduktion der kardiovaskulären Ereignisse um 13% sowie der kardiovaskulären Mortalität um 22% und der Gesamtmortalität von 15% unter der Liraglutid Therapie (13), was sehr ermutigend ist.
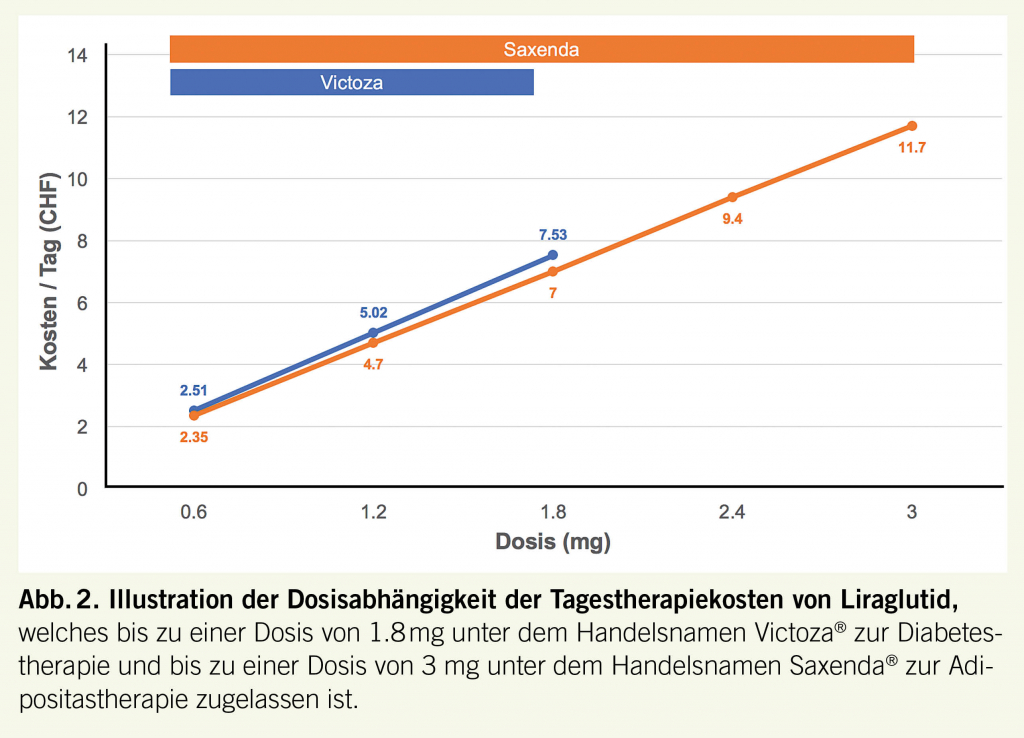
Obgleich von der Swissmedic zur Adipositasbehandlung zugelassen, wurde Liraglutid für diese Indikation bislang noch nicht in die SL aufgenommen. Daher wird z.Zt. eine Behandlung mit Saxenda® von der Grundversicherung nicht bezahlt. Ein Problem ist dabei, dass die Preisgestaltung des Präparats linear dosisabhängig ist und der Preis durch das sich auf dem Markt etablierte Präparat Victoza® zur Diabetestherapie, welches ebenfalls Liraglutid enthält, gesetzt und damit sehr teuer ist (Abb. 2).
Medikamente wirken nur so lange, wie man sie nimmt
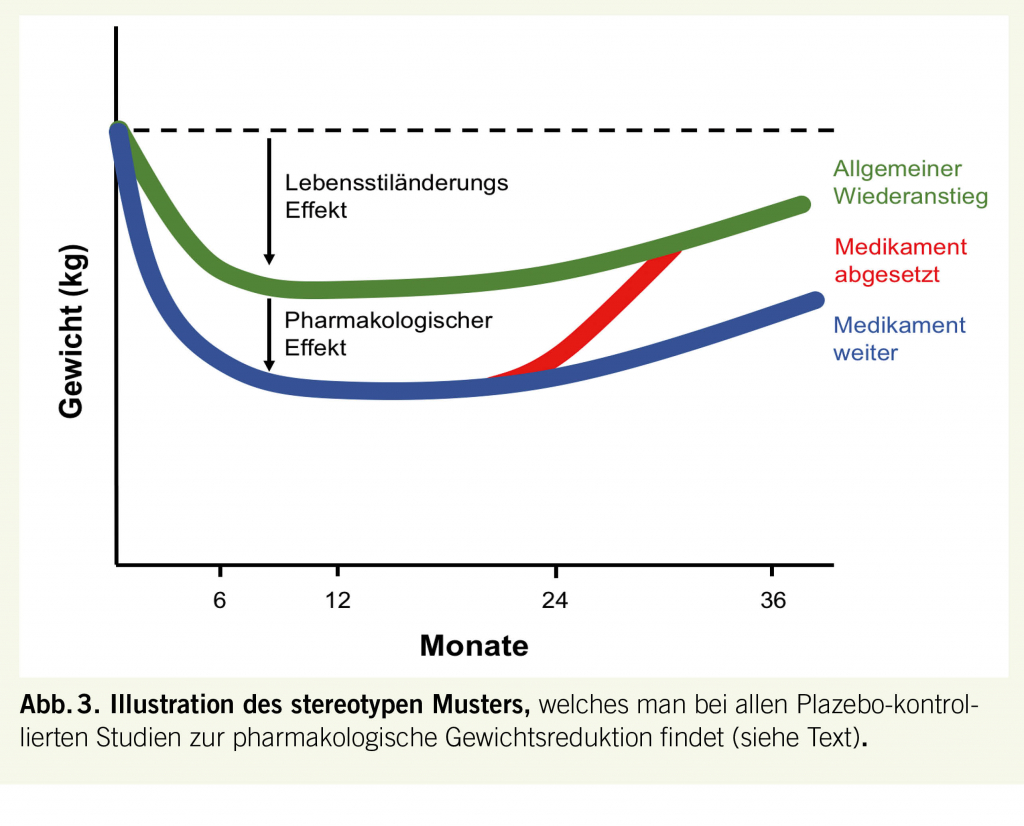
Wie bei anderen chronischen metabolischen Erkrankungen, wie beispielsweise Diabetes, Hypertonie oder Dyslipidämie, wirken entsprechende Medikamente nur solange man sie einnimmt. So zeigen alle Studien zur pharmakologischen Adipositastherapie Substanz-unabhängig konsistent ein ähnliches Muster (Abb. 3). Eine Lebensstiloptimierung führt zu einer Gewichtsreduktion über 6-9 Monaten, danach kommt es zu einem Stillstand und langfristig meist zu einem Wiederanstieg des Gewichts. Die medikamentöse Behandlung bewirkt eine zusätzliche Gewichtsreduktion, welche sich ebenfalls innerhalb der ersten 6-9 Monate etabliert. Danach ist der Gewichtsreduktionseffekt meist erschöpft und das Medikament wird nur noch zum Erhalt des reduzierten Gewichtsniveaus weiter eingesetzt. Setzt man es hingegen ab, kommt es zügig zu einem Wiederanstieg des Gewichts; eine Beobachtung, welche eindrücklich die Effektivität des Regulationssystems und die Chronizität der Erkrankung Adipositas demonstriert. Dies impliziert eine medikamentöse Dauerbehandlung, was die Überprüfung der Sicherheit der verschiedenen Medikamente im Langzeitverlauf unabdingbar macht.
Stoffwechselzentrum St. Gallen, friendlyDocs AG
Lerchentalstrasse 21
9016 St. Gallen
stoffwechselzentrum@friendlydocs.ch
Der Autor hat an nationalen advisory boards der Firma NovoNordisk, welche das Medikament Liraglutid herstellt, teilgenommen.
- Adipositas resultiert aus einer zentralnervösen Regulationsstörung und ist eine chronische Erkrankung.
- Der Nachweis eines positiven Nutzen/Risiko Verhältnisses ist bei Medikamenten gegen Adipositas schwierig. Viele Medikamentenentwicklungen sind hieran bereits gescheitert.
- Orlistat und Liraglutid sind die einzigen in der Schweiz zugelassen Medikament zur Gewichtreduktion, wobei Liraglutid z. Zt. noch nicht von den Krankenkassen für die Adipositasbehandlung bezahlt wird.
Literatur:
1. Bessesen DH, Van Gaal LF. Progress and challenges in anti-obesity pharmacotherapy. Lancet Diabetes Endocrinol 2018;6(3):237-248.
2. Schultes B. Pharmacological interventions against Obesity: Current status and future directions. Visc Med 2016;32(5):347-351.
3. Greenway FL, Fujioka K, Plodkowski RA, Mudaliar S, Guttadauria M, Erickson J, Kim DD, Dunayevich E: Effect of naltrexone plus bupropion on weight loss in overweight and obese adults (COR-I): a multicentre, randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 2010;376(9741):595-605.
4. Sjöström L, Rissanen A, Andersen T, Boldrin M, Golay A, Koppeschaar HP, Krempf M. Randomised placebo-controlled trial of orlistat for weight loss and prevention of weight regain in obese patients. European Multicentre Orlistat Study Group. Lancet 1998;352(9123):167-172.
5. Spezialitätenliste des BAG: http://www.spezialitätenliste.ch; 14.01.2019
6. Astrup A, Rossner S, Van Gaal L, Rissanen A, Niskanen L, Al Hakim M, Madsen J, Rasmussen MF, Lean ME: Effects of liraglutide in the treatment of obesity: a randomised, double-blind, placebo-controlled study. Lancet 2009;374(9701):1606-1616.
7. Davies MJ, Bergenstal R, Bode B, Kushner RF, Lewin A, Skjoth TV, Andreasen AH, Jensen CB, DeFronzo RA: Efficacy of Liraglutide for Weight Loss Among Patients With Type 2 Diabetes: The SCALE Diabetes Randomized Clinical Trial. JAMA 2015;314(7):687-699.
8. Ten Kulve JS, van Bloemendaal L, Balesar R, RG IJ, Swaab DF, Diamant M, la Fleur SE, Alkemade A: Decreased Hypothalamic Glucagon-Like Peptide-1 Receptor Expression in Type 2 Diabetes Patients. JCEM 2016;101(5):2122-2129.
9. Farr OM, Sofopoulos M, Tsoukas MA, Dincer F, Thakkar B, Sahin-Efe A, Filippaios A, Bowers J, Srnka A, Gavrieli A, Ko BJ, Liakou C, Kanyuch N, Tseleni-Balafouta S, Mantzoros CS: GLP-1 receptors exist in the parietal cortex, hypothalamus and medulla of human brains and the GLP-1 analogue liraglutide alters brain activity related to highly desirable food cues in individuals with diabetes: a crossover, randomised, placebo-controlled trial. Diabetologia 2016;59(5):954-965.
10. Ten Kulve JS, Veltman DJ, van Bloemendaal L, Barkhof F, Drent ML, Diamant M, RG IJ: Liraglutide Reduces CNS Activation in Response to Visual Food Cues Only After Short-term Treatment in Patients With Type 2 Diabetes. Diabetes care 2016;39(2):214-221.
11. Pi-Sunyer X, Astrup A, Fujioka K, Greenway F, Halpern A, Krempf M, Lau DC, le Roux CW, Violante Ortiz R, Jensen CB, Wilding JP; SCALE Obesity and Prediabetes NN8022-1839 Study Group. A randomized, controlled Trial of 3.0 mg of Liraglutide in weight management. N Engl J Med 2015;373(1):11-22.
12. le Roux CW, Astrup A, Fujioka K, Greenway F, Lau DCW, Van Gaal L, Ortiz RV, Wilding JPH, Skjøth TV, Manning LS, Pi-Sunyer X; SCALE Obesity Prediabetes NN8022-1839 Study Group. 3 years of liraglutide versus placebo for type 2 diabetes risk reduction and weight management in individuals with prediabetes: a randomised, double-blind trial. Lancet 2017;389(10077):1399-1409.
13. Marso SP, Daniels GH, Brown-Frandsen K, Kristensen P, Mann JF, Nauck MA, Nissen SE, Pocock S, Poulter NR, Ravn LS, Steinberg WM, Stockner M, Zinman B, Bergenstal RM, Buse JB: Liraglutide and Cardiovascular Outcomes in Type 2 Diabetes. NEJM 2016;375(4):311-322.
der informierte @rzt
- Vol. 9
- Ausgabe 1
- Januar 2019