- Medikamentöse Therapie der chronischen Herzinsuffizienz
Die medikamentöse Therapie der chronischen Herzinsuffizienz hat sich in den letzten Jahren durch den Miteinbezug neuer Medikamenten-Klassen in die Behandlungsrichtlinien stark weiterentwickelt. Der vorliegende Artikel fasst die aktuellen Empfehlungen kurz zusammen und geht insbesondere auf neue Studienergebnisse seit der Veröffentlichung der aktuellen Herzinsuffizienz-Leitlinien der europäischen Gesellschaft für Kardiologie (ESC) von 2016 näher ein (1).
Die medikamentöse Therapie der Herzinsuffizienz hängt nach wie vor entscheidend von der linksventrikulären Auswurffraktion (left ventricular ejection fraction, LVEF) ab, auch wenn wir wissen, dass die LVEF kein perfektes Mass für die systolische linksventrikuläre Funktion ist.
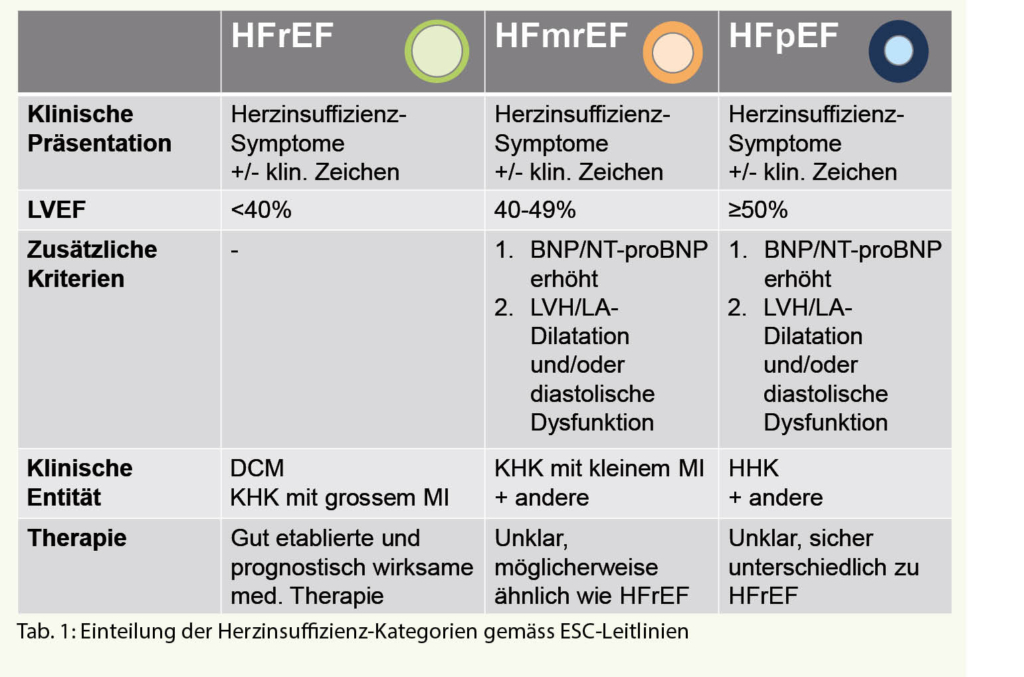
Gemäss den aktuellen ESC-Leitlinien werden gemäss LVEF drei Herzinsuffizienz-Kategorien unterschieden (Tab. 1): 1) Herzinsuffizienz mit reduzierter LVEF <40% (Heart Failure with reduced Ejection Fraction, HFrEF), 2) Herzinsuffizienz mit erhaltener LVEF (LVEF ≥50%; Heart Failure with preserved Ejection Fraction, HFpEF), und 3) eine seit 2016 definierte Zwischenkategorie der Herzinsuffizienz mit mässig eingeschränkter LVEF (LVEF 40-49%; Heart Failure with mid-range Ejection Fraction, HFmrEF). Im vorliegenden Artikel werden die Neuigkeiten der medikamentösen Therapie in Bezug auf die verschiedenen Herzinsuffizienz-Kategorien getrennt dargestellt.
Herzinsuffizienz mit reduzierter Auswurffraktion (HFrEF)
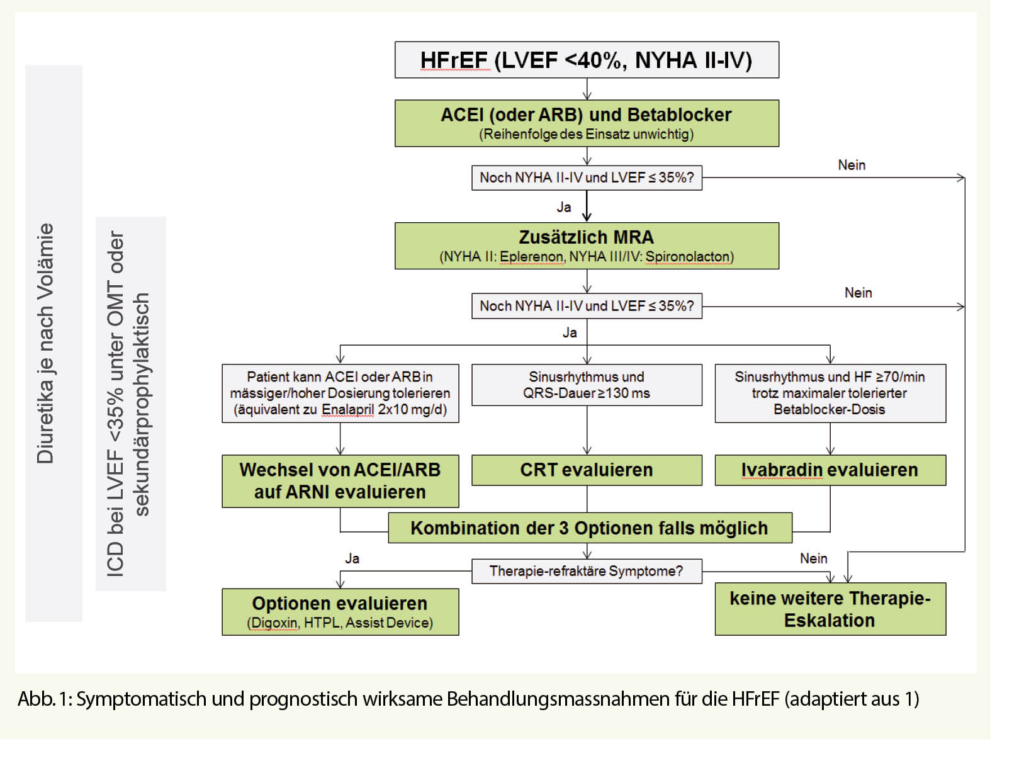
Für die HFrEF existieren mehrere symptomatisch und prognostisch wirksame Behandlungsmassnahmen (Abb. 1), deren sequentieller Einsatz durch die Datenlage bzw. die aktuellen Leitlinien relativ gut definiert ist (1). Die Basis-Therapie besteht dabei neben einer symptomatischen Therapie mit Schleifendiuretika (Prinzip: «so viel wie nötig, so wenig wie möglich») immer aus einer Kombination eines ACE-Hemmers (ACE-I) oder Angiotensin-II Rezeptor-Blocker (ARB; nur bei ACE-I-Unverträglichkeit) und einem Betablocker, wobei die Reihenfolge des Einsatzes der beiden Medikamentenklassen unwesentlich ist, aber beide möglichst maximal dosiert werden sollen. Bleibt die LVEF trotz dieser Basistherapie ≤35%, und ist der Patient weiterhin zumindest leicht symptomatisch (NYHA ≥II), kommt zusätzlich ein Mineralokortikoid-Rezeptor-Antagonist (MRA; Spironolacton oder Eplerenon) zum Einsatz. Bei weiterhin persistierender Symptomatik bestehen danach drei weitere Therapie-Optionen, die einzeln oder bei passender Indikation sequentiell kombiniert zur Anwendung kommen sollen:
1) Wechsel des ACE-I/ARB auf einen Angiotensin-Rezeptor-Neprilysin-Inhibitor (ARNI), sofern weiterhin ein erhöhtes B-type natriuretic peptide (BNP) resp. N-terminales proBNP (NT-pro BNP) nachweisbar ist. 2) Einsatz von Ivabradin bei Sinusrhythmus mit HF ≥70/min unter maximal tolerierter Betablocker-Dosis.
3) Implantation eines kardialen Resynchronisations-Devices (CRT) bei verbreitertem QRS-Komplex (bester Effekt wenn QRS≥150 ms) und typischer Linksschenkelblock-Morphologie. Bei persistierender Dyspnoe NYHA ≥II kommen individuell weitere, weniger gut etablierte Optionen wie Digoxin und H-ISDN (Hydralazin und
Isosorbid-Dinitrat) in Frage. Als letzte Optionen stehen bei einem sehr ausgewählten Patientengut ventrikuläre Assist-Devices und die Herztransplantation zur Verfügung.
HFrEF-Therapie mit einem Angiotensin-Rezeptor-Neprilysin-Inhibitor (ARNI)
Kurz vor Erscheinen der aktuellen ESC-Leitlinien von 2016 (1) wurden die Resultate der PARADIGM-HF Studie (2) veröffentlicht. Dabei zeigte sich bei Patienten mit HFrEF und NYHA II-IV unter Therapie mit Sacubitril/Valsartan gegenüber der Therapie mit Enalapril eine 20% Reduktion des primären kombinierten Endpunktes (kardiovaskulärer Tod und Hospitalisierung wegen Herzinsuffizienz). Durch dieses Studienresultat fand die ARNI-Therapie mit einer Klasse IB Indikation Eingang in die Leitlinien.
In der Zwischenzeit konnte in verschiedenen Analysen gezeigt werden, dass der relative Benefit von Sacubitril/Valsartan gegenüber Enalapril auch bei Patienten mit tiefen Ausgangs-Blutdruckwerten (3) und bei nötiger Dosisreduktion (4) bestehen bleibt. Da Patienten mit diesen beiden Eigenschaften eine Population mit fortgeschrittener HFrEF repräsentieren und deshalb auch eine allgemein gesehen höhere Ereignisrate aufweisen, profitieren diese Patientengruppen absolut gesehen sogar am meisten von einer Therapie mit Sacubitril/Valsartan. Andererseits sind das genau die Patienten, bei denen die Etablierung einer ARNI-Therapie auf Grund der relativ stark hypotensiven Wirkung besonders schwierig ist. In dieser Population ist es umso wichtiger, dass vor Therapieumstellung eine allfällige diuretische Therapie auf die minimal nötige Dosis reduziert wird und nicht-prognostisch wirksame Komedikationen mit blutdrucksenkender Wirkung abgesetzt werden.
Weitere Analysen der PARADIGM-Studie haben folgendes gezeigt: 1) Sacubitril/Valsartan verlangsamt gegenüber Enalapril die Verschlechterung der Nierenfunktion bei Patienten mit chronischer Niereninsuffizienz (5) und führt zu weniger schweren Hyperkaliämien. 2) Der Effekt von Sacubitril/Valsartan ist innerhalb des HFrEF-Spektrums unabhängig von der LVEF (6) und 3) Sacubitril/Valsartan kann im Vergleich zu Enalapril das Risiko eines plötzlichen Herztodes reduzieren (7).
Bisher wurden Patienten gemäss Guidelines bei chronischer HFrEF meist im ambulanten stabilen Setting auf ARNI umgestellt. Kürzlich konnte die PIONEER HF Studie zeigen, dass eine solche Therapieumstellung auch bei auf Grund einer dekompensierten Herzinsuffizienz hospitalisierten Patienten nach hämodynamischer Stabilisierung ohne wesentliche Risiken gut möglich ist und vielleicht sogar zu einem besseren klinischen Verlauf führt (8, 9).
Diabetes mellitus und HFrEF-Therapie
Die Gruppe der Sodium-Glucose Cotransporter 2-Inhibitoren (SGLT2-Inhibitoren), welche über eine gesteigerte Glucosurie zur Reduktion des Blutglucose-Spiegels führen, hat in letzter Zeit in kardiologischen Kreisen grosses Aufsehen erregt. In den grossen, von den Behörden verlangten kardiovaskulären Sicherheitsstudien für Empagliflozin (10), Canagliflozin (11) und Dapagliflozin (12) zeigte sich das überraschende Resultat einer signifikanten Reduktion der Hospitalisationen wegen Herzinsuffizienz bei diabetischen Patienten. Die genauen, diesen Resultaten zugrundeliegenden Mechanismen sind bis anhin nicht gänzlich geklärt. Unter anderen kommen sie durch eine diuretische Wirkung, sowie eine Reduktion der Vor- und Nachlast zu Stande. Nebst der Klärung dieser Wirkmechanismen stellte sich die Frage, ob die SGLT 2-Inhibitoren auch als primäre Herzinsuffizienztherapie bei HFrEF Patienten ohne Diabetes mellitus eine prognostische Wirkung zeigen können. Die erste von mehreren gross angelegten diesbezüglichen Studien wurde kürzlich publiziert (13): Dapagliflozin zeigte gegenüber Placebo neben einer 26%igen Risikoreduktion des kombinierten Endpunktes (kardiovaskulärer Tod, Herzinsuffizienz-Hospitalisationen, dringende Herzinsuffizienz-Therapie mit i.v. Therapie) auch eine signifikante Reduktion der herzinsuffizienzbedingten Hospitalisationen um 30%. Wesentlich ist, dass in dieser Studie nur 50% der Patienten einen Diabetes aufwiesen, und dass die Effekte bei Diabetikern und Nicht-Diabetikern in gleichem Masse ausfielen.
Aufgrund dieser Daten haben die SGLT 2-Inhibitoren in der Diabetestherapie bei Patienten mit hohem kardiovaskulärem Risiko oder bereits etablierten kardiovaskulären Erkrankungen respektive HFrEF eine zentrale Rolle erlangt. Ob und wie die SGLT 2-Inhibitoren auch als primäre Herzinsuffizienztherapie bei Patienten ohne Diabetes in der Klinik in Zukunft eingesetzt werden, wird sich mit der Überarbeitung der Herzinsuffizienz-Richtlinien 2021 zeigen. Nicht zuletzt wird dies auch von den Resultaten weiterer kurz vor Abschluss stehender Studien abhängen (z.B. EMPEROR-Reduced).
Herzinsuffizienz mit erhaltener Auswurffraktion (HFpEF)
Im Gegensatz zur HFrEF konnte bei HFpEF noch für keine medikamentöse Therapie eine Reduktion der Mortalität nachgewiesen werden. Die Leitlinien (1) halten für das Management von HFpEF fest, dass, 1) eine diuretische Therapie bei hypervolämen Patienten indiziert ist und 2) dass Komorbiditäten (z.B. Übergewicht, Lungenerkrankungen, Schlafapnoe) systematisch gesucht und wenn vorhanden rigoros behandelt werden sollen.
Allerdings muss festgehalten werden, dass in den letzten Jahren das Wissen über HFpEF durch zahlreiche Studien zu verschiedenen Therapieansätzen deutlich erweitert werden konnte (14). Zusätzlich ergaben sich wichtige neue Aspekte zur randomisierten, multinationalen TOPCAT Studie (15), welche die Wirkung von Spironolacton bei HFpEF untersucht hat. Vorangegangen waren mechanistische Studien, welche günstige Effekte von Spironolacton auf die diastolische LV-Funktion und die Leistungsfähigkeit dokumentiert hatten. Die TOPCAT-Studie fiel zwar bezüglich des primären kombinierten Endpunkts (kardiovaskulärer Tod, überlebter plötzlicher Herztod, Hospitalisation wegen Herzinsuffizienz) und Mortalität insgesamt neutral aus. Allerdings konnte eine Reduktion der Hospitalisationen wegen Herzinsuffizienz für Spironolacton gezeigt werden, was für die alten und polymorbiden HFpEF-Patienten ein wichtiges Ergebnis ist. Auf Grund einerseits sehr unterschiedlicher Ereignisraten und andererseits unterschiedlicher Therapieeffekten in den USA/Kanada gegenüber Russland wurden im Verlauf verschiedene Analysen durchgeführt, welche suggerieren, dass in Russland ein relevanter Anteil der eingeschlossenen Patienten wahrscheinlich keine HFpEF hatte (viel besserer Outcome als in den USA) und wahrscheinlich keine Spironolacton-Therapie erhielt (kein Nachweis von Spironolacton-Metaboliten im Urin und keine Veränderungen des Serum-Kaliums unter Therapie) (16). Wenn man dies berücksichtigt, könnte TOPCAT doch auf eine günstige Wirkung von Spironolacton bei HFpEF hinweisen.
Die kürzlich publizierte PARAGON-HF Studie (17), welche eine Therapie mit Sacubitril/Valsartan versus einer Therapie mit Valsartan bei Patienten mit LVEF >45% untersuchte, verfehlte es knapp, einen statistischen Benefit bezüglich Herzinsuffizienz-Hospitalisationen und kardiovaskulärem Tod zu zeigen. Subgruppen-Analysen suggerieren jedoch, dass vor allem Frauen und Patientinnen und Patienten mit tiefnormaler oder leicht eingeschränkter LVEF doch profitieren könnten (17, 18).
Aktuell noch ausstehend sind diverse grosse Studien, welche die Wirkung der SGLT 2-Inhibitoren bei HFpEF untersuchen (u.a. EMPEROR-Preserved, DELIVER).
Herzinsuffizienz mit mässig eingeschränkter Auswurffraktion (HFmrEF)
Bisherige Herzinsuffizienztherapiestudien haben sich auf die zwei Entitäten HFrEF (Einschlusskriterium jeweils meist LVEF <40% oder <35%) und HFpEF beschränkt, wobei die Einschlusskriterien für HFpEF variabel waren (LVEF >40% bis LVEF ≥50%). Die in den aktuellen Leitlinien neu geschaffene Kategorie der HFmrEF wurde somit bisher nie allein studiert, sondern nur innerhalb von HFpEF-Studien. Es ist somit unklar, ob HFmrEF-Patienten von einer HFrEF-Therapie profitieren oder eher wie HFpEF-Patienten auf die Therapie reagieren.
In einer grossen Metaanalyse (19) zeigten sich bei HFmrEF intermediäre Patienten-Charakteristika bezüglich kardiale und nicht-kardiale Komorbiditäten, Alter und Geschlecht verglichen mit Patienten der beiden anderen Herzinsuffizienz-Kategorien. Jedoch war die koronare Herzkrankheit als Ursache der Herzinsuffizienz bei HFmrEF signifikant häufiger als bei HFpEF-Patienten und von der Häufigkeit sogar vergleichbar mit derjenigen der HFrEF Populationen. Dies kann auf gewisse Ähnlichkeiten der HFmrEF Population mit der HFrEF Population auch im Hinblick auf mögliche Therapieoptionen hindeuten.
Einige post-hoc Analysen grösserer Herzinsuffizienzstudien suggerieren, dass eine HFrEF-Therapie auch im Setting einer HFmrEF einen Benefit haben könnte. In der TOPCAT Studie (Spironolacton vs Placebo bei HFpEF (15)) wurden Patienten mit LVEF >45% eingeschlossen. Der stärkste therapeutische Benefit von Spironolacton fand sich in der Subgruppe der Patienten mit LVEF 45-50%, was damit wiederum auf einen Nutzen bei HFmrEF Patienten hindeutet (20). Des Weiteren zeigte auch eine Analyse der CHARM-Studie (21), welche alle drei Herzinsuffizienz-Typen eingeschlossen hat, eine vergleichbare signifikante Reduktion des primären Endpunktes (bestehend aus kardiovaskulärer Mortalität und Hospitalisation aus Herzinsuffizienz-Gründen) unter Candesartan bei HFmrEF- und HFrEF-Patienten, während bei HFpEF kein Benefit dokumentiert werden konnte. Wie oben bereits dargelegt gibt es auch für Sacubitril/Valsartan erste Daten, die ein Therapieansprechen bei Patienten mit leicht eingeschränkter LVEF suggerieren (18).
Insgesamt gibt es somit gute Hinweise, dass Patienten mit HFmrEF von einer HFrEF-Therapie profitieren könnten. Zukünftig sind prospektive Studien nötig, um diese Daten zu bestätigen.
Klinik für Kardiologie
Kantonsspital St. Gallen
Rorschacherstrasse 95
9007 St. Gallen
marc.buser@kssg.ch
Klinik für Kardiologie
Kantonsspital St. Gallen
Rorschacherstrasse 95
9007 St. Gallen
Klinik für Kardiologie
Kantonsspital St. Gallen
Rorschacherstrasse 95
9007 St. Gallen
Dr. Buser: Referentenhonorare von Novartis und Boehringer, Dr. Maeder: Advisory Board Tätigkeit für Novartis. In direktem Zusammenhang mit diesem Artikel haben die Autoren keine Interessenskonflikte deklariert.
- Die etablierte medikamentöse HFrEF-Therapie ist prognostisch hoch wirksam und beinhaltet neben einem ACE-Hemmer/Angiotensin
II-Rezeptor-Antagonisten einen Betablocker und einen Mineralokortikoid-Rezeptor-Antagonisten. Zusätzlich haben heute auch der Angiotensin-Rezeptor-Neprilysin-Antagonist Sacubitril/Valsartan sowie Ivabradin ihren Stellenwert in der HFrEF Behandlung. SGLT 2-Inhibitoren scheinen eine positive Wirkung bei HFrEF zu haben. Laufende Studien werden zeigen, ob diese Substanzen in Zukunft auch in der primären Herzinsuffizienz-Therapie (ohne Diabetes mellitus) einen Stellenwert erlangen. - Auch wenn in den letzten Jahren durch zahleiche Studien zur HFpEF-Therapie das Wissen stark erweitert werden konnte, gibt es weiterhin kein Medikament, welches das Überleben dieser Patienten verbessert.
- In einigen post-hoc Analysen scheint ein gewisser Benefit einer HFrEF-Therapie (mit Spironolacton und Candesartan respektive auch Sacubitril/Valsartan) bei HFmrEF-Patienten zu bestehen. Prospektive Studien sind auf diesem Gebiet nötig, um die präliminären Daten zu bestätigen oder zu widerlegen.
1. Ponikowski P, Voors AA, Anker SD, Bueno H, Cleland JG, Coats AJ, Falk V, González-Juanatey JR, Harjola VP, Jankowska EA, Jessup M, Linde C, Nihoyannopoulos P, Parissis JT, Pieske B, Riley JP, Rosano GM, Ruilope LM, Ruschitzka F, Rutten FH, van der Meer P. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J 2016;37:2129-200.
2. McMurray JJ, Packer M, Desai AS, Gong J, Lefkowitz MP, Rizkala AR, Rouleau JL, Shi VC, Solomon SD, Swedberg K, Zile MR; PARADIGM-HF Investigators and Committees. Angiotensin-neprilysin inhibition versus enalapril in heart failure. N Engl J Med 2014;371:993–1004.
3. Böhm M, Young R, Jhund PS, Solomon SD, Gong J, Lefkowitz MP, Rizkala AR, Rouleau JL, Shi VC, Swedberg K, Zile MR, Packer M, McMurray JJV. Systolic blood pressure, cardiovascular outcomes and efficacy and safety of sacubitril/valsartan (LCZ696) in patients with chronic heart failure and reduced ejection fraction: results from PARADIGM-HF. Eur Heart J. 2017 Apr 14;38(15):1132-1143.
4. Vardeny O, Claggett B, Packer M, Zile MR, Rouleau J, Swedberg K, Teerlink JR, Desai AS, Lefkowitz M, Shi V, McMurray JJ, Solomon SD; Prospective Comparison of ARNI with ACEI to Determine Impact on Global Mortality and Morbidity in Heart Failure (PARADIGM-HF) Investigators. Efficacy of sacubitril/valsartan vs. enalapril at lower than target doses in heart failure with reduced ejection fraction: the PARADIGM-HF trial. Eur J Heart Fail. 2016 Oct;18(10):1228-1234.
5. Damman K, Gori M, Claggett B, Jhund PS, Senni M, Lefkowitz MP, Prescott MF, Shi VC, Rouleau JL, Swedberg K, Zile MR, Packer M, Desai AS, Solomon SD, McMurray JJV. Renal Effects and Associated Outcomes During Angiotensin-Neprilysin Inhibition in Heart Failure. JACC Heart Fail. 2018 Jun;6(6):489-498.
6. Solomon SD, Claggett B, Desai AS, Packer M, Zile M, Swedberg K, Rouleau JL, Shi VC, Starling RC, Kozan Ö, Dukat A, Lefkowitz MP, McMurray JJ. Influence of Ejection Fraction on Outcomes and Efficacy of Sacubitril/Valsartan (LCZ696) in Heart Failure with Reduced Ejection Fraction: The Prospective Comparison of ARNI with ACEI to Determine Impact on Global Mortality and Morbidity in Heart Failure (PARADIGM-HF) Trial. Circ Heart Fail. 2016 Mar;9(3):e002744.
7. Desai AS, McMurray JJ, Packer M, Swedberg K, Rouleau JL, Chen F, Gong J, Rizkala AR, Brahimi A, Claggett B, Finn PV, Hartley LH, Liu J, Lefkowitz M, Shi V, Zile MR, Solomon SD. Effect of the angiotensin-receptor-neprilysin inhibitor LCZ696 compared with enalapril on mode of death in heart failure patients. Eur Heart J. 2015 Aug 7;36(30):1990-7.
8. Velazquez EJ, Morrow DA, DeVore AD, Duffy CI, Ambrosy AP, McCague K, Rocha R, Braunwald E for the PIONEER Investigators. Angiotensin-Neprilysin Inhibition in acute decompensated heart failure. N Engl J Med. 2019;380:539-48.
9. Morrow DA, Velazquez EJ, DeVore AD, Desai AS, Duffy CI, Ambrosy AP, Gurmu Y, McCague K, Rocha R, Braunwald E. Clinical outcomes in patients with acute decompensated heart failure randomly assigned to Sacubitril/Valsartan or Enalapril in the PIONEER-HF Trial. Circulation. 2019;139:2285-2288.
10. Zinman B, Wanner C, Lachin JM, Fitchett D, Bluhmki E, Hantel S, Mattheus M, Devins T, Johansen OE, Woerle HJ, Broedl UC, Inzucchi SE; EMPA-REG OUTCOME Investigators. Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. N Engl J Med. 2015 Nov 26;373(22):2117-28.
11. Neal B, Perkovic V, Mahaffey KW, de Zeeuw D, Fulcher G, Erondu N, Shaw W, Law G, Desai M, Matthews DR; CANVAS Program Collaborative Group. Canagliflozin and Cardiovascular and Renal Events in Type 2 Diabetes. N Engl J Med. 2017 Aug 17;377(7):644-657.
12. Wiviott SD, Raz I, Bonaca MP, Mosenzon O, Kato ET, Cahn A, Silverman MG, Zelniker TA, Kuder JF, Murphy SA, Bhatt DL, Leiter LA, McGuire DK, Wilding JPH, Ruff CT, Gause-Nilsson IAM, Frederiksson M, Johansson PA, Langkilde AM, Sabatine MS; DECLARE-TIMI 58 Investigators. Dapagliflozin and cardiovascular outcomes in Typ 2 Diabetes. N Engl J Med. 2019;380(4):347-357.
13. McMurray JJV, Solomon SD, Inzucchi SE, Kober L, Kosiborod MN, Martinez FA, Ponikowski P, Sabatine MS, Anand IS, Belohlavek J, Böhm M, Chiang CE, Chopra VK, de Boer RA, Desai AS, Diez M, Drozdz J, Dukat A, Ge J, Howlett JG, Katova T, Kitakaze M, Ljungman CEA, Mekely B, Nicolau JC, O’Meara E, Petrie MC, Vinh PN, Schou M, Tereshchenko S, Verma S, Held C, DeMets DL, Docherty KF, Jhund PS, Bengtsson O, Sjostrand M, Langkilde AM; DAPA-HF Trial Committees and Investigators. Dapagliflozin in patients with heart failure and reduced ejection fraction. N Engl J Med. 2019;381(21):1995-2008.
14. Maeder MT, Buser M, Brenner R, Rickli H. Heart failure with preserved ejection fraction (HFpEF).Ther Umsch. 2018 Sep;75(3):161-169.
15. Pitt B, Pfeffer MA, Assmann SF, Boineau R, Anand IS, Claggett B, Clausell N, Desai AS, Diaz R, Fleg JL, Gordeev I, Harty B et al for the TOPCAT Investigators. Spironolactone for Heart Failure with Preserved Ejection Fraction. N Engl J Med 2014; 370:1383-1392.
16. De Denus S, O’Meara E, Desai AS, Claggett B, Lewis EF, Leclair G, Jutras M, Lavoie J, Solomon SD, Pitt B, Pfeffer MA, Rouleau JL. Spironolactone Metabolites in TOPCAT – New Insights into Regional Variation. N Engl J Med. 2017 Apr 27;376(17):1690-1692.
17. Solomon SD, McMurray JJV, Anand IS, Ge J, Lam CSP, Maggioni AP, Martinez F, Packer M, Pfeffer MA, Pieske B, Refield MM, Rouleau JL, van Veldhuisen DJ, Zannad F, Zile MR, Desai AS, Claggett B, Jhund PS, Boytsov SA, Comin-Colet J, Cleland J, Dungen H-D, Goncalvesova E, Katova T, Kerr JF, Lelonek M, Merkely B, Senni M, Shah SJ, Zhou J, Rizkala AR, Gong J, Shi VC, Lefkowitz MP; for the PARAGON-HF Investigators and Committees. Angiotensin-Neprilysin inhibition in heart failure with preserved ejection fraction. N Engl J Med. 2019;381:1609-20.
18. Solomon SD, Vaduganathan M, Claggett BL, Packer M, Zile M, Swedberg K, Rouleau J, Pfeffer MA, Desai A, Lund LH, Kober L, Anand I, Sweitzer N, Linssen G, Merkely B, Arango JL, Vinereanu D, Chen C-H, Senni M, Sibulo A, Boytsov S, Shi V, Riszkala A, Lefkowitz M, McMurray JJV. Sacubitril/Valsartan across the spectrum of ejection fraction in heart failure. Circulation. 2020;141:352-361.
19. Lauritsen J, Gustafsson F, Abdulla J. Characteristics and long-term prognosis of patients with heart failure and mid-range ejection fraction compared with reduced and preserved ejection fraction: a systematic review and meta-analysis. ESC Heart Fail. 2018 Aug;5(4):685-694.
20. Solomon SD, Claggett B, Lewis EF, Desai A, Anand I, Sweitzer NK, O’Meara E, Shah SJ, McKinlay S, Fleg JL, Sopko G, Pitt B, Pfeffer MA; TOPCAT Investigators. Influence of ejection fraction on outcomes and efficacy of spironolactone in patients with heart failure with preserved ejection fraction. Eur Heart J. 2016 Feb 1;37(5):455-62.
21. Lund LH, Claggett B, Liu J, Lam CS, Jhund PS, Rosano GM, Swedberg K, Yusuf S, Granger CB, Pfeffer MA, McMurray JJV, Solomon SD. Heart failure with mid-range ejection fraction in CHARM: characteristics, outcomes and effect of candesartan across the entire ejection fraction spectrum. Eur J Heart Fail. 2018 Aug;20(8):1230-1239.
der informierte @rzt
- Vol. 10
- Ausgabe 4
- April 2020