- Medizinische Reiseandenken
Urlaub ist die Erholung von der Arbeitszeit, und für viele bedeutet dies die Planung einer schönen Reise mit Sonne, Strand und Meer – barfuss im Sand laufen gibt uns dabei ein Gefühl der Freiheit (Abb. 1). Beim Strandspaziergang, Baden, Wassersport oder anderen Aktivitäten kann man sich allerdings Wunden, Hautausschläge, oder Parasiten zuziehen. Hier berichten wir über eine kleine Auswahl an «medizinischen Reiseandenken» und mögliche Folgen.
Seeigel
Der Sprung ins Wasser, Schnorcheln oder ein anderer Wassersport kann erfrischend sein, aber auch unangenehme Konsequenzen haben. In Küstenregionen sind Verletzungen durch Seeigel (Abb. 2)
häufig. Seeigel gehören zur Klasse der Echinoidea mit über 600 Arten (1). Bei Kontakt mit den Stacheln, welche aus Calciumcarbonat bestehen, können diese die Haut durchbohren und abbrechen, so dass diese unter der Haut stecken bleiben. Am häufigsten sind Hände oder Füsse betroffen. Die Schwere der Verletzung variiert von kleinen lokalen Wunden, einer bis Monate später verzögerten Bildung von schmerzhaften Granulomen in der Haut (2, 3), bis hin zu Arthritis oder Synovitis, die durch Stacheln in Gelenken hervorgerufen werden können (1, 4, 5). Bei den granulomatösen Entzündungsreaktionen ist bei bis zu 20% als Ursache eine Infektion mit Mycobacterium marinum beschrieben (6). Weiterhin gibt es über 80 Arten von Seeigeln, welche giftig sind. Deren Stacheln enthalten Toxine (z.B. Histamin, Serotonin oder Bradykinin), welche eine systemische Erkrankung mit starken Schmerzen, Nausea, Erbrechen, Muskelschwäche, Hypotonie und Atemnot hervorrufen können (7, 8). Der betroffene Körperteil, welcher durch Stacheln von Seeigeln verletzt wurde, sollte in warmem Wasser gebadet werden, um die Wirkung der Toxine zu reduzieren und den Schmerz zu lindern. Um Komplikationen zu vermeiden, ist die rasche Entfernung der Stacheln mit Pinzette oder einer sterilen Hohlnadel empfohlen (9). Bakterielle Superinfektionen können auftreten. Diese werden primär durch typische Hautbakterien ausgelöst (Staphylokokken, Streptokokken), können aber auch durch Wasserkeime (typischerweise gramnegative Erreger wie Pseudmonas spp., Vibrio spp. etc.) oder durch atypische Mykobakterien ausgelöst werden. Eine Kultur des Eiters oder des Stachels nach Extraktion ist empfehlenswert – spätestens aber klar indiziert nach einer ersten empirischen antibiotischen Therapie. Zudem sollte der Tetanusschutz wenn nötig aufgefrischt werden.
Tungiasis («jigger flea»)
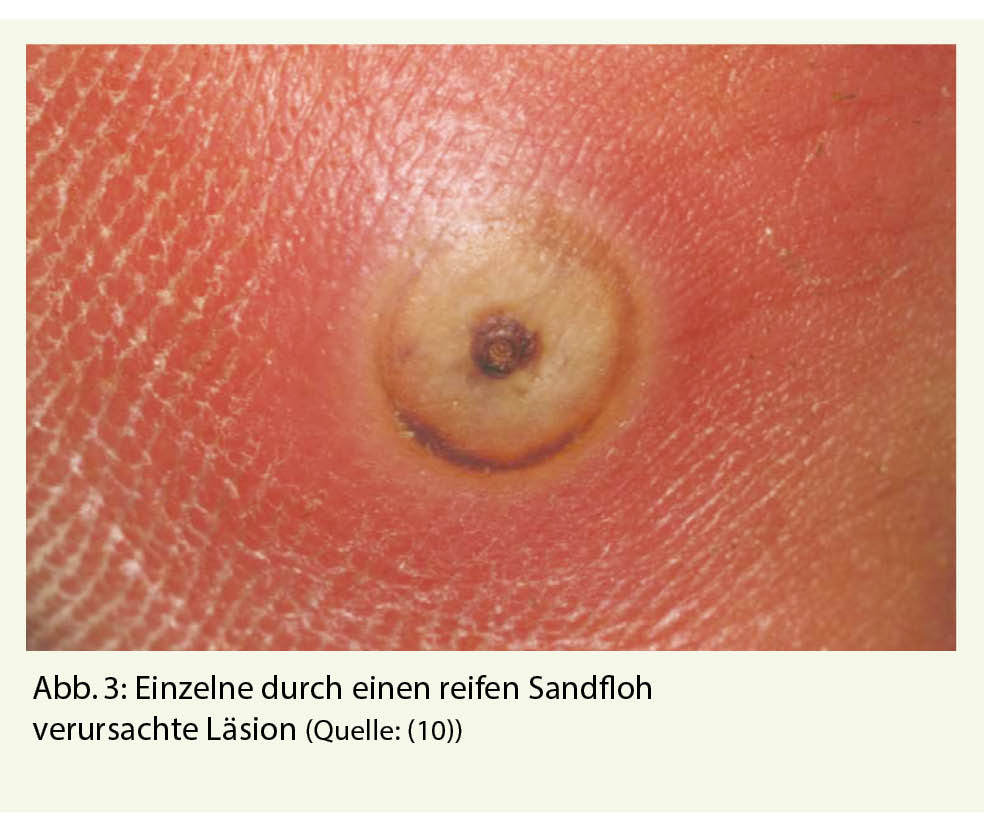
Wenige Tage nach einer Madagaskar-Reise stellte sich eine 35-jährige Reisende wegen eines juckenden und leicht schmerzhaften Knotens an der Fusssohle vor. Die Reisende berichtete, die letzten Tage der Reise am Strand verbracht zu haben, wo sie viel barfuss im Sand gelaufen sei. Während der Reise habe sie keine Beschwerden gehabt. Klinisch zeigt sich ein praller, 5 mm grosser Knoten an der rechten Fusssohle, gelblich mit einem kleinen schwarzen Punkt in der Mitte (Abb. 3) (10). Dieser war mit einem Befall durch einen Sandfloh vereinbar, welcher mit einer sterilen Nadel entfernt werden konnte.
Die Tungiasis ist eine kutane Parasitose, eine Folge der Infektion von Sandflöhen der Gattung Tunga, meist Tunga penetrans und seltener Tunga trimamillata (11). Ursprünglich kamen die Sandflöhe in Südamerika vor und breiteten sich ab dem 16. Jahrhundert weiter nach Sub-Sahara-Afrika aus. Heute kommen sie in allen tropischen und subtropischen Gebieten vor (12). Die Sandflöhe leben im Sand, so dass der Mensch beim Barfusslaufen oder Liegen im Sand befallen werden kann. Meist sind die Füsse betroffen. Das Weibchen bohrt sich in die Haut und ernährt sich von subepidermalen Blutgefässen. Der Hinterleib ragt aus der Haut heraus und ist als schwarzer Punkt erkennbar. Über diesen kann das Weibchen atmen, sich begatten lassen und Fäkalien und Eier ausscheiden. Das Weibchen stirbt nach 3-5 Wochen ab (13).
In endemischen, v.a. armen Gegenden besteht eine hohe Morbidität, wobei insbesondere Kinder häufig chronisch infiziert sind und sekundäre Infektionen sowie ein starker Befall auch zu langfristigen Komplikationen führen können (12).
Touristen hingegen sind meist nur von einem einzelnen Sandfloh befallen (14, 15). Die Diagnose kann meist klinisch gestellt werden. Obwohl der Befall selbstlimitierend ist, da die Weibchen nach wenigen Wochen absterben, sollten die Sandflöhe mit einer sterilen Nadel oder chirurgisch entfernt werden, da bakterielle Superinfektionen als Komplikation häufig sind (16). Auch der Tetanusschutz sollte überprüft werden. Schützen kann man sich, indem man auf Barfusslaufen verzichtet und Insektizid-haltige Cremes oder Sprays auf die Füsse appliziert.
Kutane Larva migrans
Auch häufig an den Füssen auftretend oder an Hautstellen, die mit Sand / der Erde in Kontakt waren, sind Hautmanifestationen eines Hakenwurmbefalls. Die kutane Larva migrans ist bei Reisenden und Migranten einer der am häufigsten importierten Hauterkrankungen (17). Häufig stecken sich Reisende an Stränden in (sub-)tropischen Zonen an (18).
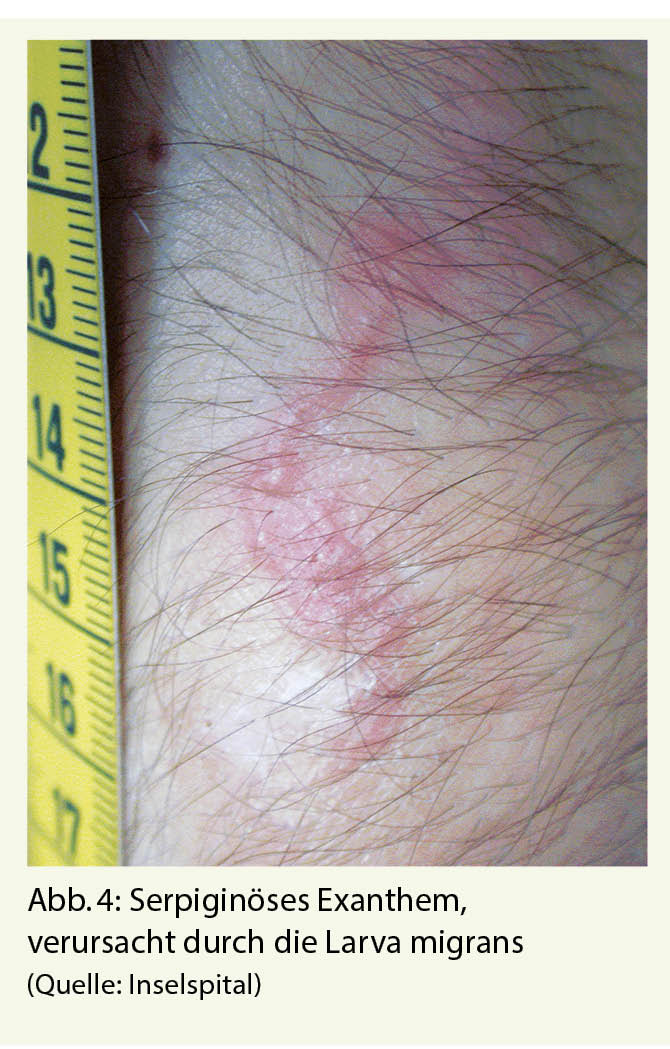
Allerdings sind Hakenwürmer auf der ganzen Welt verbreitet und es sind auch autochthone Fälle aus kälteren Regionen Europas beschrieben (19). Am häufigsten sind Larven vom Hakenwurm Ancylostoma braziliense oder Ancylostoma caninum, seltener Uncinaria stenocephala. Die Ansteckung erfolgt beim Kontakt mit den Nematodenlarven aus dem Kot von infizierten Tieren – meist Hunde oder Katzen. Häufig passiert dies beim Barfusslaufen am Strand oder Liegen auf dem Sand ohne Handtuch, wenn der Sand mit Kot von streunenden Hunden oder Katzen verunreinigt ist. Die Larven penetrieren die Haut und bilden leicht erhabene, geschlängelte Gänge (Abb. 4). In der Folge kommt es zu einem starken Juckreiz. Die Gänge werden von den wandernden Larven unter der Haut verursacht, welche sich ca. 1 cm pro Tag vorwärtsbewegen. Diese nicht humanen Hakenwurmlarven können die humane Basalmembran nicht durchdringen und bleiben daher sehr oberflächlich. Die typische Erscheinung, auch «creeping eruption» genannt, ist pathognomonisch, und tritt meist in den ersten vier Wochen nach Reiserückkehr auf, die Inkubationszeit kann aber auch mehrere Monate betragen (18).
Die kutane Larva migrans wird jedoch oft nicht erkannt, so dass Betroffene häufig einige Wochen durch den Pruritus geplagt sind und nicht wirksame Therapien erhalten (20). Allerdings ist der Mensch Fehlwirt der Hakenwürmer, so dass sich die Larven nicht weiterentwickeln können und nach fünf bis sechs Wochen absterben und resorbiert werden. Eine Therapie ist also nicht unbedingt notwendig, sollte aber vor allem wegen des ausgeprägten Juckreizes, der psychischen Belastung durch einen Parasitenbefall und Risiko von sekundären Superinfektionen erfolgen. Die Behandlung erfolgt in der Regel mit Albendazol 400 mg zweimal täglich für 3 Tage (21-24). Zudem sollte auch hier der Tetanusschutz kontrolliert werden. Nach der Therapie verschwindet der Pruritus meist innert weniger Tage bis Wochen (201). Als Prophylaxe gilt das Gleiche wie für die Sandflöhe – Tragen von Schuhwerk mit festen Sohle, Nutzen von Liegen, kein Abliegen direkt in den Sand.
Larva currens
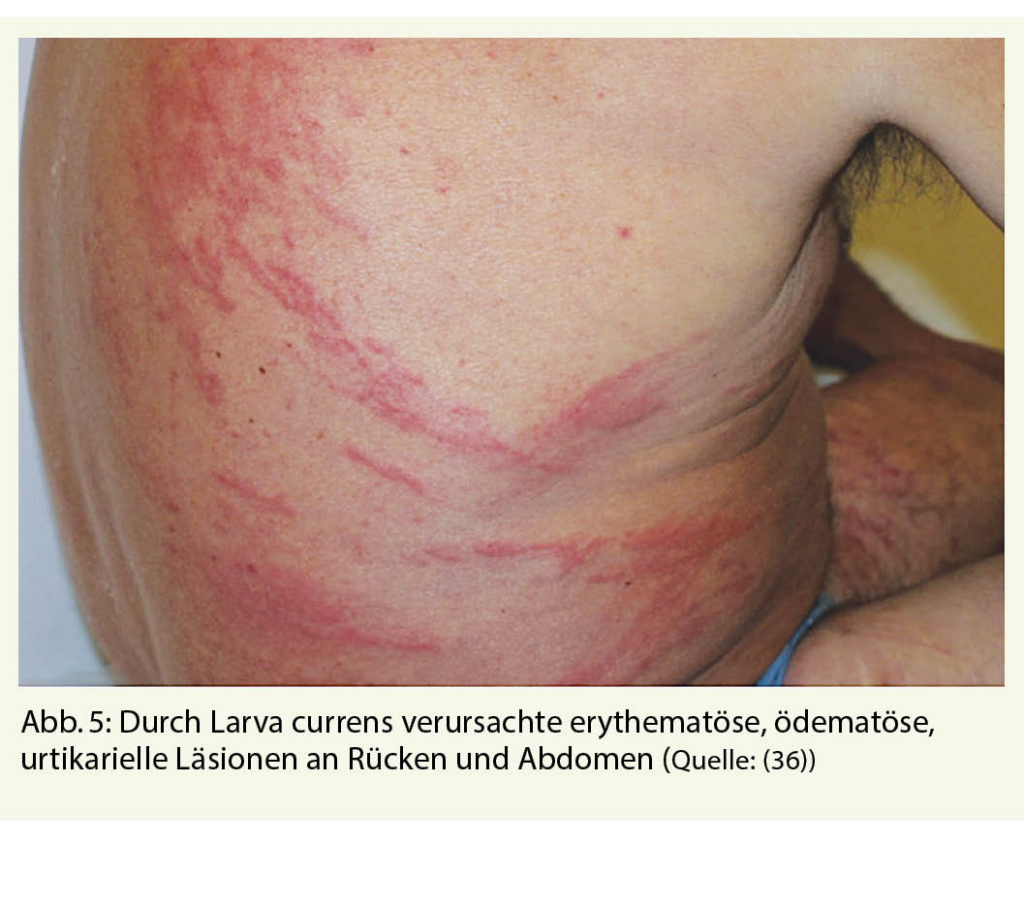
Die serpiginösen Exantheme der kutanen Larva migrans sollten nicht mit denen der Larva currens verwechselt werden. Diese werden ausgelöst durch die Larven von Strongyloides stercoralis, ebenso ein Nematode. Die Infektion erfolgt meist durch transkutane Penetration der Larven, die sich in der Erde oder in sandigen Böden befinden, weshalb man sich ebenso beim Barfussgehen infizieren kann. Endemisch ist der Zwergfadenwurm in tropischen Ländern, er kommt aber weltweit auch in gemässigten Zonen vor (25, 26). Die Larven wandern nach Penetration der kutanen Schichten in den Blutgefässen durch die Lunge, werden hochgehustet, geschluckt, und siedeln sich im Dünndarm an, wo die Weibchen Eier legen (27, 28). Aus den Eiern schlüpft das erste Larvenstadium, welches mit dem Stuhl ausgeschieden wird. Sie können sich jedoch bereits im Darm zum dritten, infektiösen filariformen Larvenstadium weiterentwickeln und zu einer Autoinfektion führen, indem sie sich perianal wieder durch die Haut des gleichen Wirtes bohren. Die Infektion ist bei Immunkompetenten meist asymptomatisch oder ruft milde gastrointestinale Symptome oder respiratorische Beschwerden bei der Lungenpassage hervor. Die Hautmanifestationen sind weniger scharf begrenzte Gänge, die sich bis zu 5 cm pro Stunde ausbreiten und daher «Larva currens» genannt werden (Abb. 5). Insgesamt sind diese Symptome aber eher selten. Bei Immunsuppression (primär bei hochdosierten Corticosteroiden) kann es hingegen zu einem Hyperinfestationsyndrom kommen, einhergehend mit hoher Morbidität und möglicher Mortalität (29, 30). Die Therapie der Wahl ist Ivermectin (31). Vor Immunsuppression, insbesondere vor Einsatz von hochdosierten Steroiden, sollte daher ein Screening mit Serologie durchgeführt werden (30). Zur Vermeidung sollten auch hier Schuhe getragen werden.
Badedermatosen
Nach manch einem Bad im Meer oder einem schönen Badesee kann auch ein unangenehmer Juckreiz auftreten. Häufige Ursache ist die Zerkariendermatitis, hervorgerufen durch die Fehlbesiedelung des Menschen mit Larven (Zerkarien) von verschiedenen Saugwürmern der Familie Schisosomatidae. Diese befallen üblicherweise Wasservögel und -tiere, und können in Süss- und Salzwasser auf der ganzen Welt vorkommen (32). Da Enten typische Endwirte sind, spricht man häufig auch von «Entenflöhen». Schnecken dienen als Zwischenwirt für die Würmer. Die Zerkarien bohren sich beim Baden durch die Haut, können sich jedoch im Menschen nicht weiterentwickeln und sterben ab. Sie können eine entzündliche immunologische Hautreaktion hervorrufen, welche nach Minuten bis Stunden zu starkem Juckreiz, Pusteln oder Quaddeln in exponierten Hautstellen führen kann (33). Der Hautausschlag ist typischerweise an den von Badekleidung unbedeckten Stellen. Antihistaminika und topische Steroide lindern die Beschwerden.
Die Zerkariendermatitis sollte nicht mit der Nesseltierlarven-Dermatitis verwechselt werden. Diese wird durch Larven von bestimmten Seeanemonen und Quallen hervorgerufen, typischerweise beim Baden in suptropischen und tropischen Ozeanen. Die Larven bleiben zwischen Kleidung und Haut haften und durch Druck und Austrocknen werden Toxine frei, wodurch stark juckende Papeln im Bereich der Badekleidung, die sogenannte «sea bathers eruption», hervorgerufen wird (34). Selten können auch systemische Reaktionen wie Fieber und Erbrechen auftreten. Innerhalb von zwei Wochen verschwinden die Exantheme spontan, zur Linderung der immunologischen Reaktion können auch hier Antihistimanika und lokale Steroide verwendet werden (35).
Copyright Aerzteverlag medinfo
FMH Tropen- und Reisemedizin, FMH Innere Medizin
Universitätsspital Bern, Klinik für Infektiologie
Freiburgstrasse 16p
3010 Bern
anna.eichenberger@insel.ch
Universitätsspital Bern, Klinik für Infektiologie
Freiburgstrasse 16p
3010 Bern
cornelia.staehelin@insel.ch
Die Autorinnen haben deklariert, in Zusammenhang mit diesem Artikel keine Interessenskonflikte zu haben.
◆ Häufige medizinische «Reisesouvenirs» sind banal und bleiben asymptomatisch oder verschwinden wieder spontan.
◆ Seeigelstachel können zu bakteriellen Superinfektionen führen oder Granulome hervorrufen, so dass sie wenn möglich rasch mit einer sterilen Nadel entfernt werden sollten.
◆ Um einer Infektion mit Sandflöhen, Strongyloides, den humanen Hakenwürmern (Necator americanus oder Ancylostoma duodenale) oder den tierpathogenen Hakenwürmern Ancylostoma braziliense oder Ancylostoma caninum vorzubeugen, sollte auf barfuss laufen verzichtet werden und sich nicht direkt in den Sand gesetzt werden.
◆ Vor Beginn einer Immunsuppressiven Therapie, insbesondere mit hochdosierten Kortikosteroiden sollte nach Auslandsreisen ein serologisches Screening für Strongyloides durchgeführt werden. Unter hoch dosierter Kortikosteroidtherapie kann eine unbehandelte Strongyloides-Infektion zu einem Hyperinfestationssyndrom führen.
1. Liram N, Gomori M, Perouansky M. Sea urchin puncture resulting in PIP joint synovial arthritis: case report and MRI study. Journal of travel medicine. 2000;7(1):43-5.
2. Hsieh C, Aronson ER, Ruiz de Luzuriaga AM. Aquatic antagonists: cutaneous sea urchin spine injury. Cutis. 2016;98(5):303-5.
3. Rossetto AL, de Macedo Mora J, Haddad Junior V. Sea urchin granuloma. Revista do Instituto de Medicina Tropical de Sao Paulo. 2006;48(5):303-6.
4. Wada T, Soma T, Gaman K, Usui M, Yamashita T. Sea urchin spine arthritis of the hand. The Journal of hand surgery. 2008;33(3):398-401.
5. Dahl WJ, Jebson P, Louis DS. Sea urchin injuries to the hand: a case report and review of the literature. The Iowa orthopaedic journal. 2010;30:153-6.
6. De la Torre C, Vega A, Carracedo A, Toribio J. Identification of Mycobacterium marinum in sea-urchin granulomas. The British journal of dermatology. 2001;145(1):114-6.
7. Hornbeak KB, Auerbach PS. Marine Envenomation. Emergency medicine clinics of North America. 2017;35(2):321-37.
8. Wu ML, Chou SL, Huang TY, Deng JF. Sea-urchin envenomation. Veterinary and human toxicology. 2003;45(6):307-9.
9. Schwartz Z, Cohen M, Lipner SR. Sea urchin injuries: a review and clinical approach algorithm. The Journal of dermatological treatment. 2021;32(2):150-6.
10. Heukelbach J, Tungiasis. Invited Review, Rev. Inst. Med. trop. S. Paulo 47(6): 307-313, november-December, 2005)
11. Feldmeier H, Keysers A. Tungiasis – A Janus-faced parasitic skin disease. Travel medicine and infectious disease. 2013;11(6):357-65.
12. Feldmeier H, Heukelbach J, Ugbomoiko US, Sentongo E, Mbabazi P, von Samson-Himmelstjerna G, et al. Tungiasis–a neglected disease with many challenges for global public health. PLoS neglected tropical diseases. 2014;8(10):e3133.
13. Nagy N, Abari E, D’Haese J, Calheiros C, Heukelbach J, Mencke N, et al. Investigations on the life cycle and morphology of Tunga penetrans in Brazil. Parasitology research. 2007;101 Suppl 2:S233-42.
14. Palicelli A, Boldorini R, Campisi P, Disanto MG, Gatti L, Portigliotti L, et al. Tungiasis in Italy: An imported case of Tunga penetrans and review of the literature. Pathology, research and practice. 2016;212(5):475-83.
15. Santos RP, Resende C, da Luz Duarte M, Brito C. Tungiasis: a poorly-known diagnosis in Europe. Two paradigmatic cases from Portugal. Acta dermatovenerologica Alpina, Pannonica, et Adriatica. 2017;26(4):115-7.
16. Feldmeier H, Heukelbach J, Eisele M, Sousa AQ, Barbosa LM, Carvalho CB. Bacterial superinfection in human tungiasis. Tropical medicine & international health : TM & IH. 2002;7(7):559-64.
17. Lederman ER, Weld LH, Elyazar IR, von Sonnenburg F, Loutan L, Schwartz E, et al. Dermatologic conditions of the ill returned traveler: an analysis from the GeoSentinel Surveillance Network. International journal of infectious diseases : IJID : official publication of the International Society for Infectious Diseases. 2008;12(6):593-602.
18. Jelinek T, Maiwald H, Nothdurft HD, Löscher T. Cutaneous larva migrans in travelers: synopsis of histories, symptoms, and treatment of 98 patients. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America. 1994;19(6):1062-6.
19. Baple K, Clayton J. Hookworm-related cutaneous larva migrans acquired in the UK. BMJ case reports. 2015;2015.
20. Kincaid L, Klowak M, Klowak S, Boggild AK. Management of imported cutaneous larva migrans: A case series and mini-review. Travel medicine and infectious disease. 2015;13(5):382-7.
21. Bouchaud O, Houzé S, Schiemann R, Durand R, Ralaimazava P, Ruggeri C, et al. Cutaneous larva migrans in travelers: a prospective study, with assessment of therapy with ivermectin. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America. 2000;31(2):493-8.
22. Caumes E. Treatment of cutaneous larva migrans. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America. 2000;30(5):
811-4.
23. Hochedez P, Caumes E. Hookworm-related cutaneous larva migrans. Journal of travel medicine. 2007;14(5):326-33.
24. Vanhaecke C, Perignon A, Monsel G, Regnier S, Bricaire F, Caumes E. The efficacy of single dose ivermectin in the treatment of hookworm related cutaneous larva migrans varies depending on the clinical presentation. Journal of the European Academy of Dermatology and Venereology : JEADV. 2014;28(5):655-7.
25. M AFW, Whiley H, K ER. A Review of Strongyloides spp. Environmental Sources Worldwide. Pathogens (Basel, Switzerland). 2019;8(3).
26. Olsen A, van Lieshout L, Marti H, Polderman T, Polman K, Steinmann P, et al. Strongyloidiasis–the most neglected of the neglected tropical diseases? Transactions of the Royal Society of Tropical Medicine and Hygiene. 2009;103(10):967-72.
27. Greaves D, Coggle S, Pollard C, Aliyu SH, Moore EM. Strongyloides stercoralis infection. BMJ (Clinical research ed). 2013;347:f4610.
28. Nutman TB. Human infection with Strongyloides stercoralis and other related Strongyloides species. Parasitology. 2017;144(3):263-73.
29. Keiser PB, Nutman TB. Strongyloides stercoralis in the Immunocompromised Population. Clinical microbiology reviews. 2004;17(1):208-17.
30. Mejia R, Nutman TB. Screening, prevention, and treatment for hyperinfection syndrome and disseminated infections caused by Strongyloides stercoralis. Current opinion in infectious diseases. 2012;25(4):458-63.
31. Albonico M, Becker SL, Odermatt P, Angheben A, Anselmi M, Amor A, et al. StrongNet: An International Network to Improve Diagnostics and Access to Treatment for Strongyloidiasis Control. PLoS neglected tropical diseases. 2016;10(9):e0004898.
32. Horák P, Mikeš L, Lichtenbergová L, Skála V, Soldánová M, Brant SV. Avian schistosomes and outbreaks of cercarial dermatitis. Clinical microbiology reviews. 2015;28(1):165-90.
33. Kolářová L, Horák P, Skírnisson K, Marečková H, Doenhoff M. Cercarial dermatitis, a neglected allergic disease. Clinical reviews in allergy & immunology. 2013;45(1):63-74.
34. Prohaska J, Jamal Z, Tanner LS. Seabathers Eruption. StatPearls. Treasure Island (FL): StatPearls Publishing Copyright © 2021, StatPearls Publishing LLC.; 2021.
35. Wong DE, Meinking TL, Rosen LB, Taplin D, Hogan DJ, Burnett JW. Seabather’s eruption. Clinical, histologic, and immunologic features. Journal of the American Academy of Dermatology. 1994;30(3):399-406.
36. Corte LD, da Silva MV, Souza PR. Simultaneous Larva Migrans and Larva Currens Caused by Strongyloides stercoralis: A Case Report. Case Rep Dermatol Med. 2013;2013:381583. doi:10.1155/2013/381583
der informierte @rzt
- Vol. 11
- Ausgabe 6
- Juni 2021