- Monoklonale Gammopathien
Der Einsatz von monoklonalen Antikörpern (mAbs – aus dem englischen «monoclonal antibodies») in der Medizin hat eine lange und faszinierende Geschichte, welche mit der Entwicklung der Hybridom-Technik nach Köhler und Milstein in den 70er-Jahre ihren Ursprung hat (1). Seitdem haben sich mAbs in mehreren Bereichen der Medizin, insbesondere auch als Arzneimittel, etabliert. Trotz nunmehr langjähriger Anwendung im klinischen Alltag wurden Interferenzen durch therapeutische mAbs bei labormedizinischen Abklärungen erst im letzten Jahrzehnt erkannt. Im Folgenden wird ein kurzer Überblick des heutigen Kenntnisstands präsentiert.
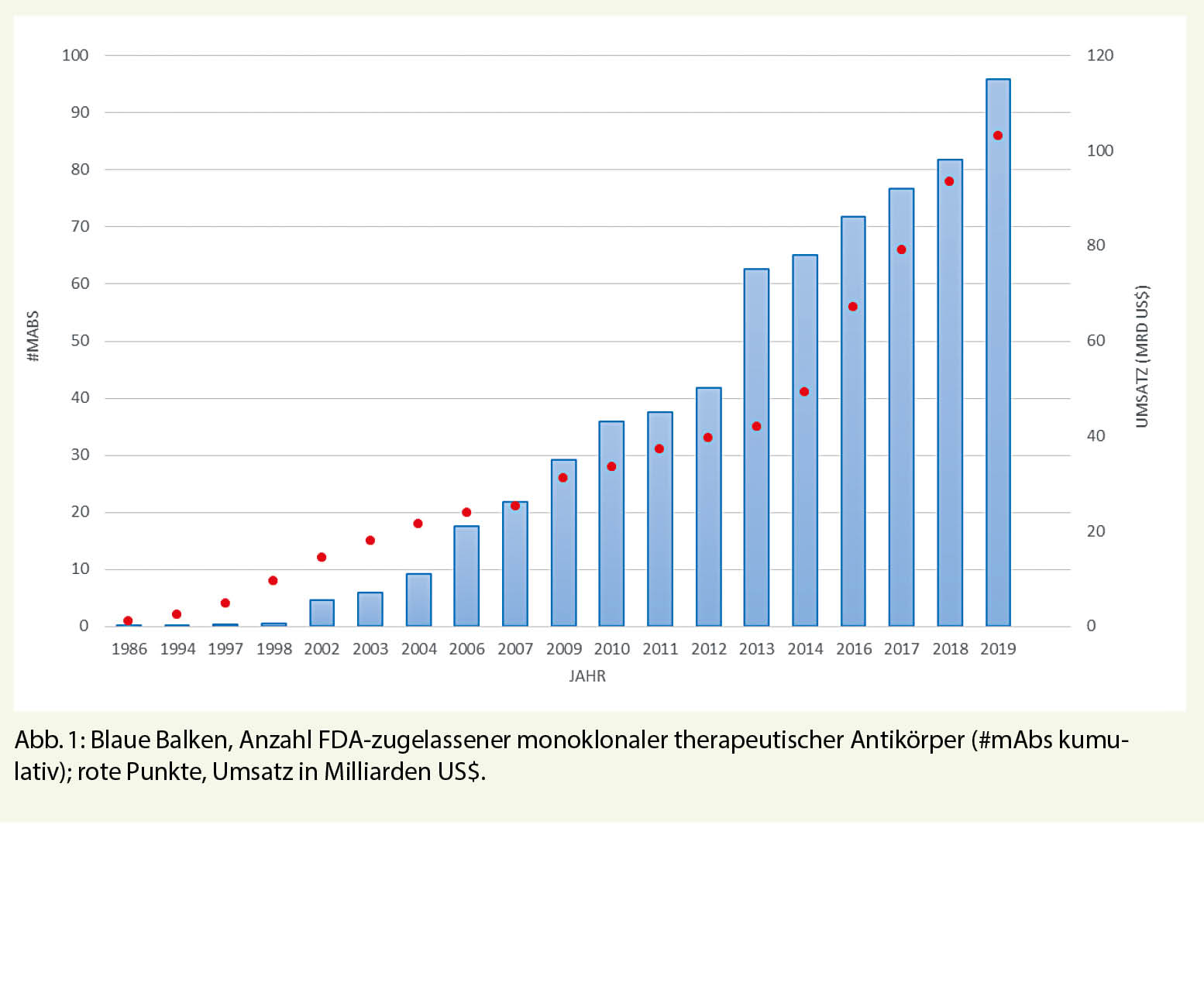
Die ursprünglichen therapeutischen mAbs wurden aus Maus- und Ratten-Hybridomen erstellt (–momab). 1986 wurde Muromomab-CD3 als erster mAb zur Behandlung akuter Abstossungsreaktionen nach allogener Nieren-, Herz- oder Lebertransplantation zugelassen. Aufgrund der kurzen Halbwertszeit und der ausgeprägten Immunogenität, fand die erste Generation limitierten Eingang in den klinischen Alltag. Durch moderne biotechnologische Verfahren konnte die mAb-Struktur humanisiert werden. Es entstanden zunächst chimäre (-ximab), später humanisierte (-zumab) und humane (-umab) Antikörper mit verbesserter Pharmakokinetik, Antigen-Spezifität und reduzierter Immunogenität. Infolgedessen wurden therapeutische Antikörper zur prädominanten Klasse neuentwickelter Arzneimittel und Bestsellern der Pharmaindustrie mit einem geschätzten jährlichen Umsatz von ca. 115 Milliarden US$ im Jahr 2019 und erwarteten 300 Milliarden US$ bis 2025(2, 3) (Fig. 1).
Interferenzen durch therapeutische mAbs bei labormedizinischen Abklärungen wurden erst in jüngerer Zeit erkannt. Störungen unterschiedlicher analytischer Methoden können bei Laborabklärungen in der Transfusions- und Transplantationsmedizin sowie Hämato-Onkologie auftreten (4), wie in den folgenden Abschnitten dargestellt wird:
Interferenz bei Histokompatibilitätsprüfung (Crossmatch Testing):
Bei Transplantatempfängern vorkommende Antikörper gegen HLA-Antigene (HLA-Allele) des Spenders können zu einer Transplantatabstossung führen. Vor einer Transplantation erfolgt daher ein sogenannter HLA-Crossmatch, bei dem das Serum des Empfängers gegen B- und T-Lymphozyten des Spenders im lymphozytotoxischen Test untersucht wird, um zu überprüfen, ob beim Empfänger zytotoxische HLA-Antikörper vorhanden sind. Für eine erfolgreiche Transplantation wird ein negativer Crossmatch vorausgesetzt (5). Die Anwesenheit von bestimmten therapeutischen mAbs (z.B. Rituximab; anti-CD20) im Empfängerserum kann durch Bindung an CD20-Antigene auf B-Lymphozyten zu einem falsch-positiven Crossmatch und demzufolge zur Ablehnung des Transplantatspenders führen. Dank einer rechtzeitigen Mitteilung der aktuellen Medikation, kann das HLA-Labor durch Vorbehandlung des Patientenserums die Interferenz beseitigen und eine fehlerhafte Interpretation der Resultate vermeiden. Weitere therapeutische mAbs, die im Crossmatch interferieren, sind Daclizumab (anti-CD25) und Alemtuzumab (anti-CD52). Beide Arzneimittel werden für die Reduktion des Risikos einer Graft-versus-Host-Reaktion eingesetzt.
Interferenz beim Antikörpersuchtest und der Verträglichkeitsuntersuchung:
Störungen von Laboruntersuchungen in der Transfusionsmedizin durch Daratumumab-Behandlung wurden schon während Phase-I/II-Studien erkannt. Daratumumab und das neu zugelassene Isatuximab sind humane monoklonale IgG-Kappa-Antikörper mit einer hohen Affinität zum Oberflächenantigen CD38, welche immer häufiger für die Therapie des Multiplen Myeloms (MM) eingesetzt werden. Da CD38 auch auf der Erythrozytenoberfläche exprimiert wird, kann die Behandlung mit anti-CD38 mAbs bis zu sechs Monate nach der letzten therapeutischen Gabe zu Interferenzen bei Antikörpersuchtests, Antikörperdifferenzierungen und Kreuzproben führen. Daher sollte bei diesen Patienten vor Beginn der Behandlung eine umfassende Bestimmung transfusionsrelevanter Blutgruppen erfolgen, um eine möglichst rasche Freigabe kompatibler Erythrozytenkonzentrate zu ermöglichen.
Interferenz in der Serum-Elektrophorese und Immunfixation:
Seit 2016 sind Daratumumab (anti-CD38) und Elotuzumab (anti-SLAMF-7) sowie seit 2020 Isatuximab (anti-CD38) für die Behandlung des MM in der Schweiz zugelassen. Als neue Option wurde kürzlich Belantamab (anti-BCMA) Mafodotin zur Monotherapie bei rezidiviertem, refraktärem MM für die EU bestätigt – die Schweiz könnte nachziehen (6). Als humane monoklonale IgG-Kappa-Antikörper können diese mAbs sowohl mittels Serum-Protein Elektrophorese (SPE) als auch durch Immunfixations-Elektrophorese (IFE) nachgewiesen werden (Fig. 2). Beide Methoden werden routinemässig für das Screening (Gammopathie-Abklärung) und die Überwachung eines endogenen monoklonalen Proteins (M-Protein) angewendet (7). Diese Interferenz ist stark von der Pharmakokinetik der einzelnen mAbs abhängig. Bei Patienten mit einem endogenen IgG-Kappa-Myelomprotein unter Behandlung mit Daratumumab kann die Überwachung des Therapieansprechens erschwert und eine komplette Remission maskiert werden. Umgekehrt kann bei Myelom-Patienten in Remission ein Rezidiv oder sogar eine Progression der Erkrankung vorgetäuscht werden. Spezielle Analysenansätze erlauben heute die Unterscheidung zwischen endogenem und therapeutischem monoklonalen M-Protein bei Daratumumab-Behandlung (8). Ob ein solch aufwändiger Ansatz erforderlich ist, kann nur durch das durchführende Labor aufgrund der elektrophoretischen Migrationseigenschaften des endogenen M-Proteins beurteilt werden.

Darüber hinaus können weitere therapeutische mAbs, hauptsächlich Rituximab und Bevacizumab (9), als niedrig-konzentriertes monoklonales IgG-Kappa-M-Protein bei einer Gammopathie-Abklärung nachgewiesen werden. Bei fehlenden Angaben zu einer mAb-Behandlung werden solche Fälle in der Regel als MGUS (monoklonale Gammopathie unbekannter Signifikanz) diagnostiziert, eine klinisch asymptomatische klonale Plasmazellproliferation ohne Malignitätskriterien und ohne Therapiebedarf. Nichtdestotrotz stellt eine MGUS die Vorstufe einer malignen lymphoproliferativen Erkrankung (MM, lymphoplasmozytisches Lymphom, Non-Hodgkin-Lymphom) dar und hat klinische Folgen. Weiterführende Abklärungsuntersuchungen, jährliche serologische Verlaufskontrollen und eine unnötige psychische Belastung der Patienten müssten in Kauf genommen werden. Um das Risiko einer Interferenz bei der Abklärung einer Gammopathie zu minimieren, sollte die entsprechende Blutentnahme frühestens zwei Tage nach der Gabe monoklonaler mAbs durchgeführt werden.
Durch die rasante Zunahme an neuen therapeutischen mAbs und deren potenziellem kombinierten Einsatz wird in näherer Zukunft der Umgang mit Interferenzen bei Laboruntersuchungen komplexer werden. Neue Labormethoden, die nicht durch therapeutische mAbs gestört werden, sind schon in Entwicklung (10). Ob diese Einsatz im Routinelabor finden werden, ist noch unklar. In der Zwischenzeit können die Kenntnis potenzieller Risiken und der systematische Informationsaustausch zwischen Klinikern und Labor die beschriebenen Interferenzen grossteils vermeiden.
Copyright bei Aerzteverlag medinfo AG
Institut für Labormedizin
Kantonsspital Aarau AG
Tellstrasse 25
5000 Aarau
luca.bernasconi@ksa.ch
Institut für Labormedizin
Kantonsspital Aarau AG
Tellstrasse 25
5000 Aarau
Freiguterstr. 12
8022 Zürich
LB gibt an, von der Firma Sebia GmBH innerhalb der letzten 5 Jahre einmalig ein Vortrags-Honorar bekommen zu haben.
Die beiden anderen Autoren haben in Zusammenhang mit diesem Artikel keine Interessenskonflikte deklariert.
- Die Behandlung mit therapeutischen mAbs führt zur Störung verschiedener Laboruntersuchungen.
- Interferenzen können durch eine sorgfältige Planung der Blutentnahmezeit vermieden oder anhand geeigneter Labormethoden beseitigt werden.
- Der Informationsaustausch zwischen Klinikern und Labor (und vice versa) erlaubt den meisten Interferenzen aus dem Weg zu gehen.
1. Kohler, G. and C. Milstein, Continuous cultures of fused cells secreting antibody of predefined specificity. Nature, 1975. 256(5517): p. 495-7.
2. Kaplon, H., et al., Antibodies to watch in 2020. MAbs, 2020. 12(1): p. 1703531.
3. Lu, R.-M., et al., Development of therapeutic antibodies for the treatment of diseases. Journal of Biomedical Science, 2020. 27(1): p. 1.
4. Lazar-Molnar, E. and J.C. Delgado, Implications of Monoclonal Antibody Therapeutics Use for Clinical Laboratory Testing. Clin Chem, 2019. 65(3): p. 393-405.
5. Kleesiek, K., et al., HLA-Crossmatch, in Lexikon der Medizinischen Laboratoriumsdiagnostik, A.M. Gressner and T. Arndt, Editors. 2019, Springer Berlin Heidelberg: Berlin, Heidelberg. p. 1129-1129.
6. Holtick, U. and C. Scheid, Aktuelle immuntherapeutische Ansätze beim multiplen Myelom. best practice onkologie, 2019. 14(10): p. 412-422.
7. Bernasconi, L., Monoklonale Gammopathien – Klinische Assoziation und Labordiagnostik. Der informierte Arzt, 2015. 12.
8. Thoren, K.L., et al., Distinguishing Drug from Disease by Use of the Hydrashift 2/4 Daratumumab Assay. J Appl Lab Med, 2019. 3(5): p. 857-863.
9. Ruinemans-Koerts, J., et al., Interference of therapeutic monoclonal immunoglobulins in the investigation of M-proteins. Clin Chem Lab Med, 2014. 52(11): p. e235-7.
10. Mills, J.R., et al., A universal solution for eliminating false positives in myeloma due to therapeutic monoclonal antibody interference. Blood, 2018. 132(6): p. 670-672.
der informierte @rzt
- Vol. 11
- Ausgabe 1
- Januar 2021









