- Neue Lipidrichtlinien der ESC
Die neue, in 2019 präsentierte ESC/EAS Leitlinie zum Management von Dyslipidämie wurde mit Spannung erwartet und enthält viele praxisrelevante Neuerungen. Das LDL-Cholesterin steht wie bereits 2016 im Mittelpunkt. Die kardiovaskuläre Risiko Klasse, die Rolle von Bildgebung für eine Früherkennung der Atherosklerose und die LDL-Zielwerte wurden neu definiert und die Empfehlungen für alte und neue lipidsenkende Medikamente werden schematisch zusammengefasst, basierend auf den neuesten wissenschaftlichen Ergebnissen. Zudem enthalten die Leitlinie auch spezifische Informationen über spezielle Kategorien, wie z.B. Frauen, Personen mit familiärer Dyslipidämie oder betagte Menschen, und erwähnt im welchem Bereich die wissenschaftliche Datenlage noch ungenügend ist. Obwohl diese Europäische Leitlinie nicht 1 zu 1 für die Schweiz passend ist, ist es sehr wichtig, diese zu kennen und mit Wissen und Gewissen einzusetzen.
Gemäss der «CH-Gesundheit Befragung 2019» des Bundesamts für Statistik (1) wird die Hypercholesterinämie weniger häufig kontrolliert als andere kardiovaskuläre Risikofaktoren: 2017 hatten 45% der Männer und 47% der Frauen innerhalb eines Jahres ihre Cholesterinwerte kontrollieren lassen; beim Bluthochdruck waren es z.B. 71% der Männer und 82% der Frauen. 2017 war eine Dyslipidämie (bekannte erhöhte Cholesterinspiegel oder Einnahmen eines cholesterinsenkenden Medikamentes) bei 13% der Bevölkerung bekannt. Ab 65 Jahren steigt die Inzidenz der Dyslipidämie auf 32%, Männer waren in dieser Altersgruppe häufiger als Frauen (36% gegenüber 28%) betroffen.
Bedeutung der LDL-Senkung
Hypercholesterinämie ist einer der am umfassendsten dokumentierten modifizierbaren kardiovaskulären (KV) Risikofaktoren (2, 3). Zu viel LDL-Cholesterin (LDL-C) im Blut führt jedoch zu ernsthaften Gesundheitsschäden und vorzeitiger Sterblichkeit durch die Atherothrombose und deren Folgen.
Epidemiologische Studien zeigen, dass das LDL-C direkt mit dem Herzinfarktrisiko und der Sterblichkeit durch Herzkreislauf-Erkrankungen korreliert (3).
Aktuelle genetische Untersuchungen zeigen, dass Personen mit einem angeborenen niedrigen LDL-C-Spiegel ein tiefes kardiovaskuläres Risiko aufweisen, während eine familiäre Veranlagung zu hohem LDL-C das kardiovaskuläre Risiko erhöht (3). Es ist sehr gut dokumentiert, dass eine LDL-C Senkung mit Statinen oder durch Lebensstilveränderungen, andere Medikamente oder durch die Lipid-Apherese zu einer parallelen Senkung des Herz-Kreislauf-Risikos führt (2, 3).
Um das Risiko eines kardiovaskulären Ereignisses zu senken, ist es deshalb wichtig, das LDL-C zu senken und das so tief und so früh wie möglich.
Zusammenfassung der 2019 Dyslipidämie-Leitlinien der European Society of Cardiology (ESC) und der European Atherosclerosis Society (EAS)
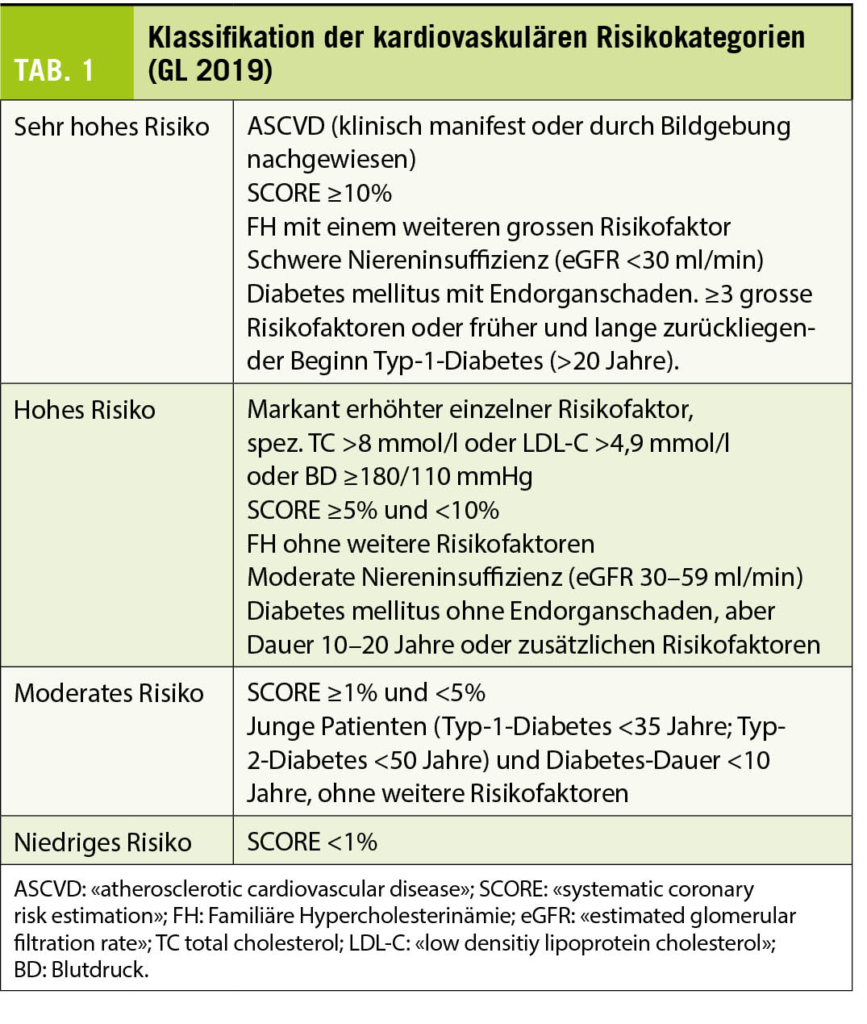
Die 2019 veröffentlichten Dyslipidämie-Richtlinien der ESC und EAS (2) unterscheiden vier Kategorien von Personen/Patienten, die zu sehr hohem, hohem, moderatem oder niedrigem kardiovaskulärem Risiko gehören (Tab. 1).
Zur «sehr hohen» Risikokategorie gehören Patienten mit dokumentierter atherosklerotischer kardiovaskulärer Erkrankung (ASCVD) oder einem kalkulierten SCORE (Systematic COronary Risk Evaluation)-Risiko ≥ 10% sowie Personen mit Familiärer Hypercholesterinämie (FH) in Kombination mit ASCVD oder einem anderen bedeutenden kardiovaskulären Risikofaktor. Auch Patienten mit schwerer chronischer Nierenerkrankung (eGFR < 30ml / min/1,73m2) oder einem Diabetes mellitus Typ 2 mit Endorganschädigung, ≥ 3 grossen Risikofaktoren oder lange zurückliegendem Diabetes mellitus Typ 1 (>20 Jahre) fallen unter die höchste Risikokategorie. Bei Personen/Patienten mit «sehr hohem» kardiovaskulärem Risiko sollte das LDL < 50% von Baseline gesenkt werden mit Zielwert <1.4 mmol/l (Tab. 2) (2).
Bei Patienten mit FH und Risikofaktoren, aber ohne ASCVD, sowie bei Patienten mit schwerer Nierenerkrankung ohne ASCVD gilt die strengere LDL-Zielvorgabe somit schon für die Primärprävention. Und das auch wenn die Evidenz dafür nicht so gut wie für die Sekundärprävention ist. Zur «hohen» Risikokategorie gehören Patienten mit SCORE ≥5% und <10%, mit einem markant erhöhten einzelnen Risikofaktor (z.B. TC >8 mmol/l oder LDL-C >4,9 mmol/l oder BD ≥180/110 mmHg), Personen mit FH ohne weitere Risikofaktoren oder mit moderater Niereninsuffizienz (eGFR 30 – 59 ml/min), Diabetes mellitus Typ 2 ohne Endorganschaden oder Diabetes mellitus Typ 1 seit 10 - 20 Jahren. Für Patienten mit als «hoch» eingestuftem Risiko lautet die Empfehlung, das LDL-Cholesterin soll mindestens 50% relativ zum Ausgangswert reduziert werden mit Zielwert < 1.8 mmol/l. Bei «moderater» Risikoerhöhung (Tab. 1) sollten die Werte möglichst unter 2.6 mmol/l liegen, während bei Patienten mit niedrigem Risiko (Tab. 1) Werte unter 3 mmol/l als Ziel in Betracht gezogen werden können (2, 4).
Neu ist auch, dass Bildgebung (CT-basierte Koronarkalk-Messung oder Ultraschall-Messung zur Ermittlung des Plaque-Befalls in den Karotis- oder Femoralarterien) zur Verbesserung der Risikoprädiktion bei asymptomatischen Personen mit einem als niedrig oder moderat erhöht eingestuften Risiko in Betracht gezogen werden (Klasse-IIa-Empfehlung) (2, 4).
Lipidsenkende Therapie
Nichtmedikamentöse Massnahmen (Ta-bakentwöhnung, Ernährungsumstellung, regelmässige Bewegung mit mindestens 30 – 45 min aerobem Training dreimal wöchentlich, Gewichtsabnahme bei Übergewicht) sollten immer eine notwendige medikamentöse Behandlung begleiten. Eine nicht-pharmakologische Therapie ist aber selten als alleinige Massnahme ausreichend: Durch Lebensstil-Veränderungen kann das LDL-Cholesterin nur um 10 – 20% reduziert werden. Die LDL-C Spiegel im Blut sind wesentlich von der Regulation in der Leber (nicht der Nahrungsaufnahme) abhängig, die genetisch bestimmt ist (2, 4).
Allerding wird die Qualität der LDL-Partikel positiv beeinflusst: Eine Ernährung reich an Anti-Oxidantien (Früchte, Gemüse, Nüsse, …) und der Verzicht auf Pro-Oxidantien (Tabak, Transfett, …) kann die Oxidation von LDL vermindern und dadurch möglicherweise einen günstigen Effekt auf das Herzkreislaufsystem erzielen.
Statine
Die neuen Leitlinien betonen erneut, dass wenn eine Therapie mit Medikamenten notwendig ist, Statine die Therapie der ersten Wahl darstellen (2, 4). Statine hemmen die körpereigene Bildung von Cholesterin in der Leber. Um den Cholesterinbedarf der Leber zu decken, werden auf ihrer Oberfläche mehr LDL-Rezeptoren gebildet. Infolgedessen kann die Leber mehr LDL-C aus dem Blut aufnehmen und der LDL-C Wert im Blut sinkt. Für Statine ist in grossen wissenschaftlichen Untersuchungen bewiesen, dass sie das Risiko für Herzinfarkt und Schlaganfall senken und ihre Einnahme über viele Jahrzehnte sicher ist (5, 6).
Die möglichen Nebenwirkungen von Statinen und das klinischenVorgehen bei Patienten, die über solche Symptome berichten, ist ebenfalls in den Guidelines in Detail erklärt (2, 7).
Zu betonen ist, dass die Vorteile der Statintherapie das Risiko von Nebenwirkungen deutlich überwiegen (2, 7).
Senken die Statine das LDL-C nicht in den Zielbereich oder werden sie nicht toleriert, empfehlen die Leitlinien den Einsatz einer nicht-Statin Therapie wie Ezetimib oder PCSK9-Hemmer (2, 4, 8).
Ezetimibe
Ezetimib hemmt die Cholesterinaufnahme im Darm durch Blockierung des Cholesterin-Transporters Niemann-Pick C1-like Protein 1 (NPC1L1) (9). Die Standarddosis von 10 mg/Tag als Monotherapie senkt das LDL-Cholesterin um etwa 15 – 20% (8). Die Kombinationstherapie mit Statinen ist besonders sinnvoll: Die IMPROVE-IT-Studie (9) zeigte bei 18.144 Teilnehmern mit kardiovaskulären Krankheiten, dass die Kombination Simvastatin-Ezetimib die kardiovaskulären Ereignisse (Kombination der Ereignisse kardiovaskulärer Tod, Herzinfarkt, erneute Hospitalisierung wegen instabiler Angina, Revaskularisation und Schlaganfall) signifikant stärker als die Monotherapie mit Simvastatin senkt (9).
Kein Unterschied zeigte sich hingegen bei der Mortalität. Zudem wurde kein signifikanter Unterschied in den Sicherheitsparametern zwischen den beiden Behandlungsstrategien und kein Unterschied bezüglich Nebenwirkungen auch bei sehr niedrigem LDL-C festgestellt (9).
PCSK9-Hemmer
Diese vollhumanen monoklonalen Antikörper senken die Plasma-Konzentration von Proprotein convertase subtilisin/kexin type 9 (PCSK9) und führen dadurch zur Erhöhung der LDL-Rezeptordichte und somit Senkung der Plasmaspiegel von LDL-C (8). PCSK9-Hemmer sind besonders wichtig für Hochrisikopatienten und Patienten mit familiärer Hypercholesterinämie, welche mit anderen lipidsenkenden Therapien keine ausreichende LDL-C Senkung erreichen können.
Zwei Medikamente dieser Klasse sind in der Schweiz zugelassen, Alirocumab und Evolocumab, deren Wirksamkeit und Sicherheit in den Studienprogrammen ODYSSEY bzw. PROFICIO evaluiert wurden.
Die GL basieren die neuen Empfehlungen auf zwei doppelblinde, randomisierte, Plazebo-kontrollierte Outcome Studien: FOURIER (10) mit Evolocumab und ODYSSEY OUTCOME (11) mit Alirocumab.
In FOURIER (10) wurden 27 564 Studienteilnehmer mit einer manifesten kardiovaskulären Erkrankung (Myokardinfarkt, MI), ischämischem Schlaganfall oder symptomatischer PAVK und einem LDL-Cholesterin-Wert von ≥1,8 mmol/l unter Statin-Therapie eingeschlossen. Es wurde gezeigt, dass die Kombination von Evolocumab und Statine das Risiko für den primären Endpunkt (Kombination von kardiovaskulärem Tod, Herzinfarkt, Schlaganfall, Hospitalisation wegen unstabiler Angina und Koronar-Revaskularisation) über 2,2 Jahren gegenüber Plazebo signifikant senkt. Dies bedeutet eine absolute Risikoreduktion um 1,5% bzw. eine relative um 15% (10).
In der ODYSSEY-Outcome-Studie (11) mit Alirocumab, wurde der Effekt von Alirocumab auf kardiovaskuläre Ereignisse bei ca. 18 000 Patienten nach Myokardinfarkt im Jahr vor Studieneinschluss evaluiert. Die Studie erreichte ihren primären Endpunkt und zeigte, dass Alirocumab das Risiko für schwere kardiovaskuläre Ereignisse (MACE) signifikant senkt. Auch diese Studie zeigte eine absolute Risikoreduktion um 1,5% bzw. eine relative um 15% (11).
In der Schweiz ist der Einsatz von PCSK9-Hemmer durch eine Limitatio eingeschränkt (Tab. 3). Deshalb sollen die Patienten vor Beginn einer Therapie mit PCSK9-Hemmern von Spezialisten diagnostiziert und betreut werden.
Die Empfehlungen für Fibrate, Anionenaustauschharze und LDL-Apherese sind in den aktuellen GL unverändert geblieben (2).
Praktischer Einsatz der Leitlinie
Mit den genannten Lipidsenkern und ihren Kombinationen lässt sich der LDL-C-Spiegel nach Auffassung der Leitlinien-Verfasser in dem für das Erreichen der Zielwerte erforderlichen Mass senken. Bei Patienten mit bestätigter Dyslipidämie soll das kardiovaskuläre Risiko immer evaluiert werden, durch Score oder direkt wenn eine Person zu der Risikokategorie «Sehr hohes Risiko» oder «Hohes Risiko» gehört (www.agla.ch, Tab. 1).
Faktoren wie das biologische Alter, die Lebenserwartung, andere kardiovaskuläre Risikofaktoren/Krankheiten, Polypharmazie, und die Familienanamnese sind wichtige Faktoren, welche die Indikation für eine lipidsenkende Therapie beeinflussen sollen.
Zu Beginn sollten die Patienten auf die maximal verträgliche Dosis eines Statins eingestellt werden. Reicht das nicht aus, um das risikoadaptierte Therapieziel für die LDL-C-Reduktion zu erreichen, wird nun mit mehr Nachdruck die Kombination mit Ezetimib empfohlen. Genügt auch das nicht, und sind die Limitationen (Tab. 3) erfüllt, besteht die nächste Option in der Zugabe eines PCSK9-Hemmers. Mit intensiver Statin-Monotherapie kann eine LDL-C-Senkung um 50%, mit intensiver Statin- plus Ezetimib-Therapie um 65% und mit einer Dreier-Kombination unter Einschluss eines PCSK9-Hemmers um 85% erreicht werden (2).
Die Richtlinien dienen als wertvolle Hilfe für unsere tägliche Praxis, es bleibt den einzelnen Ärzten überlassen, wie sie die Richtlinien umsetzen.
Copyright bei Aerzteverlag medinfo AG
Hypertonie-, Lipid-, Tabakentwöhnungssprechstunde
Kardiovaskuläre Forschung
Universitäres Herzzentrum, Klinik für Kardiologie
UniversitätsSpital Zürich
Rämistrasse 100
8091 Zürich
isabella.sudano@usz.ch
Konsulting- und Referentenhonorare und Vergütung von Reisespesen von Amgen, Astra-Zeneca, Boston-Scientific, Daiichi-Sankio, Medtronic, MSD, Novartis, Recordati, Sanofi und Servier. Die Autorin war Reviewer der ESC/EAS Lipidrichtlinien 2019 and Board-Mitglied der AGLA.
- Dyslipidämie/Hypercholesterinämie sind in der Schweiz deutlich unterdiagnostiziert und unterbehandelt.
- Bei Plasma LDL-C gilt «the lower the better»: Eine Senkung um 1 mmol/l entspricht einer Reduktion des kardiovaskulären Risikos um 20% und es gibt keine bekannten unerwünschten Effekte bei sehr tiefen LDL-C-Werten (<1 mmol/l).
- Bei Diagnose einer familiären Hypercholesterinämie soll die Therapie so früh wie möglich etabliert sein («the earlier the better»).
- Nicht nur Patienten in sekundär Prävention weisen ein sehr hohes resp. hohes kardiovaskuläres Risiko auf: in solchen Fällen soll die Therapie intensiv sein mit den Ziel, das LDL-C um >50% zu reduzieren und einen Zielwert von <1,4 mmol/l resp. 1.8 mmol/l zu erreichen.
- Statine sind die Medikamente erster Wahl. Wenn Statine nicht toleriert sind oder die Zielwerte nicht erreicht werden können, sollen nicht-Statin Medikamente wie Ezetimib oder PCSK9-Hemmer eingesetzt werden.
1. CH-Gesundheit Befragung 2019. In: Statistik Bf, editor. 2019.
2. Mach F, Baigent C, Catapano AL, Koskinas KC, Casula M, Badimon L, et al. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur Heart J. 2020;41(1):111-88.
3. Ference BA, Ginsberg HN, Graham I, Ray KK, Packard CJ, Bruckert E, et al. Low-density lipoproteins cause atherosclerotic cardiovascular disease. 1. Evidence from genetic, epidemiologic, and clinical studies. A consensus statement from the European Atherosclerosis Society Consensus Panel. Eur Heart J. 2017;38(32):2459-72.
4. Riesen WF, Kaiser W, Gallino A, Von Eckardstein A, Theus G, Beer JH. Neue ESC/EAS-Dyslipidämie-Guidelines. SWISS MEDICAL FORUM. 2020;20(9-10).
5. Cholesterol Treatment Trialists C, Baigent C, Blackwell L, Emberson J, Holland LE, Reith C, et al. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170,000 participants in 26 randomised trials. Lancet. 2010;376(9753):1670-81.
6. Collins R, Reith C, Emberson J, Armitage J, Baigent C, Blackwell L, et al. Interpretation of the evidence for the efficacy and safety of statin therapy. Lancet. 2016;388(10059):2532-61.
7. Mach F, Ray KK, Wiklund O, Corsini A, Catapano AL, Bruckert E, et al. Adverse effects of statin therapy: perception vs. the evidence – focus on glucose homeostasis, cognitive, renal and hepatic function, haemorrhagic stroke and cataract. Eur Heart J. 2018;39(27):2526-39.
8. Barthelmes J, Sudano I. Praxis (Bern 1994). 2017;106(17):933-40.
9. Cannon CP, Blazing MA, Giugliano RP, McCagg A, White JA, Theroux P, et al. Ezetimibe Added to Statin Therapy after Acute Coronary Syndromes. N Engl J Med. 2015;372(25):2387-97.
10. Sabatine MS, Giugliano RP, Keech AC, Honarpour N, Wiviott SD, Murphy SA, et al. Evolocumab and Clinical Outcomes in Patients with Cardiovascular Disease. N Engl J Med. 2017;376(18):1713-22.
11. Schwartz GG, Steg PG, Szarek M, Bhatt DL, Bittner VA, Diaz R, et al. Alirocumab and Cardiovascular Outcomes after Acute Coronary Syndrome. N Engl J Med. 2018;379(22):2097-107.
der informierte @rzt
- Vol. 10
- Ausgabe 12
- Dezember 2020