- Neue medikamentöse Therapien in der Rheumatologie
Mit der Einführung der ersten biotechnologisch hergestellten Therapie (sog. Biologikum) mit Remicade® (Infliximab) bei ungenügendem Ansprechen auf konventionelle Basistherapeutika (disease-modifying anti-rheumatic drugs, DMARDs) im Jahre 1999 begann die Zeit der modernen zielgerichteten immunologischen Therapien in der Rheumatologie. Dieser Artikel soll in Kürze die aktuellen Therapiemöglichkeiten zusammenfassen. Die meisten Zulassungen der Spezialitätenliste in der Rheumatologie existieren für die rheumatoide Arthritis (RA), die Psoriasis Arthritis (PsA) und die axiale Spondyloarthritis (früher M. Bechterew).
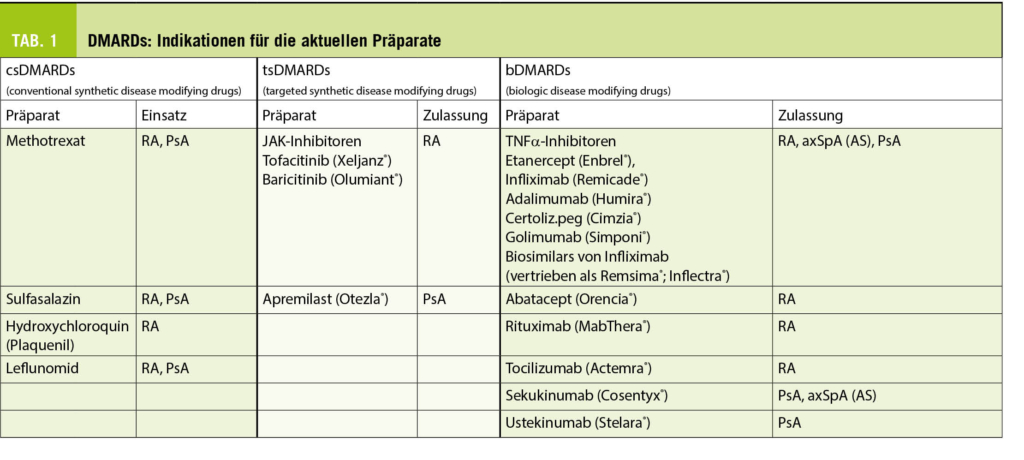
Bei den modernen zielgerichteten DMARDs kommen Antikörper, als Biologika bezeichnet und parenteral zu verabreichen, und synthetische, kleinmolekulare Signalübermittlungshemmer, als targeted synthetic DMARDs bezeichnet und peroral einzunehmen, zum Einsatz.
Biologika
Tumor-Nekrose-Faktor-alpha Inhibitoren (TNFα-I)
Die Gruppe TNFα-I umfasst aktuell fünf verschiedene Präparate und ein Nachahmer-Produkt (Biosimilar), welches in der Schweiz unter zwei verschiedenen Namen vertrieben wird (Tab.1). Ausser Infliximab, welches an das Körpergewicht adaptiert als Infusion appliziert wird, werden alle Präparate mit einer fixen Dosis nach einem vorgegebenen Schema subkutan verabreicht.
Actemra® (Tocilizumab)
Ist ein Interleukin-6 Rezeptor Hemmer und vorerst der einzig Zugelassene seiner Klasse. In der Wirksamkeit bei der RA und im Infektionsrisikoprofil ist es vergleichbar mit den anderen Biologika. Die Therapie ist sowohl als wöchentliche subkutane Applikation als auch monatliche Infusion verfügbar. Die Dosierung der Letzteren ist an das Körpergewicht adaptiert. Laborchemisch können Infekte kaschiert werden, da IL-6 direkt in die Synthese des CRPs eingreift. Daher gilt die unbedingte Regel, dass Patienten unter Actemra® besonderes genau klinisch begleitet werden müssen. Anders gesagt, bei Verdacht auf eine Infektion ist eine solche auch bei normwertigen humoralen Entzündungsparametern zu suchen.
Orencia® (Abatacept)
Ist ein Antikörper, welcher als Fusionsprotein die Aktivierung von T-Zellen durch Antigen präsentierende Zellen verhindert und bei der RA angewendet wird. Damit wirkt es als bisher einziges Biologikum direkt auf die T-Zellantwort. Obwohl keine direkten Kopf-an-Kopf Studien existieren, geht man von einem leicht besseren Infektionsrisikoprofil aus als bei anderen Biologika (1). Orencia® kann sowohl subkutan als auch intravenös verabreicht werden, wobei eine teilweise Gewichtsadaptation möglich ist.
Stelara® (Ustekinumab)
Ist ein monoklonaler Antikörper gegen Interleukin 12 und 23 und wird in der Rheumatologie bei Gelenkbefall bei Psoriasisarthritis angewendet. Eine Wirkung auf den Befall des Achsenskelettes wie bei der axialen Spondyloarthritis konnte bisher nicht bewiesen werden. Im Vergleich zu TNFα-I wirkt es ähnlich gut bei muskuloskelettalen peripheren Manifestationen (Arthritis, Enthesitis, Daktylitis) und sogar besser auf den psoriatischen Hautbefall. Das Risikoprofil ist vergleichbar mit den anderen biologischen Therapien.
Cosentyx® (Sekukinumab)
Ist ein monoklonaler Antikörper gegen Interleukin-17, der bei Spondylitis ankylosans zugelassen ist und auf sämtliche muskuloskelettale Manifestationen (Arthritis, Daktylitis, Enthesitis und auch auf den entzündlichen Befall des Achsenskeletts) eine Wirkung zeigt. IL-17-Hemmung scheint das bisher beste Wirkprinzip bei psoriatischem Hautbefall zu sein. Das Risikoprofil ist vergleichbar mit den anderen biologischen Therapien.
Mabthera® (Rituximab)
Mabthera ist ein chimärer monoklonaler anti-CD20-Antikörper (B-Zellen), welcher als 2nd-line Therapie bei RA zugelassen ist. Die mögliche Entwicklung einer Hypogammaglobulinämie, insbesondere bei Einsatz über vielen Jahren, sollte besonders kontrolliert werden. Der Vorteil der langen Dosierungsintervalle (6–12 Monate) kann bei Nichtansprechen auf die Behandlung ein Nachteil sein, da ein Wechsel auf ein anderes Biologikum erst nach einer gewissen Zeit möglich ist.
Targeted synthetic DMARDs
JAK-Inhibitoren
Seit 2013 ist Xeljanz® (Tofacitinib) und ganz neu auch Olumiant® (Baricitinib) zugelassen. Diese Januskinase-Inhibitoren werden der Gruppe der sogenannten targeted synthetic DMARDs zugeordnet und werden oral verabreicht. Ihre Wirkung entfalten sie über der Hemmung der Signal-Übertragung an Zytokinrezeptoren. Die Wirksamkeit (2) und das Sicherheitsprofil (3) sind gemäss bisherigen Erfahrungen mit den Biologika vergleichbar. In der Schweiz sind beide Präparate vorerst nur für die RA bei Versagen einer Behandlung mit konventionellen Basistherapien oder Biologika zugelassen
Otezla® (Apremilast)
Otezla® ist ein Phosphodiesterase-4-Hemmer, der eine Wirkung bei Psoriasis und Psoriasisarthritis zeigt. Vorteile bestehen in der oralen Einnahmeform, den im Gegensatz zu den meisten anderen Therapien nicht notwendigen Laborkontrollen und der Tatsache, dass er nicht immunsuppressiv wirkt. Im Gegensatz zu den konventionellen Basistherapeutika wie Methotrexat, das nur auf den Befall der peripheren Gelenke wirkt, ist Apremilast auch bei Enthesitiden und Daktylitiden wirksam. Allerdings ist der Wirkungsgrad schwächer und der Wirkungseintritt später als bei Biologika. Da es über Cytochrom P450 abgebaut wird, wird eine Kombination mit CYP P450 Induktoren wie beispielsweise Rifampicin, Antiepileptika und Johanniskraut mit Otezla nicht empfohlen (4).
Wesentliches im Umgang mit modernen DMARDs
Allgemeines Infektionsrisiko
Alle Biologika erhöhen das Risiko für schwere sowie atypische Infektionen. Es wird von ca. drei schweren Infektionen pro 100 Patientenjahre ausgegangen, was rund doppelt so hoch ist wie bei konventionellen DMARDs. Ebenfalls zweifach erhöht ist das Risiko für leichte Infektionen (5). Co-Morbiditäten, begleitende Immunsuppressiva inkl. Steroide oder Rauchen können das Infektionsrisiko zusätzlich erhöhen. Die Patienten werden angehalten sich bei Verschlechterung des Allgemeinzustandes oder Fieber rasch beim Arzt zu melden. Die Messung des CRP-Wertes hilft beim Entscheid inwieweit ein bakterieller Infekt vorliegt und Antibiotika verabreicht werden müssen. Besondere Vorsicht ist bei einer Behandlung mit Actemra angebracht, da Interleuktin-6 die CRP-Erhöhung ermöglicht und bei dessen Blockierung ein bakterieller Infekt mit normalem CRP-Wert einhergehen kann.
Perioperatives Management
Aufgrund eines erhöhten Infektionsrisikos und potentieller Wundheilungsstörungen sollten Biologika bei elektiven Eingriffen perioperativ pausiert werden. Die Dauer der Pausierung vor einer Operation entspricht dem jeweiligen Applikationsintervall eines Präparates (Beispiel: bei einem Biologikum, das monatlich subkutan verabreicht wird, sollte die letzte Verabreichung vier Wochen vor dem Eingriff erfolgen). Die Wiederaufnahme der Behandlung erfolgt bei gesicherter oberflächlicher Wundheilung, in der Regel nach 14 Tagen. Bei kleinchirurgischen Eingriffen mit tiefem Infektionsrisiko können alle Biologika weitergegeben werden. Konventionelle Basistherapeutika wie Methotrexat, Leflunomid, Sulfasalazin und Hydroxychloroquin müssen perioperativ nicht gestoppt werden.
Schwangerschaft
Empfehlungen zur antirheumatischen Therapie während Schwangerschaft und Stillzeit werden laufend aktualisiert (6, 7). Bei den meisten Biologika gibt es keine genügende Datenlage, so dass sie mehrere Monate vor der geplanten Schwangerschaft abgesetzt werden müssen (7, 8). Bei TNF-I ergaben Studien überwiegend keine erhöhte Malformationsrate, aber einen hohen aktiven Plazentatransfer bei kompletten monoklonalen Antikörpern, einen geringen Plazentatransfer bei Etanercept und keinen aktiven Transfer bei Certolizumab. Bei aktiver Erkrankung ist der Einsatz eines TNF-Hemmers in der SS nach Nutzen-Risiko-Abwägung möglich (Infliximab und Adalimumab bis in der 20. SSW, Etanercept bis in die 32. SSW und Certolizumab während der gesamten SS). TNF-Hemmer sind in der Stillzeit erlaubt, da keine messbaren TNF-I-Blutspiegel bei gestillten Säuglingen gefunden wurden. Hinsichtlich der «targeted synthetic DMARDs» war Tofacitinib teratogen in Tierstudien, so dass das Präparat zwei Monate vor einer SS abgesetzt werden muss. Apremilast sollte einen Monat vor einer geplanten Schwangerschaft abgesetzt werden.
Impfungen unter einer Biologika Therapie
Grundsätzlich sollte vor dem Beginn jeglicher immunsuppressiven Therapie eine Auffrischung des Impfstatus vorgenommen werden. Dabei ist zu beachten, dass Lebendimpfstoffe generell kontraindiziert sind, Totimpfstoffe aber weiterhin gegeben werden können. Generell gilt, dass eine alters- und geschlechtsspezifische Auffrischung des Impfstatus gemacht werden sollte. Empfohlen ist zudem eine jährliche Grippeimpfung (9), welche im Gegensatz zur Normalbevölkerung in allen Altersklassen unter Immunsuppression empfohlen wird. Zudem sollte eine Pneumokokken-Impfung durchgeführt werden, Die Impfantwort unter laufender Biologika Therapie wurde in Studien untersucht, wobei sich für TNFα-I keine verminderte Immunantwort zeigte, ganz im Gegensatz zu einer Therapie mit Rituximab (10).
Malignitätsrisiko
Seit der Einführung der ersten biologischen Therapien wird diskutiert, ob mit der immunsuppressiven Wirkung ein erhöhtes Malignitätsrisiko erkauft wird. Aufgrund der bisherigen Datenlage kann diesbezüglich grösstenteils Entwarnung gegeben werden (11, 12). Einzig bei Melanomen und Nicht-Melanom-Hautkrebsraten gibt es noch einzelne Kontroversen, so dass bei Immunsupprimierten weiterhin empfohlen wird, die Haut 1x jährlich von einem Dermatologen begutachten zu lassen.
Wirkungsspektrum und Therapiemonitoring
In Abhängigkeit der gewählten Medikation ist mit weiteren Nebenwirkungen zu rechnen, wie Lupus- und MS-ähnlichen Syndromen, psoriasiformen Hautveränderungen, Gewichtszunahme oder Hepatopathien, was eine entsprechende Überwachung notwendig macht.
Grundsätzlich fehlen aktuell Prädiktoren, um das Ansprechen auf ein einzelnes Präparat beim individuellen Patienten vorauszusagen. Aktuell geht man davon aus, dass bei der RA eine Remission oder tiefe Krankheitsaktivität in etwa 40–50% der Patienten unter einem Biologikum erreicht werden kann. Dabei sinkt die Ansprechrate mit jedem Therapiewechsel wegen Ineffektivität. Auch hier existieren nur vereinzelt Kopf-an-Kopf Studien. Das Ansprechen auf die Therapie soll bei sämtlichen Basistherapeutika mit validierten Scores wie dem DAS28 (Disease Activity Score mit 28 Gelenken) regelmässig (alle 1–3Monate) überprüft werden. Eine ungenügend wirksame Therapie sollte nie länger als 6 Monate erfolgen. Metho-trexat wird bei guter Verträglichkeit als Kombinationspartner zu den Biologika/ts DMARDs bei RA beibehalten, da es synergistisch wirkt. Entsprechend müssen auch weiterhin regelmässig Kontrollen von Blutbild, Transaminasen und Kreatinin erfolgen.
Klinik für Rheumatologie
UniversitätsSpital Zürich
Gloriastrasse 25
8091 Zürich
Matthias.Zingg@usz.ch
Klinik für Rheumatologie
UniversitätsSpital Zürich
Gloriastrasse 25
8091 Zürich
Mit der Einführung der ersten biotechnologisch hergestellten Therapie (sog. Biologikum) mit Remicade® (Infliximab) bei ungenügendem Ansprechen auf konventionelle Basistherapeutika (disease-modifying anti-rheumatic drugs, DMARDs) im Jahre 1999 begann die Zeit der modernen zielgerichteten immunologischen Therapien in der Rheumatologie. Dieser Artikel soll in Kürze die aktuellen Therapiemöglichkeiten zusammenfassen. Die meisten Zulassungen der Spezialitätenliste in der Rheumatologie existieren für die rheumatoide Arthritis (RA), die Psoriasis Arthritis (PsA) und die axiale Spondyloarthritis (früher M. Bechterew).
- Zu den modernen zielgerichteten Antirheumatika, welche den Krankheitsverlauf zu modifizieren vermögen, gehören eine Reihe von parenteral zu verabreichenden Antikörpern und von peroral wirksamen kleinmolekularen Substanzen
- Mit Ausnahme von Apremilast wirken diese Medikamente immunsuppressiv, so dass eine erhöhte Infektionsgefahr besteht. Actemra kann die laborchemische Infektdiagnostik beeinträchtigen wegen Hemmung des Interleukin-6 vermittelten CRP-Anstiegs
- Das allgemeine Malignitätsrisiko scheint nicht erhöht zu sein, jedoch ist wegen der Möglichkeit von Hauttumoren eine regelmässige dermatologische Überwachung angezeigt
- Bei knapp der Hälfte der behandelten Patienten kann eine tiefe Krankheitsaktivität oder gar Remission erreicht werden
1 Yun H, Xie F, Delzell E, Levitan EB, Chen L, Lewis JD, Saag KG, Beukelman T, Winthrop KL, Baddley JW, Curtis JR. Comparative Risk of Hospitalized Infection Associated With Biologic Agents in Rheumatoid Arthritis Patients Enrolled in Medicare. Arthritis Rheumatol. 2016 Jan;68(1):56-66. doi: 10.1002/art.39399.
2 Keystone EC, Taylor PC, Tanaka Y, Gaich C, DeLozier AM, Dudek A, Zamora JV, Cobos JAC, Rooney T, Bono S, Arora V, Linetzky B, Weinblatt ME. Patient-reported outcomes from a phase 3 study of baricitinib versus placebo or adalimumab in rheumatoid arthritis: secondary analyses from the RA-BEAM study. Ann Rheum Dis. 2017 Nov;76(11):1853-1861. doi: 10.1136/annrheumdis-2017-211259. Epub 2017 Aug 10.
3 Cohen SB, Tanaka Y, Mariette X, Curtis JR, Lee EB, Nash P, Winthrop KL, Charles-Schoeman C, Thirunavukkarasu K, DeMasi R, Geier J, Kwok K, Wang L, Riese R, Wollenhaupt J. Long-term safety of tofacitinib for the treatment of rheumatoid arthritis up to 8.5 years: integrated analysis of data from the global clinical trials. Ann Rheum Dis. 2017 Jul;76(7):1253-1262. doi: 10.1136/annrheumdis-2016-210457. Epub 2017 Jan 31.
4 Liu Y, Zhou S, Wan Y, Wu A, Palmisano M. The impact of co-administration of ketoconazole and rifampicin on the pharmacokinetics of apremilast in healthy volunteers. Br J Clin Pharmacol. 2014 Nov;78(5):1050-7. doi: 10.1111/bcp.12448.
5 Strangfeld A, Zink A. Safety of biologic therapy – results from the German biologics register RABBIT. Dtsch Med Wochenschr. 2014 Sep;139(37):1817-20. doi: 10.1055/s-0034-1370252. Epub 2014 Sep 2.
6 Homepage Schweizerische Gesellschaft für Rheumatologie: http://www.rheuma-net.ch/download/Content_attachments/FileBaseDoc/Antirheumatische-Therapie-in-der-Schwangerschaft-Emfehlungen-SGR-01-2016.pdf
7 Götestam Skorpen C, Hoeltzenbein M, Tincani A, Fischer-Betz R, Elefant E, Chambers C, da Silva J, Nelson-Piercy C, Cetin I, Costedoat-Chalumeau N, Dolhain R, Förger F, Khamashta M, Ruiz-Irastorza G, Zink A, Vencovsky J, Cutolo M, Caeyers N, Zumbühl C, Østensen M. The EULAR points to consider for use of antirheumatic drugs before pregnancy, and during pregnancy and lactation. Ann Rheum Dis. 2016 May;75(5):795-810. doi: 10.1136/annrheumdis-2015-208840. Epub 2016 Feb 17.
8 Pottinger EM, Woolf RT, Exton LS, Burden AD, Nelson-Piercy C, Smith CH. Exposure to biologic therapies during conception and pregnancy: a systematic review. Br J Dermatol. 2017 Jul 18. doi: 10.1111/bjd.15802. [Epub ahead of print].
9 Klinkenberg RE, Gelinck LB. Influenza vaccination in immunocompromised patients. Ned Tijdschr Geneeskd. 2014;158:A7574.
10 Hua C, Barnetche T, Combe B, Morel J. Effect of methotrexate, anti-tumor necrosis factor α, and rituximab on the immune response to influenza and pneumococcal vaccines in patients with rheumatoid arthritis: a systematic review and meta-analysis. Arthritis Care Res (Hoboken). 2014 Jul;66(7):1016-26. doi: 10.1002/acr.22246.
11 Wadström H, Frisell T, Askling J; Anti-Rheumatic Therapy in Sweden (ARTIS) Study Group. Malignant Neoplasms in Patients With Rheumatoid Arthritis Treated With Tumor Necrosis Factor Inhibitors, Tocilizumab, Abatacept, or Rituximab in Clinical Practice: A Nationwide Cohort Study From Sweden. JAMA Intern Med. 2017 Nov 1;177(11):1605-1612. doi: 10.1001/jamainternmed.2017.4332.
12 Ramiro S, Sepriano A, Chatzidionysiou K, Nam JL, Smolen JS, van der Heijde D, Dougados M, van Vollenhoven R, Bijlsma JW, Burmester GR, Scholte-Voshaar M, Falzon L, Landewé RBM. Safety of synthetic and biological DMARDs: a systematic literature review informing the 2016 update of the EULAR recommendations for management of rheumatoid arthritis. Ann Rheum Dis. 2017 Jun;76(6):1101-1136. doi: 10.1136/annrheumdis-2016-210708. Epub 2017 Mar 15.
der informierte @rzt
- Vol. 8
- Ausgabe 5
- Mai 2018