- Neue Therapiemöglichkeiten beim lokalisierten Prostatakarzinom?
Im Bestreben, die Invasivität und Nebenwirkungsquote der aktuellen Behandlungsoptionen des Prostatakarzinoms zu reduzieren, werden aktuell verschiedene fokale Therapieverfahren entwickelt und kommen heute zunehmend als experimentelle Behandlung v.a. im Rahmen von klinischen Studien zum Einsatz. In diesem Artikel werden die Verfahren im Einzelnen vorgestellt. Es sei aber betont, dass die EAU Guidelines (European Association of Urology) all diese fokalen Therapien als klinisch experimentell betrachtet und nur in prospektiv kontrollierten Studien zur Anwendung empfiehlt. Aktuell stellt einzig die radikale Prostatektomie, die Radiotherapie oder die LDR-Brachytherapie eine leitliniengerechte onkologische Therapie mit vertretbaren Nebenwirkungen dar.
Da es sich hauptsächlich um prospektive klinische Studien handelt mit nur kurzem Follow-up sind keine Zahlen bezüglich des tumorfreien Überlebens oder PSA free survival vorhanden.
Prostatakrebs ist die zweithäufigste Krebserkrankung bei Männern. Weltweit wurden 2012 schätzungsweise 1,1 Millionen diagnostiziert. Das sind 15% aller diagnostizierten Krebserkrankungen. Schweizweit sind es ca. 6000 Neuerkrankungen pro Jahr und 1300 Todesfälle aufgrund der Erkrankung.
Ein Hinweis für das Vorliegen einer Prostatakrebserkrankung kann das Abtasten der Prostata und die Bestimmung des PSA Wertes geben. Die Diagnose wird schlussendlich durch eine Gewebeentnahme (Biopsie) gesichert, heutzutage wird diese meistens mittels MRT-TRUS fusionsgesteuert durchgeführt.
Aufgrund eines wachsenden Bewusstseins für das Prostatakarzinom (PCa) zeigte sich in den letzten zwei Dekaden ein Trend zur früheren Diagnose durch Screening-Strategien und laufend verbesserte Bildgebungen. Die Folge davon ist, dass Männer in einem früheren Stadium mit kleineren Tumoren, die nur einen geringen Teil des Prostatavolumens ausmachen (meistens unifokal oder unilateral), identifiziert werden (1, 2). Daher sind in den letzten Jahren immer mehr neue Therapiemodalitäten entwickelt worden, die mit den Standardverfahren zur kurativen Therapie konkurrieren. Das Ziel ist, mit einem minimal invasiven Verfahren eine gleichwertige onkologische Sicherheit, eine verringerte Toxizität und verbesserte funktionelle Ergebnisse zu gewährleisten, indem sie nur die Indexläsion, also den klinisch relevanten Tumorherd, eliminieren (3, 4). Im Folgenden werden ausgehend von den Standardtherapieverfahren die neuen fokalen Therapiemodalitäten, die in der Literatur beschrieben sind, aufgeführt.
Standardtherapieverfahren
Beim klinisch lokalisierten Prostatakarzinom sind die nachfolgend aufgeführten Standardtherapieverfahren bekannt, es sei nochmals darauf hinzuweisen, dass diese bis heute als einzige Therapieverfahren gelten, die zur Kuration der Tumorerkrankung führen können. Alle Standarttherapieverfahren sind mit einer gewissen Morbidität insbesondere erektiler Dysfunktion oder Kontinenzproblemen verbunden, die auch die Lebensqualität der Patienten einschränken können.
Eine Lebenserwartung von mindestens zehn Jahren sollte vorhanden sein, um von einer lokalen Behandlung zu profitieren. Bei Männern mit PCa sind die Komorbiditäten wichtiger als das Alter, um die Lebenserwartung vorherzusagen.
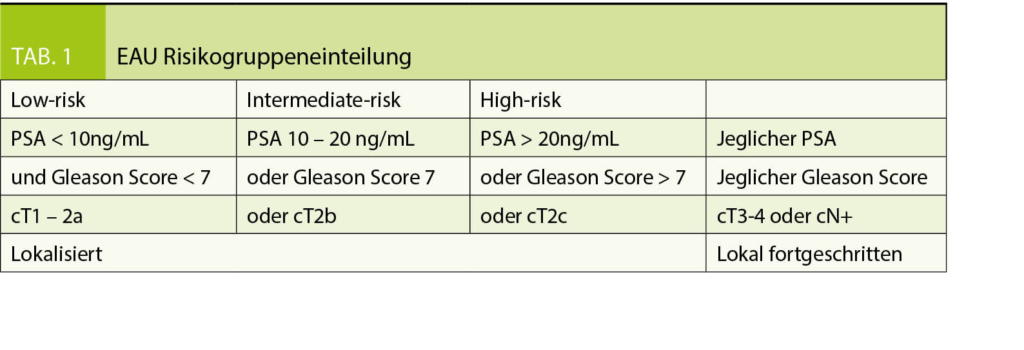
Radikale Prostatektomie (RP): offen retropubische oder heutzutage meistens roboterassistierte laparoskopische Prostatektomie (RALP). Das Ziel dieser Therapiemethode ist die totale Entfernung des Tumors, wobei die Kontinenz und Potenz erhalten bleiben, wann immer dies möglich ist. Das Verfahren umfasst das Entfernen der gesamten Prostata mit intakter Kapsel und Samenbläschen, gefolgt von einer vesiko-urethralen Anastomose. Zur Erhöhung der postoperativen Kontinenz- und Potenzraten kann bei der Operation je nach Tumorstadium meist eine Nervschonung angeboten werden. Verschiedene Studien haben gezeigt, dass das CSS (cancer specific survival) beim low risk und intermediate risk Karzinom (Tab. 1) 80-99% beträgt, bei einem medianen follow-up von, je nach Studie, 120-283 Monaten (5, 6, 7).
Radiotherapie (EBRT, External Beam Radiation Therapy)
Bei der perkutanen Strahlentherapie, das heisst der Bestrahlung von ausserhalb des Körpers, werden hochenergetische Röntgenstrahlen eingesetzt, um die Krebszellen abzutöten. Patienten mit einem Tumor mit niedrigem Risiko sollen mit mindestens 70-72 Gray (Gy; ggf. 74-80 Gy bei intensitätsmodulierter Strahlentherapie, IMRT) bestrahlt werden. Patienten mit einem Tumor mit mittlerem Risiko sollten dagegen eine höhere Strahlendosis (74- 80 Gy) erhalten. Die Bestrahlung dauert je nach Einzeldosisapplikation (ca. 2.5 Gy) 4-6 Wochen. Zudem folgt konkomitierend je nach Aggressivität des Prostatakarzinoms eine Androgendeprivation für 6-24 Monate. Häufige Nebenwirkungen sind irritative Miktionsbeschwerden. Je nach Studie zeigt sich eine 5-Jahres-Überlebensrate von 85% beim low risk oder intermediate risk Karzinom.
Bei der Low-dose rate (LDR) Brachytherapie werden Titanstifte mit niedriger Dosisrate permanent in die Prostata implantiert. Meistens wird für die radioaktiven Samen Iod-125 (I-125) oder auch Palladium (PD-103) verwendet. Die Strahlendosis wird über Wochen und Monate abgegeben. Die Samen können problemlos in der Prostata belassen werden. Akute Nebenwirkungen wie obstruktive oder irritative Miktion klingen über Monate ab. Es gibt bestimmte Kriterien, die über die Möglichkeit der Verwendung dieser Therapieoption entscheiden. Das 5 bis 10 Jahre tumorfreie Überleben bei low risk Karzinom liegt je nach Studien, zwischen 71%-93% bzw. 65%-85% (8).
Fokale Therapiemodalitäten
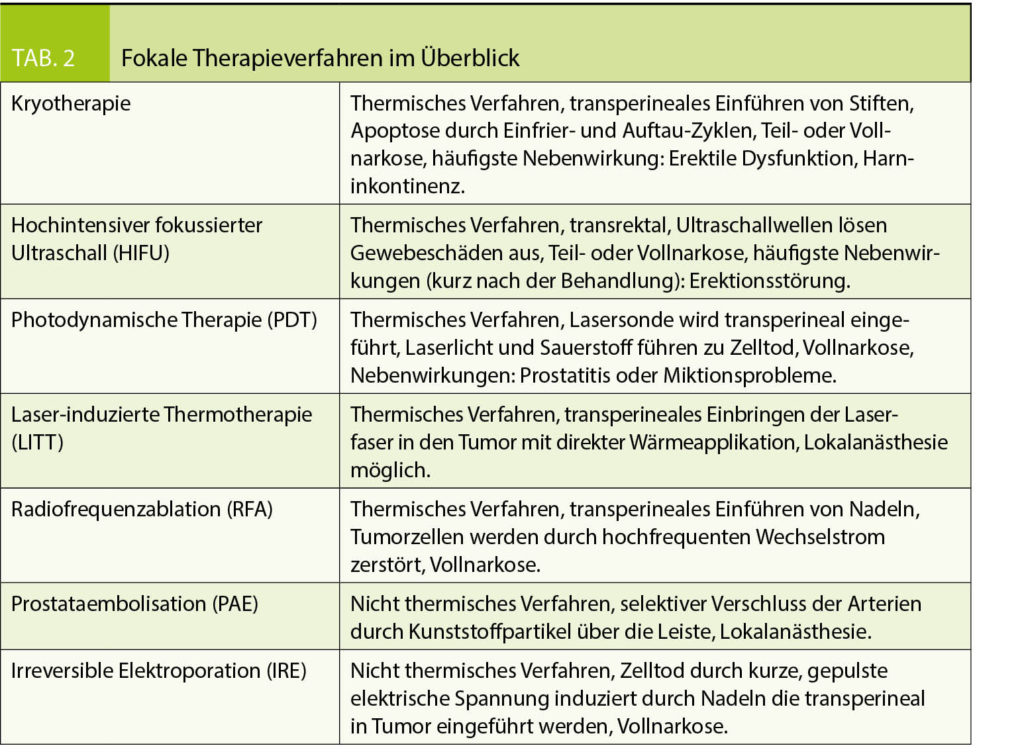
Der Hauptzweck der Fokaltherapie besteht darin, Tumore selektiv abzutragen und gleichzeitig die Toxizität zu begrenzen, indem die neurovaskulären Bündel der Prostata, der Schliessmuskel und die Harnröhre geschont werden (Tab. 2) (9, 10).
Die Hauptunterscheidung zwischen den Ablationsmodalitäten besteht darin, ob die Ablation auf einer thermischen Schädigung des Gewebes oder nicht-thermischen Veränderungen beruht, die auf zellulärer Ebene zu Apoptose führen.
Unter Kryotherapie versteht man die kontrollierte Abtötung von Tumorgewebe durch Gefrieren und Auftauen, wodurch der Zelltod durch Dehydratisierung induziert wird. Über Denaturierungsprozesse führt dies zur ischämischen Apoptose. Das Einfrieren der Prostata wird durch die Platzierung von Stiften unter TRUS (Transrektaler Ultraschall)-Führung, durch den Damm in das Prostatagewebe, durchgeführt. Es erfolgen Einfrier-Auftau-Zyklen, die zu einer Temperatur von -40 ° C führen (11). Häufigste Nebenwirkungen sind erektile Dysfunktion und Harninkontinenz. Die Behandlung erfolgt in Teil- oder Vollnarkose.
Hochintensiver fokussierter Ultraschall (HIFU) besteht aus fokussierten Ultraschallwellen, die von einem Wandler ausgesendet werden und Gewebeschäden durch mechanische und thermische Effekte sowie durch Kavitation verursachen (12). Das Ziel von HIFU ist es, Tumorgewebe über 65° C zu erhitzen, so dass es durch koagulative Nekrose zerstört wird. Zu den Nachteilen von HIFU gehören Schwierigkeiten bei der Erzielung einer vollständigen Ablation der Prostata, insbesondere in Drüsen, die grösser als 40 ml sind, und bei der Bekämpfung von Krebserkrankungen in der vorderen Zone der Prostata (13). Nebenwirkungen, die kurz nach Intervention auftreten können, sind Miktionsprobleme oder Erektionsstörungen. Die Behandlung erfolgt in Teil- oder Vollnarkose.
Unter photodynamischer Therapie (PDT) versteht man eine Behandlungsmethode, bei der eine Substanz intravenös appliziert wird. Der Wirkstoff (Photosensibilisator) reichert sich im Tumor an und schädigt diesen, sobald er mit Licht, über eine transperineal eingeführte Laser-Faser, in der Prostata aktiviert wird. Dabei überträgt sich die Lichtenergie auf das Medikament, es entsteht aktiver Sauerstoff, der die Tumorzelle zerstört (14). Nebenwirkungen können Prostatitis und Miktionsprobleme sein.
Laser-induzierte Thermotherapie (LITT), auch fokale Laserablation genannt, ist ein weiteres thermisches Verfahren, das zur Ablation führt. Es wird Wärmeenergie in Form von Laserlicht anstelle von heissen Drähten oder elektrischem Strom, verwendet. Im Gegensatz zu PDT ist LITT eine direkte Wärmeenergie und verwendet keine Photosensibilisatoren. Die Laserfasern sind transperineal oder transrektal direkt im Tumor positioniert. Die Anzahl der Fasern hängt vom Volumen des Zielgewebes ab (15). Eine lokale Betäubung ist möglich.
Radiofrequenzablation (RFA) ist ein weiteres thermisches Verfahren, das mittelfrequenten oder hochfrequenten Wechselstrom liefert, um im Zielgebiet Wärme zu erzeugen, die zum Zelltod führt. Ähnlich wie bei allen anderen Energiequellen, ausser HIFU der Prostata, wird es durch transperineales Einführen bestimmter Nadeln abgegeben (15). Der Eingriff erfolgt in Vollnarkose.
Die PAE (Prostatic Artery Embolization, dt. Prostataembolisation) ist ein Verfahren, welches in örtlicher Betäubung durchgeführt wird. Es wird die prostatische arterielle Versorgung mittels selektiver Arteriographie identifiziert. Danach die Prostatagefässe selektiv katheterisiert und die Arterien, welche die Prostata mit Blut versorgen, selektiv mit kleinen Kunststoffpartikeln verschlossen. In einer Pilotstudie wurde gezeigt, dass durch das Verfahren in einige Läsionen Tumorregression induziert wurde, ohne allerdings den vitalen Krebs vollständig zu eliminieren (16).
Die irreversible Elektroporation (IRE) ist eine neuartige bildgesteuerte Gewebeabtragungstechnologie, die den Zelltod durch sehr kurze, aber stark gepulste elektrische Spannung, die durch im Tumor applizierte Nadeln (transperineal eingeführt), induziert wird, hervorruft. Der Hauptunterschied zu anderen Ablationsmodalitäten besteht darin, dass es nicht thermischer Natur ist (17). Der Eingriff erfolgt in Vollnarkose. Es zeigen sich weniger Nebenwirkungen als bei thermischen Verfahren, trotzdem können Entzündung des Einstichkanals oder Blutungen auftreten.
Bisher ist die onkologische Wirksamkeit für die meisten Fokaltherapien angesichts des Mangels an zuverlässigen prospektiven Daten noch nicht belegt und muss weiter untersucht werden, bevor Empfehlungen für die klinische Routinepraxis gegeben werden können.
Eine leitliniengerechte onkologische Therapie mit vertretbaren Nebenwirkungen stellt aktuell einzig die radikale Prostatektomie, die Radiotherapie oder die LDR-Brachytherapie dar.
Copyright bei Aerzteverlag medinfo AG
Klinik für Urologie
Kantonsspital St. Gallen
Rorschacherstr. 95
9007 St. Gallen
Klinikum rechts der Isar
Technische Universität München
Klinik und Poliklinik für Urologie
Ismaninger Strasse 22
D-81675 München
Klinik für Urologie
Kantonsspital St. Gallen
Rorschacherstr. 95
9007 St. Gallen
Die Autoren haben im Zusammenhang mit diesem Beitrag keine Interessenskonflikte zu deklarieren.
- Der Hauptzweck jeder invasiven Therapie des Prostatakarzinoms besteht in der Tumorfreiheit und einem anhaltenden tumorfreien Überleben, was mit der fokalen Therapie bis heute noch keinesfalls der Fall ist, denn Tumore können nicht selektiv abgetragen werden, um das Karzinom zu heilen.
- Das Rationale für eine fokale Therapie besteht darin, Tumore selektiv abzutragen und gleichzeitig die Toxizität zu begrenzen unter Schonung des neurovaskulären Bündels, des Schliessmuskels und der Harnröhre.
- Aufgrund der aktuellen Datenlage handelt es sich um klinisch experimentelle Verfahren und können daher nicht gleichwertig wie die Standardtherapieverfahren in Bezug auf Kuration des Prostatakarzinoms gesehen werden.
1. Ferlay, J., et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer, 2015. 136: E359.
2. Haas, G.P., et al. The worldwide epidemiology of prostate cancer: perspectives from autopsy studies. Can J Urol, 2008. 15: 3866.
3. Han, K.R., et al. Third-generation cryosurgery for primary and recurrent prostate cancer. BJU Int, 2004. 93: 14.
4. Schmid, H.-P., et al. Embolisation der Prostataarterien bei benigner Prostatahyperplasie und beim lokalisierten Prostatakarzinom. Leading Opinions Urol, 2018 8:9.
5. Hamdy, F.C., et al. 10-Year Outcomes after Monitoring, Surgery, or Radiotherapy for Localized Prostate Cancer. N Engl J Med, 2016. 375: 1415.
6. Wilt, T.J., et al. Follow-up of Prostatectomy versus Observation for Early Prostate Cancer. N Engl J Med, 2017. 377: 132.
7. Bill-Axelson, A., et al. Radical Prostatectomy or Watchful Waiting in Prostate Cancer – 29-Year Follow-up. N Engl J Med, 2018. 379: 2319.
8. Grimm, P., et al. Comparative analysis of prostate-specific antigen free survival outcomes for patients with low, intermediate and high risk prostate cancer treatment by radical therapy. Results from the Prostate Cancer Results Study Group. BJU Int, 2012. 109 Suppl 1: 22.
9. Ahmed, H.U., et al. Will focal therapy become a standard of care for men with localized prostate cancer? Nat Clin Pract Oncol, 2007. 4: 632.
10. Crawford, E.D., et al. Targeted focal therapy: a minimally invasive ablation technique for early prostate cancer. Oncology (Williston Park), 2007. 21: 27.
11. Fahmy, W.E., et al. Cryosurgery for prostate cancer. Arch Androl, 2003. 49: 397.
12. Madersbacher, S., et al. High-Energy Shockwaves and Extracorporeal High-Intensity Focused Ultrasound. J Endourol, 2003;17: 667-72
13. Ramsay, C. R., et al. “Ablative Therapy for People with Localised Prostate Cancer: A Systematic Review and Economic Evaluation.” Health Technol Assess, 2015 19: 1.
14. Zhu T.C., et al. Determination of the distribution of light, optical properties, drug concentration, and tissue oxygenation in-vivo in human prostate during motexafin lutetium-mediated photodynamic therapy. J Photochem Photobiol, 2005 79:231
15. Valerio M. et. al. New and Established Technology in Focal Ablation of the Prostate: A Systematic Review. Eur Urol. 2017. 71: 1
16. Mordasini L. et al. Prostatic Artery Embolization in the Treatment of Localized Prostate Cancer: A Bicentric Prospective Proof-of-Concept Study of 12 Patients. J Vasc Interv Rasiolo, 2018 29:589
17. Guenther E et al. Prostate cancer treatment with Irreversible Electroporation (IRE): Safety, efficacy and clinical experience in 471 treatments. PLoS One, 2019 14: e0215093
der informierte @rzt
- Vol. 10
- Ausgabe 6
- Juni 2020