- Neurogene Gesichtsschmerzen
Schmerzphysiologische Aspekte
Generell werden intensive mechanische, thermische oder chemische Reize durch spezialisierte Rezeptoren an peripheren Endigungen von myelinfreien oder -armen Nervenfasern (Nozizeptoren) in sog. Rezeptorpotenziale umgewandelt. Thermische Reize werden z.B. von TRP-Kanälen (transient receptor potential channels) in neurale Signale umkodiert, chemische Reize von ASI-Kanälen (Acid-sensing ion channels), etc. (3). Die Ionenströme durch diese Rezeptorkanäle resultieren in einer Änderung des neuronalen Ruhepotenzials. Dies wiederum führt zur Aktivierung von membranständigen Na+- Kanälen. Im Gesichtsbereich erfolgt dies entlang der trigeminalen Hauptäste (N. ophthalmicus V1; N. maxillaris V2; N. mandibularis V3). Je nach Nervenfasertyp verläuft die «Signalwelle» unterschiedlich schnell Richtung Hirnstamm, was mit der Verteilung der Na+-Kanäle zu tun hat. Diese sind bei unmyelinisierten Nervenfasern sequentiell (entlang der Nervenmembran) eingelagert, was mit einer relativ langsamen Reizleitung einhergeht. Bei den viel schneller leitenden berührungs- und vibrationsvermittelnden Fasern mit isolierender Myelinschicht sind die Na+- Kanäle an den Ranvierschen Schnürringen konzentriert. Dies hat zur Folge, dass die Reizleitung via Schnürringe «springt» und daher viel schneller erfolgt. Die dicke Myelinscheide trennt demzufolge berührungsvermittelnde Nervenfasern von Nozizeptoren.
Trigeminus-Neuropathie
Die physiologischen Kenntnisse sind Voraussetzung zum Verständnis des unterschiedlichen Empfindungscharakters und zeitlichen Schmerzmusters bei selektiven Myelinschäden (neuralgiformer Schmerz) gegenüber Nervenverletzungen (neuropathischer Schmerz).
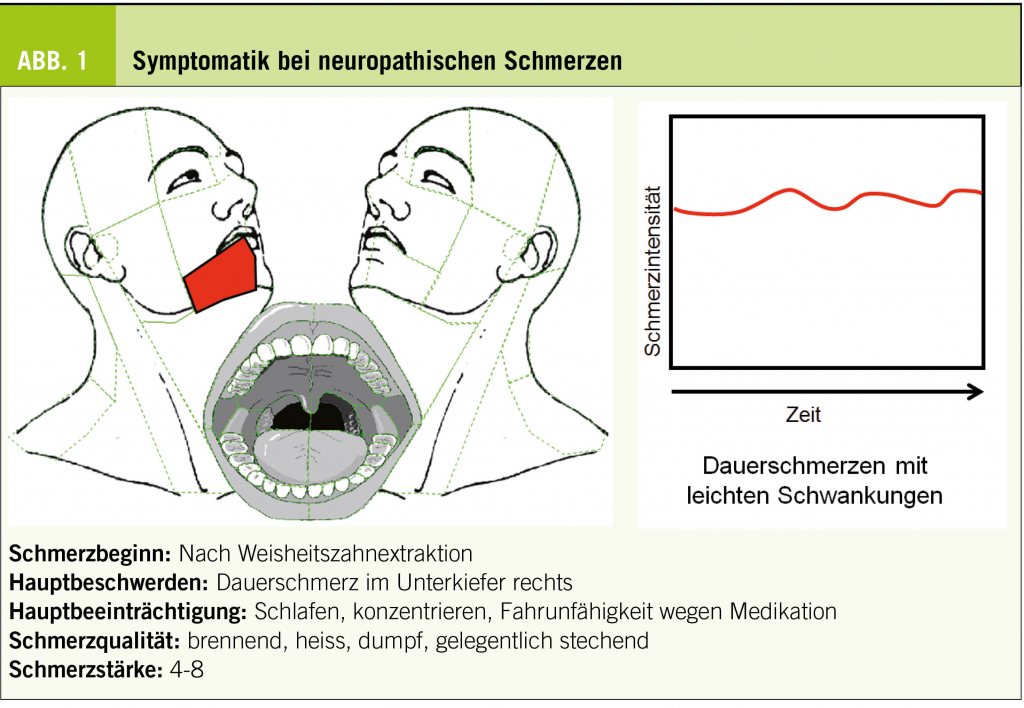
Bei peripheren Nervenverletzungen imponieren überwiegend persistierende Schmerzen von brennender Qualität (Abb. 1) (18). Dieser neuropathische Schmerzcharakter ist zumindest teilweise dadurch erklärlich, dass bei fehlerhafter Heilung Neurome entstehen (desorganisierte Aussprossungen von Nervenfasern). Dabei kommt es zu vermehrter Einlagerung von Thermorezeptoren (TRP-Kanäle) in verletzte wie auch benachbarte unverletzte Nervenfasern (10, 19). Das Anhalten der Schmerzen wird durch eine Akkumulation von dysfunktionalen Na+-Kanälen begünstigt und führt zusätzlich zu erhöhter Gewebeempfindlichkeit (Allodynie), häufig auch von benachbarten Regionen (1, 22).
Anhaltenden neuropathischen Mund- und Gesichtsschmerzen geht fast immer ein Trauma voran. Gemäss einer prospektiven klinischen Studie leiden ca. 10% der Personen, die eine Zahnwurzelbehandlung benötigten – also einen auf den Zahnnerv beschränkten Eingriff – noch nach 6 Monaten an persistierenden Schmerzen (15). Das zur Zahnabdichtung notwendige Füllmaterial verhindert die normale Nervenregeneration und fördert dadurch die Entstehung von Mikroneuromen (9). Der Schmerzcharakter hat gemäss den oben beschriebenen molekularen Mechanismen meist einen brennenden Anteil.
Ein Hauptproblem bei anhaltenden Zahn- bzw. Gesichtsschmerzen ist das mangelnde Verständnis dieser Schmerzmechanismen, was Patienten, deren Angehörige und gelegentlich auch Behandelnde zu «Verzweiflungstaten» bewegt. Der unnötige Austausch von Füllmaterialien, weitere Wurzelbehandlungen oder gar Zahnextraktionen ziehen aber letztlich nur zusätzlichen biologischen, emotionalen und finanziellen Schaden nach sich. Zentral für die Therapie ist vielmehr das empathische aufklärende Gespräch mit der Information, dass operative Eingriffe an Zähnen, Kiefer und Gesicht die persistierenden Schmerzen nicht lindern können, sondern dass im Gegenteil ein Risiko zur Verstärkung besteht. Zur systematischen Befragung der somatischen Symptomatik und psychologischen Belastung sind web-basierte Instrumente entwickelt worden (Zugang auf Anfrage beim korrespondierenden Autor erhältlich) (7). Auch wenn keine psychische Störung mit Krankheitswert vorliegt, sollte je nach Ausmass des Leidensdrucks von Anfang an die Wichtigkeit einer unterstützenden schmerzpsychologischen Begleitung angesprochen werden.
Die Pharmakotherapie bei anhaltenden Gesichtsschmerzen orientiert sich an den Empfehlungen für andere neuropathische Schmerzen (8). Bei intraoralen Schmerzen im dento-alveolaren Bereich bietet sich eine lokale Therapie mittels Medikamententrägern in Form weicher Zahnschienen mit Deckung der Schleimhaut an (2). Mit der Kombination von Amitriptylin und Ketamin in Gelform haben die Autoren gute Erfahrungen gemacht, allerdings sind keine Fertigpräparate verfügbar (14). Bei systemischer Applikation zeigen trizyklische Antidepressiva die höchste Wirksamkeit, wobei der analgetische Effekt vor der antidepressiven Wirkung einsetzt und die Dosis meist niedrig gehalten werden kann (unter 50 mg) (16). An zweiter Stelle sind Ca++-Kanal-Hemmer wie Gabapentin und Pregabalin empfehlenswert. Enttäuschenderweise haben sich modernere Antidepressiva (SSRI, SNRI) bei neuropathischen Schmerzen als weniger erfolgreich erwiesen. Ihr Einsatz kann aber indiziert sein, wenn psychische Begleitkrankheiten das Beschwerdebild prominent mitprägen. Konventionelle Schmerzmedikamente (nicht-steroidale Antirheumatika) sind i.d.R. nutzlos.
Trigeminus-Neuralgie
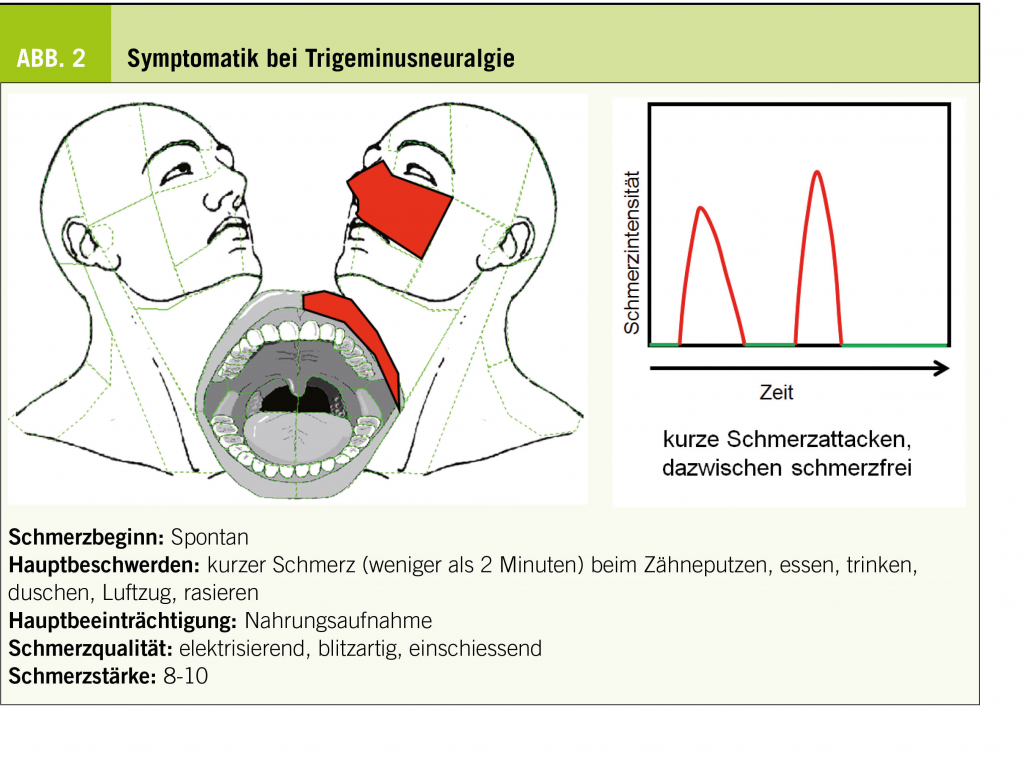
Die Trigeminusneuralgie kann in jedem Alter auftreten, betrifft aber überwiegend Personen älter als 60 Jahre. Die Inzidenz beträgt ca. 3-5/100 000 Einwohner. Der charakteristische Schmerz der Trigeminus-Neuralgie ist dem lokalen Verlust von Myelin zuzuschreiben, welches normalerweise die rasche Signalleitung auf taktile Fasern beschränkt. Wenn das schnelle neurale Signal am Ort des Myelinschadens (meist nahe dem Hirnstamm) vom taktilen aufs schmerzleitende System überspringen kann, entstehen neuralgiforme Schmerzen (5). Die Krankheit ist charakterisiert durch kurzzeitige (Sekunden bis max. 2 min) attackenartige Gesichtsschmerzen von hoher bis höchster Intensität, welche als elektrisierend, blitzartig und einschiessend beschrieben werden. Typische Schmerzauslöser sind leichte Berührungsreize wie Windzug, Schminken, Zähneputzen, Rasieren, aber auch Alltagsaktivitäten wie Sprechen und Schlucken. Spontane Attacken sind möglich, aber eher selten. Dazwischen bestehen schmerzfreie Phasen von variabler Dauer (Abb. 2). Die Schmerzen sind strikt im Innervationsgebiet eines (selten mehrerer) Trigeminusäste lokalisiert (V3 > V2 > V1).
Sie sind gelegentlich mit Tränenfluss und Rötung des ipsilateralen Auges vergesellschaftet (autonome Symptome), was eine Abgrenzung zu selteneren Diagnosen mit kurzdauernden Schmerzparoxysmen und ausgeprägten autonomen Zeichen erschweren kann, darunter «Short-lasting unilateral neuralgiform headache attacks with conjunctival injection and tearing» (SUNCT) oder «Short-lasting unilateral neuralgiform headache attacks with cranial autonomic symptoms» (SUNA). Weil neuralgiforme Gesichtsschmerzen oft Kontraktionen der Gesichtsmuskulatur evozieren, ist die Trigeminus-Neuralgie besonders in französischen Sprachgebieten auch als «Tic douloureux» bekannt. Nebst der einzigartig kurzen Schmerzdauer und der interiktalen Schmerzfreiheit ist bemerkenswert, dass Trigeminus-Neuralgien über mehrere Monate oder Jahre remittieren, was bei anderen neuropathischen Schmerzformen unüblich ist (17). Zum anfänglich neuralgiformen Schmerzbild kann sich im Verlauf ein persistierender, oft als brennend beschriebener Dauerschmerz gesellen, was nebst dem Myelinschaden auf eine zusätzliche Schädigung der Neurone selbst hinweist (13).
Schäden des Myelins erfolgen meist im Bereich des Kleinhirn-Brückenwinkels. Sie können durch Tumoren, demyelinisierende Krankheiten (allen voran die multiple Sklerose), Gefässmissbildungen, Aneurysmen und andere schädigende Gefässkontakte entstehen. Eine verlässliche ätiologische Differenzierung ist aufgrund klinischer Charakteristika nicht möglich, sondern bedarf einer Magnetresonanz-Bildgebung. Aufgrund der Bildgebung wird in der aktuellen Klassifikation (ICHD-3) der Internationalen Kopfschmerzgesellschaft (IHS) die häufigste «klassische» Form (mit kennzeichnendem nervenschädigendem Gefässkontakt am Nervenstamm) von «sekundären» Formen mit anderen zugrundeliegenden Pathologien abgegrenzt. Hierbei sind am häufigsten Meningeome zu finden, gefolgt von Schwannomen und seltenen Tumoren wie Epidermoide, Lymphome, Metastasen. Aber auch infiltrative Prozesse (Meningeosis carcinomatosa, Amyloidome) oder nicht-tumoröse Prozesse (u. a. Arachnoidalzyste, fibröse Dysplasie) können einer Trigeminus-Neuralgie zugrunde liegen (6). Zeigt die Bildgebung keinen erklärenden Befund, liegt eine «idiopathische» Form vor (11).
Grundsätzlich werden die klassische und idiopathische Trigeminusneuralgie medikamentös behandelt. Ziel ist die Hinderung der neuralen Signalweiterleitung, worauf Na+-Kanalblocker wie Carbamazepin, Oxcarbazepin und Lamotrigin abzielen. Auf Carbamazepin bzw. Oxcarbazepin spricht die Mehrzahl der Betroffenen initial an, wobei je nach Körpergewicht mit 100 bis 200 mg täglich begonnen und dann durch langsame Dosissteigerung (100 mg zusätzlich alle 2-3 Tage) die optimale Dosierung individuell eruiert wird. Retard-Präparate sind zu bevorzugen. Dosislimitierend sind meist die zentralnervösen Nebenwirkungen (Müdigkeit, Schwindel, Doppelbilder, Übelkeit, Ataxie, Benommenheit), deren Auftreten u.U. durch langsames Eintitrieren abgeschwächt werden kann. Aufgrund der Hepatotoxizität und möglicher Veränderungen der Elektrolyte (Hyponatriämie) und des Blutbildes sind vorab die entsprechenden Ausgangswerte zu bestimmen und später zu monitorisieren, initial in engmaschigen Abständen. Zu beachten sind allfällige pharmakologische Interaktionen (z. B. verminderte Wirkung oraler Antikoagulanzien) und die mögliche verminderte Wirksamkeit infolge Enzyminduktionen, welche einen rascheren Abbau der Na+-Kanalblocker bewirkt. Betroffene sind zu informieren, dass allergische Hautreaktionen nach mehreren Tagen auftreten können. In Medikamenten-Fachinformationen wird zudem auf mögliche schwerwiegende epidermolytische Hautreaktionen bei Trägern des HLA-A*3101 Allels hingewiesen (4). Phenytoin hat eine deutlich geringere Wirksamkeit als Carbamazepin, kann aber bei akuter Schmerzexazerbation intravenös verabreicht (15 mg/kg) wirksam sein (20). Ein neu entwickelter Na+-Kanalblocker zeigte in einer kleinen Studienpopulation eine vielversprechende Wirkung und vor allem ein verbessertes Nebenwirkungsprofil (21). Vor einer Marktzulassung sind aber weitere klinische Studien notwendig. Bei Unverträglichkeit von Na+-Kanalblockern oder in Ergänzung dazu kann durch Hemmung präsynaptischer Ca++-Kanäle die Weiterleitung neuraler Schmerzsignale durch Gabapentin und Pregabalin herabgesetzt werden. Vorteile dieser Medikamentengruppe sind die Möglichkeit der relativ raschen Aufdosierung und das Ausbleiben relevanter Arzneimittelinteraktionen. Trizyklische Antidepressiva haben abweichend von ihrer guten Wirkung bei vielen neuropathischen Schmerzsyndromen nur eine geringe Wirksamkeit bei der Trigeminus-Neuralgie. Bei medikamentösem Therapieversagen und hohem Leidensdruck ist ein neurochirurgisches Konsilium angezeigt.
Universität Zürich, Zentrum für Zahnmedizin
Klinik für Kaufunktionsstörungen, Interdisziplinäre Schmerzsprechstunde
Plattenstrasse 11
8032 Zürich
Die Autoren haben keine Interessenskonflikte im Zusammenhang mit diesem Beitrag deklariert.
- Zur Einordnung von Schmerzbeschwerden im Gesicht ist ein Verständnis beteiligter neurophysiologischer Mechanismen hilfreich.
- Bei Schäden des Gesichtsnervs können überwiegend die Myelinscheide (Trigeminus-Neuralgie) oder der ganze Nerv (Trigeminus-Neuropathie) beteiligt sein.
- Während die Trigeminus-Neuralgie durch blitzartig einschiessende, elektrisierende Schmerzattacken von sehr hoher Intensität mit interiktaler Schmerzfreiheit charakterisiert ist, steht bei der Neuropathie meist ein konstant vorhandener Brennschmerz im Vordergrund.
Literatur
1. Bird EV, Christmas CR, Loescher AR, Smith KG, Robinson PP, Black JA, Waxman SG, Boissonade FM (2013) Correlation of Nav1.8 and Nav1.9 sodium channel expression with neuropathic pain in human subjects with lingual nerve neuromas. Mol Pain 9:52. doi:10.1186/1744-8069-9-52
2. Casale R, Symeonidou Z, Bartolo M (2017) Topical Treatments for Localized Neuropathic Pain. Curr Pain Headache Rep 21(3):15. doi:10.1007/s11916-017-0615-y
3. Cheng Y-R, Jiang B-Y, Chen C-C (2018) Acid-sensing ion channels. Dual function proteins for chemo-sensing and mechano-sensing. J Biomed Sci 25(1):46. doi:10.1186/s12929-018-0448-y
4. compendium.ch. https://compendium.ch/home/de. Zugegriffen: 11. Juli 2018
5. Devor M, Govrin-Lippmann R, Rappaport ZH (2002) Mechanism of trigeminal neuralgia. An ultrastructural analysis of trigeminal root specimens obtained during microvascular decompression surgery. J Neurosurg 96(3):532–543. doi:10.3171/jns.2002.96.3.0532
6. Diener H-C, Gerloff C, Dieterich M (Hrsg) (2018) Therapie und Verlauf neurologischer Erkrankungen, 7. Aufl. Verlag W. Kohlhammer, Stuttgart
7. Ettlin DA, Sommer I, Brönnimann B, Maffioletti S, Scheidt J, Hou M-Y, Lukic N, Steiger B (2016) Design, construction, and technical implementation of a web-based interdisciplinary symptom evaluation (WISE) – a heuristic proposal for orofacial pain and temporomandibular disorders. J Headache Pain 17(1):77. doi:10.1186/s10194-016-0670-5
8. Finnerup NB, Attal N, Haroutounian S, McNicol E, Baron R, Dworkin RH, Gilron I, Haanpää M, Hansson P, Jensen TS, Kamerman PR, Lund K, Moore A, Raja SN, Rice ASC, Rowbotham M, Sena E, Siddall P, Smith BH, Wallace M (2015) Pharmacotherapy for neuropathic pain in adults. A systematic review and meta-analysis. The Lancet Neurology 14(2):162–173. doi:10.1016/S1474-4422(14)70251-0
9. Holland GR (1995) Periapical neural changes after pulpectomy. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 80(6):726–734
10. Hudson LJ, Bevan S, Wotherspoon G, Gentry C, Fox A, Winter J (2001) VR1 protein expression increases in undamaged DRG neurons after partial nerve injury. Eur J Neurosci 13(11):2105–2114
11. International Headache Society 13.1.1 Trigeminal neuralgia. https://www.ichd-3.org/13-painful-cranial-neuropathies-and-other-facial-pains/13-1-trigeminal-neuralgia/13-1-1-classical-trigeminal-neuralgia/. Zugegriffen: 11. Juli 2018
12. Jayawardena ADL, Chandra R (2018) Headaches and facial pain in rhinology. Am J Rhinol Allergy 32(1):12–15. doi:10.2500/ajra.2018.32.4501
13. Maarbjerg S, Gozalov A, Olesen J, Bendtsen L (2014) Trigeminal neuralgia–a prospective systematic study of clinical characteristics in 158 patients. Headache 54(10):1574–1582. doi:10.1111/head.12441
14. Mercadante S (2015) Topical amitriptyline and ketamine for the treatment of neuropathic pain. Expert Rev Neurother 15(11):1249–1253. doi:10.1586/14737175.2015.1101347
15. Nixdorf DR, Law AS, Lindquist K, Reams GJ, Cole E, Kanter K, Nguyen RHN, Harris DR (2016) Frequency, impact, and predictors of persistent pain after root canal treatment. A national dental PBRN study. Pain 157(1):159–165. doi:10.1097/j.pain.0000000000000343
16. Obata H (2017) Analgesic Mechanisms of Antidepressants for Neuropathic Pain. Int J Mol Sci 18(11). doi:10.3390/ijms18112483
17. Rasmussen P (1990) Facial pain. II. A prospective survey of 1052 patients with a view of. Character of the attacks, onset, course, and character of pain. Acta Neurochir (Wien) 107(3-4):121–128
18. Truini A (2017) A Review of Neuropathic Pain. From Diagnostic Tests to Mechanisms. Pain Ther 6(Suppl 1):5–9. doi:10.1007/s40122-017-0085-2
19. Urata K, Shinoda M, Honda K, Lee J, Maruno M, Ito R, Gionhaku N, Iwata K (2015) Involvement of TRPV1 and TRPA1 in incisional intraoral and extraoral pain. J Dent Res 94(3):446–454. doi:10.1177/0022034514565645
20. Vargas A, Thomas K (2015) Intravenous fosphenytoin for acute exacerbation of trigeminal neuralgia. Case report and literature review. Ther Adv Neurol Disord 8(4):187–188. doi:10.1177/1756285615583202
21. Zakrzewska JM, Palmer J, Morisset V, Giblin GMP, Obermann M, Ettlin DA, Cruccu G, Bendtsen L, Estacion M, Derjean D, Waxman SG, Layton G, Gunn K, Tate S (2017) Safety and efficacy of a Nav1.7 selective sodium channel blocker in patients with trigeminal neuralgia. A double-blind, placebo-controlled, randomised withdrawal phase 2a trial. The Lancet Neurology 16(4):291–300. doi:10.1016/S1474-4422(17)30005-4
22. Zhang X, Priest BT, Belfer I, Gold MS (2017) Voltage-gated Na+ currents in human dorsal root ganglion neurons. Elife 6. doi:10.7554/eLife.23235
der informierte @rzt
- Vol. 8
- Ausgabe 10
- Oktober 2018