- Nicht-variköse gastrointestinale Blutungen
Die gastrointestinale Blutung ist ein häufiges Krankheitsbild, welches sich in unterschiedlichen Verläufen und Gefahren für unsere Patienten präsentieren kann. Dies erfordert ein differenziertes und der Situation angepasstes Vorgehen in der Praxis. Viele der Blutungen sind selbstlimitierend, andere verlaufen fulminant und müssen umgehend therapiert werden. Sowohl die Epidemiologie als auch die Diagnostik und Therapie von gastrointestinalen Blutungen haben sich in den letzten Jahrzehnten stetig verändert. Aufgrund der technischen Weiterentwicklung der Endoskopie und der interventionellen Radiologie gelingt es heute meist, die Blutungsquelle zu lokalisieren und auch zu stillen. Ein chirurgisches Vorgehen bleibt seltenen Problemfällen vorbehalten.
Gastrointestinal bleeding is a common clinical picture that can present itself in different courses and dangers for our patients. This requires a differentiated approach in practice, adapted to the situation. Many of the hemorrhages are self-limiting, others are fulminant and must be treated immediately. The epidemiology as well as the diagnosis and therapy of gastrointestinal bleeding have changed steadily over the last decades. Due to the technical advancement of endoscopy and interventional radiology, it is nowadays usually possible to localize the source of bleeding and also to stop it. Surgical intervention is reserved for rare problem cases.
Key Words: Gastrointestinale Blutung, peptisches Ulcus, Divertikelblutung, Risikostratifizierung, Antikoagulation
Gastrointestinale Blutungen sind mit einer Inzidenz von 50-100 pro 100’000 Personen (1–3) sehr häufig. Das klinische Spektrum reicht von der nur laborchemisch fassbaren Anämie bis hin zur fulminanten Blutung mit vitaler Bedrohung. Es werden prinzipiell die obere und untere gastrointestinale Blutung unterschieden, wobei die Blutungsquelle der oberen GI-Blutung proximal, die der unteren GI-Blutung distal des Treitz-Bandes (Flexura duodenojejunalis) lokalisiert ist. Die Letalität ist mit 3-14% für obere GI-Blutungen hoch und stark abhängig vom Alter und den Komorbiditäten (3). Untere GI-Blutungen verlaufen seltener (< 4%) letal (4).
Obere gastrointestinale Blutung (nicht-varikös)
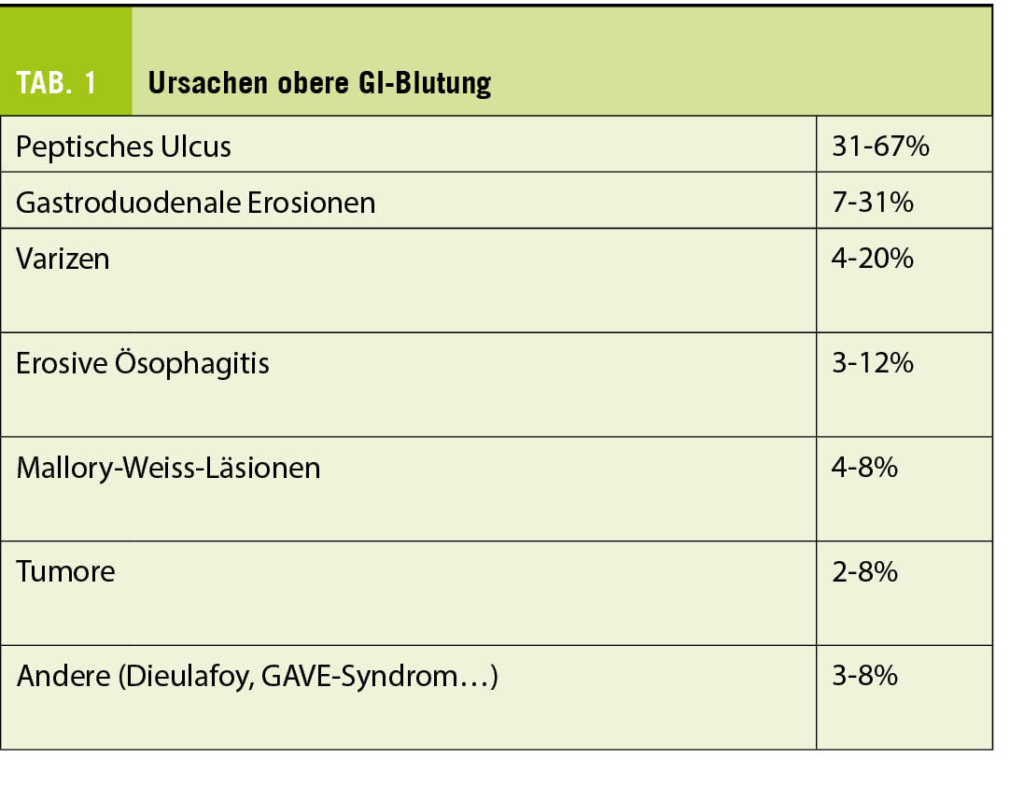
Die allermeisten Blutungen (70-90%) sind im oberen Gastrointestinaltrakt lokalisiert. Klinische Zeichen sind das Erbrechen von Frischblut (Hämatemesis) sowie Teerstuhl (Meläna). Letzterer kommt durch die Zersetzung von Hämoglobin in schwarzes Hämatinchlorid durch die Magensäure zustande. Im Falle einer schweren Blutung kann aufgrund einer raschen Darmpassage auch Frischblut ab Ano (Hämatochezie) auftreten. Die wesentlichen Blutungsquellen sind in Tab. 1 aufgelistet (1).
Die häufigste Blutungsursache sind peptische Ulcera. Diese werden je nach Blutungsaktivität anhand der Forrest-Klassifikation eingeteilt, womit sich das Re-Blutungsrisiko sowie die Mortalität abschätzen lässt. Bei Forrest Ia-, Ib- und IIa-Ulcerationen (beinhalten noch aktive Blutungen oder einen sichtbaren Gefässstumpf) sollte aufgrund des hohen Risikos für eine erneute Blutung immer eine endoskopische Intervention erfolgen (5). Die Mehrheit der peptischen Ulcera sind mit Helicobacter Pylori (welcher stets gesucht werden sollte) oder nichtsteroidalen Antirheumatika (NSAR) assoziiert. Seltenere Ursachen für peptische Ulcera beinhalten das Gastrinom, Nikotinabusus, Malignome oder die Therapie mit einem selektiven Serotonin-Wiederaufnahme-Inhibitor (SSRI).
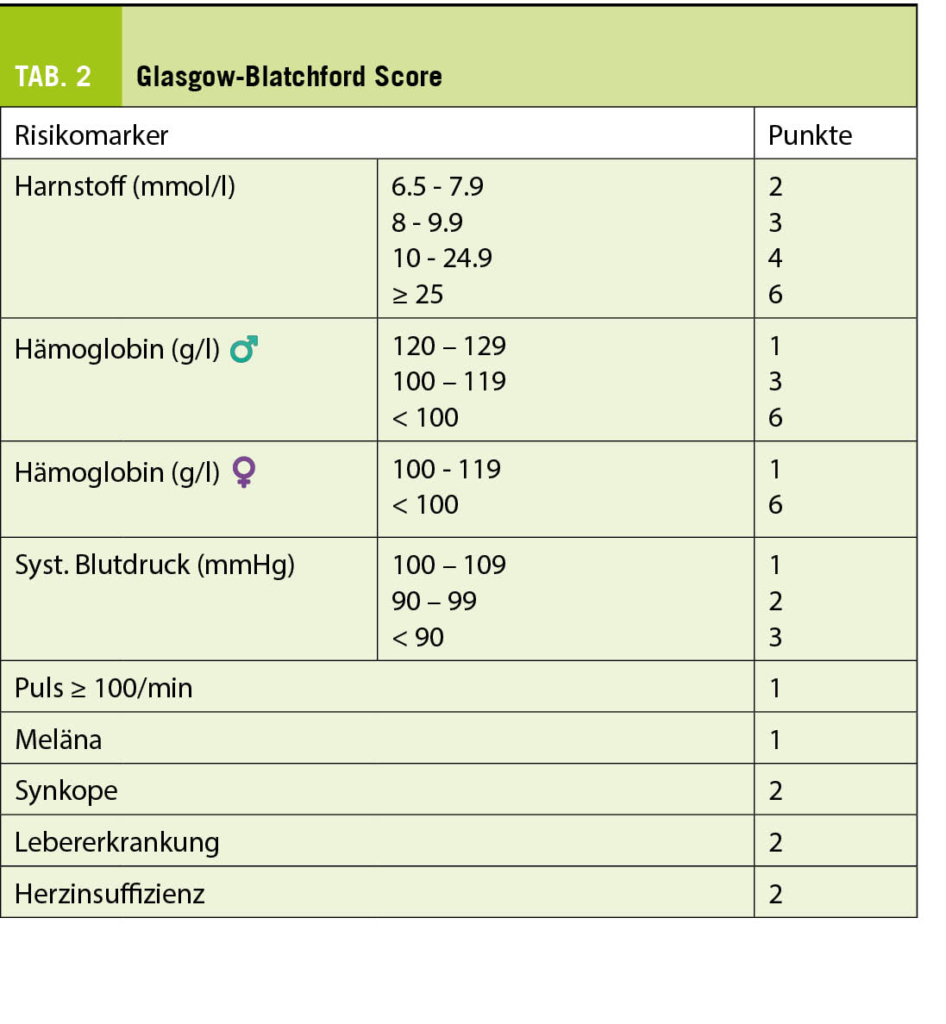
Zur individuellen Risikoabschätzung kann der Glasgow-Blatchford Score (Tab. 2) bei vermuteter nicht-variköser oberer GI-Blutung verwendet werden, welcher von 0-23 Punkten reicht. Je höher der Score, desto höher ist die Wahrscheinlichkeit, dass eine endoskopische Intervention notwendig wird. Patienten mit einem Score von 0-1 Punkt benötigen mit einer > 99% Wahrscheinlichkeit keine endoskopische Intervention und somit auch nicht unbedingt eine stationäre Aufnahme (5).
Bei Verdacht auf obere GI-Blutung wird der rasche Start mit einem Protonenpumpeninhibitor (PPI) 80mg i.v. als Bolus, gefolgt von 40mg 2x täglich empfohlen. Eine kontinuierliche Infusion hat keinen Vorteil gegenüber der 2x täglichen Gabe. Mindestens die ersten 72 Stunden sollte die PPI-Gabe intravenös erfolgen. Zur besseren endoskopischen Beurteilung kann 30-120 Minuten vor der oberen Endoskopie 250mg Erythromycin i.v. verabreicht werden, was als starker Motilin-Agonist zu einer rascheren Magenentleerung führt. Dadurch kann die Re-Endoskopierate aufgrund der besseren Übersicht reduziert werden, das klinische Outcome an sich wird aber nicht verändert (7). Von einer Magensondeneinlage mit Lavage bei vermuteter oberer GI-Blutung wird abgeraten (8). Die Gastroskopie sollte möglichst innert den ersten 24h nach Patientenpräsentation erfolgen. Eine dringliche Gastroskopie innert 12h ist jedoch nicht mit einem besseren Outcome assoziiert, eine notfallmässige Gastroskopie innert 6h ist sogar mit einem schlechteren Outcome vergesellschaftet (5). Eine vorgängige gute umfassende Diagnostik und Stabilisierung des Patienten sind daher essenziell.
Untere gastrointestinale Blutung
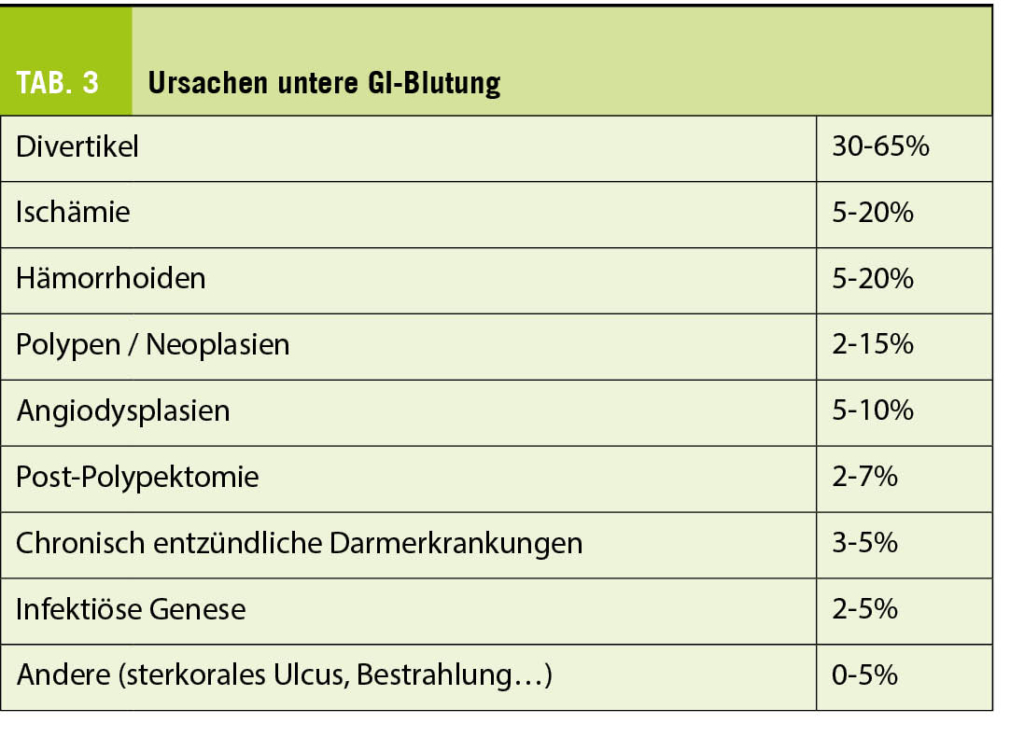
Die Blutung im unteren Gastrointestinaltrakt ist deutlich seltener, dafür oft schwieriger zu stoppen. Klinisches Zeichen ist die Hämatochezie oder (je nach Blutungslokalisation) auch Teerstuhl. Die häufigsten Blutungsquellen sind in Tab. 3 aufgelistet.
Bei Verdacht auf eine untere GI-Blutung erfolgt als primäre Diagnostik in den meisten Fällen eine Koloskopie. Bei stabiler klinischer Situation (z.B. okkultes Blut im Stuhl) und niedrigem Risikoprofil kann die Koloskopie durchaus ambulant erfolgen. Ansonsten sollte die Koloskopie möglichst innert 24h im stationären Setting durchgeführt werden, jedoch erst nach adäquater Vorbereitung. Sollte der Patient die Abführmittel nicht trinken können, kann eine Nasogastralsonde zur Applikation verwendet werden. Bei instabiler Situation sollte primär eine Gastroskopie zum Ausschluss einer schweren oberen GI-Blutung erfolgen. Bei den meisten Patienten mit einer akuten unteren GI-Blutung stoppt die Blutung ohne Intervention. Blutungen aufgrund von Divertikel, Angiektasien oder nach Polypektomie haben die grösste Wahrscheinlichkeit einer erfolgreichen endoskopischen Blutstillung.
Unklare Blutungsquelle
Bei 5-10% der Patienten mit einer GI-Blutung wird mit den Standardendoskopien (Gastro- und Koloskopie) keine Blutungsquelle gefunden (6), was als obskure Blutung bezeichnet wird. Ist dies der Fall, liegt die Blutungsquelle zu 75% im Dünndarm. Am häufigsten kommen da bei älteren Patienten Angiodysplasien vor, seltener auch Malignome oder NSAR-assoziierte Ulzerationen. Bei jüngeren Patienten (< 40 Jahre) handelt es sich häufiger um chronisch-entzündliche Darmerkrankungen, Meckel-Divertikel oder Dieulafoy-Läsionen (kaum sichtbare submukosale Gefässe). Bei obskurer Blutung und hämodynamisch stabilen Patienten ist die Kapselendoskopie diagnostisches Mittel der Wahl. Dazu wird nach abführenden Massnahmen eine Videokapsel mit Wasser geschluckt. Dessen Bilder werden dann an einen Datenrekorder, welcher mitgetragen wird, übermittelt. Die Bilder können schliesslich in Form eines Videos am Computer ausgewertet werden. Die Kapsel wird auf natürlichem Wege ausgeschieden und wird nicht zur Datenanalyse benötigt. Die wichtigste Kontraindikation hierfür ist eine Stenose im Gastrointestinaltrakt, da die Kapsel dort potenziell steckenbleiben könnte. Eine CT-Angiographie sollte im Falle einer hämodynamisch relevanten Blutung der Kapselendoskopie zugunsten einer rascheren Beurteilung bevorzugt werden.
Erstbeurteilung
Bei der initialen Patientenbeurteilung im Rahmen einer vermuteten gastrointestinalen Blutung ist die Frage nach der hämodynamischen Relevanz essenziell. Die Tachykardie ist dabei oftmals das erste Zeichen der Hypovolämie.
Bei stabiler Situation mit normwertigen Vitalparametern sollten mögliche Risikofaktoren (insbesondere Vorerkrankungen und frühere GI-Blutungen) bzw. die Medikamenteneinnahme (NSAR, SSRI, Antikoagulation, Thrombozytenaggregationshemmer) genau erfragt werden. Laborchemisch interessiert nebst dem Hämatogramm und dem Gerinnungsstatus auch der Harnstoff, welcher durch die Verdauung der Blut-Proteine bei oberer GI-Blutung typischerweise ohne konkomitantem Kreatininanstieg erhöht ist. Man spricht von einer Harnstoff-Kreatinin Dissoziation. Daher ist der Harnstoff ebenfalls Teil des Glasgow-Blatchford Scores. Das Hämoglobinlevel kann bei raschem Blutverlust initial noch normal bleiben, da es einige Stunden dauert, bis der Verlust durch zuströmende extravasale Flüssigkeit zu einem Hämoglobinabfall führt.
Bei instabiler Situation steht die Kreislaufstabilisierung im Vordergrund. Dazu gehört die Flüssigkeitsgabe nach Installation von 2 venösen Zugängen (mind. 18G), die Transfusion von Erythrozytenkonzentraten im Falle eines Hämoglobins von < 70g/l bzw. < 80g/l bei bekannter kardiovaskulärer Erkrankung, eventuell auch Fresh Frozen Plasma (FFP) und die Korrektur der Gerinnung. Bei Risikosituationen wie Hämatemesis, Enzephalopathie oder Vigilanzminderung erfolgt aufgrund des hohen Aspirationsrisikos die Notfallendoskopie in der Regel erst nach endotrachealer Intubation.
Interventionelle Therapie
Nebst der Endoskopie steht die Angiographie oder allenfalls eine chirurgische Intervention zur Blutstillung zur Verfügung. Endoskopische Methoden beinhalten die Adrenalininjektion, thermische Koagulation (bipolare Koagulation, Argon Plasma Coagulation), topische Applikation chemischer Hämostatika (z.B. Hemospray®, Nexpowder®, PuraStat®) sowie die mechanische Blutstillung mittels Clip, Loop oder Gummiband. Bei Patienten mit einer aktiven Blutung, die nicht für eine Endoskopie stabilisiert werden können, kann eine CT-Angiographie zwecks Lokalisation der Blutungsquelle erfolgen. Diese kann jedoch bei zu langsamem Blutfluss (< 0.3ml/min) negativ ausfallen. Kann eine Blutungsquelle dargestellt werden, stellt die Blutstillung via Angiographie mit superselektiver Embolisation der zuführenden Arterie eine Alternative zur Endoskopie dar. Aufgrund des Risikos einer Ischämie von 1-4% sollte diese Methode aber für Patienten mit fulminanter Blutung reserviert bleiben. Insbesondere bei der unteren GI-Blutung stellt die Angiographie eine Alternative dar, da in der Notfallsituation keine Zeit für eine Darmreinigung bleibt. Die chirurgische Intervention muss im Falle einer persistierenden Blutung trotz endoskopischer bzw. angiographischer Blutstillung in Erwägung gezogen werden. Eine Second-look-Endoskopie kann bei Hochrisikopatienten evaluiert werden, wird jedoch nicht generell empfohlen (5,9).
Antikoagulation
Es ist bekannt, dass unter Warfarin ein deutlich (> 4x) höheres Risiko für eine gastrointestinale Blutung besteht als unter direkten oralen Antikoagulantien (DOAK) (10). Weiter haben in den letzten Jahren mehrere Studien gezeigt, dass innerhalb der DOAK-Gruppe Apixaban das beste Sicherheitsprofil bezüglich gastrointestinalen Blutungen hat (11–13). Daher sollte im Falle einer Blutung unter etablierter DOAK-Therapie der Substanzwechsel auf Apixaban erwogen werden. Die periinterventionelle Pausierung der Thrombozytenaggregationshemmung und/oder Antikoagulation ist sowohl vom Risikograd der Intervention wie auch vom Thromboembolierisiko abhängig. Im Zweifelsfall sollte hier mit dem behandelnden Gastroenterologen Kontakt aufgenommen werden. Bei Interventionen mit niedrigem Risiko (z.B. diagnostische Endoskopie auch mit Biopsieentnahme) können diese Medikamente grundsätzlich weiter eingenommen werden. Der ideale Zeitpunkt des postinterventionellen Wiederbeginns der Antikoagulation ist aufgrund fehlender Evidenz nicht abschliessend definiert. Er ist sowohl stark vom thromboembolischen Risiko wie auch vom Blutungsrisiko der Intervention abhängig. Ist die Blutung kontrolliert, sollte die Antikoagulation bei hohem thromboembolischen Risiko innert 2-3 Tagen, ansonsten innert 7 Tagen wiederbegonnen werden. Bei erhöhtem Re-Blutungsrisiko stellt die vorübergehende Umstellung auf ein Heparin eine gute Option dar.
Copyright by Aerzteverlag medinfo AG
Abteilung für Gastroenterologie / Hepatologie
Luzerner Kantonsspital
Spitalstrasse
6000 Luzern 16
chantal.hasler@luks.ch
Abteilung für Gastroenterologie / Hepatologie
Luzerner Kantonsspital
Spitalstrasse
6000 Luzern 16
Die Autoren haben keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
◆ Die häufigste Ursache einer oberen gastrointestinalen Blutung ist das peptische Ulcus
◆ Hämatochezie tritt nicht nur bei der unteren, sondern auch bei der massiven oberen GI-Blutung auf
◆ Mittels Glasgow-Blatchford Score kann die Notwendigkeit einer
Endoskopie bzw. einer stationären Aufnahme bei vermuteter
GI-Blutung abgeschätzt werden
◆ Nach stattgehabter Blutung unter DOAK kann der Substanzwechsel auf Apixaban evaluiert werden
1. 1Hearnshaw SA, Logan RFA, Lowe D, Travis SPL, Murphy MF, Palmer KR. Use of endoscopy for man-agement of acute upper gastrointestinal bleeding in the UK: results of a nationwide audit. Gut. 1. August 2010;59(8):1022–9.
2. Hreinsson JP, Kalaitzakis E, Gudmundsson S, Björnsson ES. Upper gastrointestinal bleeding: inci-dence, etiology and outcomes in a population-based setting. Scand J Gastroenterol. April 2013;48(4):439–47.
3. Rockall TA, Logan RFA, Devlin HB, Northfield TC. Incidence of and mortality from acute upper gastro-intestinal haemorrhage in the United Kingdom. BMJ. 22. Juli 1995;311(6999):222–6.
4. Hreinsson JP, Gumundsson S, Kalaitzakis E, Björnsson ES. Lower gastrointestinal bleeding: incidence, etiology, and outcomes in a population-based setting. Eur J Gastroenterol Hepatol. Januar 2013;25(1):37–43.
5. Gralnek IM, Stanley AJ, Morris AJ, Camus M, Lau J, Lanas A, u. a. Endoscopic diagnosis and manage-ment of nonvariceal upper gastrointestinal hemorrhage (NVUGIH): European Society of Gastroin-testinal Endoscopy (ESGE) Guideline – Update 2021. Endoscopy. März 2021;53(03):300–32.
6. Gerson LB, Fidler JL, Cave DR, Leighton JA. ACG Clinical Guideline: Diagnosis and Management of Small Bowel Bleeding. Am J Gastroenterol. September 2015;110(9):1265–87.
7. Laine L, Jensen DM. Management of Patients With Ulcer Bleeding. Am J Gastroenterol. März 2012;107(3):345–60.
8. Huang ES, Karsan S, Kanwal F, Singh I, Makhani M, Spiegel BM. Impact of nasogastric lavage on out-comes in acute GI bleeding. Gastrointest Endosc. November 2011;74(5):971–80.
9. Barkun AN, Almadi M, Kuipers EJ, Laine L, Sung J, Tse F, u. a. Management of Nonvariceal Upper Gastrointestinal Bleeding: Guideline Recommendations From the International Consensus Group. Ann Intern Med. 3. Dezember 2019;171(11):805.
10. Cangemi DJ, Krill T, Weideman R, Cipher DJ, Spechler SJ, Feagins LA. A Comparison of the Rate of Gastrointestinal Bleeding in Patients Taking Non-Vitamin K Antagonist Oral Anticoagulants or Warfa-rin. Am J Gastroenterol. Mai 2017;112(5):734–9.
11. Ray WA, Chung CP, Murray KT, Smalley WE, Daugherty JR, Dupont WD, u. a. Association of Oral Anti-coagulants and Proton Pump Inhibitor Cotherapy With Hospitalization for Upper Gastrointestinal Tract Bleeding. JAMA. 4. Dezember 2018;320(21):2221.
12. Graham DJ, Reichman ME, Wernecke M, Hsueh YH, Izem R, Southworth MR, u. a. Stroke, Bleeding, and Mortality Risks in Elderly Medicare Beneficiaries Treated With Dabigatran or Rivaroxaban for Nonvalvular Atrial Fibrillation. JAMA Intern Med. 1. November 2016;176(11):1662.
13. Proietti M, Romanazzi I, Romiti GF, Farcomeni A, Lip GYH. Real-World Use of Apixaban for Stroke Prevention in Atrial Fibrillation: A Systematic Review and Meta-Analysis. Stroke. Januar 2018;49(1):98–106.
der informierte @rzt
- Vol. 12
- Ausgabe 11
- November 2022