- Obstipation
Der Begriff Obstipation beschreibt eine subjektiv als unbefriedigend empfundene Defäkation. Die typischen Symptome umfassen neben der zu seltenen Entleerung (< 3 Stuhlgänge/Woche) und zu harter Stuhlkonsistenz, die häufig starkes Pressen erfordert, das Ausbleiben der Entleerung trotz Stuhldrangs («unproduktiver» Stuhldrang, Blockadegefühl), das Gefühl der unvollständigen Entleerung oder den Einsatz digitaler Manipulationen zur Stuhlentleerung (Ausräumung oder Stützen des Beckenbodens). Der Artikel resümiert differentialdiagnostische Überlegungen und präsentiert aktuelle Behandlungsmöglichkeiten.
Stehen die 3 letztgenannten Beschwerden im Vordergrund, ist unter dem Verdacht auf Vorliegen einer obstruktiven anorektalen Entleerungsstörung die anorektale Funktionsdiagnostik mittels Analmanometrie (inkl. Messung der Perzeptionsschwellen) sowie eine MRI-Defäkographie zu erwägen. Kommen Abdomial- schmerzen und Blähungen hinzu, die sich nach der Defäkation bessern, ist von einem obstipationsprädominanten Reizdarmsyndrom (Colon irritabile, IBS-C) auszugehen. Eine weitere Sonderform stellt die opiatinduzierte Obstipation dar.
Diagnostik
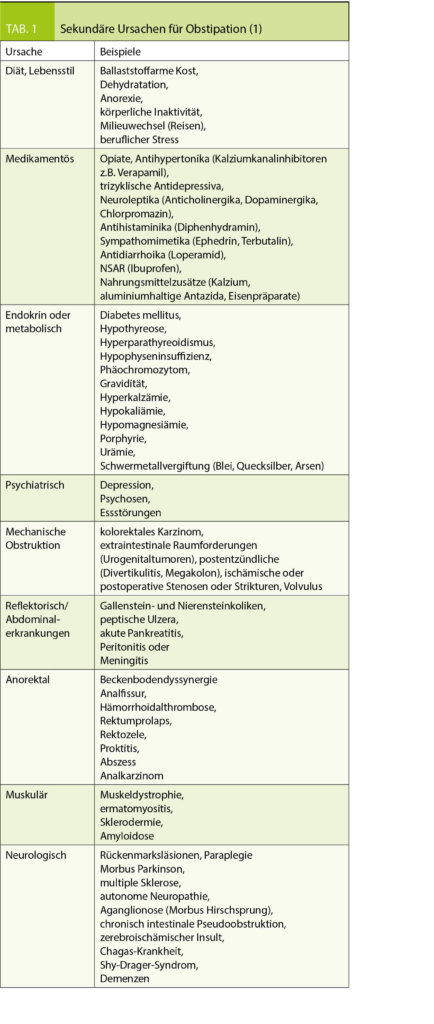
Für eine differenzierte Therapie ist es wichtig, die zugrundeliegende Ätiologie der Obstipation zu identifizieren, sekundäre Ursachen einer Obstipation (Tab. 1) auszuschliessen und vor allem obstipationsauslösende Medikamente abzusetzen. Insbesondere bei plötzlich neu aufgetretener Obstipation in Verbindung mit einer positiven Familienanamnese für kolorektale Karzinome, Alarmzeichen oder jenseits des 50. Lebensjahres ist eine Koloskopie zum Ausschluss eines Kolonkarzinoms oder einer Divertikulitis erforderlich. Bei fehlendem Ansprechen auf die Standardtherapie (s.u.) sind die anorektale Funktionsdiagnostik und eine MRI-Defäkographie anzustreben. Damit gelingt es, eine mechanische anorektale Obstruktion, z.B. durch eine anteriore Rektozele, von einer funktionellen Obstruktion durch unzureichende Propulsionskräfte, z.B. durch eine fehlende Relaxation der Puborektalis-Schlinge oder eine paradoxe Sphinkterkontraktion während der Defäkation, zu unterscheiden.
Differenzierte und evidenzbasierte Therapie
Basis jeglicher Behandlung sind Allgemeinmassnahmen und die Beeinflussung des Lebensstils, wie die Wiedereinübung eines festen Defäkationsrhythmus unter Ausnutzung des gastrokolischen Reflexes, genügend körperliche Betätigung und eine Vergrösserung der Stuhlmenge durch ballaststoffreiche Ernährung (ca. 20–30 g/d).
Letzteres muss häufig durch die Einnahme inerter Quellmittel wie Flohsamenschalen (Plantago ovata; z.B. Metamucil®, Mukofalk®) oder Sterculiae gummi (Colosan mite®, Normacol®) zusammen mit ausreichender Flüssigkeitszufuhr erreicht werden. Als Nebenwirkung – vor allem bei Ballaststoffen auf Getreidebasis wie Leinsamen und Weizenkleie – ist aber mit Meteorismus zu rechnen, sodass einschleichend dosiert werden sollte und diese Massnahmen bei IBS-C oder IBS-A auch kontraproduktiv sein können. Häufig suchen die Patienten aber erst ärztliche Hilfe, wenn diese Massnahmen nicht ausreichen. Dann kommen typischerweise klassische Laxanzien zum Einsatz.
Die beste Evidenz besteht für den Einsatz von Polyäthylenglykol bzw. Macrogol (z.B. Movicol® 10-40g/d) und Laktulose. Diese Substanzen sind osmotisch aktiv, erhöhen die Stuhlfrequenz, reduzieren das zur Defäkation erforderliche Pressen und führen zu einem weicheren Stuhl. Die bei der bakteriellen Fermentation von Laktulose im Kolon entstehenden Gase sind für die Nebenwirkungen (Meteorismus) verantwortlich, sodass bei entsprechenden Beschwerden dem nicht metabolisierbaren Polyäthylenglykol der Vorzug zu geben ist.
Bleiben diese Massnahmen ohne Erfolg, kommen zusätzlich stimulierende Laxanzien wie Bisacodyl (Dulcolax®) oder Anthrachinonderivate (Folia Sennae) zum Einsatz. Sie entfalten ihre Wirkung 6–10 h nach Einnahme über eine Veränderung des Elektrolyttransports in der Darmmukosa und stimulieren die Motilität. Entgegen der vielfach kolportierten Nebenwirkungen gilt heute auch die langfristige Anwendung dieser Präparate als sicher. Inzwischen konnte die Wirksamkeit auch für das seit den 50er Jahren therapeutisch genutzte und in zahlreichen Studien als «Rescue»-Medikation eingesetzte Dulcolax Bisacodyl in einer randomisierten plazebo-kontrollierten Doppelblind-Studie belegt werden.
Therapierefraktäre Obstipation
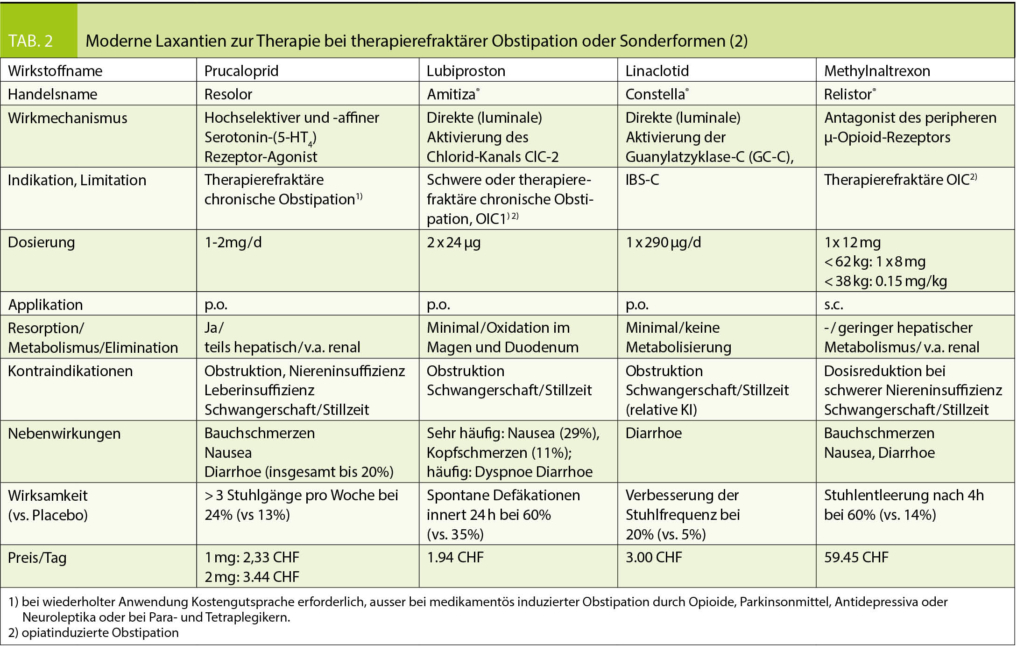
Kommt es nach einer Behandlung mit mindestens zwei Laxanzien unterschiedlicher Klassen über einen Zeitraum von mindestens 9 Monaten nicht zu einem Ansprechen, ist nach nochmals kritischem Hinterfragen der Ätiologie (mechanische Obstruktion/Karzinom? Anorektale Entleerungsstörung mit Indikation zur Funktionsdiagnostik? Sekundäre Ursachen? Obstipierende Medikamente/Opiate?) eine Therapie mit den neueren und ca. 2-3fach teureren Laxanzien wie Lubiproston (Amitiza®) oder Prucaloprid (Resolor) indiziert (Tab. 2).
Lubiproston ist ein Metabolit des Prostaglandins E1, der die Chloridkanäle vom Typ 2 in der apikalen Membran der Darmepithelzellen aktiviert. Das führt zu einer chloridreichen intestinalen Flüssigkeitssekretion und einer erleichterten Stuhlpassage. Nach peroraler Gabe von zweimal täglich einer Tablette Lubiproston 24 µg zusammen mit einer Mahlzeit haben 60% der Patienten innerhalb von 24 Stunden eine spontane Darmentleerung und Stuhlfrequenz und obstipationsassoziierte Symptome bessern sich. Limitierender Faktor sind dosisabhängig auftretende Kopfschmerzen (12%) und Übelkeit (32%!), die durch Einnahme des Medikaments zusammen mit einer Mahlzeit zwar etwas gemildert werden kann, aber bei bis zu 5% der Patienten Anlass für einen Therapieabbruch gibt.
Prucaloprid ist ein hochselektiver Serotonin-(5-HT4) Rezeptor-Agonist, der über eine Freisetzung von Acetylcholin eine gesteigerte mukosale Sekretion und Kolonmotilität führt. Aufgrund der hohen Rezeptorselektivität treten die bei anderen 5-HT4-Agonisten wie Cisaprid oder Tegaserod beobachteten kardialen Nebenwirkungen nicht auf. Die empfohlene Initialdosis beträgt 1 mg einmal täglich p.o. und kann auf einmal täglich 2 mg gesteigert werden. Prucaloprid führt bei ca. zwei Dritteln der Patienten zu einer Erhöhung der Stuhlfrequenz und einer Minderung assoziierter Symptome wie Meteorismus und abdominalem Diskomfort. Bei insgesamt bis zu 20% der Patienten können Nebenwirkungen im Sinne von Kopfschmerzen, Übelkeit oder Diarrhoe auftreten. Die Substanz ist vor allem bei sehr stark verzögerter Kolontransitzeit eine hervorragende Ergänzung der therapeutischen Möglichkeiten. Als maximale Therapiedauer gibt der Hersteller 12 Wochen an. Für eine wiederholte Therapie ist eine Kostengutsprache erforderlich.
Sonderform opiatindizierte Obstipation
Zur Behandlung schwer erkrankter Patienten mit opiatinduzierter Obstipation, die auf eine kombinierte Laxanzientherapie aus osmotischen und stimulierenden Laxanzien oder Lubiproston nicht angesprochen haben, steht mit Methylnaltrexon (Relistor®) ein peripher wirksamer μ-Opioid-Rezeptorantagonist zur Verfügung. Es handelt sich dabei nicht um eine Dauertherapie mit fixem Dosisintervall, sondern wird bei Bedarf eingesetzt, wenn andere Therapiemassnahmen versagt haben. Die Applikation erfolgt subkutan in einer Dosierung von maximal 12 mg alle 48 Stunden, bei einem Körpergewicht unter 62 kg in adaptierter Dosis (8 mg). Da die Substanz die Blut-Hirn-Schranke nicht überwinden kann, bleibt die zentralnervöse analgetische Wirkung der Opiate erhalten. Aus ungeklärten Gründen spricht aber nur etwa die Hälfte der Patienten an. Als häufigste Nebenwirkungen wurden Blähungen und Bauschmerzen beobachtet. Die Therapiedauer in den Zulassungstudien lag bei maximal 4 Monaten. Die Dosis muss bei schwerer Niereninsuffizienz (Kreatinin-Clearance < 30ml/min) halbiert werden. Bei der primären chronischen idiopathischen Obstipation ist die Substanz nicht wirksam (Tab. 2).
Sonderform obstipationsprädominantes Reizdarmsyndrom (IBS-C)
Zur Behandlung des obstipationsprädominanten Reizdarmsyndroms steht seit einigen Jahren Linaclotid (Constella®) zur Verfügung. Das aus 14 Aminosäuren bestehende Peptid bewirkt durch direkte Aktivierung der im Darmepithel vorkommenden Guanylatzyklase-C (GC-C) eine lokale Erhöhung der cGMP-Konzentration, die über eine Aktivierung eines Chloridionenkanals zur Sekretion von Chlorid, Bikarbonat und Wasser in das Darmlumen führt. Darüber hinaus werden der Substanz schmerzlindernde Eigenschaften zugeschrieben, die aus einer Beeinflussung der viszeralen Hypersensibilität resultieren, die wiederum beim Reizdarmsyndrom eine wesentliche pathophysiologische Rolle spielt. Bei IBS-C werden einmal täglich 30 Min. vor dem (Mittag-)Essen 290 µg/d Linaclotid p.o. (für bis zur 3 Monate) verabreicht. In der Zulassungsstudie an insgesamt 1276 Patienten kam es bei 20% der Patienten zu einer signifikanten Steigerung der Stuhlfrequenz im Vergleich zu nur 5% im Placebo-Arm. Ein Drittel der Patienten berichtete zudem über einen Rückgang von Blähungen und Bauchschmerzen. Ein klinisch relevanter Vorteil gegenüber herkömmlichen Laxantien ist der viszeral-analgetische Effekt, der allerdings erst nach einigen Wochen einsetzt (Tab. 2).
Therapieprinzipien bei anorektalen Entleerungsstörungen
Zur Behandlung funktioneller anorektaler Entleerungsstörungen infolge paradoxer Sphinkterkontraktion oder einer fehlenden Relaxation der Puborektalis-Schlinge beim Pressen (Anismus) ist eine spezifische anorektale Physiotherapie und Biofeedback zur Optimierung der Bauchpresse und zur Verbesserung der anorektalen Koordination und Perzeption Mittel der Wahl. Dabei wird den Patienten mit Hilfe verschiedener Sensoren der Sphinkterdruck während der Defäkation visualisiert, so dass inadäquate Kontraktionen der Beckenbodenmuskulatur und des Schliessmuskels modifiziert werden können. Die Wirksamkeit von mehreren Biofeedbacksitzungen ist gut belegt und übertrifft die einer Laxantientherapie.
Im Falle struktureller anorektaler Erkrankungen, z. B. einer klinisch relevanten Rektozele oder Intussuszeption kann bei ausgewählten Patienten auch ein chirurgisches Vorgehen indiziert sein (z. B. staplerassistierte transanale Rektumresektion), idealerweise nach interdisziplinärer Besprechung an einem zertifizierten Beckenbodenzentrum.
Zentrum für Gastroenterologie und Hepatologie
Vulkanplatz 8
8048 Zürich
fruehauf@zgh.ch
Der Autor hat in Zusammenhang mit diesem Artikel keine Interessenskonflikte deklariert.
- Für eine differenzierte Therapie der Obstipation ist es wichtig, die zugrundeliegende Ätiologie zu kennen und sekundäre Ursachen,
insbesondere Medikamente sowie ein Kolonkarzinom auszuschliessen - Neben Allgemeinmassnahmen und Quellmitteln sind osmotische Laxantien wie Macrogol oder Laktulose, ggf. in Kombination mit
Dulcolax Bisacodyl die beste Therapie - Führt die Standardtherapie nicht zu einem klinischen Ansprechen, kommt der Einsatz von Lubiproston (Amitiza®) oder Prucaloprid
(Resolor®) in Betracht - Bei obstipationsprädominantem Reizdarmsyndrom steht mit Linaclotid (Constella®) ein Medikament zur Verfügung, das neben der laxierenden auch eine viszeral-analgetische Wirkung hat, die allerdings erst nach einigen Therapiewochen einsetzt
- Bei fehlendem Ansprechen auf die Standardtherapie können die anorektale Funktionsdiagnostik und eine MRI-Defäkographie therapierelevante Zusatzinformationen liefern.
1. Fried M, Frühauf H: Obstipation. In: Siegenthalers Differenzialdiagnose, 21. Auflage. Battegay E (ed.), Kapitel 12: 386-94, Thieme-Verlag: Stuttgart 2017
2. Sauter M, Frühauf H: Neue Therapien der Obstipation. Leading Opinions Innere Medizin 2013; 66-69
3. M Camilleri: New treatment options for chronic constipation: Mechanisms, efficacy and safety. Can J Gastroenterol 2011; 25(Suppl B): 29B-35B.
4. Tack J, Müller-Lissner S, Stanghellini V, Boeckxstaens G, Kamm MA, Simren M, Galmiche JP, Fried M: Diagnosis and treatment of chronic constipation – a European perspective. Neurogastroenterol Motil 2011; 23: 697-710.
5. Frühauf H: Herausforderung Obstipation: Strukturierte Diagnostik, individualisierte Behandlung. Hausarzt Praxis 2009; 4: 9-13
6. Fruehauf H, Fox M: Obstipation. Gastroenterologe 2008; 3: 488-496.
7. Rao SS (2007) Constipation: evaluation and treatment of colonic and anorectal motility disorders. Gastroenterol Clin North Am 36: 687–711. Stimulierende Laxantien vom Diphenylmethantyp
8. Kamm MA, Mueller-Lissner S, Wald A, Richter E, Swallow R, Gessner U: Oral bisacodyl is effective and well-tolerated in patients with chronic constipation. Clin Gastroenterol Hepatol 2011; 9: 577-583.
9. Mueller-Lissner S, Kamm MA, Wald A, Hinkel U, Koehler U, Richter E, Bubeck J: Multicenter, 4-week, double-blind, randomized, placebo-controlled trial of sodium picosulfate in patients with chronic constipation. Am J Gastroenterol 2010; 105: 897-903. Prucaloprid
10. Camilleri M, Kerstens R, Rykx A, Vandeplassche L: A placebo-controlled trial of prucalopride for severe chronic constipation. N Engl J Med 2008; 358: 2344-2354.
11. Quigley EM, Vandeplassche L, Kerstens R, Ausma J: Clinical trial: the efficacy, impact on quality of life, and safety and tolerability of prucalopride in severe chronic constipation – a 12-week, randomized, double-blind, placebo-controlled study. Aliment Pharmacol Ther 2009; 29: 315-328.
12. Tack J, van Outryve M, Beyens G, Kerstens R, Vandeplassche L: Prucalopride (Resolor) in the treatment of severe chronic constipation in patients dissatisfied with laxatives. Gut 2009; 58: 357-365. Lubiproston
13. Johanson JF, Morton D, Geenen J, Ueno R: Multicenter, 4-week, double-blind, randomized, placebo-controlled trial of lubiprostone, a locally-acting type-2 chloride channel activator, in patients with chronic constipation. Am J Gastroenterol 2008; 103: 170-177.
14. Bassil AK, Borman RA, Jarvie EM, McArthur-Wilson RJ, Thangiah R, Sung EZ, Lee K, Sanger GJ: Activation of prostaglandin EP receptors by lubiprostone in rat and human stomach and colon. Br J Pharmacol 2008; 154: 126-135. Linaclotid
15. Lembo AJ, Kurtz CB, Macdougall JE, Lavins BJ, Currie MG, Fitch DA, Jeglinski BI, Johnston JM: Efficacy of linaclotide for patients with chronic constipation. Gastroenterology 2010; 138: 886-895. Opiatinduzierte Obstipation
16. Camilleri M. Opioid-induced constipation: challenges and therapeutic Opportunities. Am J Gastroenterol 2011; 106: 835-842.
der informierte @rzt
- Vol. 9
- Ausgabe 11
- November 2019