- Osteoporose beim Mann
Die Osteoporose wird beim Mann unterschätzt. 1 auf 5 Männer besitzen ein erhöhtes Risiko für eine osteoporotische Fraktur. Der Goldstandard zur Diagnose der Osteoporose ist auch beim Mann die Messung der BMD mittels DXA. FRAX® ermittelt auch beim Mann die 10-Jahres-Probabilität einer schweren Fraktur («major fracture»). Da es noch kein Netz zur Früherkennung der männlichen Osteoporose gibt, werden die vorhandenen zur Senkung des Frakturrisikos wirksamen Medikamente beim Mann zu wenig und oft zu spät eingesetzt. Bei hohem Frakturrisiko sind die Präparate der ersten Wahl orale Bisphosphonate, die der zweiten Wahl Denosumab oder Zoledronat. Bei Patienten mit Hypogonadismus muss immer auch eine zusätzliche Testosteronsubstitution erwogen werden. Die Früherkennung ist vor allem Aufgabe der Grundversorger und der Urologen. Gynäkologen sollten in Kinderwunsch- und Menopause-Sprechstunden sowie bei sexualmedizinischen Beratungen auch an einen Hypogonadismus mit erhöhtem Osteoporoserisiko des Partners denken.
In men, osteoporosis is still underestimated. One in five men possesses an increased risk for osteoporotic fractures. Also in men, determination of BMD by DXA is still the gold standard for the diagnosis of osteoporosis. FRAX® calculates fracture probability from easily obtainable clinical risk factors also in men. Its output is the 10-year probability of a major fracture. Because there is no network for early detection of male osteoporosis, the medications available for the reduction of fragility fractures are used in man only rarely and often late. In men with a high fracture risk, the first-line preparations are oral bisphosphonates, the second-line preparations denosumab or zoledronate. In patients with hypogonadism, an additional testosterone substitution has always to be evaluated. Early detection is mainly the task of the general practitioners and the urologists. But gynaecologists should always think of the possibility of male hypogonadism with consecutive osteoporosis in the partners of their female patients consulting for infertility, menopause or sexual problems.
Key words: Osteoporosis – Man – Hypogonadism – Therapy – Testosterone
Einleitung
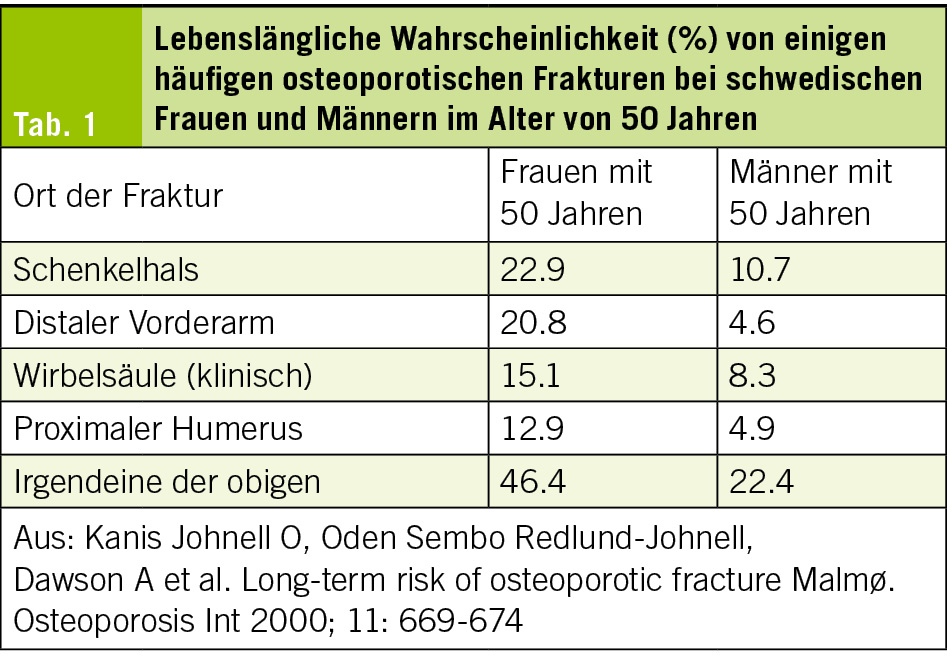
Die Osteoporose ist die häufigste Knochenerkrankung. Weltweit tritt alle 3 Sekunden eine osteoporotische Fraktur ein. 2015 litten in der EU 20 Mio. Menschen darunter, davon waren 4.2 Mio. Männer. Die Osteoporose beim Mann wird immer noch stark unterschätzt, unterdiagnostiziert und untertherapiert (1–5), obwohl das Lebenszeitrisiko einer osteoporotischen Fraktur bei einem 50-jährigen Mann 13–25 % beträgt (Tab. 1). Ärzt/-innen, die Paare mit Sexualproblemen und menopausale Frauen betreuen, sollen dafür sensibilisiert sein, denn sie haben am ehesten die Gelegenheit, deren männliche Partner einer rechtzeitigen Abklärung zuzuführen. Zum Beispiel, wenn sie in Rahmen von Eheproblemen auf Symptome treffen, die mit einem männlichen Hypogonadismus vereinbar sind.
Diese Übersicht für Nichtspezialisten soll grundlegende Hinweise zu Erkennung und Abklärung bei Verdacht auf Osteoporose und zum Vorgehen bei erhöhtem Risiko für Fragilitätsfrakturen bei Männern geben.
Beim Mann steigt das Frakturrisiko erst ab dem Alter von 75 Jahren signifikant an, also rund 10 Jahre später als bei Frauen. Männer besitzen dickere Knochen mit massiveren Strukturen. Ihre Peak Bone Mass (PMB; maximale erreichte Knochenmasse) ist grösser als diejenige der Frau. Beide Vorteile senken das Risiko einer Fragilitätsfraktur. Zudem erfolgt die Abnahme der Konzentration der Sexualsteroide und damit die Veränderungen im Knochenstoffwechsel langsamer und gleichmässiger. Der Mann kennt keinen der Menopause vergleichbaren abrupten Funktionsabfall der Gonadenachse mit konsekutiver rascher Abnahme der Bone Mineral Density (BMD).
1 auf 3 Frauen und 1 auf 5 Männer besitzen ein erhöhtes Risiko für eine osteoporotische Fraktur. 68 % betreffen Frauen, 22 % Männer. Die Prävalenz von Vorderarmfrakturen ist bei Frauen im Alter von 50 Jahren ungefähr viermal höher als bei Männern (0.4 % versus 0.1 % der Risikopopulation) mit einer Risiko-Ratio von 4.5 zwischen den Geschlechtern (6).
Die Häufigkeit einer Schenkelhalsfraktur ist mit 70 % bei Frauen grösser als bei Männern mit 30 % (6), allerdings vermindert sich dieser Unterschied mit zunehmendem Alter. In der Dubbo Osteoporosis Epidemiology Study (7) lag bei Schenkelhalsfrakturen das Verhältnis der Inzidenzrate zwischen Männern und Frauen im Alter von 60–69 Jahren bei 1 : 4.5 (95 % CI 1.3–15.7), im Alter von 70–79 Jahren bei 1 : 1.5 (95 % CI 0.9–2.5), und im Alter ≥ 80 Jahren bei 1:1.19 (95 % CI 1.2–2.8).
Andererseits haben Männer nach Schenkelhalsfrakturen eine höhere Mortalität als Frauen (8, 9), vermutlich wegen einer erhöhte Ko-Morbidität und einer höheren Infektionsrate. Bei hospitalisierten älteren Patienten (≥ 60 Jahre alt) betrug die Mortalität nach einer Schenkelhalsfraktur bei Männern 10.2 % gegenüber 4.7 % bei Frauen, die 1-Jahresmortalität 37.5 % bei Männern gegenüber 28.2 % bei Frauen (mediane Aufenthaltsdauer der Überlebenden 8 Tage [interquartiler Bereich 6–13 Tage]). Das erhöhte männliche Risiko kann für mehr als 10 Jahre fortbestehen.
Osteoporose als Folge von Hypogonadismus
Der männliche Hypogonadismus mit seiner Abnahme der Testosteronproduktion hat eine Erhöhung des Knochenstoffwechsels zur Folge. Dies führt wiederum über den vermehrtem Knochenabbau zu einem erhöhten Frakturrisiko (10, 11). Doch hat auch beim Mann nicht nur Testosteron, sondern auch Östradiol einen Einfluss auf den Knochenstoffwechsel (12). Östradiol wird aus Testosteron aromatisiert und korreliert mit diesem direkt. Den hauptsächlichen protektiven Effekt auf den Knochen scheint Östradiol zu besitzen. Jede Abnahme des Testosterons führt somit auch zu einer Senkung von Östradiol und damit zu einer Schwächung seines protektiven Effekts bei beschleunigtem Knochenabbau (10–11).
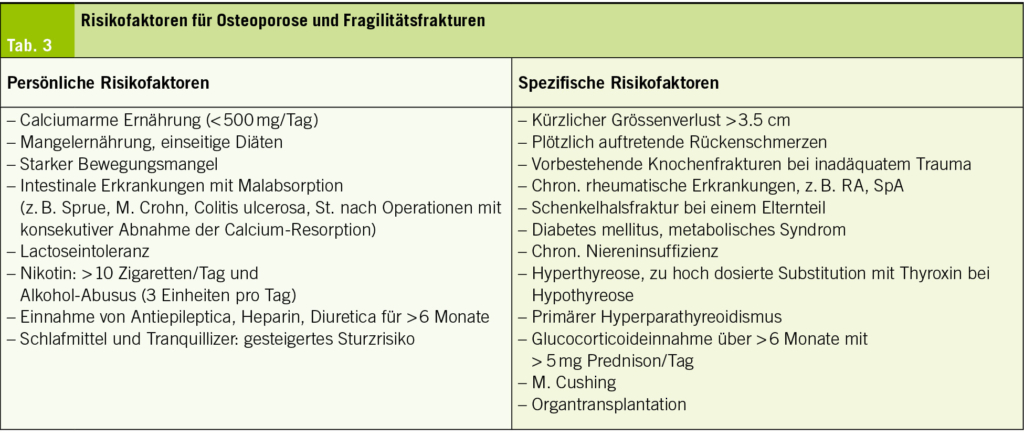
Das Erkennen eines Hypogonadismus ist beim Mann nicht immer offensichtlich. Die Diagnose folgt oftmals einer Vielzahl von klinischen Zeichen (Tab. 2), die jeweils einzeln oder in Kombination auftreten, aber zum Teil auch fehlen können (13). Für das Erkennen eines Hypogonadismus im Rahmen einer Osteoporoseabklärung ist die Beurteilung der klinischen Bedeutung der jeweiligen Symptome zentral (z.B. Rückenschmerzen oder Kyphose).
Eine Subgruppe des Hypogonadismus stellt die iatrogene Gonadensuppression dar, insbesondere bei Männern mit Prostatakarzinom (14–16). Früher die Kastration, heute die in der Regel medikamentöse Testosteronsuppression induziert gezielt einen supraphysiologischen Testosteronabfall auf das Kastrationsniveau. Ein solcher rapider und subtotaler Testosteronverlust führt zu einem Verlust an Knochendichte im peripheren und zentralen Skelett und zu erhöhter Frakturneigung. Aufgrund der Schwere des induzierten Hypogonadismus bedürfen betroffene Männer eines besonderen Augenmerks hinsichtlich der Einleitung einer Osteoporose-Prophylaxe oder -Therapie im Rahmen regelmässiger Nachsorgeuntersuchungen (16).
Die gleiche Problematik besteht bei der Suppression der Gonadenachse im Rahmen der Gender-Medizin.

Erkennung und Diagnose der Osteoporose beim Mann
Klinische Untersuchung
Zuerst müssen in einer gezielten Anamnese die Risikofaktoren für Osteoporose und Fragilitätsfrakturen herausgearbeitet werden (Tab. 3). Die klassischen Zeichen und Symptome einer Osteoporose sind in (Tab. 4) zusammengefasst.

Osteodensitometrie mittels DXA
Während die konventionelle Radiologie zur Frakturerkennung dient, bleibt die Knochendichtemessung mittels DXA auch beim Mann der Goldstandard zur Diagnose einer Osteoporose (Tab. 5). Die BMD erlaubt es, die Osteoporose zu definieren, aber sie ist nur einer der Risikofaktoren für eine Fragilitätsfraktur. Sie gilt als spezifischer Marker für ein hohes Frakturrisiko, doch ist ihre Sensitivität gering. Personen mit einer niedrigen BMD besitzen individuell ein hohes Frakturrisiko. Allerdings tritt die Mehrzahl aller Frakturen in einer Population mit einem T-Score oberhalb der Schwelle von −2.5 ein (17). Diese Population besitzt individuell betrachtet ein niedrigeres Frakturrisiko, aber sie schliesst viel mehr Personen ein als die osteoporotische Gruppe mit einem T-Score von <2.5.

FRAX®
FRAX® ist ein erstmals 2008 publizierter Computer-basierter Algorithmus (18, 19). Er ist auf den Einsatz in der ärztlichen Grundversorgung ausgerichtet und berechnet bei Männern und Frauen die Probabilität einer Fraktur über einfach erhältliche klinische Risikofaktoren. FRAX® ermittelt die 10-Jahres-Probabilität einer schweren Fraktur (= major fracture; Schenkelhals, Wirbelsäule (klinisch), Oberarm, Handgelenk). Die Wahrscheinlichkeit berechnet sich aus dem Risiko für Fraktur und Tod in Bezug auf Alter, BMI und einfache dichotome Risikofaktoren wie frühere Fragilitätsfrakturen, Anamnese von Schenkelhalsfrakturen bei den Eltern, aktuelles Zigarettenrauchen, Langzeitanwendung von Glucocorticoiden, rheumatoider Arthritis, anderer Ursachen einer sekundären Osteoporose und Alkohol-Abusus.
Optional kann die BMD am Schenkelhals bei der Berechnung von FRAX® eingeschlossen werden. Dadurch wird die Voraussage des Frakturrisikos verbessert.
Laboruntersuchungen
Laboruntersuchungen werden vor allem zur Abklärung einer sekundären Osteoporose benötigt und sind nicht Thema dieser Übersicht.
Prävention und Therapie
Allg. Prävention: ausgewogenen Ernährung, Supplemente (20)
Bei Männern mit Osteoporose ist eine ausgewogene Ernährung ein absolutes «must». Für beide Geschlechter dürfen die gleichen Richtlinien verwendet werden.
Wichtig ist eine adäquate Eiweisszufuhr. Bei Risikopatienten scheint ein höherer Proteinkonsum als die übliche für Gesunde empfohlene tägliche Menge die Knochenqualität zu verbessern (21, 22).
Als Grundregel sollten pro Tag 800–1200 mg Calzium über die normale Ernährung aufgenommen werden. Die Gabe eines Calzium-Supplements muss dann erwogen werden, wenn die tägliche Aufnahme unter 800 mg liegt. Eine Supplementation mit Vit D (in der Regel 800 IU) macht für jüngere Männer nur bei erhöhtem Frakturrisiko oder zu niedrigen Vitamin D Spiegel Sinn. Hingegen sollten Männer über 65 Jahren generell Supplemente von Calcium und Vit D erhalten (5, 17) (starke Empfehlung nach 17).
Sturzprävention
Eine neue systematische Übersicht (23) zur Evidenz des Nutzens von körperlichem Training zur Sturzprophylaxe kommt unter Einbezug einer Cochrane Analyse (24) zum Schluss, dass Training das Sturzrisiko um 23 % senkt.
Der Effekt von Stürzen auf das Frakturrisiko ist in FRAX®-plus als Option zur Verbesserung der 10-Jahres Wahrscheinlichkeit einer Fraktur aufgenommen worden (17). In FRAX®-plus wird die Anzahl der eingetretenen Stürze im letzten Jahr angegeben (0, 1, 2 und 3 oder mehr Stürze).
Interventionsschwelle
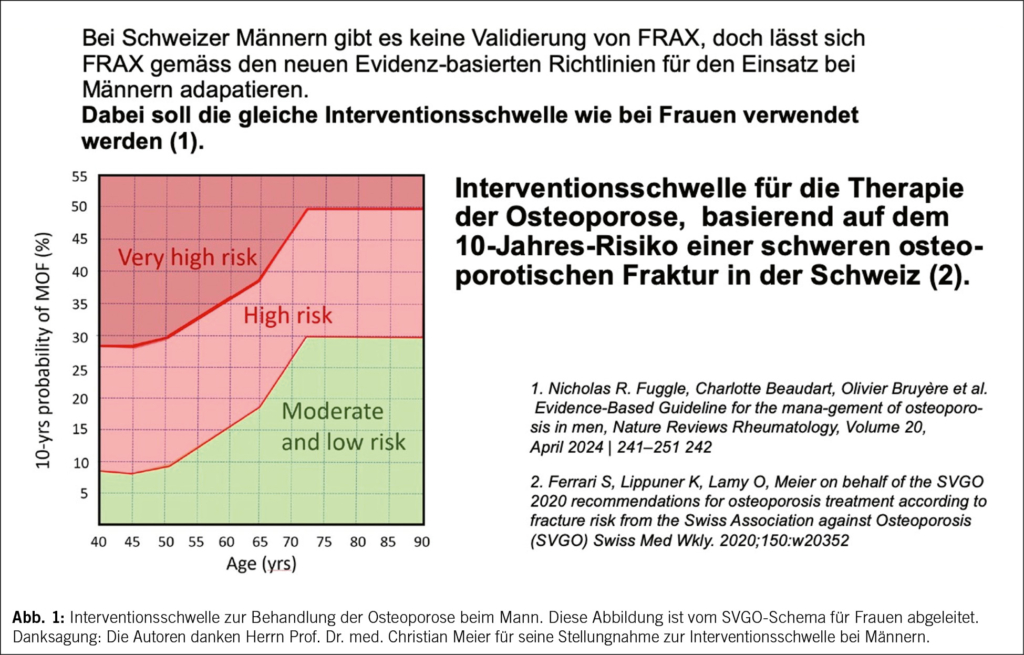
Beim Mann liegen deutlich weniger Daten zur Berechnung und Definition der Interventionsschwelle für eine Therapie vor als bei der Frau. Die Endocrine Society empfiehlt bei Männern mit hohem Frakturrisiko, eine Behandlung vor allem unter folgenden Voraussetzungen einzuleiten (25):
– Anamnese einer Fragilitätsfraktur von Schenkelhals oder Wirbelsäule
– (Europa) BMD ≤ 2.5 Standardabweichungen unter dem Mittelwert für normale junge weisse Männer (benützen von weissen jungen Männern als Referenzpopulation)
– (USA) solche mit einer BMD innerhalb des osteopenischen Bereichs und einem 20 % 10-Jahresrisikos einer schweren osteoporotischen Fraktur oder einem 10 % Risiko einer Schenkelhalsfraktur.
Die heute verfügbare Evidenz stützt den Gebrauch einer gemeinsamen Interventionsschwelle (T-Score-Schwellenwert) und die Verwendung des weiblichen NHANES Referenz-Bereichs auch für Männer (17, 25). Die in der Schweiz für Männer zu empfehlende Interventionsschwelle zeigt (Abb. 1).
Medikamentöse Therapie
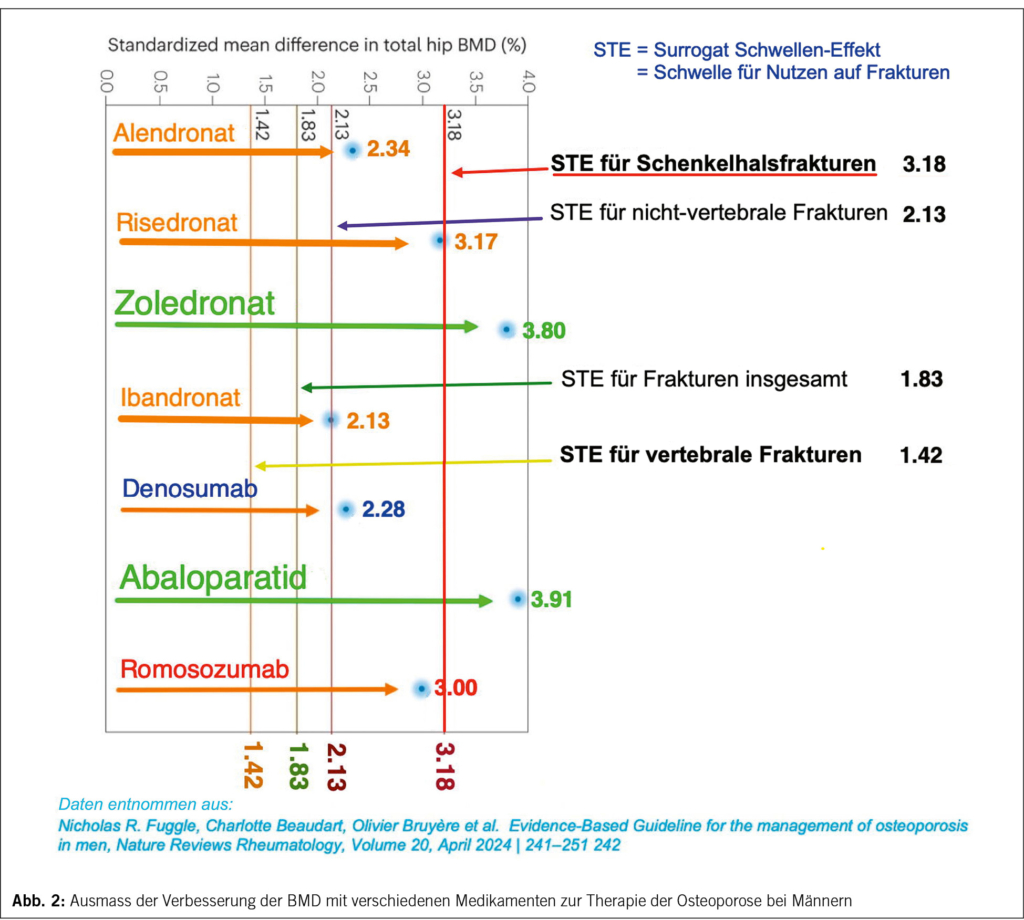
Die erste Wahl zur Behandlung der Osteoporose ist bei Männern mit erhöhtem Frakturrisiko und überschrittener Interventionsschwelle (Abb. 1) die medikamentöse Therapie. Das gleiche gilt für alle Männer mit einer vorbestehenden Fragilitätsfraktur (starke Empfehlung, nach 17). Die Palette der zur Verfügung stehenden Präparate ist die gleiche wie bei der Frau: die Antiresorptiva Bisphosphonate, Denosumab, Romosozumab, und die Anabolica Teriparatid und Abaloparatid. Die Präparate der ersten Wahl bei Männern mit hohem Frakturrisiko sind orale Bisphosphonate (Alendronat oder Risedronat) (starke Empfehlung, 17), zu denjenigen der zweiten Wahl gehören Denosumab oder Zoledronat (starke Empfehlung, 17). Gestützt auf die verfügbaren BMD-Daten gilt Abaloparatid international als Therapie der ersten Wahl für Männer mit Osteoporose und einem sehr hohen osteoporotischen Frakturrisiko (schwache Empfehlung, 17). In der Schweiz ist Abaloparatid seit dem 07.03.2024 zugelassen, doch erst für die postmenopausale Frau. (Abb. 2) zeigt die Wirksamkeit der verschiedenen therapeutischen Möglichkeiten nach dem Modell von Fuggle et al. (17).
Männern mit sehr hohem Frakturrisiko muss eine sequentielle Behandlung (27) empfohlen werden. Diese wird mit einem knochenbildenden Präparat begonnen, gefolgt von einer antiresorptiven Substanz (starke Empfehlung nach 17).
Die Durchführung der medikamentösen Therapie gehört auch beim Mann in die Hände des Spezialisten. Zur Sicherstellung einer wirksamen Senkung des Frakturrisikos soll auch bei hypogonaden Männern eine medikamentöse Osteoporosetherapie eingesetzt werden, unabhängig von einer Testosteron-Substitution (17).
Substitution mit Testosteron
Der Nutzen einer Testosteronsubstitution auf das Skelett wird kontrovers diskutiert (114). Frakturdaten fehlen. Eine positive Wirkung ist bisher bei einer hypogonaden Population einzig auf die BMD der LWS und des Schenkelhalses erwiesen (28–30).
Doch ist eine zur medikamentösen Therapie zusätzliche Testosteronsubstitution bei Hypogonadismus indiziert. Der Entscheid muss unter Einbezug eines Endokrinologen ganzheitlich gefällt werden. Zu den Entscheidungskriterien gehören die Symptome des männlichen Hypogonadismus inklusive Sexualfunktion, das kardiovaskuläre System und der freie oder totale Testosteronwert im Serum.
Bisher wurde beim älteren Mann unter einer physiologisch dosierten Testosterongabe kein Anstieg des kontrovers diskutierten kardiovaskulären Risikos nachgewiesen (31). Die bisherigen RCTs weisen trotz zu geringer Power auf den gleichen Schluss hin. Eine klare Antwort zum kardiovaskulären Risiko könnte die noch laufende TRAVERSE-Studie geben, in der bei Männern mit hypogonaden Symptomen, niedrigen Serum-Testosteronwerten und hohem kardiovaskulärem Risiko Testosteron gegen Placebo getestet wurde (31, 32). Der primäre Endpunkt der TRAVERSE-Studie ist die kardiovaskuläre Sicherheit.
Schlussfolgerung
Die Osteoporose ist beim Mann unterschätzt und bleibt ein medizinisches und gesundheitspolitisches Sorgenkind. Da es noch kein Netz zur Früherkennung der männlichen Osteoporose gibt, werden die vorhandenen zur Senkung des Frakturrisikos wirksamen Medikamente beim Mann zu wenig und oft zu spät eingesetzt. Der Goldstandard zur Diagnose der Osteoporose ist auch beim Mann die Messung der BMD mittels DXA. Die First-Line Präparate sind bei hohem Frakturrisiko orale Bisphosphonate, die Second-Line-Präparate Denosumab oder Zoledronat. Bei hypogonaden Patienten muss gleichzeitig eine Testosteronsubstitution erwogen werden.
Die Früherkennung ist Aufgabe der Grundversorger und der Urologen. Gynäkologen sollten in Kinderwunsch- und Menopause-Sprechstunden sowie bei einer sexualmedizinischen Beratung beim männlichen Partner vermehrt an einen Hypogonadismus mit erhöhtem Osteoporoserisiko denken.
Copyright Aerzteverlag medinfo AG
– Urologie St. Anna
St. Anna-Strasse 32
6006 Luzern
– Senior Consultant
Klinik für Urologie
Universitätsspital Basel
frederic.birkhaeuser@hin.ch
Gartenstrasse 67
4052 Basel
martin.birkhaeuser@bluewin.ch
Die Autoren haben keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
- Die Osteoporose wird beim Mann unterschätzt. 2015 litten in der EU 20 Mio. Menschen an Osteoporose, davon waren 4.2 Mio. Männer.
- Gesunde Ernährung mit genügend Proteinen und Ca ist essentiell.
- Männer über 65 Jahren sollten generell Supplemente von Calcium und Vitamin D erhalten. Sturzprophylaxe empfehlen!
- Die Knochendichtemessung mittels DXA ist auch beim Mann der Goldstandard zur Diagnose einer Osteoporose.
- FRAX® eignet sich auch beim Mann zur Ermittlung des 10-Jahres-Frakturrisikos. Die Evidenz stützt eine gemeinsame Interventionsschwelle für Frau und Mann.
- Wird die Interventionsschwelle überschritten oder liegt eine vorbestehende Fragilitätsfraktur vor, so muss eine medikamentöse Therapie eingeleitet werden.
- Bei Hypogonadismus und niedrigen Serum-Testosteronwerten muss unabhängig von der medikamentösen Osteoporosetherapie eine Testosteron-Substitution erwogen werden.
1. Kanis JA et al. on behalf of the Scientific Advisory Board of ESCEO and the Committee of Scientific Advisors of IOF. European guidance for the diagnosis and management of osteoporosis in postmenopausal women. Osteoporos Int. 2013; 24: 23–57.
2. National Osteoporosis Foundation. Available at: http://www.nof.org/ Accessed April 6, 2010.
3. Kanis JA, Johnell O, Oden A et al. Epidemiology of Osteoporosis and Fracture in Men Calcif Tissue Int 2004;5:90–99.
4. Hopkins RB, Pullenayegum E, Goeree R et al. Estimation of the lifetime risk of hip fracture for women and men in Canada. Osteoporos Int. 2012;23(3):921-927.
5. Kaufman J-M. Management of osteoporosis in older men. Aging Clinical and Experimental Research 2021; 33:1439–1452.
6. Borgström, F. et al. Fragility fractures in Europe: burden, management and opportunities.Arch. Osteoporos 2020;15(1):59-79.
7. Chang, K. P., Center, J. R., Nguyen, T. V. & Eisman, J. A. Incidence of hip and other osteoporotic fractures in elderly men and women: Dubbo osteoporosis epidemiology study. J. Bone Min. Res.2004;19,532–536.
8. Wehren, L. E. et al. Gender differences in mortality after hip fracture: the role of infection. J. Bone Min. Res.2003; 18:2231–2237.
9. Jiang, H. X. et al. Development and initial validation of a risk score for predicting in-hospital and 1-year mortality in patients with hip fractures. J. Bone Min. Res.2005;20:494–500.
10. Rochira V. Late-onset Hypogonadism: Bone health. Andrology 2020; 8:1539-1550.
11. Kaufman JM, Lapaw B, Mahmoud A et al. Aging and the Male Reproductive System. Endocr Rev 2019;40(4):906-972.
12. Vanderschueren D, Laurent MR, Claessens F et al., Sex Steroid Actions in Male Bone. Endocr Rev 2014;35(6):906–960.
13. Rochira V, Antonio L, Vanderschueren D. EAA clinical guideline on management of bone health in the andrological outpatient clinic. Andrology. 2018;6(2):272-285.
14. Shahinian VB Kuo Yong-Fang Freeman JL, et al., Risk of fracture after androgen deprivation for prostate cancer. N Engl J Med 2005;13;352(2):154-164.
15. Mittan D, Lee S, Miller E et al., Bone loss following hypogonadism in men with prostate cancer treated with GnRH analogs. J Clin Endocrinol Metab 2002;87(8):3656-3661.
16. Vilaca, T., Eastell, R. and Schini, M. Osteoporosis in men. Lancet Diabetes & Endocrinology 2022:10(4):273-283.
17. Fuggle NR, Beaudart Ch, Bruyère O et al. Evidence-Based Guideline for the management of osteoporosis in men. Nature Reviews Rheumatology 2024;20:241–251.
18. Kanis, J. A. et al. A decade of FRAX: how has it changed the management of osteoporosis? Aging Clin. Exp. Res. 2022; 32:187–196.
19. Kanis, J. A. et al. The use of clinical risk factors enhances the performance of BMD in the prediction of hip and osteoporotic fractures in men and women. Osteoporos. Int. 2007; 18:1033–1046.
20. Kanis, J. A., Cooper, C., Rizzoli, R. & Reginster, J. Y. European guidance for the diagnosis and management of osteoporosis in postmenopausal women. Osteoporos. Int. 2019; 30:3–44.
21. Rizzoli R, Biver E, Brennan-Speranza TC. Nutritional intake and bone health. Lancet Diabetes Endocrinol 2021:9:606–621.
22. Rizzoli R Biver E, Bonjour J-P et al. Benefits and safety of dietary protein for bone health-an expert consensus paper endorsed by the European Society for Clinical and Economical Aspects of Osteopororosis, Osteoarthritis, and Musculoskeletal Diseases and by the International Osteoporosis Foundation. Osteoporos. Int 2018; 29:1933–1948.
23. Sherrington C, Firhall N, Kwok W et al. Evidence on physical activity and falls prevention for people aged 65+ years: systematic review to inform the WHO guidelines on physical activity and sedentary behaviour. Int. J. Behav. Nutr. Phys. Act. 2020; 17:144-152.
24. Sherrington C, Fairhall NJ, Wallbank GK, Tiedemann A, Michaleff ZA, Howard K, et al. Exercise for preventing falls in older people living in the community. Cochrane Database Systematic Reviews 2019;1:CD012424.
25. Watts, N. B. et al. Osteoporosis in men: an Endocrine Society clinical practice guideline. J. Clin. Endocrinol. Metab. 2012; 97:1802–1822.
26. Ferrari S, Lippuner K, Lamy O, Meier Ch on behalf of the SVGO. 2020 recommendations for osteoporosis,treatment according to fracture risk from theSwiss Association against Osteoporosis (SVGO): Swiss Med Wkly. 2020;150:w20352.
27. Cosman F, Nieves JW, Dempster DW. Treatment sequence matters: anabolic and antiresorptive therapy for osteoporosis. Journal of Bone and Mineral Research 2017;32(2):198-202.
28. Snyder, P. J. et al. Effect of testosterone treatment on volumetric bone density and strength in older men with low testosterone: a controlled clinical trial. JAMA Intern. Med. 2017;177:471–479.
29. Ng Tang Fui, M. et al. Effect of testosterone treatment on bone microarchitecture and bone mineral density in men: a 2-year RCT. J. Clin. Endocrinol. Metab. 2021;106:e3143–e3158.
30. Corona, G. et al. Testosterone supplementation and bone parameters: a systematic review and meta-analysis study. J. Endocrinol. Invest. 2022;45,:911–926.
31. Lincoff, A. M. et al. Cardiovascular safety of testosterone-replacement therapy. N. Engl. J. Med. 2023;389:107–117.
32. Anawalt BD. The TRAVERSE trial: cardiovascular safety of testosterone therapy for older men. THE LANCET Diabetes & Endocrinology 2023;Vol II(10): 714-771.
der informierte @rzt
- Vol. 14
- Ausgabe 10
- Oktober 2024









