- Osteoporose Update: Screening, Diagnostik und Therapie

In der Schweiz ist jede 2. Frau uns jeder 5. Mann von Osteoporose betroffen. Die Frakturen finden sich in der Wirbelsäule, der Hüfte, des Vorderarms, des Humerus und des Beckens, so PD Dr. med. Christof Iking-Konert, Stadtspital Zürich. Wirbelkörperfrakturen sind nicht selten. Sie sind klinisch inapparent.
Der Referent präsentierte eine typische Osteoporose-Geschichte:
Patientin 66-jährig, BMI 23.3, Raucherin, FRAX® 23% für MOF (Major Osteoporotic Fracture), ohne DXA (Dual-Energy X-ray absorptiometry) gerechnet.
Ein grosser Anteil der Frauen mit hohem Frakturrisiko erhalten in der Schweiz keine Behandlung, so der Referent.
Diagnose einer Osteoporose
Eine frühe Diagnose wäre wichtig, aber eine kassenpflichtige Indikation für eine Knochendichtemessung beinhaltet die folgenden Punkte:
– Klinisch manifeste Osteoporose inkl. Osteoporose-assoziiert Frakturen
– Langzeit -Cortisonbehandlung (>5mg/d)
– Hypogonadismus (inkl. frühe Menopause)
– Primärer Hyperparathyreoidismus
– Gastrointestinale Erkrankungen mit Malabsorption (inkl. Morbus Crohn, Zöliakie)
– Osteogenesis imperfecta
– HIV-Erkrankung
– Therapie mit Aromatasehemmer (nach der Menopause) oder mit der Kombination GnRH
– Basislaborparameter: Differentialdiagnostik, Hinweis auf Analogon + Aromatasehemmer (vor der Menopause) oder antiandrogener Therapie
– Verlaufsmessung bei bekannter Osteoporose alle 2 Jahre inkl. Verlaufsmessung unter Therapie.
FRAX® Risikorechner zur Bestimmung des Frakturrisikos
Mit dem FRAX-Risiko-Rechner kann unter Berücksichtigung von klinischen Risikofaktoren das 10-Jahres-Risiko einer Hüft- oder Osteoporose-Fraktur abgeschätzt werden. Bei Vorhandensein einer Knochendichtemessung am Schenkelhals lässt sich das Frakturrisiko noch genauer abschätzen.
Basislaborparameter Differentialdiagnostik/Hinweis auf
Creatiniclearance (GFR).
- Erniedrigt bei renaler Osteopathie, höhergradige Niereninsuffizienz als Kontraindikation für verschiedene Medikamente
C-reaktives Protein
- erhöht bei entzündlicher Erkrankung und Malignom-Hinweis BSG erhöht bei entzündlicher Erkrankung, rheumatische Erkrankung, Autoimmun-Erkrankung, bei auffälligem Wert zusätzlich wegen möglichem Hinweis auf eine Paraproteinämie: Elektrophorese.
Grosses Blutbild
TSH
BZ/HbA1c
Serum-Calcium (erhöht)
- Primärer Hyperparathyreoidismus paraneoplastisches Syndrom oder andere Ursachen einer Hyperkalzämie (erniedrigt) z.B. sekundärer Hyperparathyreoidismus, Malabsorption Medikamente. Hypocalcämie als Kontraindikation für mehrere Osteoporose.
Serum-Phosphat (erhöht)
- Niereninsuffizienz, Stadium 4 Sekundärer renaler Hyperparathyreoidismus
Serum-Phosphat (erniedrigt)
- Malabsorption, Hypophosphatämie, z.B. im Rahmen einer XLH
Serum-Natrium(erniedrigt)
- Risikofaktor für Hüftfrakturen, erhöhtes Sturzrisiko
Alkalische Phosphatase (erhöht)
- z.B. Osteomalazie, erniedrigt: mögliche Hinweis auf Hypophosphatasie, unter langjähriger antiresorptiver Therapie
Gamma-GT ( erhöht) (erniedrigt)
- DD hepatisch bedingte AP-Erhöhung, Zöliakie oder Alkoholabusus (Sturzrisiko) Leberschädigung
Abweichende Parameter Empfohlene Differenzialdiagnostik
Serum-Calcium erniedrigt Albumin korrigiertes Calcium berechnen, z.B. bei MGUS AP Iso-Enzyme
Serum-Calcium erhöht
- Parathormon, 24h-Ausscheidung Calcium und Phosphat
Vitamin D (Sarcoidose)
- Vitamin D Hypervitaminose ?
Vitamin D (Sarcoidose) erhöht
- AP Isoenzyme, ggf. Skelettszintigraphie
Vitamin D (Sarcoidose) erniedrigt
- AP Isoenzyme, Pyridoxal-5-Phosphat
(Vit B6), ggf. Humangenetik
TSH fT3, fT4, Thyroxin- oder Trijodthyronin- Substitution?
Monoklonale Gammopathie Immunfixation, Leichtketten
Creatinin, GFR erniedrigt PTHm 1,25(OH)2Vitamin D
je nach Klinik Zöliakie-AK etc.
angelehnt an DVO Osteoporose Leitlinien-DVO e.V.
Zurück zur Patientinnenvignette – es kommt wie es kommen muss
Die Patientin BMI 23.3, Raucherin, 68-jährig wird vorstellig wegen Rückenschmerzen. Nachweis einer frischen LWK4-Fraktur. FRAX für MOF 30% (T-Score (Schenkelhals): -2.8 SD. Fragilitätsfrakturen sind der wichtigste Risikofaktor für eine neue Fraktur, deshalb ist die Frakturprävention nach einer schon erlittenen Fraktur so wichtig. Der Referent verwiest auf einen Artikel im Swiss Medical Weekly von 2020 (Lippuner K et al. 2020 recommendations for osteoporosis treatment according to fracture risk from the Swiss Association against Osteoporosis (SVG). Swiss Med. Weekly 2020, 150:w20352).
Therapie der Osteoporose
Sturzprävention durch Bewegung. Physiotherapie: ambulante Gangsicherheitskurs. Jede dritte Person über 65 Jahre ist ein Sturzopfer. Zwischen Osteoklasten (Knochenabbau) und Osteoblasten (Knochenaufbau) herrscht ein Gleichgewicht. Ab der Menopause überwiegt der Knochenabbau.
Der erste Therapiemechanismus ist der antiresorptive Mechanismus: Bisphosphonate, Desnosumab und SERM (Selektiver Erstrogen-Rezeptor-Modulator) hemmen die Osteoklasten und sind antiresorptiv. Der zweite Mechanismus ist der osteoanabole Mechanismus. Die Osteoblasten werden aktiviert. Medikamente sind die Parathormon Analoga (Teriparatid) und die Antikörper gegen Sklerostin (Romosozumab).
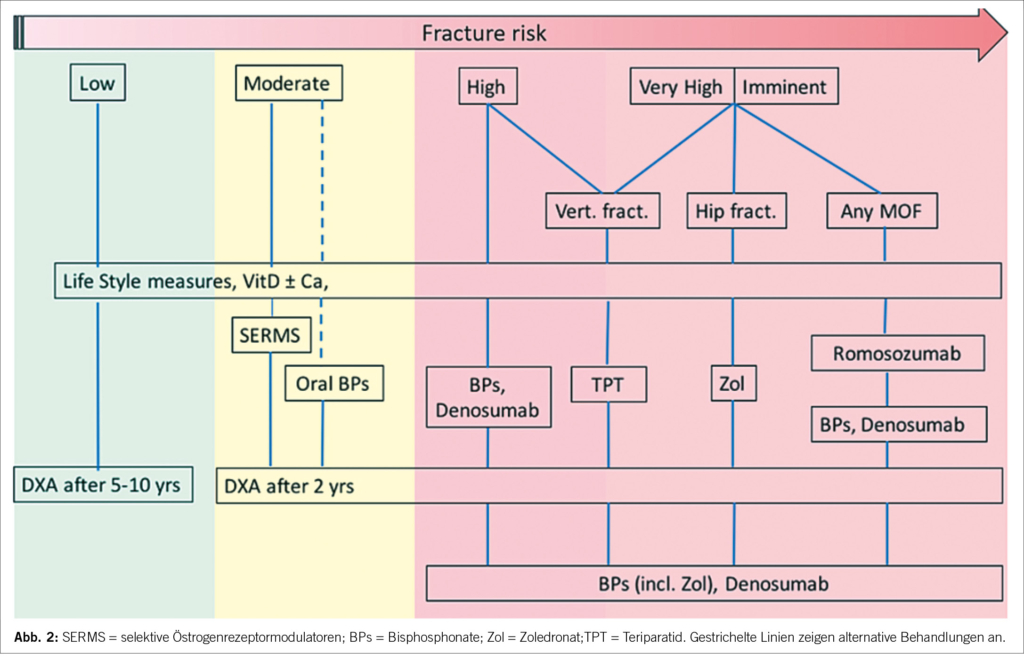
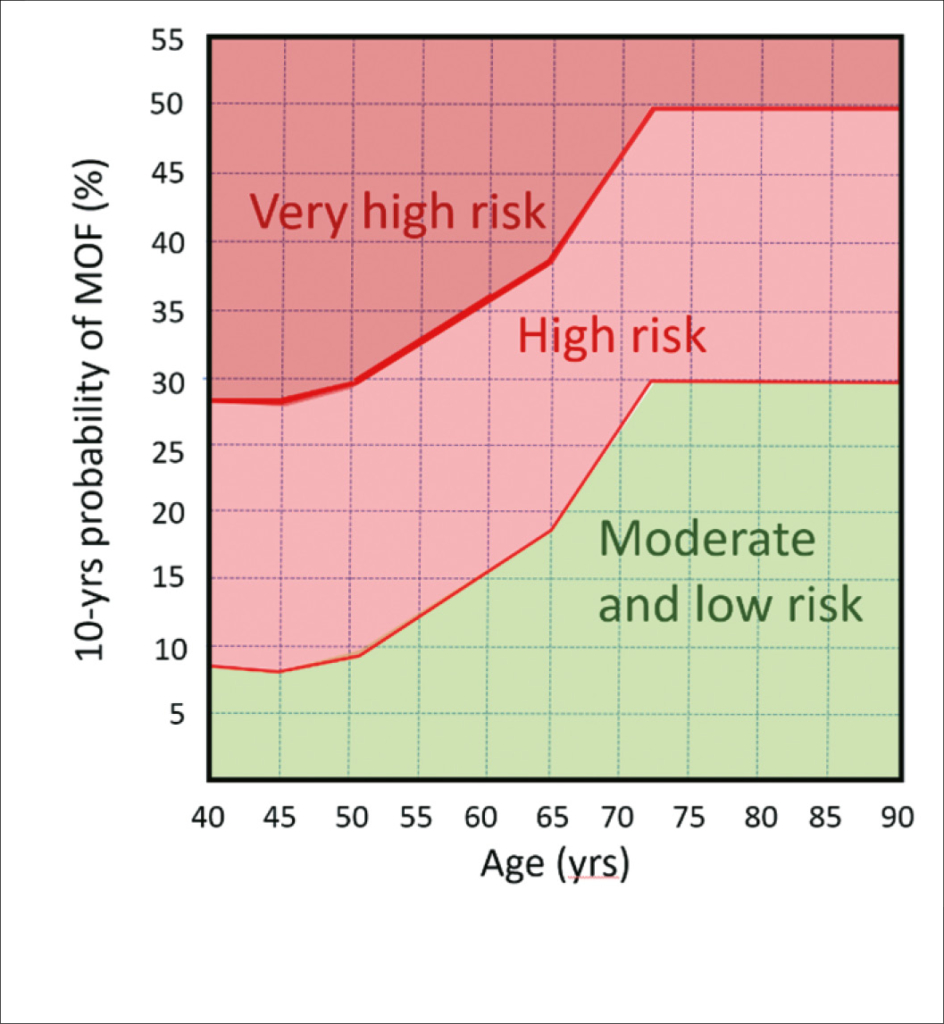
SGVO-Richtlinie zur Behandlung der Osteoporose. Interventionsschwellen nach Frakturrisiko nach FRAX: Die Interventionsschwellen für die Osteoporosetherapie basierend auf dem 10-Jahresrisiko für schwere osteoporotische Frakturen sind in der folgenden Abb. wiedergegeben (Ferrari S et al Swiss Med Wkly 2020:150:w20352)
Medikamentöse Therapie der Osteoporose bei älteren Erwachsenen
Ziel der Osteoporosebehandlung ist es, Knochenbrüche zu verhindern. Zur Senkung des Frakturrisikos stehen mehrere pharmakologische Wirkstoffe zur Verfügung, die entweder die Knochenresorption verringern oder die Knochenbildung anregen. Bisphosphonate sind die am weitesten verbreiteten Antiresorptiva, die die Knochenumsatzmarker auf niedrige prämenopausale Konzentrationen senken und die Frakturraten reduzieren (Wirbelkörper um 50-70 %, Nicht-Wirbelkörper um 20-30 % und Hüfte um ~40 %). Bisphosphonate erreichen ein Plateau nach 3-5 Jahren.
Denosumab ist ein monoklonaler Antikörper gegen RANKL, der die Entwicklung und Aktivität von Osteoklasten wirksam hemmt. Denosumab wird alle 6 Monate durch subkutane Injektion verabreicht. Die Wirksamkeit von Denosumab kann bis 10 Jahre nachgewiesen werden. Zur Stimulierung der Knochenbildung stehen heute zwei Klassen von Anabolika zur Verfügung.
Teriparatid und Abaloparatid zielen beide auf den Parathormon-1-Rezeptor ab Romosozumab ist ein monoklonaler Anti-Sklerostin-Antikörper, der die Knochenbildung anregt und die Resorption hemmt. Romosozumab wird als monatliche subkutane Injektion über 1 Jahr verabreicht. Head-to-Head-Studien deuten darauf hin, dass Anabolika eine größere Wirksamkeit gegen Frakturen haben und eine größere Zunahme der Knochendichte bewirken als antiresorptive Medikamente. Die Wirkung von Anabolika ist vorübergehend, so dass ein Übergang zu antiresorptiven Medikamenten erforderlich ist.
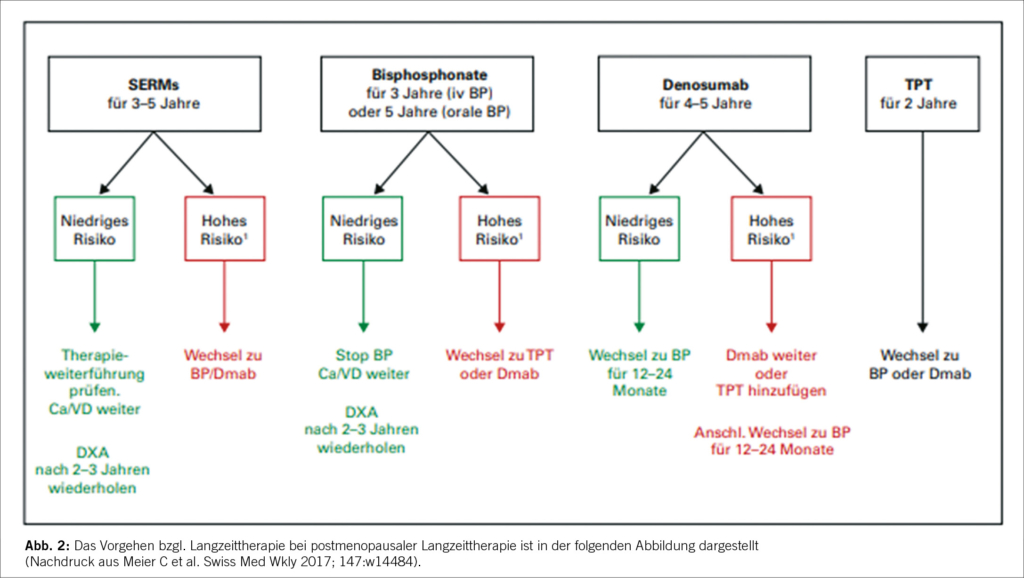
Langzeittherapie bei postmenopausaler Osteoporose
Die Hüfte BMD DATA Switch Study zeigte, dass bei postmenopausalen osteoporotischen Frauen, die von Teriparatid auf Denosumab umgestellt wurden, die Knochenmineraldichte weiter zunahm, während die Umstellung von Denosumab auf Teriparatid zu einem fortschreitenden oder vorübergehenden Knochenverlust führte. Diese Ergebnisse sollten bei der Wahl der Erst- und Folgebehandlung von postmenopausalen Osteoporose-Patientinnen berücksichtigt werden.
Die osteoanabole Therapie mit Romosozumab hat sich als besser als die antiresorptive Therapie mit Alendronat erwiesen (Saa g KG et al N Engl J Med 2017;377:1417-1427).
Optionen nach Denosumab für postmenopausale Osteoporose – ECTS-Empfehlungen
riesen@medinfo-verlag.ch