- Pankreas-Karzinom – was der Hausarzt wissen muss
Das duktale Adenokarzinom des Pankreas (PDAC) ist die vierthäufigste Karzinom-bedingte Todesursache in entwickelten Ländern und wird voraussichtlich bis im Jahr 2030 zur zweithäufigsten aufsteigen. Mit einer 3-Jahres-Überlebensrate von unter 5% ist der natürliche Verlauf des Pankreaskarzinoms äusserst ungünstig. Patienten, bei welchen eine kurative chirurgische Therapie durchgeführt werden kann, haben eine durchschnittliche 5-Jahres-Überlebensrate von 15-20%. Neue Therapiemodalitäten inklusive adjuvante Chemotherapie führen zu einem signifikanten Überlebensvorteil, wie auch die Systemtherapie beim metastasierten Pankreaskarzinom.
Das duktale Adenokarzinom des Pankreas (PDAC) wird voraussichtlich bis im Jahr 2030 zur zweithäufigsten Karzinom-bedingten Todesursache aufsteigen (1, 2). Die Inzidenz des Pankreaskarzinoms in der Schweiz liegt bei 1100 Fällen pro Jahr und entspricht somit der siebthäufigsten Krebserkrankung. Mit einer Sterblichkeit von über 1000 Fällen pro Jahr (entsprechend einem Anteil von 7% an allen Krebs-Todesfällen pro Jahr) gehört das Pankreaskarzinom zu den folgenschwersten Karzinomarten (3). Zum Zeitpunkt der Diagnose sind weniger als 20% der Karzinome resektabel. Patienten, welche eine kurative chirurgische Therapie erhalten, profitieren mit einer durchschnittlichen 5-Jahres-Überlebensrate von 15-20%. Zudem ist die operative Mortalität in den letzten Jahren stark rückläufig, von über 10% berichtet in historischen Publikationen bis unter 4% heutzutage (4) und sogar bei 2% in hochspezialisierten Zentren (5). Postoperative Komplikationen treten in 58% der Patienten auf, wobei über 50% als geringgradige Komplikationen nach Clavien-Dindo eingestuft werden (6). Im Vordergrund stehen Infektionen (17%), verspätete Magenentleerung (engl. delayed gastric emptying) (13%), Pankreasfisteln im Bereich der pankreato-digestiven Anastomose (9%), Galleleck im Bereich der hepatiko-digestiven Anastomose (2.5%), sowie kardiopulmonal (5%) und neurologische (0.6%) Komplikationen (5).
Einer der wichtigsten Faktoren zur Verringerung von Komplikationen ist die Zentralisierung von grossen, seltenen und komplexen chirurgischen Eingriffen, wie beispielsweise die chirurgische Therapie des Pankreaskarzinoms, im Rahmen der hochspezialisierten Medizin (7). Bei der Pankreasresektion konnte die postoperative Mortalität in hochspezialisierten Zentren von 16% auf 3.7% reduziert werden (8). Die chirurgische Therapie in hochspezialisierten Zentren bringt nicht nur einen Gewinn für Patienten hinsichtlich der operativen Morbidität und Mortalität sondern auch einen signifikanten Vorteil im Langzeitüberleben (9). Dabei wird eine 5-Jahres-Überlebesrate von 16% in hochspezialisierten Zentren und 11% in Spitälern mit geringer Fallzahl berichtet (10). Neben der chirurgischen Expertise ist auch eine umfassende Erfahrung in der perioperativen und interventionellen Therapie erforderlich.
Ähnlich wie beim kolorektalen Karzinom geht man bei der Entstehung des Pankreaskarzinoms von einem Progressionsmodell aus. Dabei verändert sich das gesunde duktale Epithel zur intraepithelialen Neoplasie und schliesslich zum duktalen Adenokarzinom (11). Der Einsatz von Biomarkern zur Vorsorge sowie Beurteilung des Therapieansprechens konnte trotz intensiver Forschung bis heute nicht etabliert werden. Von zahlreichen beschriebenen Tumormarkern weist Carbohydrate-Antigen (CA) 19-9 die höchste Sensitivität und Spezifität auf; kann jedoch auch bei benigner Erkrankung erhöht sein und eignet sich deshalb eher zur Verlaufskontrolle als zur primären Diagnostik (12). Neue und hochsensible Verfahren zur Tumordetektion mittels Nachweis von zellfreier-zirkulierender Tumor-DNA im Blut (engl. Liquid Biopsy) sind in klinischer Erprobung und werden sich voraussichtlich in Zukunft klinisch etablieren(13). Dieses Verfahren ist ca. 100-mal sensitiver als der Nachweis von zirkulierenden Tumorzellen im Blut und ermöglicht ein Tumornachweis mittels einfacher Blutentnahme und ohne invasive Biopsie. Viele Experten prognostizieren, dass die «Liquid Biopsy» das klinische Management des Pankreaskarzinoms und anderer bösartigen Tumore revolutionär verändern wird.
Wie sollte bei Verdacht auf ein Pankreaskarzinom abgeklärt werden?
Die erste Untersuchung bei Verdacht auf Pankreaskarzinom ist meist ein abdominaler Ultraschall, sei dies wegen unspezifischen Bauchbeschwerden, B-Symptomatik oder schmerzlosem Ikterus. Zeigt der Ultraschall dilatierte Gallenwege oder selten gar eine Raumforderung im Bereich des Pankreaskopfes kann das ein erster Hinweis für ein Pankreaskarzinom sein. Bei Abwesenheit von Lebermetastasen im Ultraschall ist die nächstbeste und bevorzugte Untersuchung zur Diagnosesicherung der endoskopische Ultraschall (EUS) mit Feinnadelzytologie oder -biopsie (FNP). Der EUS kann Tumoren kleiner 2 cm besser detektieren als MRI und CT und ermöglicht zudem die Gewebepunktion in der gleichen Untersuchung mit einer hohen Trefferquote von über 90% (14, 15). Insbesondere bei gleichzeitiger Dilatation des Gallen- und Pankreasganges (engl. Double Duct Sign) im EUS erhöht sich der Verdacht auf einen Pankreaskopftumor. Hinsichtlich der Lymphknotendetektion ist der EUS den anderen bildgebenden Verfahren nicht überlegen. Bei bereits hepatisch metastasiertem Leiden ist die perkutane Punktion die Methode der Wahl und hilft zur schnellen Entscheidungsfindung für die weitere Therapieplanung. In unserem und vielen anderen Zentren wird die EUS-gesteuerte FNP mit pathologischer Schnellbefundung im Endoskopieraum direkt durchgeführt, sodass wiederholt punktiert werden kann, bis die Diagnose mikroskopisch gesichert ist (16). Eine endoskopische retrograde Cholangiopankreatikographie (ERCP) mit Bürstenzytologie ist nur selten als zusätzliche Methode diagnostisch notwendig, obwohl das Cholangiogramm selbst diagnostisch sein kann. Dennoch hat eine ERCP als invasive Untersuchung eine nicht vernachlässigbare Komplikationsrate, unter anderem Blutung und post-ERCP Pankreatitis. Bei zeitnaher geplanter chirurgischer Resektion ist man sich heute einig, dass keine präoperative Drainage der Gallenwege durchgeführt werden soll (17). Tumormarker wie CA 19-9 haben in der Primärdiagnostik keinen Stellenwert, da bei Cholestase der Wert deutlich erhöht sein kann und 5-10% der Bevölkerung (Lewis-Antigen negativer Phänotyp) kein CA 19-9 produziert. Andere serologische Marker und Gallenflüssigkeitsanalysen sind nicht etabliert. Ein erhöhtes IgG 4 als diagnostischer Marker der autoimmunen Pankreatitis schliesst ein Karzinom nicht aus, da mindestens 16% der Tumoren auch erhöhte IgG 4 Werte zeigen (18). Ein zytologischer oder histologischer Tumornachweis sollte vor einer Operation immer angestrebt werden, da andere Tumorentitäten wie zum Beispiel ein neuroendokriner Tumor, ein Lymphom oder andere Metastasen gegebenenfalls andere Staging-Untersuchungen und Therapien erfordern würden.
Nach Diagnosestellung ist es erforderlich ein sorgfältiges Staging durchzuführen. Dabei sollten zwei essentielle Fragen, welche die Wahl der Therapie entscheiden, beantwortet werden: Liegen Fernmetaststasen vor und ist der Tumor lokal resektabel?
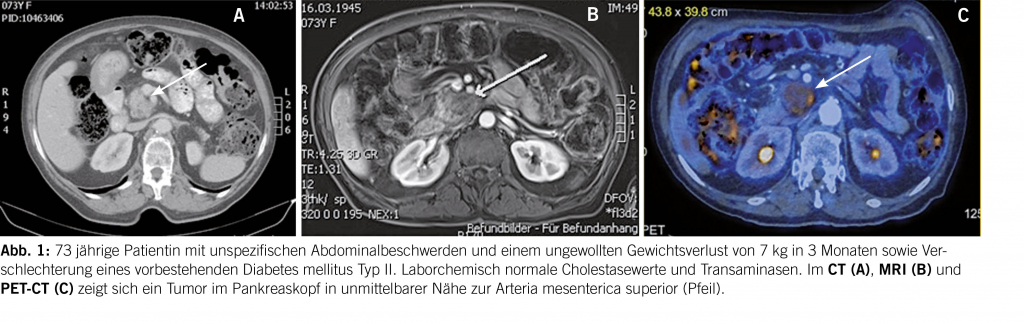
Letzteres wird am besten mit einem Angio-CT oder Angio-MRI beantwortet (Abb. 1A/B). Das Staging selbst bedarf einer Kontrastmittel-verstärkten Computertomographie des Thorax und des Abdomens, wobei bei Unklarheiten betreffend Lebermetastasen ein MRI oder Kontrastmittel-verstärkter Ultraschall weiterhelfen kann. Das CT-Protokoll muss aus drei Phasen bestehen mit Fokus auf früharterielles Enhancement und portalvenöser Phase sowie zusätzlicher Dünnschichttechnik. Eine PET-CT Untersuchung ist nicht als Standarduntersuchung etabliert, obwohl publizierte Daten auf eine erhöhte Sensitivität und Spezifität gegenüber der CT zeigen (19, 20). An unserem Zentrum gehört das PET-CT zum Standardprotokoll der Abklärung eines Pankreaskarzinoms (Abb. 1C). Bei Verdacht auf Peritonealkarzinomatose in der Bildgebung bei ansonsten chirurgisch-entfernbaren Befund, sollte als nächstes eine diagnostische Laparoskopie zur Entscheidungsfindung durchgeführt werden.
Muss jeder Fall eines Pankreaskarzinoms im Tumorboard vorgestellt werden?
Jeder Patient mit einem Pankreaskarzinom sollte im interdisziplinären Tumorboard vorgestellt werden, um die optimale Behandlungsstrategie festzulegen. Dies gehört heutzutage zum internationalen und nationalen Standard von Tumorzentren. Am UniversitätsSpital Zürich besteht ein wöchentliches Tumorboard, welches speziell für Tumore des hepato-pankreato-biliären Organsystems ausgerichtet ist. Zudem ist die interdisziplinäre und hochspezialisierte Behandlung des Pankreaskarzinoms in die Strukturen des Swiss HPB Centers (21) sowie des Comprehensive Cancer Center Zürich (www.cancercenter.usz.ch) am UniversitätsSpital Zürich integriert. Darüber hinaus ist das spezialisierte Tumorboard für Pankreastumore ein integraler Bestandteil der Zertifizierungsanforderung für ein ausgewiesenes Pankreaszentrum wie es am UniversitätsSpital Zürich besteht.
Multimodale Therapieansätze beim Pankreaskarzinom
Was bedeutet chirurgisch resektabel?
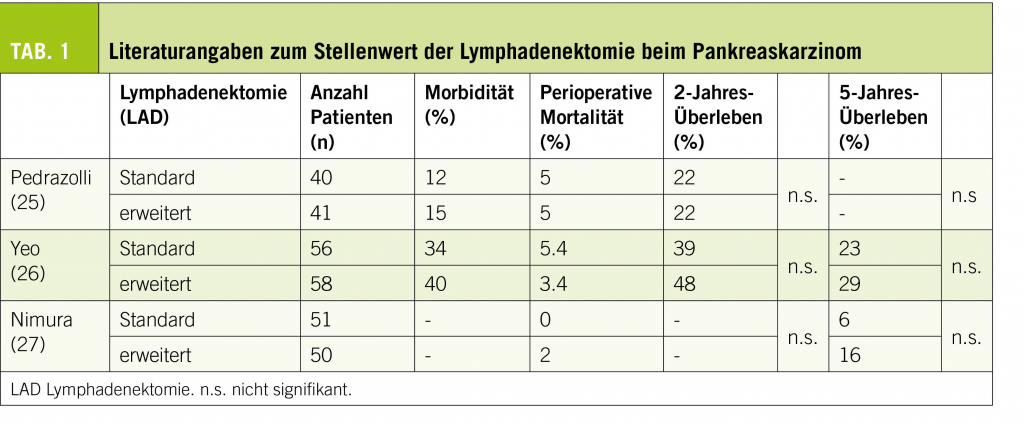
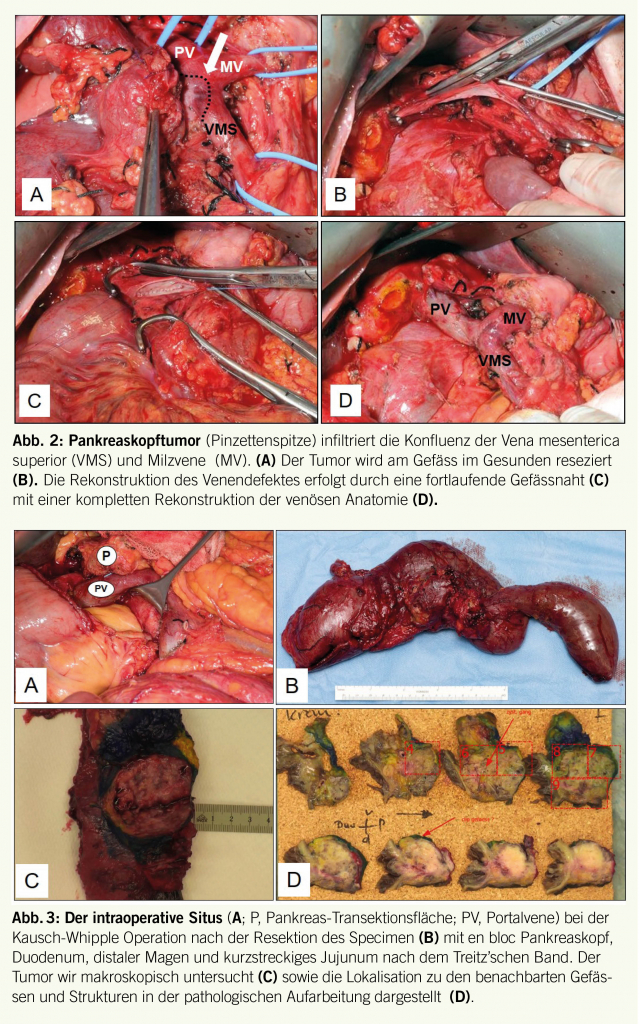
Die Resektabilität des Tumors hängt vom Staging ab und wird mittels Bildgebung beurteilt. Die Bildgebung beruht vorwiegend auf Computertomographie, jedoch auch auf Magnetresonanztomographie, PET/CT oder endoskopischen Ultraschall. Dabei sind anatomische Faktoren wie Fernmetastasen, Lymphadenopathie sowie Befall grosser Viszeralgefässe, zum Beispiel eine Infiltration der Portalvene oder der Vena mesenterica superior, entscheidend. Daraus leitet man die Einteilung in resektabel, grenzwertig («borderline») resektabel, lokal fortgeschritten («locally advanced») sowie nicht-resektabel ab. Die Beteiligung der venösen Gefässe, also Pfortader und Vena mesenterica superior, stellt nur eine relative Kontraindikation dar, da die tumorinfiltrierten Gefässe reseziert und rekonstruiert werden können (Abb. 2) (22-24). Die Resektion der Pfortader erhöht die lokale Resektabilität. Hinsichtlich der Lymphadenektomie (LAD) zeigt die erweiterte LAD, im Vergleich zur standardisierten LAD, keinen Unterschied bezüglich Morbidität, Mortalität und Überleben (Tabelle 1) (25-28). Die Infiltration der Arteria mesenterica superior oder der Arteria hepatica stellen für die meisten Zentren eine Kontraindikation für die kurative Resektion dar. Neben den anatomischen Verhältnissen spielt die Tumorbiologie sowie der Allgemeinzustand des Patienten eine wichtige Rolle zur Beurteilung einer chirurgischen Resektion (29).
Welche chirurgischen Operations-techniken kommen zum Einsatz?
Abhängig von der Tumorlokalisation und dem klinischen Staging erfolgt nach einer Fallbesprechung am interdisziplinären Tumor Board die Evaluierung eines operativen Verfahrens. Dabei ist grundsätzlich zu unterscheiden, ob ein kuratives oder palliatives Vorgehen gewählt wird.
Kurative chirurgische Strategien bei Pankreaskopftumoren beinhalten die klassische Pankreatikoduodenektomie nach Kausch-Whipple sowie die Pylorus-erhaltende Pankreatoduodenektomie nach Traveso, wobei beide Operationen als gleichwertig hinsichtlich Morbidität, Mortalität und Überleben anzusehen sind (Abb. 3) (30). Tumore im Bereich des Pankreaskorpus oder -schwanzes können mittels Pankreaslinksresektion und Splenektomie entfernt werden. Sollte der Pankreaskorpustumor den Truncus coeliacus infiltrieren bei ansonsten resektablem Befund kann eine Appleby-Operation zum Einsatz kommen (31). Dabei erfolgt im ersten Schritt die interventionelle Embolisierung der Arteria hepatica communis mit dem Ziel eine dominante Revaskularisierung der Leberarterie über die Arteria gastroduodenalis zu erreichen. In einem zweiten Schritt kann dann die erweiterte Pankreaslinksresektion mit Resektion des Truncus coeliacus erfolgen.
Pankreastumore, welche den Kopf- und Schwanzbereich betreffen, können mittels totaler Pankreatektomie entfernt werden, jedoch muss die fehlende endo- und exokrine Funktion medikamentös ersetzt werden.
Sämtliche Operationsverfahren können mittlerweile auch minimal-invasiv bzw. laparoskopisch durchgeführt werden (32, 33). Minimal-invasive Pankreas-Resektionsverfahren zeigen in den neuesten Studien ähnliche Ergebnisse im Vergleich zur offenen Chirurgie bezüglich Komplikationen und onkologischem Verlauf (34). Die laparoskopische Pankreasresektion, insbesondere die Pankreaslinksresektion ist eine sichere Operationstechnik, welche bei uns und anderen Zentren sehr häufig zum Einsatz kommt (35). Mit dem Einzug des Operationsroboters (da Vinci® System) in den klinischen Alltag im Operationssaal können mittlerweile viele minimal-invasive Pankreasoperationen Roboter-assistiert durchgeführt werden. Hierbei eignet sich der Roboter insbesondere für Pankreaslinksresektionen, was an unserem Zentrum bereits erfolgreich praktiziert wurde. Die erste Roboter-unterstützte Whipple-
Operation wurde 2003 von Guilianotti et al durchgeführt mit einem Update der Serie auf über 50 Fälle (36).
Die chirurgisch-palliativen Operationsmöglichkeiten bei enteraler oder biliärer Tumorkompression umfassen unter anderem die Gastrojejunostomie bei Nahrungsintoleranz und die Hepatikojejunostomie bei Galleabflussstörungen sowie deren Kombination als sogenannte Double Bypass Operation. Dies ermöglicht neben der lokalen palliativen Therapie eine schnelle Rekonvaleszenz von der Operation und somit einen zeitnahen Beginn der palliativen
Chemotherapie (37).
Ist die Pankreasresektion Teil der Hochspezialisierten Medizin?
Mit der Interkantonalen Vereinbarung über die hochspezialisierte Medizin (IVHSM) aller Kantone wurde im Jahre 2008 «im Interesse einer bedarfsgerechten, qualitativ hochstehenden und wirtschaftlich erbrachten medizinischen Versorgung die Konzentration der hochspezialisierten Medizin (HSM)» geregelt. Fünf Themen aus der Viszeralchirurgie (HSM VISZ), darunter die totale oder partielle Pankreasresektion, wurden im Jahre 2013 der HSM zugeordnet (38). Eine flächendeckende Analyse aller Schweizer Spitäler hat gezeigt, dass die postoperative Frühmortalität nach Pankreaskarzinom-
Chirurgie in Kliniken, die diese Eingriffe nur selten durchführen, deutlich höher ist als in Zentren mit höherem Patientenaufkommen (39).
Was ist der aktuelle Stand der Systemtherapie und multimodalen Therapiekonzepte?
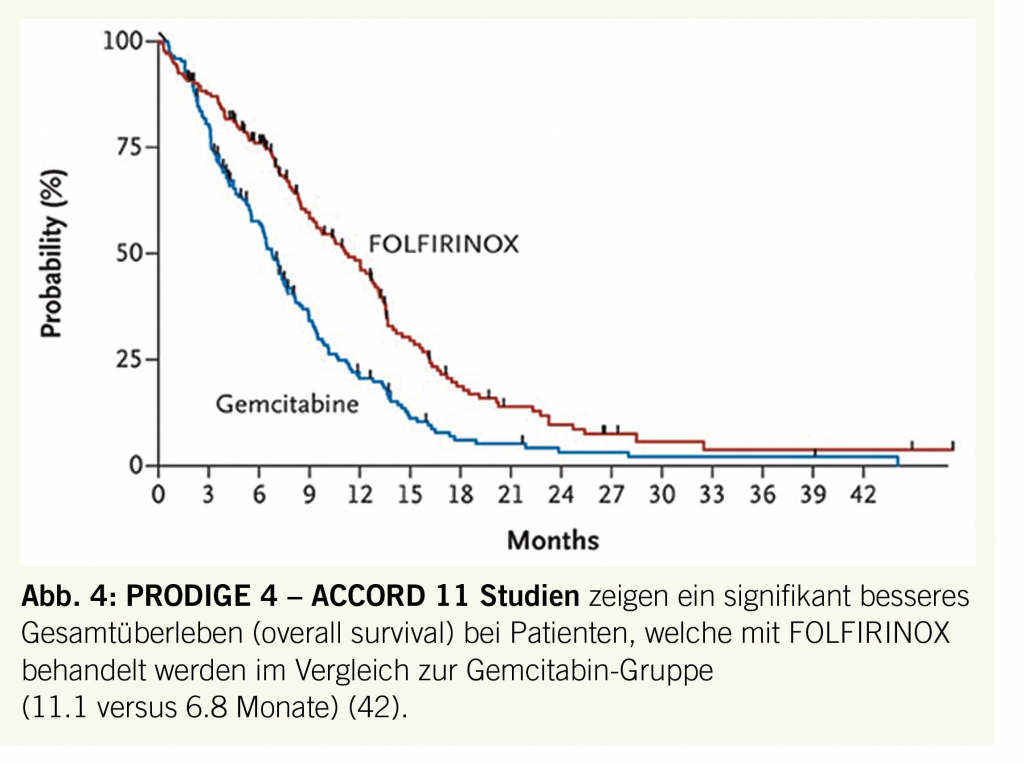
Auch die Systemtherapie des Pankreaskarzinoms hat grosse Fortschritte gemacht. Die erste wirksame Substanz war Gemcitabin beim metastasierten Pankreaskarzinom (40). Später konnte nachgewiesen werden, dass Gemcitabin adjuvant (postoperativ über 6 Monate) das Langzeitüberleben verbessert (41). Im Jahre 2010 zeigte eine grosse randomisierte französische Studie, dass beim metastasierten Pankreaskarzinom die Kombination von Folinsäure, Fluorouracil, Irinotecan und Oxaliplatin (FOLFIRINOX) dem Gemcitabin im Überleben deutlich überlegen ist (Abb. 4) (42). Im 2014 zeigte eine internationale Studie unter amerikanischer Führung ebenfalls einen Überlebensvorteil von Nab-Paclitaxel/Gemcitabin gegen Gemcitabin beim metastasierten Pankreaskarzinom (43). Und am diesjährigen ASCO-Kongress in Chicago konnten die Franzosen nachdoppeln: FOLFIRINOX ist auch in der adjuvanten Situation dem Gemcitabin allein deutlich überlegen (Conroy, 2018, ASCO Abstract). Da die Systemtherapie sowohl in der adjuvanten wie auch in der metastasierten Situation klare Wirksamkeit gezeigt hat, wird sie heute auch in der lokal-fortgeschrittenen Situation eingesetzt. Beim lokal-fortgeschrittenen und beim Borderline-resektablen Pankreaskarzinom wird bei fitten Patienten FOLFIRINOX für 2-3 Monate vor einer allfälligen Operation oder Lokaltherapie (Radiotherapie, Irreversible Elektroporation (IRE), Hyperthermie) angewandt. Patienten mit lokal-fortgeschrittenem Pankreaskarzinom werden mit Vorteil in der HEATPAC-Studie behandelt (44). Nach zwei Monaten FOLFIRINOX folgt bei unauffälliger Laparoskopie die Lokaltherapie (Radiotherapie, Gemcitabin mit oder ohne Hyperthermie) vor weiterer Systemtherapie mit FOLFIRINOX. Wie bei anderen gastrointestinalen Malignomen ist nur ein kleiner Teil der Pankreaskarzinome sensitiv auf Immuntherapie.
Nämlich diejenigen mit einer Defizienz der Mismatch Repair Proteine (MMRD). Eine neue Schweizer Studie will nun die Immunogenität des Pankreaskarzinoms durch lokale Intervention (IRE) in Kombination mit Immuntherapie (Immune Checkpoint Inhibitors) steigern (ClinicalTrials.gov Identifier: NCT03069599).
Swiss Hepato-Pancreato-Biliary (HPB) Center
Klinik für Viszeral- und Transplantationschirurgie
Rämistrasse 100
8091 Zürich
Gastroenterologie & Hepatologie
Stadtspital Zürich
Birmensdorferstrasse 497
8063 Zürich
Swiss Hepato-Pancreato-Biliary (HPB) Center
Klinik für Viszeral- und Transplantationschirurgie
Liver and Pancreas Tumor Center, Comprehensive Cancer Center Zürich
Rämistrasse 100
8091 Zürich
henrik.petrowsky@usz.ch
Die Autoren haben keine Interessenskonflikte im Zusammenhang mit diesem Beitrag deklariert.
- Das Überleben von Patienten mit Pankreaskarzinom hat sich im letzten Jahrzehnt signifikant dank der Beurteilung und Therapie in einer interdisziplinären hepato-pankreato-biliären Zentrumsklinik verbessert.
- Das Staging umfasst morphologische (KM-CT) und funktionelle (PET) Bildgebung sowie eine Biopsie mittels EUS zur Bestätigung der Dignität mittels FNP.
- Die chirurgische Resektion ist derzeit die einzige kurative Therapiemöglichkeit beim Pankreaskarzinom, welche mittlerweile auch minimal-invasiv entweder laparoskopisch oder Roboter-unterstützt durchgeführt werden kann.
- Eine adjuvante Chemotherapie führt zu einem signifikanten Überlebensvorteil wie auch die Systemtherapie beim metastasierten PDAC. Der Wert einer neoadjuvanten Therapie vor der Resektion ist nicht bewiesen, jedoch wahrscheinlich. Der Wert einer primären Systemtherapie beim lokal fortgeschrittenen Pankreaskarzinom wird allgemein akzeptiert.
Literatur
1. Siegel, R.L., K.D. Miller, and A. Jemal, Cancer statistics, 2015. CA Cancer J Clin, 2015. 65(1): p. 5-29.
2. Rahib, L., et al., Projecting cancer incidence and deaths to 2030: the unexpected burden of thyroid, liver, and pancreas cancers in the United States. Cancer Res, 2014. 74(11): p. 2913-21.
3. Foundation National Institute for Cancer Epidemiology and Registration (NICER). 2012.
4. Li, D., et al., Pancreatic cancer. Lancet, 2004. 363(9414): p. 1049-57.
5. DeOliveira, M.L., et al., Assessment of complications after pancreatic surgery: A novel grading system applied to 633 patients undergoing pancreaticoduodenectomy. Ann Surg, 2006. 244(6): p. 931-7; discussion 937-9.
6. Dindo, D., N. Demartines, and P.A. Clavien, Classification of surgical complications: a new proposal with evaluation in a cohort of 6336 patients and results of a survey. Ann Surg, 2004. 240(2): p. 205-13.
7. Vonlanthen, R., et al., Toward a Consensus on Centralization in Surgery. Ann Surg, 2018. 268(5): p. 712-724.
8. Birkmeyer, J.D., et al., Surgeon volume and operative mortality in the United States. N Engl J Med, 2003. 349(22): p. 2117-27.
9. Bilimoria, K.Y., et al., Directing surgical quality improvement initiatives: comparison of perioperative mortality and long-term survival for cancer surgery. J Clin Oncol, 2008. 26(28): p. 4626-33.
10. Birkmeyer, J.D., et al., Hospital volume and late survival after cancer surgery. Ann Surg, 2007. 245(5): p. 777-83.
11. Lennon, A.M., et al., The early detection of pancreatic cancer: what will it take to diagnose and treat curable pancreatic neoplasia? Cancer Res, 2014. 74(13): p. 3381-9.
12. Ballehaninna, U.K. and R.S. Chamberlain, Biomarkers for pancreatic cancer: promising new markers and options beyond CA 19-9. Tumour Biol, 2013. 34(6): p. 3279-92.
13. Yadav, D.K., et al., Liquid biopsy in pancreatic cancer: the beginning of a new era. Oncotarget, 2018. 9(42): p. 26900-26933.
14. Cannon, M.E., et al., EUS compared with CT, magnetic resonance imaging, and angiography and the influence of biliary stenting on staging accuracy of ampullary neoplasms. Gastrointest Endosc, 1999. 50(1): p. 27-33.
15. DeWitt, J., et al., Comparison of endoscopic ultrasonography and multidetector computed tomography for detecting and staging pancreatic cancer. Ann Intern Med, 2004. 141(10): p. 753-63.
16. Iglesias-Garcia, J., et al., Rapid on-site evaluation of endoscopic-ultrasound-guided fine-needle aspiration diagnosis of pancreatic masses. World J Gastroenterol, 2014. 20(28): p. 9451-7.
17. van der Gaag, N.A., et al., Preoperative biliary drainage for cancer of the head of the pancreas. N Engl J Med, 2010. 362(2): p. 129-37.
18. Sadler, R., et al., The diagnostic significance of serum IgG4 levels in patients with autoimmune pancreatitis: a UK study. Eur J Gastroenterol Hepatol, 2011. 23(2): p. 139-45.
19. Ghaneh, P., et al., PET-PANC: multicentre prospective diagnostic accuracy and health economic analysis study of the impact of combined modality 18fluorine-2-fluoro-2-deoxy-d-glucose positron emission tomography with computed tomography scanning in the diagnosis and management of pancreatic cancer. Health Technol Assess, 2018. 22(7): p. 1-114.
20. Heinrich, S., et al., Positron emission tomography/computed tomography influences on the management of resectable pancreatic cancer and its cost-effectiveness. Ann Surg, 2005. 242(2): p. 235-43.
21. Clavien, P.A., B. Mullhaupt, and B.C. Pestalozzi, Do we need a center approach to treat patients with liver diseases? J Hepatol, 2006. 44(4): p. 639-42.
22. Ramacciato, G., et al., Does portal-superior mesenteric vein invasion still indicate irresectability for pancreatic carcinoma? Ann Surg Oncol, 2009. 16(4): p. 817-25.
23. Girelli, R., et al., Results of 100 pancreatic radiofrequency ablations in the context of a multimodal strategy for stage III ductal adenocarcinoma. Langenbecks Arch Surg, 2013. 398(1): p. 63-9.
24. Cantore, M., et al., Combined modality treatment for patients with locally advanced pancreatic adenocarcinoma. Br J Surg, 2012. 99(8): p. 1083-8.
25. Pedrazzoli, S., et al., Standard versus extended lymphadenectomy associated with pancreatoduodenectomy in the surgical treatment of adenocarcinoma of the head of the pancreas: a multicenter, prospective, randomized study. Lymphadenectomy Study Group. Ann Surg, 1998. 228(4): p. 508-17.
26. Yeo, C.J., et al., Pancreaticoduodenectomy with or without extended retroperitoneal lymphadenectomy for periampullary adenocarcinoma: comparison of morbidity and mortality and short-term outcome. Ann Surg, 1999. 229(5): p. 613-22; discussion 622-4.
27. Nimura, Y., et al., Standard versus extended lymphadenectomy in radical pancreatoduodenectomy for ductal adenocarcinoma of the head of the pancreas: long-term results of a Japanese multicenter randomized controlled trial. J Hepatobiliary Pancreat Sci, 2012. 19(3): p. 230-41.
28. Sergeant, G., et al., Extended lymphadenectomy in patients with pancreatic cancer is debatable. World J Surg, 2013. 37(8): p. 1782-8.
29. Isaji, S., et al., International consensus on definition and criteria of borderline resectable pancreatic ductal adenocarcinoma 2017. Pancreatology, 2018. 18(1): p. 2-11.
30. Diener, M.K., et al., Pancreaticoduodenectomy (classic Whipple) versus pylorus-preserving pancreaticoduodenectomy (pp Whipple) for surgical treatment of periampullary and pancreatic carcinoma. Cochrane Database Syst Rev, 2008(2): p. CD006053.
31. Gagandeep, S., et al., Extended pancreatectomy with resection of the celiac axis: the modified Appleby operation. Am J Surg, 2006. 192(3): p. 330-5.
32. Kooby, D.A., et al., Left-sided pancreatectomy: a multicenter comparison of laparoscopic and open approaches. Ann Surg, 2008. 248(3): p. 438-46.
33. Kendrick, M.L. and D. Cusati, Total laparoscopic pancreaticoduodenectomy: feasibility and outcome in an early experience. Arch Surg, 2010. 145(1): p. 19-23.
34. Torphy, R.J., et al., Comparing Short-term and Oncologic Outcomes of Minimally Invasive Versus Open Pancreaticoduodenectomy Across Low and High Volume Centers. Ann Surg, 2018.
35. Boggi, U., et al., Laparoscopic pancreaticoduodenectomy: a systematic literature review. Surg Endosc, 2014.
36. Giulianotti, P.C., et al., Robotics in general surgery: personal experience in a large community hospital. Arch Surg, 2003. 138(7): p. 777-84.
37. Limani, P., et al., (Pancreatic cancer- a curable disease). Praxis (Bern 1994), 2015. 104(9): p. 453-60.
38. Martin, F., Hochspezialisierte Viszeralchirurgie: Zentralisiert oder Carte blanche? . BULLETIN DES MÉDECINS SUISSES – SCHWEIZERISCHE ÄRZTEZEITUNG – BOLLETTINO DEI MEDICI SVIZZERI 2018. 99(1–2): p. 24-27.
39. Guller, U., et al., Lower hospital volume is associated with higher mortality after oesophageal, gastric, pancreatic and rectal cancer resection. Swiss Med Wkly, 2017. 147: p. w14473.
40. Burris, H.A., 3rd, et al., Improvements in survival and clinical benefit with gemcitabine as first-line therapy for patients with advanced pancreas cancer: a randomized trial. J Clin Oncol, 1997. 15(6): p. 2403-13.
41. Oettle, H., et al., Adjuvant chemotherapy with gemcitabine vs observation in patients undergoing curative-intent resection of pancreatic cancer: a randomized controlled trial. JAMA, 2007. 297(3): p. 267-77.
42. Conroy, T., et al., FOLFIRINOX versus gemcitabine for metastatic pancreatic cancer. N Engl J Med, 2011. 364(19): p. 1817-25.
43. Von Hoff, D.D., D. Goldstein, and M.F. Renschler, Albumin-bound paclitaxel plus gemcitabine in pancreatic cancer. N Engl J Med, 2014. 370(5): p. 479-80.
44. Datta, N.R., et al., “HEATPAC” – a phase II randomized study of concurrent thermochemoradiotherapy versus chemoradiotherapy alone in locally advanced pancreatic cancer. Radiat Oncol, 2017. 12(1): p. 183.
der informierte @rzt
- Vol. 8
- Ausgabe 11
- November 2018