- Periphere Neuropathien
Periphere Neuropathien können Menschen in jedem Alter betreffen, treten jedoch am häufigsten bei Personen über 65 Jahren auf. Sie weisen eine Vielzahl von Beschwerden auf, die von rein sensiblen Symptomen bis hin zu schweren sensomotorischen Beeinträchtigungen reichen und sich unterschiedlich schnell entwickeln können. Periphere Neuropathien sind mit einer Vielzahl von Erkrankungen assoziiert. Die Diagnose erfordert einen systematischen Ansatz und eine umfassende Evaluation. Die Behandlung beinhaltet gezielte Therapie der zugrundeliegenden Erkrankung, Symptommanagement und Prävention, einschliesslich Schmerzlinderung bei schmerzhaften Neuropathien, Ergo- und Physiotherapie sowie der Verwendung von orthopädischen Hilfsmitteln.
Peripheral neuropathies can affect individuals at any age but are most prevalent in those over 65. They present with a variety of symptoms from purely sensory to severe sensorimotor impairment and can progress at varying rates. They can be the manifestation of a broad range of conditions. Diagnosis requires a systematic approach and comprehensive evaluation. Treatments focus on management of the underlying disease, symptom control and prevention, including pain relief for painful neuropathies, physical and occupational therapies, and the use of orthopaedic devices.
Key words: Sensible Neuropathie, Motorische Neuropathie, Diabetische Neuropathie, Guillain-Barré Syndrom, Schmerzmodulation
Periphere Neuropathien sind häufige Erkrankungen des peripheren Nervensystems mit einer Prävalenz von mindestens 7 % bei Menschen über 65 Jahren, wobei die tatsächlichen Zahlen wahrscheinlich höher liegen, da insbesondere milde Formen unentdeckt bleiben können.
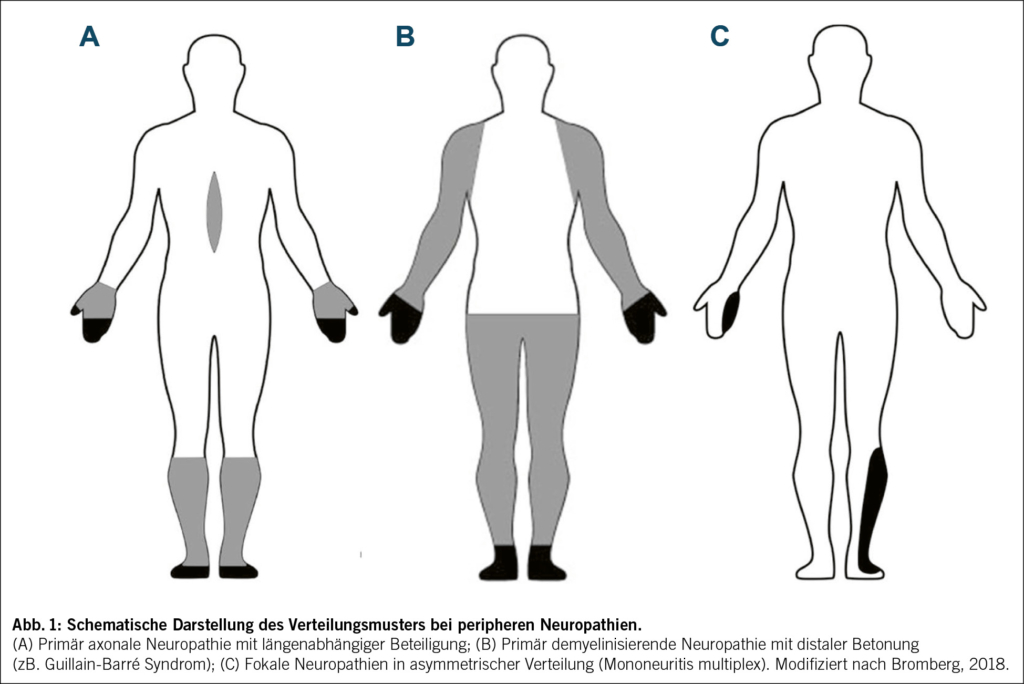
Bei Polyneuropathien besteht in der Regel eine distal symmetrische, längenabhängige Beteiligung der sensomotorischen Nerven, mit klinisch sensibel-betonter Symptomatik und langsamer Progression. Bei der schmerzhaften multifokalen Neuropathie (Mononeuritis multiplex, meistens assoziiert mit Vaskulitis) liegt dagegen eine asymmetrische Beteiligung einzelner Nerven in unterschiedlichen Körperregionen vor, während Polyradikulopathien (wie z.B. das Guillain-Barré Syndrom) auch einen proximalen Befall und teilweise Hirnnervenbeteiligung aufweisen. Polyneuropathien sind zudem von Mononeuropathien zu unterscheiden, bei denen nur ein Nerv betroffen ist (wie z.B. das Karpaltunnelsyndrom) (Abb. 1).
Klassifikation
Periphere Neuropathien können klassifiziert werden nach:
► Beteiligung des Fasertyps (motorische Neuropathie, sensible Neuropathie, autonome Neuropathie, gemischt, Small-Fiber Neuropathie);
► Verteilungsmuster (distal-symmetisch, asymmetrisch, proximal, proximal und distal);
► Zeitlichem Verlauf (akut, subakut, chronisch);
► Pathophysiologie (primär axonal, primär demyelinisierend, gemischt) ;
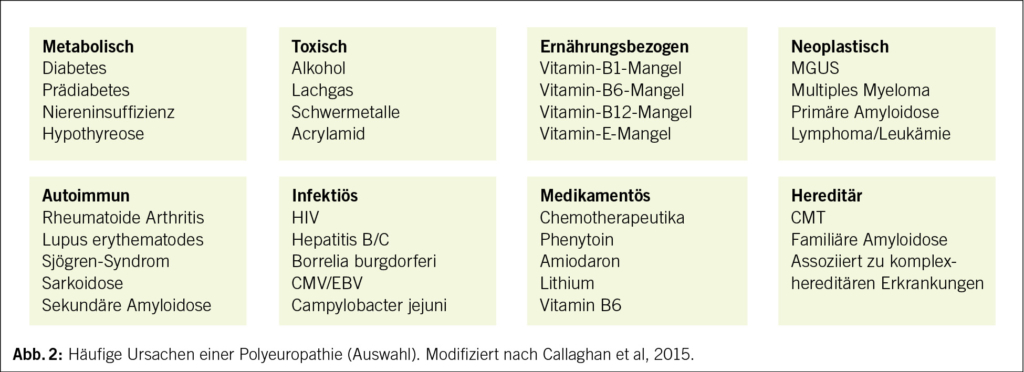
► Zugrundeliegender Ätiologie (Abb. 2).
Die Anamneseerhebung sowie die klinische und paraklinische Diagnostik dienen der präziseren Zuordnung peripherer Neuropathien, um ein gezielteres therapeutisches Vorgehen zu ermöglichen.
Es muss jedoch betont werden, dass trotz ausführlicher Abklärungen die Ursache einer Neuropathie bei bis zu 27 % der Patienten unklar bleibt.
Anamneseerhebung und klinische Evaluation
Bereits bei der ersten allgemeinärztlichen Evaluation sollten der Symptombeginn und der zeitliche Verlauf erfragt werden, ebenso ob eine Seitenasymmetrie vorliegt oder eine Beteiligung der oberen Extremitäten. Da die meisten Patienten spontan über Sensibilitätsstörungen berichten, sollte auch nach einer Schwäche gefragt werden. Symptome einer autonomen Funktionsstörung umfassen insbesondere trophische Störungen, Orthostase, Ruhetachykardie, urogenitale Funktionsstörungen und gastrointestinale Störungen, die evaluiert werden sollten. Die Abfrage von Systemerkrankungen sowie eine Alkoholanamnese sind obligat, ebenso die Medikamentenanamnese. Insbesondere bei langsamer Progression und Fussdeformitäten sollte an eine hereditäre Ursache gedacht werden. In diesem Fall helfen weitere spezifische Fragen zur motorischen Entwicklung, zu Leistungen im Sport/Militär und zur Familienanamnese.
▷ Bei anamnestischen Hinweisen auf einen (sub)akuten Beginn mit aufsteigenden sensomotorischen Ausfällen und rascher Progredienz sollte an ein Guillain-Barré-Syndrom gedacht werden und eine notfallmässige neurologische Zuweisung erfolgen.
Die häufigsten Neuropathien zeigen eine sensomotorische und längenabhängige, somit distal-symmetrische und beinbetonte Beteiligung, wobei in der Regel zuerst sensible Störungen auftreten. Die Patienten berichten über Negativsymptome wie Taubheitsgefühle, oft beschrieben als ein Gefühl wie auf «Watte zu laufen». Dieses beginnt zunächst in den Zehen und kann im Verlauf den ganzen Fuss betreffen. Positive sensible Symptome können in unterschiedlicher Qualität und Ausprägung auftreten, von leichtem Druckgefühl über Berührungsintoleranz, Kribbelparästhesien, Brennen, Stechen und Elektrisieren bis hin zu starken Schmerzen. Ungewöhnlich ist jedoch eine ausgeprägte Schmerzsymptomtik im Vordergrund. In solchen Fällen sollte insbesondere an eine Vaskulitis, an Morbus Fabry oder an eine Amyloid-Neuropathie gedacht werden. Die Patienten mit Small-Fiber Neuropathie berichten auch über schmerzhafte Missempfindungen.
Bei einer Small-Fiber Neuropathie mit Beteiligung der dünn myelinisierten und unmyelinisierten Nervenfasern ist in der Regel das Temperatur- und Schmerzempfinden reduziert. Bei Beteiligung der grosskalibrigen myelinisierten Nervenfasern sind die Oberflächensensibilität und die Tiefensensibilität betroffen. In der klinischen Untersuchung sollte demnach die Beurteilung aller sensiblen Funktionen erfolgen, insbesondere das Berührungs-, Temperatur-, Schmerz- und Vibrationsempfinden sowie der Lagesinn sind zu berücksichtigen. Aufgrund der reduzierten Wahrnehmung können schmerzlose Wunden entstehen. Bei zunehmender Beteiligung der Tiefensensibilität entstehen ein unsicheres Gangbild, insbesondere im Dunkeln, ein erschwerter Seiltänzergang sowie ein positiver Romberg-Stehversuch. In schweren Fällen zeigt sich eine deutliche sensible Ataxie beim Gehen.
Die motorischen Symptome treten meistens erst im Verlauf auf und umfassen Muskelschwäche, Muskelschwund, Muskelkrämpfe und ggf. Muskelzuckungen. Passend dazu findet man in der Untersuchung eine distal- und beinbetonte Schwäche und Atrophie, initial eher mit Beteiligung der Zehenspreizung und Zehenhebung sowie eine Atrophie der kurzen Zehenextensoren, im Verlauf aber auch der Wadenmuskulatur. Erschwerte Gangprüfungen, wie der Fersen- und Zehengang, können ansonsten diskrete Fussheber- und Fusssenkerparesen deutlicher sichtbar machen. Das Testen des Aufstehens aus der Hocke sowie aus kniender Position liefert Informationen über eine mögliche Beteiligung auch der proximalen Beinmuskulatur. Bei Beteiligung der Hände zeigt sich oft eine Schwäche der Fingerspreizung und der Daumenabduktion mit Atrophie der kleinen Handmuskeln und des Thenars und Hypothenars. Die Reflexe sind schwach oder erloschen, insbesondere der Achillessehnenreflex. Man kann visuell Muskelkrämpfe und Faszikulationen beobachten.
Hinweise auf autonome Störungen findet man bei den meisten Patienten im Bereich der unteren Extremitäten.Diese sind reduzierte Behaarung, eine trockene Haut aufgrund der An- oder Hypohidrose, Ödeme sowie eine Veränderung der Hautfarbe mit Rubeosis plantaris. Pupillenstörungen sowie eine Ruhetachykardie können in der Untersuchung auffallen.
Skelettabnormalitäten sollten beurteilt werden. Insbesondere Fussdeformitäten wie ein Pes cavus, Pes planus, Hammerzehen, sowie Skoliose/Kyphose können auf eine genetische Ursache hindeuten. Bei deutlicher Diskrepanz zwischen einer ausgeprägten klinischen Ausfallsymptomatik und einem subjektiv milden Beschwerdebild sollte an eine lange bestehende, langsam fortschreitende Ätiologie im Sinne einer hereditären Ursache gedacht werden.
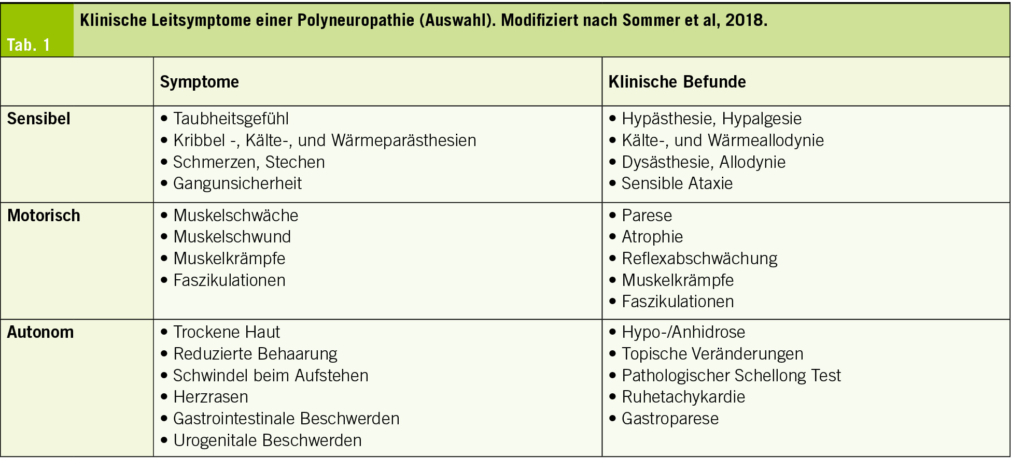
Die häufigsten Symptome und klinischen Untersuchungsbefunde sind in Tab. 1 abgebildet.
Diagnostische Tests
Labordiagnostik
Bereits im Rahmen der ersten Evaluation einer Polyneuropathie sollte eine Basis-Labordiagnostik mit Bestimmung folgender Parameter erfolgen:
▷ Differentialblutbild, Chemogramm inkl. Elektrolyte, Leber- und Nierenwerte, CRP, TSH, HbA1c, Vitamin B12-Stufendiagnostik, Immunelektrophorese.
Weitere optionale Analysen: CDT, Vitamin B1, Vitamin B6, ANA, ANCA, Rheumafaktor, Kryoglobuline, Hepatitis B- und C-Serologie, HIV-Serologie, Borrelien-Serologie, Anti-MAG Antikörper, paraneoplastische Antikörper.
Bei Patienten mit einer bekannten Grunderkrankung, die mit einer Neuropathie in Verbindung gebracht werden kann, ist die oben beschriebene Basisdiagnostik ebenfalls sinnvoll, da mehrere Ursachen gleichzeitig vorliegen können (so wird z.B. Vitamin B12-Mangel bei Patienten mit Diabetes Mellitus häufig beobachtet).
Lumbalpunktion
Die Nervenwasseruntersuchung gehört nicht zur Routinediagnostik und wird nur bei Verdacht auf eine inflammatorische oder eine maligne/paraneoplastische Genese durchgeführt.
Elektrodiagnostik
Die Evaluation mittels Neurographie ermöglicht die Differenzierung zwischen axonalem und demyelinisierendem Nervenschaden und auch, ob eine motorische, sensible oder gemischte Beteiligung vorliegt. Zudem kann der Schädigungsort identifiziert werden. Bei einer Small-Fiber-Neuropathie bleibt die Neurographie dagegen unauffällig, da in dieser Untersuchung nur die Funktion der grosskalibrigen myelinisierten Fasern erfasst wird.
Bei Verdacht auf eine Small-Fiber Beteiligung wird Sudoscan angewendet, eine sensitive Methode zur Messung der elektrochemischen Hautleitfähigkeit der Hände und Füße mittels reverser Iontophorese.
Die Nadelmyographie liefert Informationen über die Chronizität und hilft auch bei der weiteren differentialdiagnostischen Zuordnung. Die Elektrodiagnostik kann auch longitudinal durchgeführt werden, um die Progression sowie ein mögliches Therapieansprechen zu beurteilen.
Bildgebende Verfahren
Der Nervenultraschall ist eine schnelle und kostengünstige Untersuchung, die eine wichtige Rolle insbesondere in der Zusatzdiagnostik der inflammatorischen Neuropathien spielt. Mit dieser Methode können (insbesondere bei inflammatorischen, aber auch bei vielen hereditären Neuropathien) vergrösserte Nervenschnittflächen der Nerven und/oder Nervenwurzeln nachgewiesen werden. In den letzten Jahren hat sich auch die MR-Neurographie als wertvolles diagnostisches Tool erwiesen.
Nervenbiopsie
Die Nervenbiopsie ist eine invasive Diagnostik und wird an einem sensiblen Nerv durchgeführt (in der Regel dem Nervus suralis). Residuelle Taubheitsgefühle distal der Biopsiestelle sind zu erwarten. Eine residuelle Schmerzsymptomatik tritt mit variabler Häufigkeit (0-60 %) auf. Die Untersuchung wird nur in begründeten Fällen durchgeführt, wie bei Verdacht auf eine vaskulitische Genese, maligne Genese oder Amyloid-Neuropathie.
Hautbiopsie
Die minimalinvasive Hautbiopsie kann im Rahmen der Abklärung einer Small-Fiber-Neuropathie ergänzt werden. Dadurch erfolgt die Quantifizierung der intraepidermalen Innervation, die eine hohe Sensitivität aufweist.
Quantitative sensorische Testung
Die Quantitative Sensorische Testung (QST) ist ein semiobjektives Verfahren zur Bestimmung der Detektionsschwellen für mechanische und thermische Reize und sollte bei Patienten mit Verdacht auf eine Small-Fiber Beteiligung ergänzend eingesetzt werden.
Autonome Testung
Ein Schellong-Test beantwortet die Frage nach einer orthostatischen Hypotonie oder einem posturalen orthostatischen Tachykardiesyndrom (POTS). Auch eine Frequenzstarre kann auffallen.
Genetische Testung
Abhängig von der klinischen Präsentation, Zusatzbefunde und der Familienanamnese wird bei Verdacht auf eine hereditäre Ursache eine gezielte oder umfassende genetische Panel-Diagnostik im Rahmen einer genetischen Beratung durchgeführt.
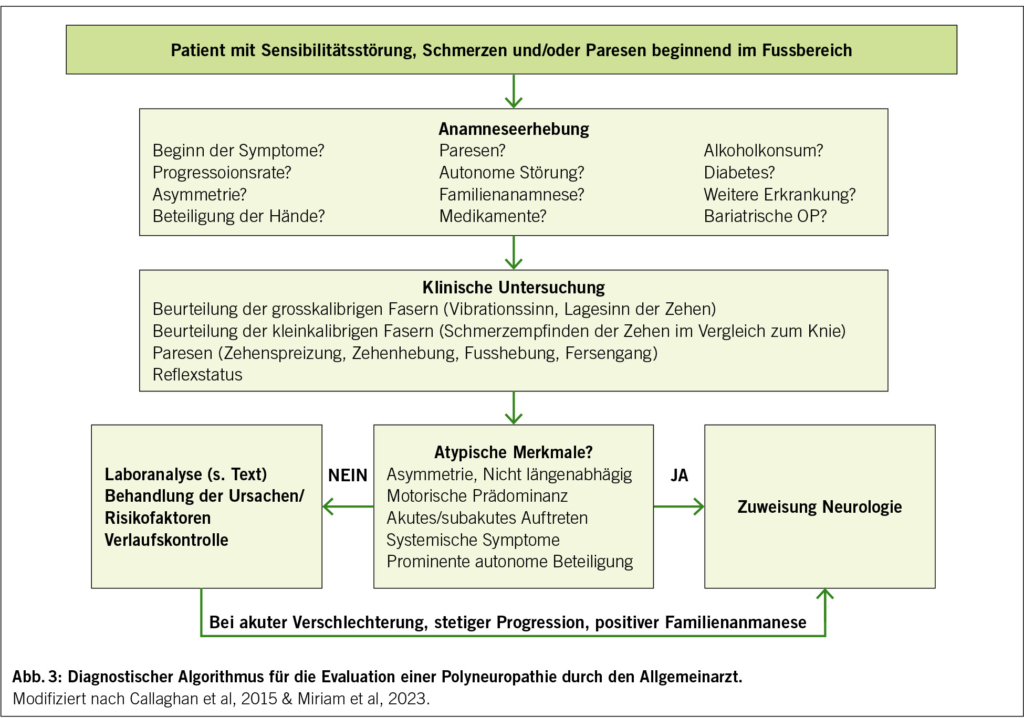
Für einen empfohlenen diagnostischen Ablauf zur Evaluation einer Polyneuropathie durch den Allgemeinarzt siehe Abb. 3.
Die wichtigsten Neuropathien auf einen Blick
Diabetische Neuropathie
Mit der Zeit weist jeder zweite Patient mit Diabetes Mellitus (Typ 1 oder Typ 2) eine periphere Nervenbeteiligung auf, so dass Diabetes die häufigste Ursache einer Polyneuropathie in der westlichen Welt ist. Zu den Risikofaktoren gehören unter anderem die Krankheitsdauer, das Alter, der HbA1c-Spiegel, das Vorliegen eines metabolischen Syndroms, Mangel an körperlicher Aktivität sowie Nikotin- und Alkoholkonsum. Bereits eine pathologische Glukosetoleranz kann eine Small-Fiber-Beteiligung hervorrufen, mit in diesem Fall im Vordergrund stehenden Schmerzen, sodass bereits der Prädiabetes mit einer peripheren Nervenbeteiligung verbunden ist. Typischerweise besteht jedoch bei Diabetes-Patienten eine chronische, sensomotorische, axonal-betonte Polyneuropathie mit überwiegend sensiblen Symptomen, während motorische Ausfälle in der Regel erst später auftreten. Wichtige potenzielle Komplikationen sind der diabetische Fuss sowie die kardiovaskuläre autonome Neuropathie. Letztere kann zu einer bis zu vierfach erhöhten Mortalität führen, bedingt durch plötzlichen Herztod, Arrhythmien, stumme Ischämien oder eine Kardiomyopathie.
Alkoholtoxische Neuropathie
Der chronische Alkoholkonsum führt bei bis zu 66 % der Patienten zu einer Polyneuropathie und ist die zweithäufigste erworbene Ätiologie. Die Dauer des Alkoholmissbrauchs und die Menge des konsumierten Alkohols sind wichtige beeinflussende Faktoren, wobei >100 g/Tag über mehrere Jahre als wahrscheinlich pathogene Grenze gesehen wird. Die Patienten leiden oft auch an Mangelernährung und konsekutivem Vitamin-B-Mangel (B1, B6, B12), was zur Polyneuropathie beiträgt. Meistens besteht eine langsam progrediente, sensomotorische und axonale Polyneuropathie, die oft auch mit Schmerzen verbunden ist. Eine begleitende sensible Ataxie kompliziert nicht selten gleichzeitig bestehende zerebelläre Defizite.
Vitamin-B12-Mangel
Die Vitamin-B12-Defizienz führt zu einer rein sensiblen Neuropathie mit einem subakuten Beschwerdebild, das Kribbeln, Hypästhesie und sensible Ataxie umfasst. Es muss beachtet werden, dass es alleine nicht ausreicht Vitamin-B12-Spiegel zu messen, sondern bei grenzwertigen Befunden auch der Holotranscobalamin-Spiegel bestimmt werden sollte. Zudem ist bei Patienten mit neurologischen Symptomen die für Vitamin-B12-Mangel typische makrozytäre Anämie oft nicht nachweisbar. Patienten nach einem bariatrischen Eingriff sind besonders anfällig für ernährungsbedingte Komplikationen und somit auch für Vitamin-B-Mangel.
Medikamentös-toxische Neuropathien
Polyneuropathien können durch eine Vielzahl von Medikamenten ausgelöst werden. Die häufigsten sind die chemotoxischen Neuropathien, insbesondere bei der Anwendung von Platinderivaten, Vinca-Alkaloiden, Taxanen, Proteasom-Inhibitoren und Antikörper-basierten Therapien. Die Häufigkeit einer Neuropathie unter Chemotherapie variiert zwischen 10 % und 90 %, abhängig von der Einzeldosis, Gesamtdosis und Therapiedauer.
Klinisch zeigt sich eine sensible-betonte axonale Neuropathie mit sensiblen Ausfällen und Schmerzen, die Wochen bis Monate nach Beginn der Behandlung auftreten. Neue Therapieansätze mit Checkpoint-Inhibitoren können zudem akute und chronische Immunneuropathien induzieren.
▷ Die tägliche Zufuhr von Vitamin B6 (hohe Dosen können unter anderem Sport- und Energiegetränke sowie Multivitaminpräparate enthalten) sollte 12 mg für Erwachsene nicht überschreiten, um eine Vitamin-B6-assoziierte Neurotoxizität zu vermeiden.
Guillain-Barré-Syndrom
Die akut-inflammatorische demyelinisierende Poly(radikulo)neuropathie, bekannt als Guillain-Barré-Syndrom, tritt in 2/3 der Fälle nach einer vorausgehenden (1-3 Wochen) respiratorischen oder gastrointestinalen Infektion auf. Es entwickeln sich innerhalb von Stunden bis zu 4 Wochen distal beginnende und proximal aufsteigende Lähmungen in den Armen und Beinen, begleitet von Sensibilitätsstörungen, Hypo- oder Areflexie sowie Schmerzen. In etwa 50 % der Fälle sind die Hirnnerven betroffen, und bei 2/3 der Patienten kommt es zu autonomen Funktionsstörungen mit kardiovaskulärer Dysregulation. Etwa 25 % der Patienten benötigen eine Beatmung. Aufgrund der Schwere ist das Guillain-Barré-Syndrom ein medizinischer Notfall, der häufig eine initiale Überwachung der Vitalfunktionen auf einer Intensivstation erfordert.
Bei anfänglich teilweise milden und diffusen Beschwerden kommt es weiterhin vor, dass manche Patienten fälschlicherweise als funktionell eingestuft werden. Daher sollte bis zum Ausschluss einer organischen Ursache entsprechend abgeklärt werden. Die chronische Form einer inflammatorischen demyelinisierenden Poly(radikulo)neuropathie wird als CIDP bezeichnet.
Amyloid-Neuropathie
Die Amyloid-Neuropathie ist die periphere Beteiligung einer systemischen Amyloidose, verursacht durch Mutationen im Transthyretin (ATTR)-Gen oder Leichtketten-Amyloidose. Es handelt sich um eine progressive, längenabhängige Polyneuropathie mit vorwiegender Beteiligung der Small-Fibers und der autonomen Nervenfasern, sodass neuropathische Schmerzen, Sensibilitätsstörungen und autonome Störungen im Vordergrund stehen. Paresen treten aufgrund des progredienten Verlaufs bereits innerhalb von 2 Jahren auf. Im Falle einer progressiven Neuropathie mit beidseitigem Karpaltunnelsyndrom, autonomer Dysfunktion, kardialer Beteiligung, Proteinurie sowie unklarem Gewichtsverlust sollte eine diagnostische Abklärung zum Ausschluss einer Amyloidose erfolgen.
Hereditäre Neuropathie
Die genetisch-bedingten Neuropathien umfassen eine klinisch und genetisch heterogene Gruppe mit motorischer, und/oder sensibler sowie autonomer Beteiligung. Derzeit sind mehr als 100 Gene und über 1500 Mutationen bekannt, die mit autosomal-dominant, autosomal-rezessiv, X-chromosomal oder mitochondrial vererbten Neuropathien in Zusammenhang stehen. Aufgrund des breiten klinischen Spektrums der hereditären Neuropathien sowie der phenotypischen Überlappung mit anderen neuromuskulären Erkrankungen in vielen Fällen, erfolgt in der Regel die weitere Abklärung mittels breiter Paneldiagnostik im Rahmen eines genetischen Beratungstermins.
Therapie
Die Therapie einer Neuropathie besteht als erstes darin, Risikofaktoren zu vermeiden oder bei bekannten Ursachen gezielt zu behandeln. Bei diabetischer Neuropathie sollte eine strenge glykämische Kontrolle in Kombination mit Bewegung, Diät und regelmässiger Fusskontrolle erfolgen. Bei alkoholassoziierter Neuropathie sind Abstinenz sowie die Korrektur der Mangelernährung mit Vitamin-B-Substitution entscheidend. Bei Vitamin-B12-Mangel sollte eine entsprechende Substitutionstherapie durchgeführt und regelmässig der Spiegel kontrolliert werden. Medikamentös-toxische Neuropathien erfordern häufig das Absetzen/Umstellung der entsprechenden Medikamente, einschliesslich Chemotherapie nach interdisziplinärer Entscheidung. Entzündliche Neuropathien werden mit immunmodulatorischen oder immunsuppressiven Medikamenten behandelt, im Falle eines chronischen Verlaufes oft langfristig. Bei einer Leichtketten-Amyloidose, assoziiert zu einer monoklononalen Gammopathie unklarer Signifikanz oder Malignome, werden Chemotherapeutika oder eine autologe Stammzelltransplantation verwendet.
Symptomatisch werden Begleitschmerzen mit Antikonvulsiva oder Antidepressiva (Gabapentin, Pregabalin, Duloxetin, Venlaflaxin, trizyklische Antidepressiva) als erste Wahl behandelt. Zudem kommen topische Therapien wie Lidocain- oder Capsaicin-Pflaster je nach Grösse des Schmerzbereichs zur Anwendung (zweite Wahl). Schwache und starke Opioide (zweite und dritte Wahl) sollten nicht bei Behandlungsbeginn verwendet werden. Bei therapieresistenten Schmerzen ist eine schmerzmedizinische Konsultation empfehlenswert, um weitere intensivierte oder invasive Therapiemethoden wie die Implantation eines Neurostimulators zu evaluieren.
▷ Es gibt keine Evidenz für die breite Verwendung von Vitamin-B-Präparaten bei neuropathischen Beschwerden ohne nachweisbarem Vitamin-B-Mangel, sodass eine gezielte Substitution nur bei nachgewiesenem Defizit erfolgen sollte.
Insbesondere bei begleitenden Gleichgewichtsstörungen und Paresen ist eine ergo- und physiotherapeutische Begleitung sinnvoll, um Mobilität und Koordination, somit die Lebensqualität zu verbessern. Fussheberorthesen sind bei höhergradigen Fussheberparesen sinnvoll, ebenso orthopädische Schuheinlagen bei Fussdeformitäten, und Gehhilfen (Gehstock, Rollator) bei erhöhtem Sturzrisiko. Eine neurorehabilitative Evaluation im ambulanten oder stationären Setting kann hilfreich sein.
Bei einzelnen genetisch-bedingten Polyneuropathien kommen therapeutische Ansätze in Frage, unter anderem bei hereditärer Amyloidose.
Prognose
Die Prognose der Neuropathien variiert je nach Ursache und Schweregrad der Erkrankung. Der frühe Therapiebeginn ist entscheidend, um bleibende Schäden zu vermeiden.
Eine Glukosekontrolle ist bei Patienten mit Diabetes Mellitus effektiv, um das Fortschreiten der Erkrankung, mehr bei Typ 1 als bei Typ 2, zu kontrollieren.
Die Vitamin-B12-Substitution kann innerhalb weniger Monate zu einer Rückbildung der Neuropathie führen.
Auch bei Alkoholabstinenz kann sich die Neuropathie innerhalb von Monaten bis Jahren zurückbilden. Nach dem Absetzen des toxischen Medikaments kann sich die Neuropathie ebenfalls stabilisieren oder zurückbilden, wobei vor allem bei Platin-haltigen Präparaten zunächst eine weitere Verschlechterung nach Absetzen der Substanz auftreten kann.
Die Mortalität bei Guillain-Barré-Syndrom liegt aufgrund autonomer Komplikationen bei bis zu 10 %, wobei 80 % der Betroffenen die Fähigkeit zurückgewinnen, selbstständig zu gehen. Bei chronisch-inflammatorischen Neuropathien behalten die meisten Patienten Defizite trotz langjähriger Therapie.
Bei einer hereditären Neuropathie ist mit einer stetigen, langsamen Progression zu rechnen, weshalb die langfristige symptomatische und supportive Behandlung von grosser Bedeutung ist.
Copyright Aerzteverlag medinfo AG
Oberärztin Neuromuskuläres Zentrum
Neurologische Klinik und Poliklinik
Universitätsspital Basel
Petersgraben 4
4031 Basel
Die Autorin hat keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
1. Alvarez M, Sierra OR, Saavedra G, Moreno S. Vitamin B12 deficiency and diabetic neuropathy in patients taking metformin: a cross-sectional study. Endocr Connect. 2019 Oct 1;8(10):1324-1329.
2. Bromberg MB. Peripheral Neuropathies: A Practical Approach. Cambridge University Press; 2018.
3. Bunschoten C, Blomkwist-Markens PH, Horemans A, van Doorn PA, Jacobs BC. Clinical factors, diagnostic delay, and residual deficits in chronic inflammatory demyelinating polyradiculoneuropathy. J Peripher Nerv Syst. 2019 Sep;24(3):253-259.
4. Callaghan BC, Price RS, Feldman EL. Distal Symmetric Polyneuropathy: A Review. JAMA. 2015 Nov 24;314(20):2172-81.
5. Finnerup NB, Attal N, Haroutounian S, McNicol E, Baron R, Dworkin RH, Gilron I, Haanpää M, Hansson P, Jensen TS, Kamerman PR, Lund K, Moore A, Raja SN, Rice AS, Rowbotham M, Sena E, Siddall P, Smith BH, Wallace M. Pharmacotherapy for neuropathic pain in adults: a systematic review and meta-analysis. Lancet Neurol. 2015 Feb;14(2):162-73.
6. FSA Panel on Nutrition, Novel Foods and Food Allergens (NDA); Turck D, Bohn T, Castenmiller J, de Henauw S, Hirsch-Ernst KI, Knutsen HK, Maciuk A, Mangelsdorf I, McArdle HJ, Pelaez C, Pentieva K, Siani A, Thies F, Tsabouri S, Vinceti M, Fairweather-Tait S, Vrolijk M, Fabiani L, Titz A, Naska A. Scientific opinion on the tolerable upper intake level for vitamin B6. EFSA J. 2023 May 17;21(5):e08006.
7. Giordano C, Sciarrone MA, Vitali F, Romano A, Guerri G, Perlangeli V, Gaudino S, Luigetti M. Nerve MR in the Differential Diagnosis of Neuropathies: A Case Series from a Single Center. J Clin Med. 2023 Jul 30;12(15):5009.
8. Hanewinckel R, van Oijen M, Ikram MA, van Doorn PA. The epidemiology and risk factors of chronic polyneuropathy. Eur J Epidemiol. 2016 Jan;31(1):5-20.
9. Heuß D. et al., Diagnostik bei Polyneuropathien, S1-Leitlinie, 2024, in: Deutsche Gesellschaft für Neurologie (Hrsg.), Leitlinien für Diagnostik und Therapie in der Neurologie.
10. Kapoor M, Rossor AM, Jaunmuktane Z, Lunn MPT, Reilly MM. Diagnosis of amyloid neuropathy. Pract Neurol. 2019 Jun;19(3):250-258.
11. Kramer M, Grimm A, Winter N, Dörner M, Grundmann-Hauser K, Stahl JH, Wittlinger J, Kegele J, Kronlage C, Willikens S. Nerve Ultrasound as Helpful Tool in Polyneuropathies. Diagnostics (Basel). 2021 Jan 31;11(2):211.
12. Kuehl M, Stevens MJ. Cardiovascular autonomic neuropathies as complications of diabetes mellitus. Nat Rev Endocrinol. 2012 Feb 28;8(7):405-16.
13. Leonhard SE, Mandarakas MR, Gondim FAA, Bateman K, Ferreira MLB, Cornblath DR, van Doorn PA, Dourado ME, Hughes RAC, Islam B, Kusunoki S, Pardo CA, Reisin R, Sejvar JJ, Shahrizaila N, Soares C, Umapathi T, Wang Y, Yiu EM, Willison HJ, Jacobs BC. Diagnosis and management of Guillain-Barré syndrome in ten steps. Nat Rev Neurol. 2019 Nov;15(11):671-683.
14. Mirian A, Aljohani Z, Grushka D, Florendo-Cumbermack A. Diagnosis and management of patients with polyneuropathy. CMAJ. 2023 Feb 13;195(6):E227-E233. doi: 10.1503/cmaj.220936. Erratum in: CMAJ. 2023 Mar 20;195(11):E415.
15. Nathani D, Spies J, Barnett MH, Pollard J, Wang MX, Sommer C, Kiernan MC. Nerve biopsy: Current indications and decision tools. Muscle Nerve. 2021 Aug;64(2):125-139.
16. Parmar JM, Laing NG, Kennerson ML, Ravenscroft G. Genetics of inherited peripheral neuropathies and the next frontier: looking backwards to progress forwards. J Neurol Neurosurg Psychiatry. 2024 May 24:jnnp-2024-333436.
17. Smyth D, Kramarz C, Carr AS, Rossor AM, Lunn MP. Toxic neuropathies: a practical approach. Pract Neurol. 2023 Apr;23(2):120-130.
18. Sommer C, Geber C, Young P, Forst R, Birklein F, Schoser B. Polyneuropathies. Dtsch Arztebl Int. 2018 Feb 9;115(6):83-90.
19. van den Berg B, Walgaard C, Drenthen J, Fokke C, Jacobs BC, van Doorn PA. Guillain-Barré syndrome: pathogenesis, diagnosis, treatment and prognosis. Nat Rev Neurol. 2014 Aug;10(8):469-82.
der informierte @rzt
- Vol. 14
- Ausgabe 9
- September 2024