- Personalisierte Medizin in der Onkologie
Von jeher versucht die Medizin eine auf den individuellen Patienten ausgerichtete «personalisierte Medizin» mit dem zu der jeweiligen Zeit verfügbaren Wissen, Können und gewonnen Erfahrungen auszuüben. In der Zeit der biochemisch, molekulargenetisch und immunologisch dominierten Medizin, wird es möglich, immer bessere zielgerichtete, hochpräzise Behandlungsformen zu entwickeln. In diesem Artikel wird die Begrifflichkeit der «Personalisierten Medizin» geklärt und mit Beispielen aus der Onkologie erläutert.
Das jeweils aktuell vorherrschende Medizin-Modell war schon immer abhängig vom Einfluss der zeitgleich dominierenden Ergebnisse der Wissenschaften. War in der 1. Hälfte des letzten Jahrhunderts die Psychoanalyse gross en vogue, so verhalf dies der psychosomatisch orientierten Medizin zu einem beachtlichen Aufschwung und in Erweiterung durch die soziologischen und naturwissenschaftlichen Erkenntnisse zum Model der biopsychosozialen Medizin. Die Entdeckung und Entwicklung der Narkose, das erfolgreiche Konzept der Sterilität und antiinfektiösen Therapien, die Entdeckung der Blutgruppen und damit Etablierung der Transfusionsmedizin sowie die apparative Bildgebung wiederum haben der modernen operativ, pharmakologisch und technisch dominierten Medizin in der 2. Hälfte des letzten Jahrhunderts zu eindrücklichen Höhenflügen verholfen.
Nun befinden wir uns seit der Entschlüsselung des genetischen Codes in den Fünfzigerjahren des 20. Jahrhunderts in der Zeit der biochemisch, molekulargenetisch und immunologisch dominierten Medizin, neuerdings ergänzt mit den grossen Versprechungen der intelligenten «Big Data»-Analysen und künstlichen Intelligenz. Da ist nun potentiell jeder Mensch permanent Objekt und Subjekt in seiner Totalität, mit seiner ganz individuellen vollständigen molekulargenetischen Signatur und seinem Verhalten in Gesundheit und Krankheit. Eine breite öffentliche Diskussion ist nun notwendig, damit die einerseits wohl zu Recht grossen Chancen, andererseits die nicht zu unterschätzenden Risiken für den verletzlichen gläsernen Patienten verstanden werden. Das Bundesamt für Gesundheit hat ein eigenes Merkblatt zur Begrifflichkeit der «Personalisierten Medizin» verfasst, was die Bedeutung dieser Entwicklung für die hiesige Öffentlichkeit klar unterstreicht. In den USA hat sich in letzter Zeit der Begriff «Precision Medicine» vermehrt etabliert gegenüber von «Personalized Medicine», da hier mehr zum Ausdruck kommt, dass es sich um eine genau auf eine für den Patienten passende Zielstruktur gerichtete Medizin handelt. Es soll nicht übersehen werden, dass dieser Begriff auch bewusst manipulativ medial eingesetzt wird, um die teilweise exorbitant hohen Preise und Kosten neuer Therapien zu rechtfertigen.
Definitionen zu personalisierter Medizin und Gesundheit
Bundesamt für Gesundheit (BAG)
«Die personalisierte Medizin (auch Präzisionsmedizin oder individualisierte Medizin genannt) umfasst im Allgemeinen diagnostische, präventive und therapeutische Massnahmen, die auf ein Individuum optimal zugeschnitten sind. Die Person wird untersucht, insbesondere um genetische Merkmale zu bestimmen. Die Ergebnisse dieser Untersuchungen fliessen anschliessend in den Entscheidungsprozess für Therapie- und Präventionsmassnahmen zur Behandlung jener Person ein. Von solch massgeschneiderten Behandlungen erhofft man sich wirksamere Therapien und weniger Nebenwirkungen. Langfristig sollen sie somit auch positiv auf die Kostenentwicklung wirken.
Das Konzept der Personalisierten Gesundheit geht über dasjenige der Personalisierten Medizin hinaus und spielt insbesondere für die Prävention eine wichtige Rolle. Für die Personalisierte Gesundheit stehen nicht nur die Patientinnen und Patienten im Fokus, sondern auch gesunde Personen. Es werden neben Informationen zur «Biologie» der Person weitere gesundheitsbezogene Daten aus unterschiedlichen Quellen berücksichtigt.»
USA National Cancer Institute (NCI-Dictionary)
«Personalized Medicine: A form of medicine that uses information about a person’s genes, proteins, and environment to prevent, diagnose, and treat disease. In cancer, personalized medicine uses specific information about a person’s tumor to help diagnose, plan treatment, find out how well treatment is working, or make a prognosis. Examples of personalized medicine include using targeted therapies to treat specific types of cancer cells, such as HER2-positive breast cancer cells, or using tumor marker testing to help diagnose cancer. Also called precision medicine».
Die personalisierte Medizin und die moderne Onkologie
Die onkologische Hämatologie und Onkologie haben sich als klare medizinische Frontdisziplin dieser rasanten Entwicklung in den letzten 3 Jahrzehnten etabliert und sind somit mit vielen neuen offenen Fragen jeweils als Erste konfrontiert. Schon alleine durch die heute immer rascher verfügbare und auch zunehmend bezahlbare Entschlüsselung der molekulargenetischen Signatur der individuellen Tumorerkrankung unterscheiden wir von Monat zu Monat neue Untergruppen von bisher als einheitlich verstandenen Tumorentitäten. So haben wir es bereits heute mit über 1000 Untergruppen von Malignomen zu tun; letztlich ist jeder Tumor eines individuellen Patienten sogar einzigartig in seinem Muster von Mutationen und weiteren genetischen und epigenetischen Veränderungen. Diese genetische Signatur verändert sich dann noch weiter im Verlauf der Erkrankung mit den vielen Generationen an weiteren fehlerhaften Zellteilungen und ist vom Primärtumor zu den verschiedenen Metastasen dazu noch weiter variabel. Auch die Therapien verändern die genetischen Informationen zusätzlich und können die malignen Zellen mit insbesondere die Resistenz unterstützenden Mutationen selektionieren. Bei diesen häufig tausendfachen genetischen Veränderungen muss man die informativen und nicht-informativen Mutationen unterscheiden.
Für die therapeutische Nutzung dieser Daten ist es entscheidend für den jeweiligen Patienten herauszufinden, welche der vielen genetischen Veränderungen den Krankheitsprozess bestimmen («driver mutations») und welche nicht («passenger mutations»), um die dafür richtigen hochpräzisen Therapien im entsprechenden Krankheitsverlauf zu entwickeln und verwenden.
Das heutige Konzept der «Personalisierten Medizin» ist also im «Management» der einzelnen Patienten mit sehr grossen komplexen Datenmengen, die weit über die Erfahrung des einzelnen Arztes oder eines lokalen Spezialistenteams hinausgehen, konfrontiert. Der unmittelbare Austausch dieser Daten unter den Experten in grossen nationalen und internationalen Netzwerken erlaubt es grundsätzlich, die Ergebnisse bisheriger und neuer diagnostischer und therapeutischer Verfahren zeitnah zu erfassen, zu vergleichen und auszuwerten. Damit wird die Effizienz der neuen Erkenntnisse enorm gesteigert und die jeweils beste diagnostische und therapeutische Vorgehensweise für den individuellen Patienten damit viel schneller verfügbar.
Die Schweizerische Akademie der Medizinischen Wissenschaften (SAMW) hat mit dem Swiss Personalized Health Network (SPHN) die Infrastrukturen geschaffen, um die vielen Gesundheitsdaten in der Schweiz für die Forschung und letztlich die Patientinnen und Patienten nutzbar zu machen. Das vom Forum Genforschung betriebene Themenportal «Personalisierte Gesundheit» und das Dialogprojekt «Mensch nach Mass» der Stiftung Science et Cité sind weitere Aktivitäten, die von der SAMW mitgetragen werden. In einem eigenen Positionspapier überprüft die SAMW zudem den Nutzen und die Risiken des medizinischen Fortschritts für die nachhaltige Entwicklung des Gesundheitssystems insgesamt. Bei allen Erwartungen, welche die Personalisierte Medizin weckt, ist es auch eine Aufgabe der SAMW und anderer nationaler und internationaler unabhängiger Organisationen, diese im Kontext eines nachhaltigen Gesundheitssystems kritisch zu hinterfragen.
Beispiele der «Personalisierten Onkologie»
Das wohl berühmteste und auch erste Beispiel zielgerichteter Therapie stammt aus der Onkologie, nämlich die Behandlung der chronischen myeloischen Leukämie (CML). Es konnte gezeigt werden, dass sie durch eine einzigartige pathognomonische Translokation zwischen den Chromosomen 9 und 22 verursacht wird, welche zytogenetisch und molekularbiologisch nachgewiesen werden kann. Aus dieser Translokation entsteht ein neues Protein mit einer veränderten Funktion, das BCR-ABL-Eiweiss, welches ein ungebremstes Wachstum und damit die Leukämie auslöst. Diese Funktion kann durch neue Krebsmedikamente, sogenannte Kinase-Inhibitoren wie Imatinib, geblockt werden – mit dramatischer Verbesserung des Überlebens von CML-Patienten. BCR-ABL ist in der CML somit ein diagnostischer Biomarker, wie auch ein prädiktiver Test – er sagt die Wirkung von Kinase-Inhibitoren voraus.
Eine weitere onkologische Erkrankung, bei der zielgerichtete Therapien das Überleben deutlich verlängern konnten, ist das malignes Melanom. Es konnte gezeigt werden, dass rund 60 % der metastasierten Melanome der Haut eine Punktmutation im BRAF-Gen aufweisen. BRAF-Kinase- Inhibitoren (wie Vemurafenib, Dabrafenib oder Encorafenib) sind in dieser Situation sehr gut wirksam; allerdings entwickelt sich meist rasch eine Resistenz, was die Gabe weiterer Medikamente bedingt.
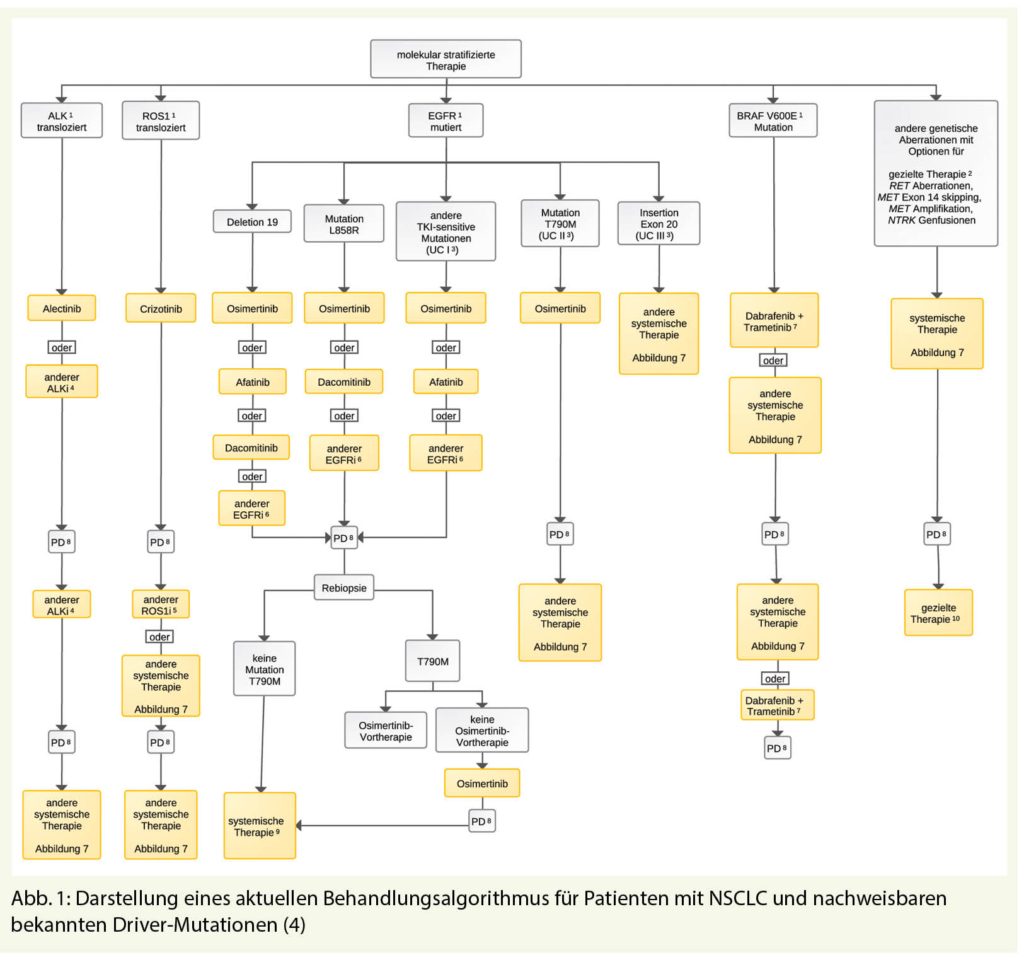
Als Beispiel wie heute die personalisierte Onkologie praktiziert wird sei hier das Nichtkleinzellige Lungenkarzinom NSCLC angeführt. Hatten wir noch vor 20 Jahren im Wesentlichen die Nichtkleinzelligen Lungenkarzinome unterschieden in die Plattenepithel- und Adeno-Karzinome so unterschieden wir heute circa 20 molekulargenetisch verschiedene Typen und diese Zahl nimmt laufend zu. Ein aktueller Behandlungsalgorithmus für Patienten mit NSCLC und nachweisbaren bekannten Driver-Mutationen ist in Abbildung 1 (4) dargestellt.
Trotz den rasanten und sehr kostspieligen Fortschritten in der Onkologie und onkologischen Hämatologie muss festgehalten werden, dass die bisherige konventionelle Chemotherapie und Radiotherapie keineswegs ausgedient haben. In vielen Situationen ergänzen sich die verschiedenen bewährten und neuen Therapieformen und bei vielen Patienten haben wir noch keine zielgerichteten Therapien verfügbar oder sie sind noch nicht ausreichend oder nur kurzfristig wirksam.
Es ist aber auch legitim die bereits absehbaren enormen Erfolge insbesondere auch der Immuntherapien z.B. in der jetzt möglichen kurativen Behandlung der Patienten mit metastasierendem malignen Melanom oder mit bisher therapierefraktären akuten Leukämien oder Lymphomen und anderen mehr zu erwähnen. Wir stehen hier erst am Anfang eines weiten Weges.
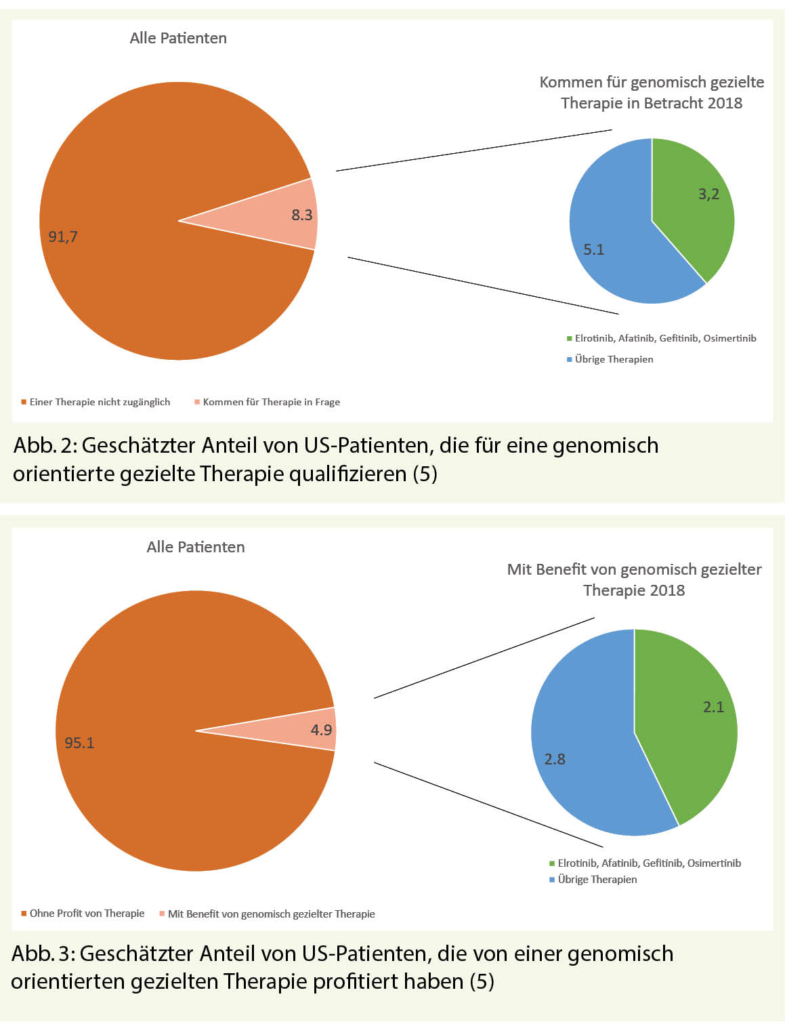
In einer breit angelegten Studie in den USA wurde kürzlich untersucht wie viele der 94 157 zielgerichtet behandelten Patienten im Zeitraum 2006-2018 profitiert haben (Abb. 2, 3) (5). In der gleichen Population betrug die Ansprechrate («response rate») 54%, während sich die Dauer des Ansprechens («duration of response») im Median auf 29,5 Monate aufsummierte (5).
Ausblick
Es wird entscheidend sein, dass der Nutzen der personalisierten Medizin als Resultat der weitgehend von der Öffentlichkeit getragenen hunderte von Milliarden Franken schweren Grundlagen- und Klinischen Forschung der breiten Bevölkerung auch umfassend zu Gute kommt. Die bisherige zu einseitige Kommerzialisierung des medizinischen Fortschritts insbesondere durch die zu grosszügige Monopolisierung durch privatisierte Patente aus der öffentlichen Forschung muss den heutigen Realitäten wieder gerecht werden und die Preise der innovativen Medikamente in ein nachvollziehbares transparentes und faires Verhältnis von Aufwand und Ertrag gesetzt werden. Eine freie Preissetzung neuer Medikamente und Indikationen, wie es die USA zulässt, ist nicht mehr haltbar in solidarisch getragenen Gesundheitssystemen wie in Europa.
Für uns als Experten der Medizin sind wir nun mitten im Aufbruch dieser Revolution der Medizin, welche in sehr raschem Tempo voranschreitet, enorm gefordert. Die therapeutischen, diagnostischen und präventiven Optionen der nahen Zukunft sind noch kaum absehbar gross und haben enorme Konsequenzen für die ganze Gesellschaft. Die Demographie, die Prävalenz und Inzidenz der Erkrankungen sind in raschem Wandel mit grossen Auswirkungen auf die Veränderungen der Gesellschaft. Die Möglichkeiten, ins Genom des Menschen, insbesondere auch in die Keimbahn einzugreifen, wie z.B. durch die CRISPER-Cas9 Methoden sind gerade erst in der Initialphase der öffentlichen Diskussion ebenso wie die Optionen der Verschmelzung von Mensch und Technik im «Transhumanismus», wo der einzelne Mensch durch technischen Implantate «verbessert» werden soll.
Prof. Daniel Scheidegger, bis Ende 2019 Präsident der SAMW schreibt: «Alle Gesundheitsfachleute müssen sich heute mit diesen neuen Trends auseinandersetzen. Da die Medizin sich in Zukunft nur noch multi- und interprofessionell weiterentwickeln kann, sind die Inhalte nicht nur auf alle Berufsgruppen ausgerichtet, sondern auch interprofessionell entstanden. Die Personalisierte Medizin wird in den nächsten Jahren rasant an Bedeutung gewinnen. Ob sich die grossen Hoffnungen bewahrheiten, wird die Zukunft zeigen.»
Rosengartenstrasse 1d
9000 St. Gallen
thomas.cerny@kssg.ch
Der Autor hat in Zusammenhang mit diesem Artikel keine Interessenskonflikte deklariert.
- Personalisierte Medizin und Personalisierte Gesundheit sind als Begriffe jeweils im Kontext zu interpretieren
- In der Onkologie wird damit meist die zielgerichtete «Precision
Medicine» gemeint - Immer mehr ist «Big Data» unterwegs zum gläsernen Patienten/
Bürger - Die Chancen und Risiken der Personalisierten Medizin und Gesundheit transparent und verständlich zu machen, ist dabei die grösste Herausforderung.
1. Publikation «Personalisierte Medizin» der SAMW: www.samw.ch unter Publikationen
2. Faktenblatt Personalisierte Medizin des BAG: unter www.bag.admin.ch eingeben: Faktenblatt Personalisierte Medizin
3. Swiss Personalized Health Network (SPHN) Initiative: www.sphn.ch
4. Onkopedia Leitlinien: https://www.onkopedia.com/de/onkopedia/guidelines/lungenkarzinom-nicht-kleinzellig-nsclc/@@guideline/html/index.html)
5. Marquart J, Chen EY, Prasad V. Estimation of the percentage of US patients with cancer who benefit from genome-driven oncology [published online April 17, 2018]. JAMA Oncol.
der informierte @rzt
- Vol. 10
- Ausgabe 5
- Mai 2020