- Primärer Hyperaldosteronismus
Der primäre Hyperaldosteronismus ist die häufigste endokrine Hypertonie und mit einer Reihe von Folgeerkrankungen assoziiert. Die Prävalenz steigt mit der Schwere einer arteriellen Hypertonie an. Ein Screening kann grosszügig indiziert werden. Ein vollständiger Abklärungsgang ist allerdings aufwendig. Somit ist im Einzelfall auch die pragmatische Behandlung mit Spironolacton eine Option. Der initiale Labortest ist die Aldosteron-Renin-Ratio, die durch mehrere Faktoren beeinflusst wird. Bei bestätigter Diagnose ist die Frage zu klären, ob der Aldosteron-Exzess von einer oder beiden Nebennieren kommt. In den meisten Fällen ist dafür eine selektive Blutabnahme aus den Nebennierenvenen nötig. Bei Dokumentation eines lateralisierten Hyperaldosteronismus ist die Chirurgie Therapie der Wahl, andernfalls muss medikamentös behandelt werden mit einem Mineralokortikoid-Rezeptor-Antagonisten wie Spironolacton. In beiden Fällen gelingt meist eine substanzielle Verbesserung der Hypertonie und die Senkung der mit dem Hyperaldosteronismus assoziierten Morbidität und Mortalität.
Primary aldosteronism is the most common endocrine hypertension and is associated with a number of sequelae. Prevalence increases with the severity of arterial hypertension. Screening may be generously indicated. However, a complete diagnostic workup is elaborate. Thus, in individual cases, pragmatic treatment with spironolactone is an option. The initial laboratory test is the aldosterone-renin ratio, which is influenced by several factors. Upon confirmed diagnosis, the question arises whether the aldosterone excess comes from one or both adrenal glands. In most cases, selective blood sampling from the adrenal veins is necessary. In case of lateralized hyperaldosteronism, surgery is the therapy of choice; otherwise, medical treatment with a mineralocorticoid receptor antagonist such as spironolactone must be pursued. In both cases, a substantial improvement in hypertension and a reduction in morbidity and mortality associated with hyperaldosteronism is usually achieved.
Key Words: sekundäre Hypertonie, Hyperaldosteronismus-Screening, Aldosteron-Renin-Ratio, Aldosteron-Lateralisation
Die Bedeutung von Aldosteron aus einem evolutionären Blickwinkel war die Sicherstellung einer ausreichenden Salzversorgung in einem ursprünglich sehr salzarmen Umfeld. Die Ernährung des Menschen hat sich über die Zeit erheblich gewandelt, die Salzzufuhr liegt in den entwickelten Industrieländern vielfach bei deutlich mehr als 4g pro Tag. Zur Aufrechterhaltung des Volumenstatus und Blutdrucks ist der Mensch vor diesem Hintergrund heute weit weniger auf Aldosteron angewiesen (1). Hingegen ist ein Aldosteronüberschuss ein immer häufigeres Problem.
Pathophysiologie
Die Aldosteron-Produktion in der Zona glomerulosa der Nebennierenrinde ist im Wesentlichen reguliert durch die Konzentration von Angiotensin II und Kalium. Bei Abfall von extrazellulärem Volumen und damit renaler Perfusion wird die Renin-Sekretion stimuliert, was die Kaskade über Angiotensin I und II zu Aldosteron in Gang setzt. Aldosteron führt zur Salz- und Wasser-Rückresorption. Diese Renin-abhängige Aldosteronwirkung ist entscheidend für die Sicherung des Volumenstatus und Blutdrucks. Hyperkaliämie führt ebenfalls zu einer Aldosteron-Stimulation, dieser Renin-unabhängige Mechanismus wird aber meist überlagert durch die Volumen- und Salz-Regulation (1).
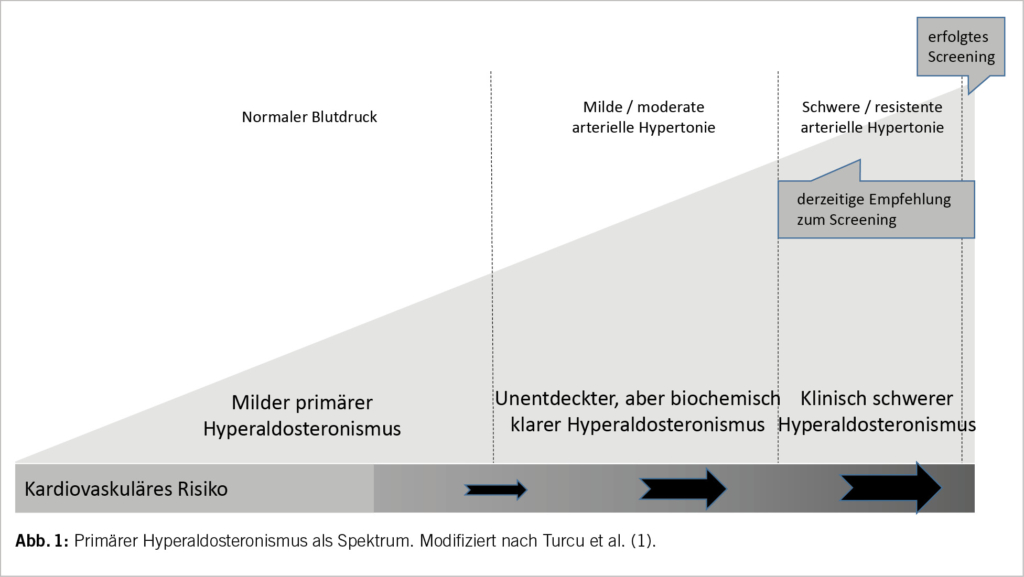
Ein Aldosteron-Exzess – unabhängig von Renin und nicht reguliert durch Volumen- und Salzhaushalt – führt in letzter Konsequenz zu arterieller Hypertonie und Hypokaliämie. Im frühen Stadium einer solchen Dysregulation kann allerdings die Volumenexpansion kompensiert werden. Primärer Hyperaldosteronismus ist in dem Sinn ein Kontinuum, das von nicht-supprimierbarem Aldosteron und normalem Blutdruck über sog. «low renin hypertension» mit milder Hypertonie und normalem Kalium bis zu schwerer / resistenter Hypertonie und Hypokaliämie reicht. Parallel dazu steigt das Risiko für kardiovaskuläre Erkrankungen, Herz- und Niereninsuffizienz (Abb. 1).
Seit der Erstbeschreibung des primären Hyperaldosteronismus durch Jerome Conn im Jahr 1954 (2) hat sich das Verständnis und die Bedeutung der Erkrankung stark gewandelt. Von einer seltenen Entität ist es zur häufigsten sekundären Hypertonie «aufgestiegen». Die Prävalenz liegt zwischen 5 und 15% bei Personen mit arterieller Hypertonie (3), bei sog. therapierefraktärer Hypertonie findet man Zahlen bis 30% (4). Diese Angaben schwanken erheblich, nicht nur abhängig von der untersuchten Population, sondern auch von den verwendeten Grenzwerten. Die klassische Unterteilung zwischen unilateralem Aldosteron-produzierendem Adenom («Conn-Adenom») und bilateralem idiopathischen Hyperaldosteronismus wird durch neue molekulare und genetische Erkenntnisse modifiziert (5). Somatische Mutationen in Genen, die in der Zona glomerulosa der Nebennierenrinde exprimiert werden, führen zur Aldosteron-Überproduktion; nur selten handelt es sich um Keimbahn-Mutationen, die einen autosomal-dominanten Familiären Hyperaldosteronismus zur Folge haben. Histopathologisch finden sich Cluster von Aldosteron-produzierenden Zellen, die oftmals somatische Mutationen tragen (6, 7). Damit wird eine gewisse Lateralisierung auch bei bilateralem Hyperaldosteronismus verständlich und illustriert den Hyperaldosteronismus ebenso als Kontinuum zwischen streng unilateraler und bilateraler Erkrankung, was für Diagnostik und Therapie bedeutsam ist.
Morbidität
Schon lange bekannt ist die Assoziation mit Komorbiditäten, die zumindest teilweise über die direkten Hypertonie-Folgen hinausgehen. Die Inzidenz von Herzinfarkt, Schlaganfall, Vorhofflimmern, Herzinsuffizienz und Niereninsuffizienz ist deutlich höher bei Personen mit primärem Hyperaldosteronismus im Vergleich zu Personen mit essentieller Hypertonie von gleichem Ausmass (8, 9). Dieses Exzess-Risiko kann bei erfolgreicher Therapie (operativ wie medikamentös mit Mineralokortikoid-Rezeptorantagonisten) gesenkt werden, womit die Bedeutung einer frühzeitigen Erkennung und Behandlung unterstrichen wird. Zusätzlich gibt es eine Assoziation von Aldosteron-Exzess und metabolischem Syndrom und Adipositas (10), was die hohe Koinzidenz mit obstruktiver Schlafapnoe erklären könnte (11). Darüber hinaus wird auch eine Assoziation mit Osteoporose beschrieben (12), sogar ein erhöhtes Risiko für Depression und Demenz wurde beobachtet (13).
Screening
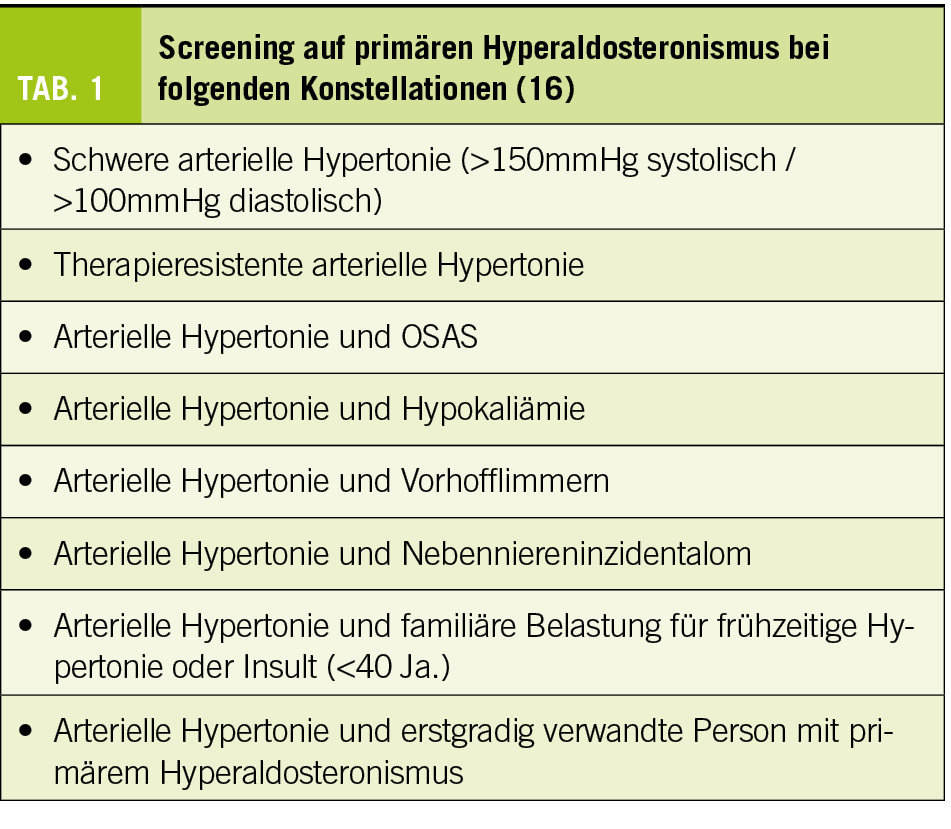
Trotz der relativ hohen Prävalenz und vermeidbaren Folgen bei rechtzeitiger Diagnose und Behandlung wird der primäre Hyperaldosteronismus weiterhin selten gesucht und spät erkannt (14). Vor diesem Hintergrund wird die Diskussion über das Screening geführt. In praktisch allen akzeptierten Guidelines wird eine Abklärung bei schwerer oder resistenter Hypertonie empfohlen mit zusätzlichen Faktoren wie Hypokaliämie oder OSAS (Tab. 1). De facto findet ein Screening am häufigsten im Kontext eines Nebenniereninzidentaloms statt (mit entsprechend geringer Ausbeute). Ein universelles Screening aller Personen mit arterieller Hypertonie, wie von verschiedenen Experten immer wieder propagiert, würde eine grosse logistische Herausforderung bedeuten, die unser Gesundheitssystem in der Schweiz wohl nicht leisten könnte. Noch eher denkbar wäre ein Screening jeweils bei Neudiagnose einer Hypertonie, zumal dann noch ohne Medikation die Interpretation der Laborwerte deutlich einfacher ist. Das Problem von Grenzbefunden bei nicht allgemein akzeptierten Diagnosekriterien und komplexer Abklärung bliebe freilich auch dann.
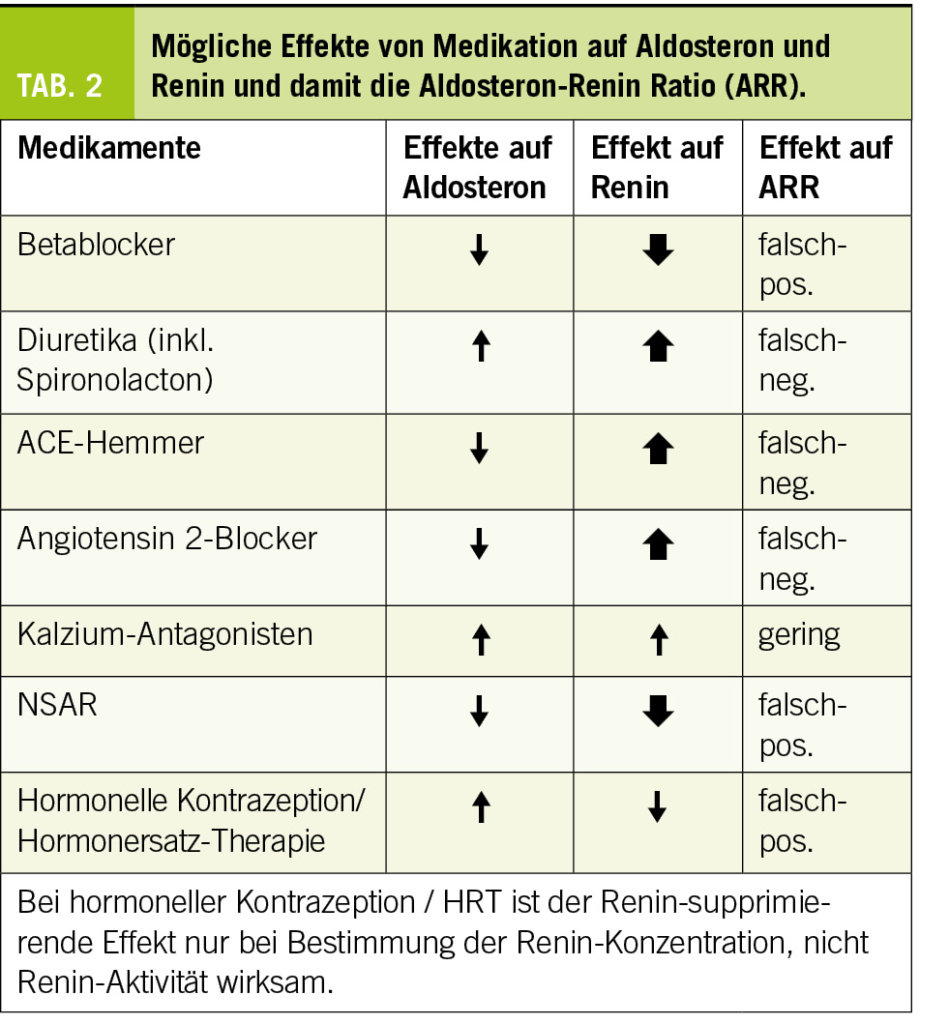
Als Standardtest zum Screening ist die Bestimmung der Aldosteron-Renin-Ratio (ARR) etabliert (15, 16). Die Beeinflussung beider Hormone und damit der Ratio durch zahlreiche Faktoren ist erheblich. Dazu gehören analytische Aspekte (immunologische vs. spektrometrische Messung, Bestimmung von Renin-Aktivität vs. -Konzentration), v.a. aber präanalytische Faktoren. In erster Linie sind das Medikamente, die Renin bzw. Aldosteron verändern (Tab. 2). Die Ratio kann in solchen Fällen falsch-positiv oder falsch-negativ ausfallen. Ideal ist die Umstellung der antihypertensiven Medikation auf solche, die die ARR vergleichsweise wenig tangieren (Kalzium-Antagonisten, Doxazosin, Moxonidin), nicht immer ist dies praktikabel. Allerdings können gelegentlich nach einer solchen Umstellung bessere Blutdruckwerte beobachtet werden als befürchtet, da die Adhärenz zur vorherigen Therapie sicher teilweise nicht optimal war. Konkret sollen wenn immer möglich zumindest Betablocker und Diuretika zwei Wochen pausiert sein, Spironolacton sogar vier Wochen, bevor eine Messung der ARR erfolgt. Da auch Tageszeit und Position eine Rolle spielen, ist eine Bestimmung am Morgen und in sitzender Position empfohlen. Wegen dennoch grosser intraindividueller Schwankungen sollte mindestens zweimal gemessen werden, bevor ein primärer Hyperaldosteronismus weiter abgeklärt oder ausgeschlossen wird (17).
Der ARR cut-off ist Gegenstand vieler Diskussionen. Bei Anwendung von Immunoassays mit Aldosteron in pmol/l und direkter Renin-Konzentration in mU/l wird ein cut-off von 50 als optimal angesehen. Tiefere Werte haben eine höhere Sensitivität zu Lasten der Spezifität, bei höherem cut-off ist es umgekehrt. Die ARR hängt stark vom Renin ab; bei sehr tiefen Renin-Werten kann die ARR hoch sein trotz tiefen Aldosterons, eine Konstellation die mit einem primären Hyperaldosteronismus schlecht vereinbar ist. Von vielen Autoren wird deshalb ein erhöhtes Aldosteron für eine Verdachtsdiagnose verlangt, die Grenze dafür ist allerdings arbiträr. Ein nicht supprimiertes Renin (>10mU/l) ohne interferierende Medikation ist ebenfalls nicht vereinbar mit einem primären Hyperaldosteronismus. Eine alleinige Beurteilung der ARR – unabhängig davon welcher cut-off gewählt wird – ist jedenfalls nicht ausreichend, die Werte von Aldosteron und Renin müssen jeweils plausibel sein.
Bestätigung
Bei auffälligem Screening i.S. erhöhter ARR unter den o.g. Aspekten ist in den meisten Fällen ein Bestätigungstest erforderlich. Dieser basiert auf der Annahme, dass die Aldosteron-Produktion bei normaler Regulation unterdrückt werden kann. Dafür sind mehrere Tests möglich, am verbreitetsten ist der Salzbelastungstest, der zu einer Renin-Suppression und damit verringerten Aldosteron-Produktion führen müsste. Der Test kann mit oraler Salzzufuhr über mehrere Tage erfolgen, besser standardisiert ist die intravenöse Zufuhr: 2 L NaCl 0.9% über 4 Std., früher meist bei liegendem Patienten, heute überwiegend im Sitzen (18). Eine Aldosteron-Suppression <170pmol/l ist physiologisch, ein Wert >220pmol/l ist sehr suspekt auf einen primären Hyperaldosteronismus, es verbleibt ein Graubereich. Nicht nur dieser, sondern auch die Auswahl verschiedener möglicher Bestätigungstests illustriert den fehlenden Goldstandard. Unterschiedliche Tests, verwendete Assays und Grenzwerte führen zumindest bei mildem Hyperaldosteronismus zu grosser Variabilität und Interpretation der Resultate. Eine Standardisierung wäre für eine einheitliche Diagnose und bessere Behandlung nützlich (19).
Hingegen kann in eindeutigen Situationen – hohes Aldosteron, supprimiertes Renin, Hypokaliämie – auf einen Bestätigungstest verzichtet werden. Das gilt gleichermassen, wenn eine Weiterabklärung mit dem Ziel einer möglichen Operation ohnehin nicht in Betracht kommt. In solchen Fällen kann eine medikamentöse Behandlung mit einem Mineralokortikoid-Rezeptorantagonisten ohne Verzögerung gestartet werden.
Bildgebung und Sampling
Wenn betroffene Personen Kandidaten für eine Operation sind und diese auch wünschen, dienen die nächsten Abklärungsschritte dem Nachweis einer Lateralisation des Hyperaldosteronismus. Wie bereits erwähnt, ist die klare Abgrenzung von unilateraler und bilateraler Aldosteronquelle – dem früheren Konzept der Erkrankung als Adenom vs. Hyperplasie – nicht mehr immer möglich. Ein unilateraler Hyperaldosteronismus kann Ausdruck einer asymmetrischen multifokalen bilateralen Erkrankung sein. Auch diese Personen können von einer Adrenalektomie profitieren, auch wenn es danach nicht zu einer vollständigen «biochemischen Heilung» kommt.
Die Computertomographie dient einerseits dem Ausschluss eines Adrenocorticalen Karzinoms (als sehr seltene Ursache eines Hyperaldosteronismus), andererseits der anatomischen Vorbereitung des Nebennierenvenen-Samplings. Das MRT ist dem CT unterlegen und somit nur selten indiziert (20). Ein Nachweis eines Nebennierenadenoms entspricht nur bei jüngeren Personen (<35 Jahren) mit hinreichender Sicherheit einem Aldosteron-produzierenden Adenom, so dass in dem Fall direkt die Operation geplant werden kann. Man geht davon aus, dass ein Nebennieren-Inzidentalom in dieser Altersgruppe selten ist. In allen anderen Fällen braucht es das Nebennierenvenen-Sampling als Goldstandard zum Entscheid, ob eine einseitige oder beidseitige Quelle (Lateralisierung) des Hyperaldosteronismus vorliegt. Diese Untersuchung ist technisch anspruchsvoll, teuer und ebenfalls kaum standardisiert. Die Erfolgsrate ist in grossen Zentren bis >90% und hängt vollständig von der Erfahrung des interventionellen Radiologen ab (21). Eine Übereinstimmung des Sampling-Resultats mit dem CT-Befund – also z.B. Lateralisation nach links und Adenom links oder keine Lateralisation und kein Adenom – findet sich nur in gut der Hälfte der Fälle, entsprechend viele Ergebnisse sind «diskordant» (22). Zur Beurteilung, ob das Sampling erfolgreich ist, die Katheter also tatsächlich die beiden Nebennierenvenen erreicht haben, wird zunächst der Selektivitätsindex verwendet: Cortisol aus der Nebennierenvene muss mindestens doppelt so hoch sein wie aus einer peripheren Vene resp. der inguinalen Schleuse. Der Faktor liegt sogar bei 5, wenn die Untersuchung bei laufender ACTH-Infusion erfolgt, was ebenfalls je nach Zentrum unterschiedlich gehandhabt wird. Eine Cortisol-Schnellbestimmung erleichtert die Erfolgsbeurteilung, da das Resultat noch während des Samplings vorliegt und die Untersuchung ggf. wiederholt werden kann. Der Lateralisationsindex folgt in einem nächsten Schritt: der Quotient aus Aldosteron und Cortisol aus den beiden Nebennierenvenen muss um mindestens Faktor 4 verschieden sein, um eine Lateralisation anzuzeigen. Die Durchführung wie auch die Interpretation des Nebennierenvenen-Samplings ist komplex und kann in unterschiedlichen Zentren zu verschiedenen Diagnosen führen (23), was die Notwendigkeit einer Harmonisierung unterstreicht bzw. nach anderen diagnostischen Verfahren verlangt (funktionelle Bildgebung, Steroidprofile), welche allerdings noch nicht Eingang in die klinische Routine gefunden haben.
Therapie
Bei Diagnose eines lateralisierten Hyperaldosteronismus ist ein chirurgisches Vorgehen (Adenom-Exstirpation bzw. Adrenalektomie) Therapie der Wahl. Dadurch gelingt idealerweise die biochemische Remission, also Normalisierung der Aldosteron-Renin-Ratio, wie auch Senkung des Blutdrucks und der assoziierten Folgeerkrankung (24). Da nicht selten eine schon länger bestehende arterielle Hypertonie durch späte Diagnose des primären Hyperaldosteronismus oder auch eine zusätzliche essentielle Hypertonie-Komponente vorliegt, wird der Blutdruck nach chirurgischer Therapie nur in gut einem Drittel der Fälle vollständig normalisiert, zu einem grossen Teil aber substantiell verbessert (24).
Die Mehrzahl der Personen mit primärem Hyperaldosteronismus weist keine eindeutige Lateralisierung auf und sollte mit einem Mineralokortikoid-Rezeptorantagonist behandelt werden. Diese Therapie kann das Ergebnis der vollständigen Abklärung sein oder auch ein pragmatischer Entscheid zu einem früheren Zeitpunkt. Zur Verfügung stehen Spironolacton und Eplerenon, wobei letzteres in der Schweiz zur Behandlung von arterieller Hypertonie bzw. primärem Hyperaldosteronismus nicht zugelassen ist. Spironolacton kann v.a. wegen der antiandrogenen Nebenwirkungen bei Männern (insb. Gynäkomastie) problematisch sein, welche dosisabhängig bei bis zu 50% auftreten können (25). Der Wirkungseintritt von Spironolacton dauert mehrere Wochen, die Startdosis ist 25mg 1x tgl. Häufig ist eine Kombinationsbehandlung mit anderen Antihypertensiva nötig, wofür sich insb. Amilorid anbietet (in der Schweiz nur in Kombination mit Thiazid verfügbar). Eine Hyperkaliämie tritt im Gegensatz zur Herzinsuffizienz-Behandlung selten auf. Wenn wegen Unverträglichkeit von Spironolacton stattdessen Eplerenon eingesetzt wird, ist (neben einer Kostengutsprache) die Einnahme 2x pro Tag in höherer Dosis nötig, um einen vergleichbaren Effekt wie mit Spironolacton zu erreichen, was die Behandlung deutlich teurer macht. Das Ziel einer medikamentösen Therapie ist neben der Blutdrucksenkung jedenfalls auch die Korrektur des Hyperaldosteronismus, zu messen an der Renin-Suppression. Sofern ein Anstieg von Renin gelingt, kann die eingangs skizzierte Exzess-Morbidität und Mortalität des Hyperaldosteronismus vergleichbar einer Adrenalektomie reduziert werden (26).
Copyright bei Aerzteverlag medinfo AG
Leitender Arzt Endokrinologie
Kantonsspital St. Gallen
Rorschacherstr. 95
9007 St. Gallen
Der Autor hat keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
◆ Der primäre Hyperaldosteronismus als häufigste endokrine Hypertonie rechtfertigt ein grosszügiges Screening, in gewissen Fällen kann aber auch eine pragmatische Behandlung mit Spironolacton erfolgen.
◆ Bei einer ARR <20 oder einem Aldosteron <170pmol/l oder einem Renin >10mU/l ohne interferierende Medikation ist die Diagnose ausgeschlossen.
◆ Bei einer ARR >50 und Aldosteron >400pmol/l und Renin <10mU/l ohne interferierende Medikation ist die Diagnose sehr wahrscheinlich.
◆ Wenn eine Lateralisation des Hyperaldosteronismus nachgewiesen werden kann, profitieren die Personen von einem chirurgischen Vorgehen, ansonsten erfolgt die Behandlung mit einem Mineralokortikoidrezeptor-Antagonisten, in beiden Fällen mit dem Ziel der Normalisierung von Blutdruck, Kalium und Renin (d.h. Anstieg >10mU/l).
1. Turcu AF et al. Primary aldosteronism – a multidimensional syndrome. Nature Rev Endocrinol 2022; 18: 665-82
2. Conn JW. Presidential address. I. Painting background. II. Primary aldosteronism, a new clinical syndrome. J Lab Clin Med 1955; 45: 3-17
3. Rossi GP et al. A prospective study of the prevalence of primary aldosteronism in 1125 patients. J Am Coll Cardiol 2006; 48: 2293-300
4. Brown JM et al. The unrecognized prevalence of primary aldosteronism: a cross-sectional study. Ann Intern Med 2020; 173: 10-20
5. Zennaro M et al. Genetic causes of functional adrenocortical adenomas. Endocr Rev 2017; 38: 516-37
6. Omata K et al. Aldosterone-producing cell clusters frequently harbor somatic mutations and accumulate with age in normal adrenals. J Endocr Soc 2017; 1: 787-99
7. Omata K et al. Cellular and genetic causes of idiopathic hyperaldosteronism. Hypertension 2018; 72: 874-80
8. Monticone S et al. Cardiovascular events and target organ damage in primary aldosteronism compared with essential hypertension: a systematic review and meta-analysis. Lancet Diabetes Endocrinol 2018; 6: 41-50
9. Monticone S et al. Renal damage in primary aldosteronism: a systematic review and meta-analysis. J Hypertens 2020; 38: 3-12
10. Fallo F et al. Prevalence and characteristics of the metabolic syndrome in primary aldosteronism. J Clin Endocrinol Metab 2006; 91: 454-9
11. Wolley MJ et al. Treatment of primary aldosteronism is associated with a reduction in the severity of obstructive sleep apnea. J Hum Hypertens 2017; 31: 561-7
12. Wu VC et al. Risk of fracture in primary aldosteronism: a population-based cohort study. J Bone Miner Res 2017; 32: 743-52
13. Velema MS et al. Health-related quality of life and mental health in primary aldosteronism: a systematic review. Horm Metab Res 2017; 49: 943-50
14. Ananda R et al. Diagnostic delay and disease burden in primary aldosteronism: an international patient survey. Hypertension 2024; 81: 348-60
15. Reincke M et al. Diagnosis and treatment of primary aldosteronism. Lancet Diabetes Endocrinol 2021; 9: 876-92
16. Funder J et al. The management of primary aldosteronism: case-detection, diagnosis, and treatment: an endocrine society clinical practice guideline. JCEM 2016; 101: 1889-916
17. Ng E et al. Aldosteron, Renin, and Aldosterone-to-Renin-Ratio variability in screening for primary aldosteronism. J Clin Endo Metab 2022; 108: 33-41
18. Stowasser M et al. Comparison of seated with recumbent saline suppression testing for the diagnosis of primary aldosteronism. J Clin Endocrinol Metab 2018; 103: 4113-24
19. Naruse M et al. International multicenter survey on screening and confirmatory testing in primary aldosteronism. Eur J Endocrinol 2023; 188: Ivac002
20. Mulatero P et al. Subtype diagnosis, treatment, complications and outcomes of aldosteronism and future direction of research: a position statement and consensus of the Working group on Endocrine Hypertension of the European Society of Hypertension. J Hypertens 2020; 38: 1929-36
21. Rossi G et al. An expert consensus statement on use of adrenal vein sampling for thy subtyping of primary aldosteronism. Hypertension 2014; 63: 151-60
22. Zhou Y et al. Diagnostic accuracy of adrenal imaging for subtype diagnosis in primary aldosteronism: systematic review and meta-analysis. BMJ open 2020; 10: e038489
23. Lethielleux G et al. Influence of diagnostic criteria on the interpretation of adrenal vein sampling. Hypertension 2015; 65: 849-54
24. Williams TA et al. Outcomes after adrenalectomy for unilateral primary aldosteronism: an international consensus on outcome measures and analysis of remission rates in an international cohort. Lancet Diabetes Endocrinol 2017; 5: 689-99
25. Pitt B et al. The effect of spironolactone on morbidity and mortality in patients with severe heart failure. New Engl J Med 1999; 341: 709-17
26. Hundemer G et al. Cardiometabolic outcomes and mortality in medically treated primary aldosteronism: a retrospective cohort study. Lancet Diabetes Endocrinol 2018; 6: 51-59
der informierte @rzt
- Vol. 14
- Ausgabe 4
- April 2024