- Protektiver Knochenumbau bei Patienten mit Multiplem Myelom
In der Schweiz erkranken ca. 570 Menschen pro Jahr an einem Multiplen Myelom oder einem Plasmozytom. Männer erkranken etwas häufiger als Frauen, über die Hälfte der Patienten sind älter als 70 Jahre. Bei Erstdiagnose sind neben der Anämie (73%) ossäre Manifestationen am häufigsten: 70% der Patienten haben Osteolysen, 26% pathologische Frakturen, 22% Kompressionsfrakturen, 23% eine Osteoporose und nur 21% haben einen unauffälligen ossären Befund (1). Im Verlauf der Erkrankung treten bei ca. 80% der Patienten Osteolysen auf und ca. 43% erleiden pathologische Frakturen (2). Die Behandlung und Prävention von ossären Komplikationen beim Multiplen Myelom ist daher ein wichtiger Baustein im therapeutischen Gesamtkonzept.
Das Multiple Myelom ist eine maligne hämatologische Erkrankung und entsteht durch eine klonale Vermehrung von Plasmazellen im Knochenmark. Nach den WHO Kriterien zählen die Multiplen Myelome zu den reifen B-Zell Neoplasien (3). Diagnostische Kriterien für das Multiple Myelom sind > 10% klonale Plasmazellen im Knochenmark, Endorganschäden durch das Myelom (CRAB-Kriterien; C: Hyperkalzämie; R: Niereninsuffizienz; A: Anämie; B: ≥ 1 Osteolyse im Röntgen, CT o. PET-CT) sowie ≥ 1 Biomarker für Malignität (SLiM-Kriterien S: ≥ 60% klonale Plasmazellen im Knochenmark, Li: Leichtkettenratio ≥ 100, M: > 1 Osteolyse im MRI) (4).
Osteolysen finden sich bei Erstdiagnose bei 70% der Patienten. Diese können zu Frakturen der langen Röhrenknochen oder Kompressionsfrakturen der Wirbelkörper führen. Im lebenden Knochen besteht ein Gleichgewicht zwischen physiologischem Knochen Ab- und Aufbau. Beim Myelom ist dieser Prozess durch eine vermehrte Osteoklasten- und verminderte Osteoblasten-Aktivität bei gleichzeitiger durch die Myelomzellen vermittelten Apoptose der Osteozyten und dadurch verändertem Micro-Environment im Knochenmark gestört. Dadurch kommt es zu einer Dysregulation des Knochenstoffwechsels und in der Folge zu einem Knochenabbau mit skelettalen Komplikationen (Schmerzen, Frakturen, Hyperkalzämie und Myelonkompression) (5).
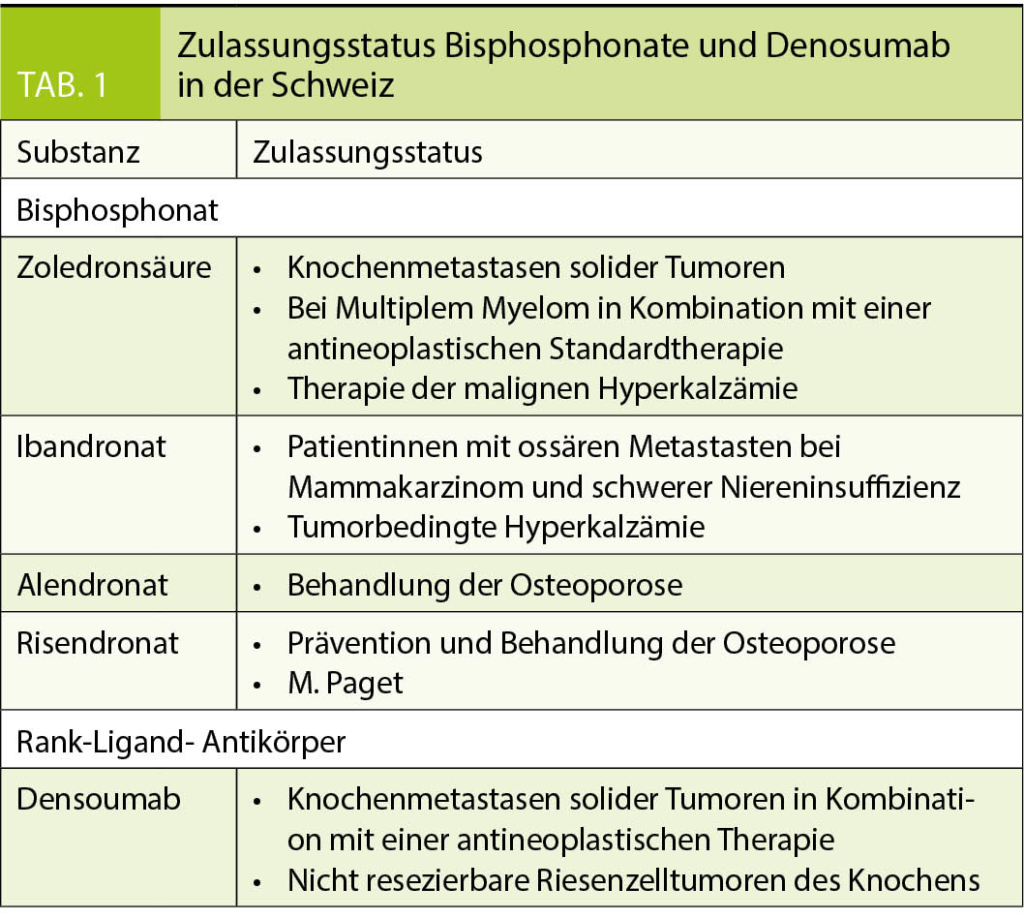
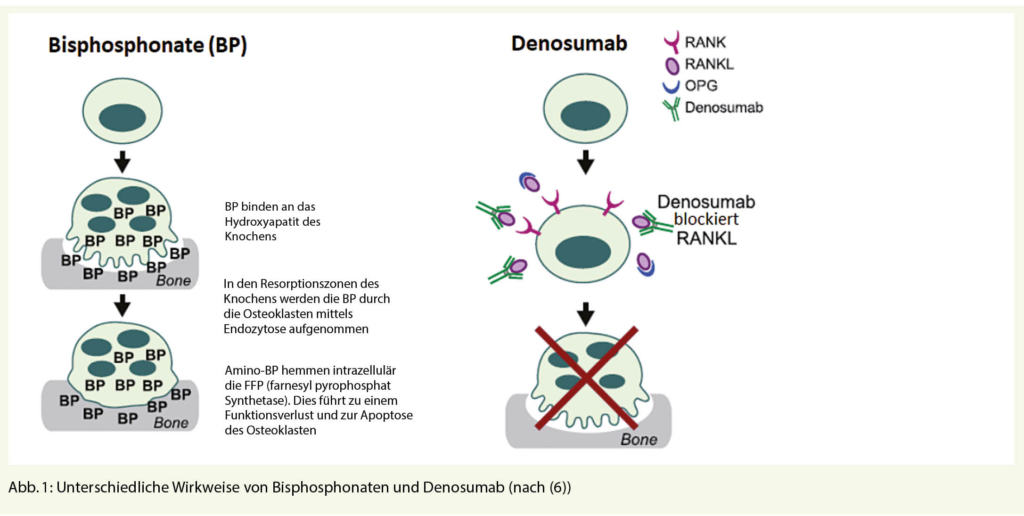
Bisphosphonate sind Medikamente, die die Knochenresorption verhindern können. Sie binden an das Hydroxyapatit des Knochens und werden mittels Endozytose durch die Osteoklasten aufgenommen. Durch intrazelluläre Prozesse kommt es zur Apoptose der Osteoklasten (Abb. 1). Es werden zwei Gruppen von Bisphosphonaten unterschieden – ohne (z.B. Clodronat) und mit Aminogruppe (z.B. Pamidronat, Ibandronat). Bisphosphonate mit Aminogruppe haben eine 10- bis 100-fach höhere Potenz der Osteoklastenhemmung, heterozyklische Aminobisphosphonate (z.B. Zoledronsäure) weisen eine 100- bis 10 000-fach höhere Potenz auf. In der Schweiz ist beim Multiplen Myelom nur Zoledronsäure zugelassen (Tab. 1).
Der RANK-Ligand-Antikörper Denosumab (XGEVA®) bindet an den RANK-Liganden und verhindert damit die Aktivierung des Osteoklasten, indem die Bindung des RANK-Liganden an RANK auf der Osteoklastenoberfläche verhindert wird (Abb. 1). Denosumab imitiert damit die endogene Wirkung des Osteoprotegerin (6). Der RANK-Ligand Antikörper ist bisher nur bei ossären Metastasen solider Tumore in Kombination mit einer antineoplastischen Therapie zugelassen und kassenpflichtig.
Indikation für eine osteoprotektive Therapie
Eine Therapie mit Bisphosphonaten beim Multiplen Myelom ist bei Knochenbeteiligung (≥ 1 Osteolyse) klar indiziert (7). Bei Patienten ohne Osteolysen ist die Evidenz nicht klar, randomisierte Studien zu dieser Fragestellung fehlen. In den ASCO-Guidelines 2018 wird vom Expertenpanel bei Patienten mit Multiplem Myelom und Osteopenie ohne Nachweis von Osteolysen eine Bisphosphonat-Gabe unterstützt (8). In den Guidelines der International Myeloma Working Group (IMWG) ist die Bisphosphonat-Gabe für symptomatische Patienten ohne Osteolysen im konventionellen Röntgen eine «kann»-Empfehlung (IB) mit dem Hinweis, dass der Nutzen für Patienten ohne Nachweis von knöchernen Läsionen im MRT oder PET-CT nicht belegt ist (9). Für asymptomatische
Patienten mit Osteopenie ohne ossären Befall sowie für Patienten mit Smoldering Myeloma, Plasmozytom oder einem indolenten Myelom wird eine Bisphosphonat-Gabe nicht empfohlen (8, 9).
Bisphosphonate und Multiples Myelom
Bei Patienten mit Multiplem Myelom und mindestens einer ossären Läsion führt der Einsatz von Bisphosphonaten zu einer Reduktion von Schmerzen, reduziert die Gesamtzahl von Skelett bezogenen Ereignissen (SREs) und von Wirbelkörperfrakturen. Einzelne Studien konnten einen Überlebensvorteil für Zoledronsäure im Vergleich zu keiner Therapie oder Clodronat bzw. Pamidronat zeigen (10-13). Allerdings zeigte sich in einer grossen Meta-Analyse (Cochrane Gruppe 2017, 15 randomisiert-kontrollierte Studien, 4866 Patienten) durch den Einsatz von Bisphosphonaten keine Verlängerung des Gesamtüberlebens bzw. des Überlebens ohne Fortschreiten der Erkrankung. Eine Evidenz für die Überlegenheit eines Bisphosphonates für die Endpunkte: alle SREs, vertebragene Frakturen oder PFS zeigte sich ebenfalls nicht (7). Die Dauer der Bisphosphonatgabe (2 Jahre, kontinuierliche Gabe) sowie das Intervall (alle 4 oder 12 Wochen) ist Gegenstand aktueller Diskussionen. Belastbare Daten zur Dauer der Bisphosphonatgabe liegen nicht vor. Bei der Dauer der Bisphosphonatgabe spielen vor allem der Remissionsstatus der Erkrankung sowie das Ausmass der Knochenbeteiligung eine Rolle. In den Guidelines wird eine Gabe über 2 Jahre empfohlen, im ersten Jahr alle 4 Wochen, danach kann nach individueller Entscheidung bei Erreichen einer CR eine Gabe alle 12 Wochen erwogen werden. Nach zwei Jahren kann bei gutem Ansprechen das Bisphosphonat bis zum Progress pausiert werden (8, 9). Hinsichtlich des Intervalls der Bisphosphonat-Gabe konnte eine 2017 publizierte Studie zeigen, dass die Gabe von Zoledronsäure alle 12 Wochen der Gabe alle 4 Wochen bei Patienten mit Prostatakarzinom, Mammakarzinom oder mit Multiplem Myelom nicht unterlegen ist (14). Bei einer schweren Niereninsuffizienz mit einer Kreatinin-Clearance < 30 ml/min sollen Bisphosphonate nicht eingesetzt werden.
Denosumab und Multiples Myelom
Der RANK-Ligand Antikörper Denosumab ist in der Schweiz für das Multiple Myelom noch nicht zugelassen. Das liegt zum Teil daran, dass eine ad hoc Subgruppenanalyse bei Patienten mit Multiplem Myelom in der Zulassungsstudie (Henry et.al (14): Denosumab versus Zoledronsäure bei Pat. mit soliden Tumoren und Myelom) einen Überlebensvorteil in der Zoledronsäuregruppe gezeigt hatte (HR: 2.26; 95% CI 1.13–4.50; p = 0.014) (15). Dieser Unterschied wurde auf Imbalancen in den Baseline-Kriterien der Patienten zurückgeführt. Die Nachfolgestudie (Zoledronsäure versus Denosumab; ausschliesslich bei Patienten mit Multiplem Myelom)(16) ergab für die primären Endpunkte OS, PFS; AE, Zeitpunkt zum Auftreten des ersten SRE, sowie alle nachfolgenden SREs keine signifikanten Unterschiede (OS: HR 0.90, 95% CI (0.70-1.16) p=0.41, PFS: HR 0.82, 95% CI (0.68-0.99); deskriptive p=0.036, AE/SAE: 96%/53% im Denosumab-Arm, 97%/56% im Zoledronsäure-Arm). Basierend auf diesen Daten ist Denosumab der Zoledronsäure nicht unterlegen und kann auch bei Niereninsuffizienz eingesetzt werden, ist allerdings in der Schweiz für das Multiple Myelom nicht zugelassen.
Kieferosteonekrosen
Osteonekrosen des Kiefers gehören zu den seltenen, aber sehr belastenden Nebenwirkungen einer Therapie mit Bisphosphonaten oder dem RANK-Ligand-Antikörper Denosumab. Die Inzidenz liegt bei 1-3% und steigt mit der kumulativen Dosis der Bisphosphonate (Behandlungsdauer von 4-12 Monaten: 1.5%, bei 37-48 Monaten: 7.7%) (17). Patienten müssen daher vor Einleitung einer Therapie über die Gefahr aufgeklärt werden, zahnärztlich untersucht und auf die Einhaltung einer optimalen Zahn- und Mundhygiene aufmerksam gemacht werden. Sind invasive Eingriffe am Kieferknochen unter einer laufenden Therapie unumgänglich, sollte die Therapie vorher unterbrochen und erst nach Abschluss der Wundheilung wieder aufgenommen werden.
Vitamin D und Kalzium
Bisphosphonate und RANK-Ligand-Antikörper hemmen die Osteoklastenaktivität und reduzieren dadurch die Calciumfreisetzung aus dem Knochen. Daher tritt häufig eine Hypokalzämie auf (18 - 21), bei Gabe eines RANK- Ligand-Antikörpers deutlich häufiger als bei der Gabe eines Bisphosphonates (18, 20 - 22). Bei der Gabe eines RANK-Ligand-Antikörpers wird daher gleichzeitig die Substitution von Vitamin D und Calcium (400 mg Calcium, 800IE Vitamin D täglich), ausser bei bereits initial bestehender Hyperkalzämie, empfohlen. Zu beachten ist, dass bei Erstdiagnose eines Multiplen Myeloms initial bei 13% aller Patienten eine Hyperkalzämie vorliegt (1).
Abteilung Hämatologie und Onkologie
KSGR Chur
Loëstrasse 170
7000 Chur
Karin.Hohloch@ksgr.ch
Die Autorin gibt an, dass für diese Publikation kein Interessenskonflikt vorliegt.
Ossäre Komplikationen beim Multiplen Myelom sind häufig und können die Lebensqualität nachhaltig beeinträchtigen.
- Bei Osteolysen ist Zoledronsäure die Therapie der Wahl.
- Bei Patienten mit symptomatischem Myelom ohne Osteolysen gibt es keine Evidenz für die Gabe von Bisphosphonaten, sie wird aber im Allgemeinen empfohlen.
- Der RANK-Ligand-Antikörper Denosumab ist eine Alternative insbesondere bei Niereninsuffizienz, ist aber in der Schweiz für diese Indikation nicht zugelassen.
- Die 12-wöchige Gabe von Zoledronsäure ist der 4-wöchigen Gabe nicht unterlegen.
- Zur Dauer der osteoprotektiven Therapie beim Myelom gibt es keine belastbaren Daten, in der Regel wird die Therapie mindestens über
2 Jahre fortgeführt.
1. Kyle RA, Gertz MA, Witzig TE et al. Review of 1027 patients with newly diagnosed multiple myeloma. Mayo Clin Proc 2003; 78: 21-33.
2. Saad F, Lipton A, Cook R et al. Pathologic fractures correlate with reduced survival in patients with malignant bone disease. Cancer 2007; 110: 1860-1867.
3. Swerdlow SH, Campo E, Pileri SA et al. The 2016 revision of the World Health Organization classification of lymphoid neoplasms. Blood 2016; 127: 2375-2390.
4. Rajkumar SV, Dimopoulos MA, Palumbo A et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol 2014; 15: e538-548.
5. Terpos E, Ntanasis-Stathopoulos I, Dimopoulos MA. Myeloma bone disease: from biology findings to treatment approaches. Blood 2019; 133: 1534-1539.
6. Baron R, Ferrari S, Russell RG. Denosumab and bisphosphonates: different mechanisms of action and effects. Bone 2011; 48: 677-692.
7. Mhaskar R, Kumar A, Miladinovic B, Djulbegovic B. Bisphosphonates in multiple myeloma: an updated network meta-analysis. Cochrane Database Syst Rev 2017; 12: CD003188.
8. Anderson K, Ismaila N, Flynn PJ et al. Role of Bone-Modifying Agents in Multiple Myeloma: American Society of Clinical Oncology Clinical Practice Guideline Update. J Clin Oncol 2018; 36: 812-818.
9. Terpos E, Kleber M, Engelhardt M et al. European Myeloma Network guidelines for the management of multiple myeloma-related complications. Haematologica 2015; 100: 1254-1266.
10. Morgan GJ, Davies FE, Gregory WM et al. First-line treatment with zoledronic acid as compared with clodronic acid in multiple myeloma (MRC Myeloma IX): a randomised controlled trial. Lancet 2010; 376: 1989-1999.
11. Aviles A, Neri N, Huerta-Guzman J, Nambo MJ. Randomized clinical trial of zoledronic acid in multiple myeloma patients undergoing high-dose chemotherapy and stem-cell transplantation. Curr Oncol 2013; 20: e13-20.
12. Aviles A, Nambo MJ, Neri N et al. Antitumor effect of zoledronic acid in previously untreated patients with multiple myeloma. Med Oncol 2007; 24: 227-230.
13. Sanfilippo KM, Gage B, Luo S et al. Comparative effectiveness on survival of zoledronic acid versus pamidronate in multiple myeloma. Leuk Lymphoma 2015; 56: 615-621.
14. Henry DH, Costa L, Goldwasser F et al. Randomized, double-blind study of denosumab versus zoledronic acid in the treatment of bone metastases in patients with advanced cancer (excluding breast and prostate cancer) or multiple myeloma. J Clin Oncol 2011; 29: 1125-1132.
15. Raje N, Vadhan-Raj S, Willenbacher W et al. Evaluating results from the multiple myeloma patient subset treated with denosumab or zoledronic acid in a randomized phase 3 trial. Blood Cancer J 2016; 6: e378.
16. Raje N, Terpos E, Willenbacher W et al. Denosumab versus zoledronic acid in bone disease treatment of newly diagnosed multiple myeloma: an international, double-blind, double-dummy, randomised, controlled, phase 3 study. Lancet Oncol 2018; 19: 370-381.
17. Bamias A, Kastritis E, Bamia C et al. Osteonecrosis of the jaw in cancer after treatment with bisphosphonates: incidence and risk factors. J Clin Oncol 2005; 23: 8580-8587.
18. Body JJ, Bone HG, de Boer RH et al. Hypocalcaemia in patients with metastatic bone disease treated with denosumab. Eur J Cancer 2015; 51: 1812-1821.
19. Jodrell DI, Iveson TJ, Smith IE. Symptomatic hypocalcaemia after treatment with high-dose aminohydroxypropylidene diphosphonate. Lancet 1987; 1: 622.
20. Lipton A, Fizazi K, Stopeck AT et al. Superiority of denosumab to zoledronic acid for prevention of skeletal-related events: a combined analysis of 3 pivotal, randomised, phase 3 trials. Eur J Cancer 2012; 48: 3082-3092.
21. Gartrell BA, Coleman RE, Fizazi K et al. Toxicities following treatment with bisphosphonates and receptor activator of nuclear factor-kappaB ligand inhibitors in patients with advanced prostate cancer. Eur Urol 2014; 65: 278-286.
22. Smith MR, Saad F, Coleman R et al. Denosumab and bone-metastasis-free survival in men with castration-resistant prostate cancer: results of a phase 3, randomised, placebo-controlled trial. Lancet 2012; 379: 39-46.
der informierte @rzt
- Vol. 9
- Ausgabe 12
- Dezember 2019