- Säureblocker – offene Fragen, häufige Fragen
Protonen-pumpen-Inhibitoren (PPI) gehören zu den am meisten verschriebenen Medikamenten in der Schweiz und weltweit. Gleichzeitig werden sie aber auch zu oft ohne korrekte Indikation gegeben. Zudem sind sie in den letzten Jahren aufgrund postulierter Nebenwirkungen in Verruf geraten. Der folgende Artikel soll für die häufigsten und umstrittensten Fragen eine Evidenz- und Guideline-basierte Antwort geben, inklusive Indikationen, Interaktionen, Stolpersteinen bei der Verschreibung und Datenlage bzgl. Langzeit-Sicherheit.
Proton Pump Inhibitors (PPIs) are among the most commonly prescribed medications in Switzerland and worldwide. At the same time however, they are often given without a proper indication. Furthermore, they have fallen into disrepute due to alleged side effects. This article aims to provide evidence- and guideline-based answers to the most frequent and controversial questions, including indications, interactions, pitfalls in prescribing, and data regarding long-term safety.
Key words: Proton Pump Inhibitors, PPI, reflux disease, peptic ulcer disease, osteoporosis
Einleitung
Die Zulassung der Protonen-pumpen-inhibitoren vor ca. 30 Jahren hat die Therapie der gastroösohagealen Refluxerkrankung (GERD) und der gastroduodenalen Ulcuskrankheit revolutioniert. Sie sind in der Therapie dieser Erkrankungen nicht mehr wegzudenken. Seit ca. 2010 sind sie in tieferer Dosierung auch als «over-the-counter»-Medikation zugelassen. 2022 wurden PPI in der Schweiz im Wert von ca. CHF 156 Mio. abgerechnet, mit einer DDD (Defined daily dose) von 70 Tabletten pro 1000 Einwohner, d. h. im Schnitt 70 pro 1000 Einwohner haben 1 Dosis PPI pro Tag eingenommen (1). In den letzten 5–8 Jahren scheint diese Zahl etwa konstant zu sein.
Wie häufig werden PPI’s falsch verschrieben?
Studien zeigen, dass bis 20-60 % der Patienten, die PPI verschrieben bekommen, keine Guideline-basierte Indikation für eine solche Therapie haben (2). Gleichzeitig werden aber auch bei einer klaren Indikation für einen PPI (z. B. bei einer gleichzeitigen Therapie mit NSAR (nicht-steroidale Antirheumatika) und systemischem Glucocorticoid) diese häufig fälschlicherweise nicht rezeptiert (3). Diese Zahlen sind natürlich davon abhängig, wie stringent man die Indikation stellt. Einer der häufigsten Fehler ist, dass trotz nur «temporärer Indikation» der PPI dann nicht korrekt gestoppt wird, wenn die Indikation nicht mehr besteht.
Worauf ist bei der Verschreibung von PPI zu achten (Stichwort Interaktionen)? Müssen PPI wirklich frühmorgens eingenommen werden?
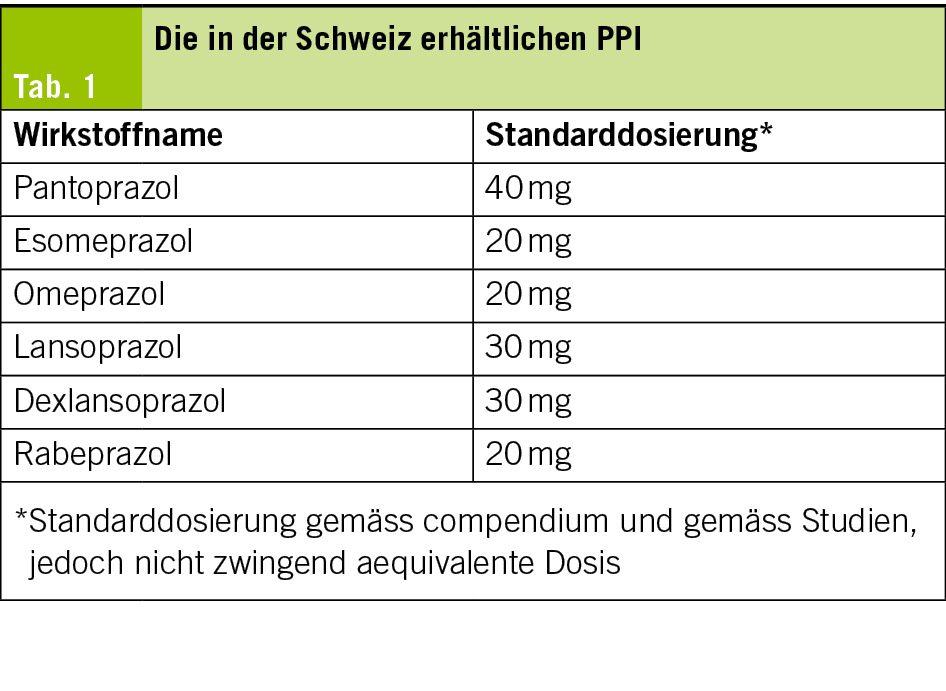
Es existieren aktuell 6 verschiedene PPI: Pantoprazol, Esomeprazol, Omeprazol, Rabeprazol, Lansoprazol und Dexlansoprazol. Die «Standard-Dosierungen» gemäss Studien und Compendium sind in Tabelle 1 aufgeführt, wobei die Standard-Dosierungen nicht äquivalent sind. PPI bewirken eine irreversible Bindung (und damit Inaktivierung) der Na+–K+–ATPase der Belegzelle des Magens. Diese zeigt einen zirkadianen Rhythmus mit maximaler Aktivität in den frühen Morgenstunden. Damit ist die auch PPI-Wirkung am frühen Morgen am grössten, so dass die Tablette am besten nüchtern 30–45 min vor dem Frühstück einzunehmen ist. Eine Ausnahme bildet Dexlansoprazol, welches (gemäss Studien bei gesunden Probanden) unabhängig von der Nahrungseinnahme eingenommen werden kann.
PPI werden durch hepatische P450-Enzyme abgebaut; welches Isoenzym ist je nach Präparat unterschiedlich, meist jedoch das Cytochrom 2C19 und weniger auch 3A4 (4). Teile der Bevölkerung metabolisieren genetisch bedingt schneller oder langsamer (5, 6). Ein Teil der Menschen asiatischen Ursprungs haben hierdurch eine höhere Bioverfügbarkeit und könnten die Dosierung reduzieren. Möglicherweise ist die Rate an Nebenwirkungen bei diesen Menschen auch höher. Umgekehrt gibt es Rapid-Metabolizer, welche das Medikament schneller verstoffwechseln. Die Wirkung von Rabeprazol ist weniger vom CYP2C19-Metabolismus beeinflusst, so dass die genetische Variabilität bei diesem Präparat möglicherweise eine geringere Rolle spielt. Die genetische Analyse wäre eigentlich sinnvoll, wird im klinischen Alltag aber selten durchgeführt (vielleicht zu selten). Bei klarer PPI-Indikation und fehlendem Ansprechen auf die Therapie kann pragmatisch auch das PPI-Präparat gewechselt werden.
Aufgrund einer möglichen Interaktion wird die gleichzeitige Einnahme von Clopidogrel und Esomeprazol / Omeprazol von manchen Guidelines nicht empfohlen (Alternative z. B. Pantoprazol und zeitlicher Abstand der Einnahme von 4h), wobei die klinische Relevanz dieser Interaktion weiterhin umstritten ist. Des Weiteren scheint die Erhöhung des Magen-pH durch PPI die Absorption von Schilddrüsenhormonen zu reduzieren. Bei Beginn eines PPI sollte die Einnahme zeitlich getrennt werden oder – wenn dies nicht möglich ist – die Schilddrüsenfunktion enger monitorisiert werden. Methotrexat wird bei gleichzeitiger PPI-Gabe verzögert renal eliminiert, so dass möglicherweise erhöhte Spiegel vorhanden sind. Inwiefern dies klinisch relevant ist, ist umstritten.
Welche Laborwerte werden durch PPI beeinflusst?
Sowohl Gastrin (s.u.) als auch Chromogranin A steigen bei einer PPI-Therapie an, was bei der entsprechenden Diagnostik (z. B. Tumorsuche) berücksichtigt werden muss (Gastrin beim Gastrinom, Chromogranin A z. B. bei neuroendokrinen Tumoren / Phäochromozytom).
Was sind die Guideline-basierten Indikationen Kurzzeit / Langzeit?
Gemäss Guidelines sind die folgenden Indikationen für eine PPI-Therapie akzeptiert (7–9):
1) Peptisches Ulcus Magen oder Duodenum
• Dauer: Je nach Aetiologie (z. B. NSAR-induziertes Ulcus je nach Grösse 4–8 Wochen)
• Ulcus-Prophylaxe siehe unten
2) Erosive Refluxösophagitis
• Leichte Erosionen (LA Klassifikation A und B): Therapie mit Antazida oder PPI für 4 Wochen, keine Erhaltungstherapie, sondern bedarfsadaptiert, Versuch Wechsel auf Antazida
• Ausgeprägte Erosionen (LA Klassifikation C und D, peptische Stenose): formale Indikation für Erhaltungstherapie in Standarddosis aufgrund hohen Rezidivrisikos
3) Nicht-erosive Refluxerkrankung
• 4–8 Wochen, danach Auslassversuch, Fortsetzung nur bedarfsadaptiert, Versuch Wechsel auf Antazida
4) Eradikation eines Helicobacter pylori:
• Je nach Schema 10–14 Tage
5) Zollinger-Ellison-Syndrom (Gastrin-produzierender Tumor)
• Erhaltungstherapie
6) Funktionelle Dyspepsie
• Therapieversuch für 4–8 Wochen, falls Ansprechen Fortsetzung nur bedarfsadaptiert
7) Sekundärprophylaxe einer idiopathischen Ulcuskrankheit (d. h. ohne H. pylori und ohne NSAR-Anamnese)
8) «Stressulcus»-Prophylaxe bei Patienten auf Intensivstation
9) Primärprophylaxe bei Medikamenten: Kombination von
• Mehreren gerinnungsaktiven / thrombozytenaggregationshemmenden (TAH) Medikamenten (z. B. ASS und OAK)
• NSAR plus OAK
• NSAR plus systemisches Glucocorticoid
• TAH plus Serotonin-Wiederaufnahmehemmer (SSRI)
Wie gut wirken PPI überhaupt?
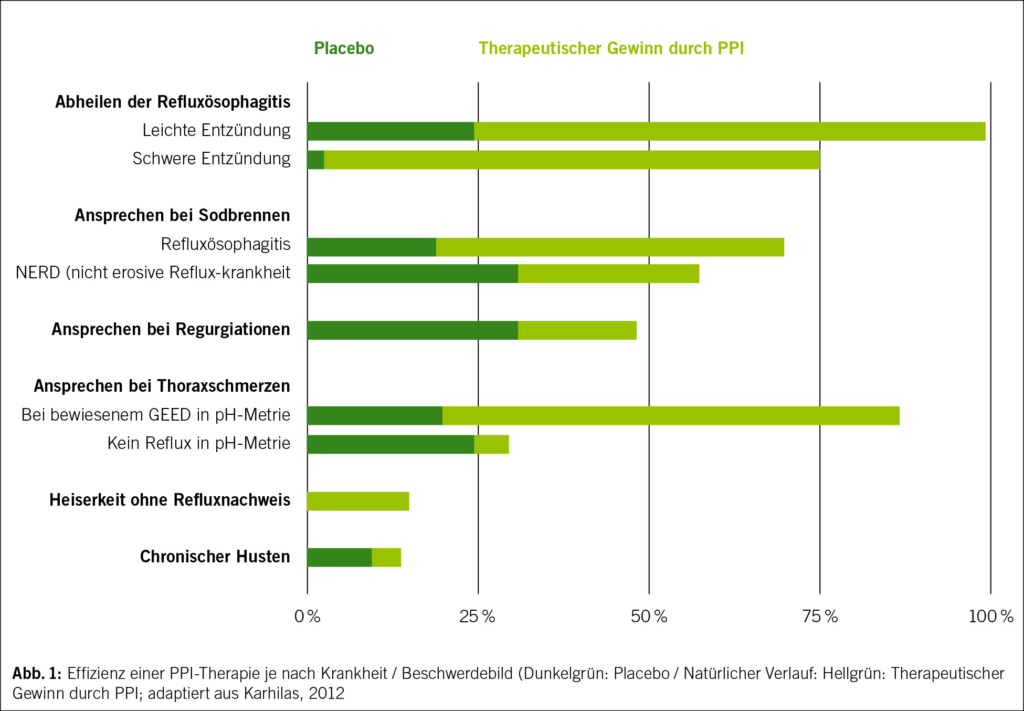
PPI sind hoch-effizient in der Suppression der Säure. Demgegenüber ist der Effekt auf die Beschwerden sehr unterschiedlich und hängt schlussendlich auch von der Pathophysiologie der jeweiligen Erkrankung ab. Allgemein kann gesagt werden, dass der Effekt höher ist bei sichtbarer Entzündung (Refluxerosionen / Ulcus). Weniger gut wirksam sind PPI, wenn viszerale Hypersensitivität (sog. ösophageale Hypersensitivität) oder anatomische Pathologien im Vordergrund sind (z. B. Regurgitation von Mageninhalt bei grosser Hiatushernie). Eine Übersicht gibt Abbildung 1 (adaptiert aus Kharilas (10)).
Warum soll bei einer längeren PPI-Therapie ein H. pylori gesucht werden?
Die Langzeit-PPI-Therapie führt bei gleichzeitiger H.pylori-Infektion zu einer Corpus-dominanten HP-Gastritis, welche ein Risikofaktor für ein Magenkarzinom darstellt (7). Deshalb soll er in diesem Fall gesucht und eliminiert werden. Jedoch ist die Sensitivität der HP-Diagnostik unter laufender PPI-Therapie sowohl beim 13C-Atemtest als auch beim Stuhlantigen und bei der Magen-Biopsie reduziert. Um dies zu umgehen muss die PPI-Therapie in den zwei Wochen vor dem Test pausiert werden.
Wie sollen PPI abgesetzt werden (Stichwort acid Rebound)
Es ist nicht verboten, PPI’s bei auslaufender Indikation direkt zu stoppen ohne sog. «Tapering». Allerdings wurden bei gesunden beschwerdefreien Probanden nach plötzlichem (und verblindetem) PPI-Stopp Refluxbeschwerden und Dyspepsie beobachtet (11). Dies kann auch z. B. bei Refluxpatienten nach PPI-Stopp auftreten (12). Der Effekt scheint mit Höhe der Dosis und Dauer der Therapie assoziiert zu sein. Der Grund für dieses Phänomen liegt in einem Anstieg des Gastrins durch den PPI (Reaktive Hypergastrinämie). Nach Absetzen desselben bleibt das Gastrin für eine gewisse Zeit hoch, was zu mehr Säuresekretion und hierdurch zu (mehr) Beschwerden führen kann (Rebound Acid Hypersecretion; RAHS).
Die Datenlage, in diesem Falle ein Tapering durchzuführen oder beim PPI-Stopp ein Antazidum oder ein Alginat einzusetzen ist dürftig, aber es gibt Hinweise dass dies helfen könnte (13):
• Ausschleichen über 2–4 Wochen (je höher dosiert und länger die Therapie war, desto länger das Ausschleichen
• Einsatz eines Alginates (Gaviscon) bis 4 x / Tag in Reserve bei PPI Stopp.
Welche akuten Nebenwirkungen können unter PPI auftreten?
Zu den akuten Nebenwirkungen gehören neben seltenen allergischen Reaktionen auch Übelkeit / Erbrechen, Diarrhoe und Obstipation sowie Kopfschmerzen. In diesem Fall kann gut auf einen anderen Wirkstoff gewechselt
werden.
Wie ist die Datenlage bezüglich Langzeitsicherheit?
PPI wurden in den letzten Jahren in Studien immer wieder in Zusammenhang gebracht mit den verschiedensten Nebenwirkungen, inklusive potentiell schwerwiegende Erkrankungen wie Demenz, Osteoporose, Infektionen und weiteres.
Hierbei ist folgendes zu beachten (7)
• Die allermeisten dieser Studien sind Assoziations-Studien, deren Wertigkeit bzgl. Kausalität sehr umstritten ist, weshalb sie mit grosser Vorsicht interpretiert werden müssen.
• Selbst wenn man diese Risiken als gegeben annehmen würde, so dürfte das absolute Risiko nahezu ausnahmslos sehr gering sein, so dass der Nutzen der Substanzen bei klarer Indikation das Risiko deutlich überwiegt.
• Des Weiteren existieren nun auch grosse randomisierte prospektive Studien (Vergleiche von Fundoplicatio vs. PPI bei Refluxpatienten, 700 Patienten (14) PPI als Primärprophylaxe bei gerinnungsaktiven Medikamenten, 18 000 Patienten (15)) mit Beobachtungszeiten von bis über 10 Jahren (und insg. 1300-1500 Personenjahren), welche bis auf ein gering erhöhtes Risiko für gastrointestinale Infektionen (s. u.) keine relevanten negativen Folgen zeigte.
Risiken
Auf eine Auswahl postulierter Risiken wird nun im Folgenden eingegangen, mit jeweils persönlichem Fazit des Autors:
Demenz
In gewissen (meist retrospektiv ausgewerteten) Kohortenstudien schien das Risiko für eine Demenz bei PPI-Einnahme erhöht (16). Demgegenüber stehen die Nurses’ Health Study II mit 13 864 Teilnehmer/-innen sowie zwei grosse, prospektive, populationsbasierte Zwillingsstudien aus Dänemark, die keinen solchen Zusammenhang fanden (17, 18). Zudem kam ein systematisches Review mit Metaanalyse, die eine randomisierte und fünf prospektive Kohortenstudien mit mindestens 5-jährigem Verlauf zusammenfasst, zum Resultat: keine Kausalität nachweisbar (19). Dies ist auch das Fazit des Autors.
Osteoporose
Es existieren mehrere (meist retrospektive) Analysen mit Assoziation von PPI und Knochenbrüchen. Die Resultate sind aber nicht konsistent. Zudem existieren mehrere prospektive, randomisierte Studien, die keinen Effekt zeigen (20–22). Fazit des Autors: Kausalität äusserst unwahrscheinlich.
Magenkarzinom
Verschiedene retrospektive Studien zeigen z.T. eine Assoziation zwischen PPI-Therapie und Magenkarzinom. Einige Studien zeigen vor allem ein erhöhtes Risiko zu Beginn der Therapie (wahrscheinlich eine sog. inverse causality, d. h. es wurden beispielsweise PPI eingenommen wegen Symptomen des noch nicht diagnostizierten Magenkarzinoms). Metanalysen zeigen keinen kausalen Zusammenhang (23). Fazit des Autors: Aktuell keine Hinweise für Kausalität.
Gastrointestinale Infektionen
Die oben erwähnte Studie mit 17 500 Patienten, die ASS +/– Rivaroxaban sowie entweder PPI oder Placebo über einen Zeitraum von 3 Jahren erhielten, ergab ein leicht erhöhtes Risiko für gastrointestinale Infektionen (1.4 vs. 1 %, OR 1.33, 95 % CI 1.01–1.75) (15). Das Risiko für eine C. difficile Infektion war doppelt so hoch, bei allerdings insg. nur 13 Ereignissen, so dass die Studie hierfür «underpowered» war. Fazit des Autors: Leicht erhöhtes Risiko für gastrointestinale Infektionen inkl. C. difficile möglich.
Ebenso ist ein gering erhöhtes Risiko für eine Mikroskopische Kolitis möglich, was während der Abklärung dieser Erkrankung berücksichtigt werden muss.
Zusammenfassend kann den PPI in den Augen des Autors ein sehr gutes Sicherheitsprofil in der Langzeiteinnahme attestiert werden. Jedoch muss festgehalten werden, dass sehr seltene Nebenwirkungen sowie solche, die erst nach langer (Jahrzehnte) Einnahme von PPI auftreten, sich auch durch die Daten der vorliegenden prospektiven kontrollierten Studien nicht mit letzter Sicherheit ausschliessen lassen (7).
Die gute Sicherheit der PPI stellt keinen Grund dar, die Indikation insb. für eine Langzeiteinnahme nicht äusserst streng zu prüfen. Zudem sollen wo möglich Alternativen eingesetzt werden (z. B. Antazida / Alginate bei GERD) und bei bedarfsadaptierter Therapie sollen die Patienten zu Auslassversuchen ermuntert werden. Dem für Langzeitsicherheit interessierten Leser sind die Artikel von Vaezi et al (24) und Ahmed (4) zu empfehlen.
Copyright Aerzteverlag medinfo AG
Leitender Arzt, Leiter Gastroenterologie
Klinik für Innere Medizin
Spital Zollikerberg
Trichtenhauser Str. 20
8125 Zollikerberg
Der Autor hat keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
1. https://www.versorgungsatlas.ch/indicator/_007. abgerufen am 5.7.2024.
2. Boster J, Lowry LE, Bezzant ML, Kuiper B, Surry L. Reducing the Inappropriate Use of Proton Pump Inhibitors in an Internal Medicine Residency Clinic. Cureus. 2020 Jan 9;12(1):e6609.
3. Schubert I, Lappe V, Marschall U, Grandt D. Missing PPI prescriptions while overprescribing? Eur J Clin Pharmacol. 2023 Nov;79(11):1579-81.
4. Ahmed A, Clarke JO. Proton Pump Inhibitors (PPI). 2024 Jan.
5. Modak AS, Klyarytska I, Kriviy V, Tsapyak T, Rabotyagova Y. The effect of proton pump inhibitors on the CYP2C19 enzyme activity evaluated by the pantoprazole-(13)C breath test in GERD patients: clinical relevance for personalized medicine. J Breath Res. 2016 Dec 17;10(4):046017.
6. El Rouby N, Lima JJ, Johnson JA. Proton pump inhibitors: from CYP2C19 pharmacogenetics to precision medicine. Expert Opin Drug Metab Toxicol. 2018 Apr;14(4):447-60.
7. S2k-Leitlinie Gastroösophageale Refluxkrankheit und eosinophile Ösophagitis der Deutschen Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS) – März 2023 – AWMF-Registernummer: 021–013. Z Gastroenterol. 2023 Jul;61(7):862-933.
8. Grandt D, Gamstätter T, Fölsch UR. [Recommendations for Drug Treatment in Patients with Multimorbidity]. Dtsch Med Wochenschr. 2020 Oct;145(20):1504-8.
9. Lorenz P, Fischbach W, Schulz C, Macke L, Jansen PL. Leitlinienreport der aktualisierten S2k-Leitlinie Helicobacter pylori und gastroduodenale Ulkuskrankheit der Deutschen Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS) – Juli 2022 – AWMF-Registernummer: 021–001. Z Gastroenterol. 2023 May;61(5):e172-e9.
10. Kahrilas PJ, Boeckxstaens G. Failure of reflux inhibitors in clinical trials: bad drugs or wrong patients? Gut. 2012 Oct;61(10):1501-9.
11. Reimer C, Søndergaard B, Hilsted L, Bytzer P. Proton-pump inhibitor therapy induces acid-related symptoms in healthy volunteers after withdrawal of therapy. Gastroenterology. 2009 Jul;137(1):80-7, 7 e1.
12. Lødrup AB, Reimer C, Bytzer P. Systematic review: symptoms of rebound acid hypersecretion following proton pump inhibitor treatment. Scand J Gastroenterol. 2013 May;48(5):515-22.
13. Vales A, Coyle C, Plehhova K, Hobson A, Woodland P. Randomised clinical trial: the use of alginates during preinvestigation proton pump inhibitor wash-out and their impact on compliance and symptom burden. BMJ Open Gastroenterol. 2023 Jan;10(1).
14. Attwood SE, Ell C, Galmiche JP, Fiocca R, Hatlebakk JG, Hasselgren B, et al. Long-term safety of proton pump inhibitor therapy assessed under controlled, randomised clinical trial conditions: data from the SOPRAN and LOTUS studies. Aliment Pharmacol Ther. 2015 Jun;41(11):1162-74.
15. Moayyedi P, Eikelboom JW, Bosch J, Connolly SJ, Dyal L, Shestakovska O, et al. Safety of Proton Pump Inhibitors Based on a Large, Multi-Year, Randomized Trial of Patients Receiving Rivaroxaban or Aspirin. Gastroenterology. 2019 Sep;157(3):682-91 e2.
16. Northuis CA, Bell EJ, Lutsey PL, George KM, Gottesman RF, Mosley TH, et al. Cumulative Use of Proton Pump Inhibitors and Risk of Dementia: The Atherosclerosis Risk in Communities Study. Neurology. 2023 Oct 31;101(18):e1771-e8.
17. Lochhead P, Hagan K, Joshi AD, Khalili H, Nguyen LH, Grodstein F, et al. Association Between Proton Pump Inhibitor Use and Cognitive Function in Women. Gastroenterology. 2017 Oct;153(4):971-9 e4.
18. Wod M, Hallas J, Andersen K, García Rodríguez LA, Christensen K, Gaist D. Lack of Association Between Proton Pump Inhibitor Use and Cognitive Decline. Clin Gastroenterol Hepatol. 2018 May;16(5):681-9.
19. Desai M, Nutalapati V, Srinivasan S, Fathallah J, Dasari C, Chandrasekhar VT, et al. Proton pump inhibitors do not increase the risk of dementia: a systematic review and meta-analysis of prospective studies. Dis Esophagus. 2020 Oct 12;33(10).
20. Kumar S, Drake MT, Schleck CD, Johnson ML, Alexander JA, Katzka DA, et al. Incidence and predictors of osteoporotic fractures in patients with Barrett’s oesophagus: a population-based nested case-control study. Aliment Pharmacol Ther. 2017 Dec;46(11-12):1094-102.
21. Targownik LE, Goertzen AL, Luo Y, Leslie WD. Long-Term Proton Pump Inhibitor Use Is Not Associated With Changes in Bone Strength and Structure. Am J Gastroenterol. 2017 Jan;112(1):95-101.
22. Targownik LE, Leslie WD, Davison KS, Goltzman D, Jamal SA, Kreiger N, et al. The relationship between proton pump inhibitor use and longitudinal change in bone mineral density: a population-based study [corrected] from the Canadian Multicentre Osteoporosis Study (CaMos). Am J Gastroenterol. 2012 Sep;107(9):1361-9.
23. Crafa P, Franceschi M, Rodriguez-Castro KI, Franzoni L, Russo M, Brandimarte G, et al. PPIs and gastric cancer: any causal relationship? Acta Biomed. 2023 Jun 14;94(3):e2023096.
24. Vaezi MF, Yang YX, Howden CW. Complications of Proton Pump Inhibitor Therapy. Gastroenterology. 2017 Jul;153(1):35-48.
der informierte @rzt
- Vol. 14
- Ausgabe 8
- August 2024